滑子菇多糖提取工艺优化
朱振元,韩丹
(食品营养与安全教育部重点实验室,天津科技大学食品工程与生物技术学院,天津300457)
食用菌是指子实体硕大、可供食用的大型真菌,通称为蘑菇,多属担子菌亚门[1]。食用菌营养价值非常丰富,含有大量的蛋白质、核酸、碳水化合物、纤维素、维生素、矿物质等[2]。食用菌多糖具有抗氧化[3-5]、调节免疫力[6-8]、抗肿瘤[9-10]、降血糖[11-12]、抑菌[13]等多种功效。研究报道表明,食用菌多糖现已广泛应用于免疫缺陷性疾病和肿瘤等疾病的临床辅助治疗,被称为一种重要的生物效应调节剂[14]。
滑子菇,又名珍珠菇、滑菇、真姬菇,因其表面附有一层黏液而得名,是集食用和药用一体的菌类植物[15]。多糖是滑子菇重要的活性成分之一,具有抗氧化、抗肿瘤和增强免疫力等生物活性。目前常用的提取方法有:热水提取法、稀碱水溶液提取法和酶解法[16],多糖是极性大分子,通常可用水做溶剂来提取,因为大部分活性多糖在低极性的有机溶剂中的溶解度较低,所以可用乙醇或丙酮沉淀粗提液中的活性多糖。为节省有机溶剂,对多糖提取液可先浓缩后沉淀。沉淀物再水洗、过滤或用离心机除去不溶物。因为操作方便,成本较低,所以该法是提取水溶性多糖最普遍的方法[17]。食用菌多糖的提取常常受提取时间、温度、加水量等因素的影响,从而影响多糖的提取得率[18]。本文采用热水浸提法提取多糖,通过单因素试验考察提取温度、提取时间以及料液比对滑子菇多糖提取得率的影响。在单因素试验的基础上,采用正交试验对多糖的提取条件进行优化从而确定滑子菇多糖的最佳提取条件。
1 材料与方法
1.1 原料
新鲜滑子菇:天津市滨海新区金元宝农贸市场,经烘干、粉粹后过60目筛得滑子菇干粉,用密封袋包好置于干燥器内。
1.2 主要设备
粉碎机:天津市康达电器有限公司;ESJ205-4型电子天平:沈阳龙腾电子称量仪器有限公司;TGL-16B台式离心机:上海安亭科学仪器厂;SP-2102UV型紫外可见分光光度计:上海光谱仪器有限公司;RE-52AA旋转蒸发器:上海亚荣生化仪器厂;循环水真空泵:郑州长城科工贸有限公司;真空干燥箱:上海益恒科技有限公司;DF-Ⅲ集热式磁力加热搅拌水浴锅:天津欧诺仪器仪表有限公司;ModeL 680酶标仪:Thermo ELectron U.S.A;XW-80A微型旋涡混合仪:上海沪西分析仪器厂。
1.3 方法
1.3.1 滑子菇粗多糖提取工艺
1.3.1.1 滑子菇粉末的制备
取定量的新鲜滑子菇在95%乙醇中在室温下浸泡24 h,以除去其大部分脂质。然后,将滑子菇烘干,用粉碎机粉碎,后过60目筛得滑子菇干粉,用密封袋包好置于干燥器内备用。
1.3.1.2 热水浸提
取8 g干燥的滑子菇粉末放入500 mL烧杯中,在按1∶4(体积比)的比例加入320 mL蒸馏水,并在90℃的搅拌水浴中浸提2 h,以4 000 r/min离心10 min。滤渣重复该过程共3次,将滤液合并。
1.3.1.3 旋转蒸发
用旋转蒸发器在60℃下冷凝浓缩至150 mL。
1.3.1.4 乙醇沉淀
旋转蒸发所得浓缩液加入4倍体积的95%乙醇溶液(体积比)醇沉24 h后,以4 000 r/min离心10 min,去除上清液,留沉淀。
1.3.1.5 Sevag法脱蛋白
醇沉得到的物质用Sevag法脱蛋白[19],按多糖水溶液的1/5~1/4体积加入Sevag试剂(氯仿∶正丁醇为5∶1,体积比),振荡混匀静置直到水层和溶液层分层,去除水层和溶液层交界处的变性蛋白质,如此反复,直至溶剂层与水的界面无乳白色沉淀为止。
1.3.1.6 脱色
脱完蛋白的多糖溶液用大孔树脂AB-8脱色[20],将粗多糖溶液按体积比2∶1加入经预处理树脂于50℃水浴锅中水浴3 h进行脱色,并间隔搅拌,抽滤将树脂除去,用少量水冲洗树脂,合并的洗液即为经过脱色的多糖溶液,冻干得滑子菇粗多糖。
1.3.1.7 可溶性糖含量的测定
采用苯酚-硫酸法[21]测定总糖含量。
葡萄糖标准溶液的配制:取干燥至恒重的无水葡萄糖0.1 g,加蒸馏水溶解,然后将溶液转移至100 mL容量瓶加水定容,获得1 g/L的溶液,振摇均匀后从中用移液管量取10 mL,加入到另一支100 mL的容量瓶中,加入蒸馏水定容至刻度线,即得0.1mg/mL的标液。
葡萄糖标准曲线的绘制:分别取0.1 mg/mL的葡萄糖标准溶液 0、0.2、0.4、0.6、0.8、1.0 mL 至 10 mL 具塞试管中,用蒸馏水补足1 mL,向各个试管中加入6%的苯酚溶液1 mL迅速加入5 mL浓硫酸摇匀,静置10 min,沸水浴15 min,置于室温冷却,在490 nm处测吸光度OD值。以葡萄糖含量为横坐标,吸光值为纵坐标,绘制葡萄糖标准曲线。
样品中总糖含量测定:精确称取样品,配成浓度为0.1 mg/mL的溶液,按上述方法测定样品在490 nm处吸光度OD值,根据标准曲线计算总糖含量。
1.3.1.8 多糖提取得率的计算[22]
多糖提取得率/%=总多糖含量(g)/滑子菇粉末质量(g)×100
1.3.2 提取工艺优化
1.3.2.1 单因素试验
1)提取温度对滑子菇多糖提取得率的影响
精确称取滑子菇粉末4.000 g,按1∶40(g/mL)的料液比加入蒸馏水,分别在不同的温度(70、75、80、85、90℃)下提取,提取时间2 h、提取次数3次,4 000 r/min离心10 min,将清液过滤,收集滤液,测定多糖的含量并计算多糖提取得率。
2)提取时间对滑子菇多糖提取得率的影响
精确称取滑子菇粉末4.000 g,按1∶40(g/mL)的料液比加入蒸馏水,提取温度80℃,分别提取提取时间 60、90、120、150、180 min,提取次数 3 次,4 000 r/min离心10 min,将清液过滤,收集滤液,测定多糖的含量并计算多糖提取得率。
3)料液比对滑子菇多糖提取得率的影响
精确称取滑子菇粉末4.000 g,提取温度80℃,提取时间 2 h、料液比分别为 1 ∶30、1 ∶35、1 ∶40、1 ∶45、1∶50(g/mL),提取次数 3次,4 000 r/min离心 10 min,将清液过滤,收集滤液,测定多糖的含量并计算多糖提取得率。
1.3.2.2 正交试验
在单因素试验结果基础上,确定各变量的水平取值,进行L9(33)的正交试验,以滑子菇多糖提取得率为评价指标,考察各因素对滑子菇多糖提取得率的影响。

表1 正交试验因素水平表Table 1 Factors and levels in orthogonal test
2 结果与讨论
2.1 单因素试验
2.1.1 提取温度对滑子菇多糖提取得率的影响
提取温度对滑子菇多糖提取得率的影响见图1。
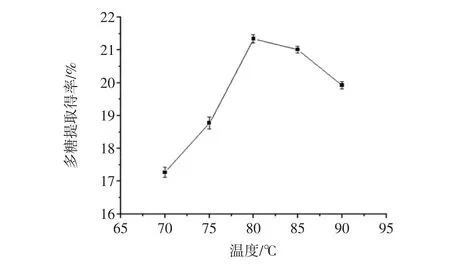
图1 提取温度对滑子菇多糖提取得率的影响Fig.1 The influence of temperature on the extraction extraction rate
结果如图1所示:当提取温度从70℃至80℃时,滑子菇多糖的提取率随提取温度的升高而上升;当提取温度从85℃至90℃时,滑子菇多糖提取得率明显下降。温度为80℃时,滑子菇多糖提取得率最大,为21.34%。多糖随温度变化的趋势分析原因可能是温度低于80℃时,随着温度的升高,加速了分子运动,多糖在水中的溶解度增大;当提取温度超过80℃后,高温提取会破坏多糖的结构影响其生物活性[23],多糖分子结构链出现一定程度的降解,从而导致多糖提取得率下降。由试验结果可确定最佳的提取温度为80℃左右。
2.1.2 提取时间对滑子菇多糖提取得率的影响
提取时间对滑子菇多糖提取得率的影响见图2。
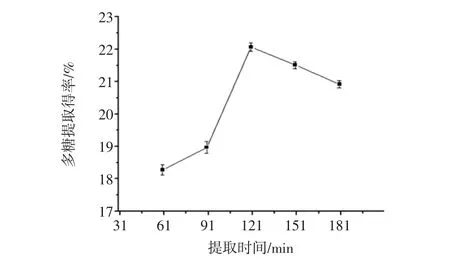
图2 提取时间对滑子菇多糖提取得率的影响Fig.2 The influence of time on the extraction rate
结果如图2所示:当提取时间从60 min~120 min时,滑子菇多糖的提取率随提取时间的增长而上升;当提取时间增长至150 min~180 min时,滑子菇多糖提取得率明显下降。提取时间为120 min时,滑子菇多糖提取得率最大,为22.07%。提取时间过短时,滑子菇多糖无法充分溶出,延长提取时间,可使滑子菇中可溶性多糖溶解,从而使多糖提取得率上升。达到一定时间后,细胞内、外渗透压逐步趋于平衡,多糖提取得率不再上升,加热状态下过长的时间可能导致多糖链结构发生变化,使多糖提取得率下降[24]。由试验结果可确定最佳的提取时间在120 min左右。
2.1.3 料液比对滑子菇多糖提取得率的影响
料液比对滑子菇多糖提取得率的影响见图3。
结果如图3所示:当料液比从1∶30(g/mL)增大到1∶40(g/mL)时,滑子菇多糖的提取率逐渐增大。料液比为1∶40(g/mL)时,滑子菇多糖提取得率最大,为22.13%。继续增大料液比,滑子菇多糖的提取得率基本保持平稳,幅度变化不明显,随着料液比的升高,多糖得率也会相应的增高;而当料液比过高时,多糖得率并未升高反而有所降低,可能是因为多糖能与水以任意比互溶,水量越多,后续工艺中的提取液的浓缩成本和醇沉中的乙醇用量就越多,提取液中多糖的浓度太低时,相同浓度的乙醇就越难以将多糖沉淀出来[25]。考虑后续试验多糖提取液需浓缩,因此,确定最佳提取的料液比为1∶40(g/mL)左右。

图3 料液比对滑子菇多糖提取得率的影响Fig.3 The influence of liquid ratio on the extraction rate
2.2 正交试验
由单因素试验结果,确定各变量的水平取值,进行L9(33)的正交试验。对试验结果进行方差分析,试验结果见表2、表3。

表2 正交试验结果Table 2 Orthogonal experimental results

表3 正交试验方差分析表Table 3 Orthogonal analysis of variance table
由表2、3可知,影响滑子菇多糖提取得率的各因素次序为B>C>A,3个因素中,即温度对滑子菇多糖提取得率影响最大(P<0.05),其次是料液比,最后为提取时间。最优提取工艺为A2B3C2,即提取温度85℃,提取时间 2 h,料液比 1 ∶40(g/mL)。
2.3 验证试验
在最佳工艺条件下进行提取多糖的验证试验,结果见表4。

表4 最佳工艺验证试验Table 4 The verification experiment of optimum extraction parameters
试验结果表明:在最佳工艺条件下提取多糖,提取率达24.55%。
3 结论
本文以滑子菇为研究对象,对滑子菇多糖的提取条件进行了优化。通过正交试验可知,3个因素中温度对滑子菇多糖提取得率影响最大,其次是提取时间和料液比。并确定了热水浸提滑子菇多糖的最佳提取条件是:提取温度85℃,提取时间2 h,料液比1∶40(g/mL)。在此工艺条件下多糖的得率为24.55%。
[1] 刘苏,姜玥,罗建平.5种食用菌多糖理化性质及免疫活性的比较研究[J].食品科学,2015,36(13):252-256
[2] 李小雨,王振宇,王璐.食用菌多糖的分离、结构及其生物活性的研究进展[J].中国农学通报,2012,28(12):236-240
[3] 臧玉红,李仁杰.响应面法对滑子菇多糖提取工艺的优化[J].湖北农业科学,2015,54(22):5702-5706
[4] 党蕾,郝佳欣,江海涛.几种食用菌多糖抗氧化活性比较[J].安徽农学通报,2010,16(5):76-77,128
[5] 侯可宁,李毅.食用菌多糖的提取、检测及应用研究进展[J].山东化工,2017(13):49-51
[6] 唐鹏,李学英,王大忠.食用菌多糖药理作用研究进展[J].临床合理用药,2014,7(6):176-178
[7] 宋伟杰,王星丽,翟亮,等.膜分离技术在食用菌多糖分离纯化中的应用研究进展[J].2015(6):1-5
[8] 孙靖轩,王延锋,王金贺,等.食用菌多糖提取技术研究概况[J].中国食用菌,2012,31(3):6-9
[9]叶忠春,梁智.食用菌多糖综述[J].轻工科技,2012(10):16-18
[10]王雪冰,赵天瑞,樊建.食用菌多糖提取技术研究概况[J].2010,29(2):3-6
[11]林魁,张燕青,魏云华.食用菌多糖酶法提取工艺研究进展[J].现代农业科技,2012(19):285-289
[12]张恒.食用菌多糖功能性研究进展[J].现代食品,2016,20(1):1-5
[13]辛英姬,方绍海,王筱凡,等.茶树菇多糖抑菌效果的试验[J].食用菌,2011(4):64-65
[14]李小雨,王振宇,王璐.食用菌多糖的抗氧化活性及抗细胞增殖活性研究[J].食品科技,2013,38(3):179-182
[15]向莹,陈健.滑子菇营养成分分析与评价[J].食品科学,2013,34(6):238-242
[16]窦佩娟.水提和碱提茶树菇多糖的结构、溶液行为及生物活性研究的比较[D].西安:陕西师范大学,2012
[17]风俐竹.香菇多糖提取工艺研究进展[J].广东化工,2015,42(13):138-139
[18]王立波.食用菌多糖的特性及其提取工艺研究[J].中国食品添加剂,2006(1):68-71
[19]任小盈,李静,马存强,等.茶多糖的提取与分离纯化技术研究新进展[J].安徽农业科学,2014,42(23):7993-7995,7999
[20]何余堂.利用大孔树脂对玉米花丝多糖脱色的研究[J].食品工业科技,2011,32(5):299-301
[21]Wang xiaoting,Zhu zhenyuan,Zhao Liang,et al.StructuraL characterization and inhibition on a-d-gLucosidase activityof non-starch poLysaccharides from Fagopyrum tartaricum[J].Carbohyd PoLym,2016,153:679-685
[22]臧玉红,牛桂玲,李丽娟,等.滑子菇水溶性多糖提取工艺的研究[J].食品科技,2006(11):115-118
[23]燕航,钟耀广.影响香菇多糖提取的因素研究[J].现代食品科技,2006,22(2):179-180
[24]刘雪蕊.黄秋葵多糖的提取及其降血糖活性研究[D].天津:天津科技大学,2017
[25]周小伟,钟瑞敏.紫菜多糖提取工艺技术及抗氧化活性研究[J].食品研究与开发,2014,35(19):43-47

