高营养盐水平下葡萄糖添加对微囊藻水华的控制
王小冬,刘兴国,陆诗敏,车 轩,朱 浩,刘 翀,朱 林
(农业部渔业装备与工程技术重点实验室 中国水产科学研究院 渔业机械仪器研究所,上海 200092)
随着天然水体的普遍富营养化,多种水体尤其是湖泊、池塘等容易出现藻类水华,特别是蓝藻门微囊藻属水华(蓝藻水华)。蓝藻水华的发生影响了水体的利用,比如我国大型湖泊中蓝藻水华暴发后产生了多方面严重的不良影响[1-2],影响了其作为水源地、旅游地、航运等多方面的功能。而水产养殖池塘发生的蓝藻水华对养殖对象产生危害[3-4],并且蓝藻毒素可能对多种生物产生毒害作用[5-7]。因此如何对蓝藻水华进行有效控制成为当前我国水环境治理的重要内容。
蓝藻水华的控制方法有多种,包括化学法、机械清除法、营养物质控制法、水动力控制法、生物控制法等[8],由于生物控制法对环境及生态的破坏较少,因此受到越来越多的重视,其又包括微生物控藻、大型水生植物抑藻、水生动物控藻等。其中微生物控藻是近些年来大家积极探索的有效途径之一,尤其是溶藻微生物被认为在维持蓝藻生物量平衡方面起重要作用[9]。而氮、磷等营养盐是蓝藻水华发生以及形成巨大生物量的物质基础,针对富营养造成的有害藻类水华,通过减少水体因人类活动引起的营养盐输入,而减少富营养的不利影响,从而在根本上治理藻类水华已成为一种共识[10,11]。因此,通过营养物质控制能够从根本上解决蓝藻水华的严重程度。但我国处于经济高速发展阶段以及庞大的人口基数使得物质的消耗及排放都处于高水平,因此理论上最可行的营养物质控制在实际执行中困难较多。而蓝藻对水体营养物质的利用还受到水温、光照、其他生物竞争等多方面因素的影响,因此理论上在不控制水体营养盐水平的基础上应该还有其他方法可控制蓝藻水华,如化感物质控藻[12]、其他藻类与蓝藻的竞争控制等[13-14]。
除了其他藻类与蓝藻的竞争,其他细菌也能通过竞争营养盐与蓝藻竞争[15],光合细菌能够利用水体的营养盐而具有控制藻类生长,达到改善水质的作用[16-17]。水体的异养细菌能跟藻类竞争水体的无机营养盐[18],而藻类却不能利用异养细菌生长所需的有机底物[19]。由于细菌的生长受碳浓度的影响较大,因此对水体添加碳源会改变水体藻类与细菌的竞争。向水体额外添加碳源,维持水体较高C∶N 水平,将有利于异养细菌的生长繁殖,而作为初级生产者的藻类生长受到限制,处于不利的竞争地位[20]。对水产养殖水体进行碳源的添加在水产养殖方面有较多的研究,并被称为生物絮团技术(biofloc technology),其通过人为向养殖水体中添加有机碳物质(如糖蜜、葡萄糖等),调节水体中的碳氮比(C/N),增加水体中异养细菌的数量来增强水体中微生物的作用,达到提高饵料氮素利用率的效果[21]。但国内外目前很少利用添加碳源,比如添加葡萄糖的方法进行蓝藻水华控制或者浮游植物控制的研究[22]。本试验拟从添加葡萄糖作为碳源的角度对蓝藻水华进行控制,以期为蓝藻水华的控制提供新途径。
1 材料与方法
1.1 样品来源与实验设计
试验于2014年9月4日—9月30日在玻璃温室中进行,试验容器为5 L的广口玻璃瓶,共分为1个对照(Control)和1个处理(+Glu),对照中不添加葡萄糖,处理中添加葡萄糖,各3个重复,共使用6个广口瓶。初始每瓶盛水 5.0 L。葡萄糖的添加浓度依据水体总氮浓度而定,参考文献[23]按DOC(溶解性有机碳)∶TN(总氮)≈20∶1进行添加。试验过程中每个玻璃瓶均采用气石曝气,曝气强度尽量调整一致。为了保证处理和对照的水温尽量一致,9月7日时将6瓶转移至1个盛水的蓝色周转箱中进行实验。
试验初始水体为蓝藻门微囊藻属水华严重的水体,叶绿素a(Chl-a)浓度高达422.78 μg·L-1;该蓝藻水华是在玻璃温室中通过对自来水中添加一定量的腐烂人工配合饲料培养而得。初始水体的微囊藻种类主要有水华微囊藻(Microcystisflosaquae)、铜绿微囊藻(Microcystisaeruginosa)等,其中微囊藻属细胞数量占所有浮游植物细胞数量的比例超过90%,其他浮游植物种类主要是栅藻属(Scenedesmus)和平裂藻属(Merismopedia)。
试验过程中对相应试验瓶进行葡萄糖、氮磷营养盐和纯水的补充,具体为:在初始、第15天及第20天时进行无水葡萄糖(C6H12O6)添加,即共3次添加葡萄糖,对各个处理瓶添加的质量依次为5.00、3.35和3.98 g,使得处理各瓶瞬时的DOC∶TN接近20∶1;第6天和第15天时对所有瓶均添加KNO3和KH2PO4,使得各瓶N浓度净增加2.1 mg·L-1,P浓度净增加0.3 mg·L-1;第12天和第20天分别对所有瓶补充纯水200和100 mL。其中N和 P的添加使用KNO3和KH2PO4配置的母液进行添加,添加氮、磷的原因是实验期间处理和对照的水体藻类因为温室中太阳辐射较强均出现了变黄的现象,而添加无机氮、磷能够连续促进水体藻类生长和变绿;同时考虑到实际的天然水体中会不断有营养盐的输入,以及微囊藻纯种培养时常用的BG-11培养基中TN、TP浓度非常高,可分别高达247.1 mg·L-1、5.3 mg·L-1[24],即微囊藻可以耐受高浓度氮、磷。
1.2 理化指标测定
试验过程中对水样测定的指标:总氮(TN)、总磷(TP)、溶解性总氮(DTN)、溶解性总磷(DTP)、活性磷(SRP)、总悬浮颗粒物(TSS)、有机悬浮颗粒物(OSS)、叶绿素a(Chl-a)、溶解性有机碳(DOC),其测定频率一般为6 d左右测定一次,其中Chl-a的测定频率为2~3 d左右测定一次,并且第6、14、19天的TN、TP、DTN、DTP、SRP和DOC浓度的测定针对的分别是处理和对照的3个重复的混合水样;第6、8、14、19天的TSS和OSS浓度的测定针对的分别是处理和对照的3个重复的混合水样;第6、8天的Chl-a的测定针对的分别是处理和对照的3个重复的混合水样。原位测定指标(一般为上午9:00和下午14:00各测定一次):水温、pH值、溶解氧(DO)、氧化还原电位(ORP),并在显微镜下拍照检查浮游植物群落结构与形态的变化。并对第0、6、14、19、24天处理和对照的混合水样进行微生物多样性的高通量测序分析,方法是经过16S rDNA V4~V5区的Illumina Miseq双末端测序,具体实验方法和微生物分析方法见参考文献[25-27]。
水温、pH值、DO、ORP的测定采用多参数水质分析仪(Professional plus,YSI,美国);DTN、DTP的测定为水样过Whatman GF/F(0.7 μm孔径, 英国)膜后与TN、TP一起采用过硫酸钾联合消解法[28]测定,SRP和DOC的测定为水样过Whatman GF/F(0.7 μm孔径)膜后,SRP利用磷钼蓝分光光度法测定[29],DOC的测定使用仪器Multi N/C 2100 (analytikjena,德国)。Chl-a的测定使用浮游植物荧光仪(PHYTO-PAM,Walz GmbH,德国)。TSS和OSS的测定选择温度分别为105、450 ℃[30]。
1.3 数据分析
试验期间处理和对照的水温、pH值、DO、ORP和Chl-a的比较采用针对重复采样的多因素方差分析(repeated measures ANOVA),对分别测定处理和对照的3个平行混合样的TN、TP、DTN、DTP、SRP、DOC、TSS和OSS的比较采用独立样本t-检验(independent samples t-test)。数据比较在软件SPSS 16.0上进行,差异显著性水平选择a=0.05。
2 结果与分析
2.1 水温、pH值、DO、ORP
试验期间处理和对照的水温、pH值、DO和ORP变化见图1。采用针对重复采样的多因素方差分析(repeated measures ANOVA)对处理和对照的水温、pH值、DO和ORP进行比较,结果表明,9:00处理和对照的水温没有差异(P>0.05),14:00处理的水温显著高于对照(P<0.05);9:00和14:00处理的pH值、DO均显著低于对照(P<0.05);9:00左右和14:00左右对照的ORP均显著高于处理(P<0.05)。

图1 实验期间水温、pH值、DO和ORP的变化(平均值±标准差)Fig.1 Changes in water temperature, pH values, DO and ORP during the experiment (mean±S.D.)
2.2 C、N、P浓度
试验期间水体TN、TP、DTN、DTP、SRP 和DOC浓度的变化见图2。试验期间水体TN、DTN分别为15.0~25.0 mg·L-1、3.5~4.5 mg·L-1,TP基本在2.0~3.0 mg·L-1。对照的DOC浓度在28.01~34.23 mg·L-1。对处理和对照的TN、TP、DTN、DTP、SRP和DOC浓度进行的独立样本t-检验结果表明,处理和对照的TN、TP、DTN、DTP、SRP浓度均没有显著差异(P>0.05),处理的DOC浓度显著高于对照(P<0.05)。
2.3 悬浮物和Chl-a
试验期间处理和对照的悬浮物TSS和OSS浓度变化见图3。对照和处理的TSS浓度在试验过程中均有升高,TSS的主要成分是OSS,其OSS占TSS的比例维持在70%~100%。Chl-a浓度变化见图4。初始Chl-a浓度高达422.78 μg·L-1;试验过程中对照的Chl-a浓度峰值达540 μg·L-1左右,而处理的Chl-a浓度在前期降低后基本在250 μg·L-1以下。对处理和对照Chl-a、TSS和OSS浓度比较结果表明,处理的Chl-a浓度显著低于对照(P<0.05),处理的TSS和OSS浓度均显著高于对照(P<0.05)。
2.4 微囊藻
图5为试验初始时的微囊藻,图6为9月22日(第18天)时的微囊藻。由试验过程中微囊藻属细胞的形态变化(图6)可见,试验后期,对照和处理的微囊藻都不是以胶被明显的大群体形式存在,且处理中的微囊藻细胞比对照的更分散,尤其是处理中微囊藻更容易形成小群体甚至是双细胞或者单细胞形态。
2.5 微生物组成
高通量测序得到的微生物群落在属水平上的分布见图7。由图7可见,试验过程中,对照和处理的微生物结构逐渐出现变化,对照的相对丰度最大的属一直是微囊藻属Microcystis,而处理在第14、19、24天时出现了丰富的固氮菌属Azotobacter,其属于化能异养、好氧性的固氮细菌。
3 讨论
向水体添加溶解性有机碳调节C∶N比例的生物絮团技术在水产养殖中应用较多,其目的为水质调控、病害控制或者提高饲料利用效率[31-33],其理论实质是水体溶解氧比较充足时,适宜溶解性有机碳浓度促进水体异养微生物的生长,从而实现对水体无机氮(总氨氮、亚硝酸盐氮、硝酸盐氮)的同化[34]。比如,卢炳国等[32]研究了草鱼池生物絮团形成所需的适合C∶N,包括分析了不同C∶N水平对水泥池中生物絮团的形成、水质及草鱼生长的影响;夏耘等[23]研究了生物絮团培养过程中养殖水体水质因子及原核与真核微生物的动态变化,并认为生物絮团技术是一种能有效对养殖水体藻菌分布进行调控的技术,为控制藻类水华的发生提供了新的方法与途径。
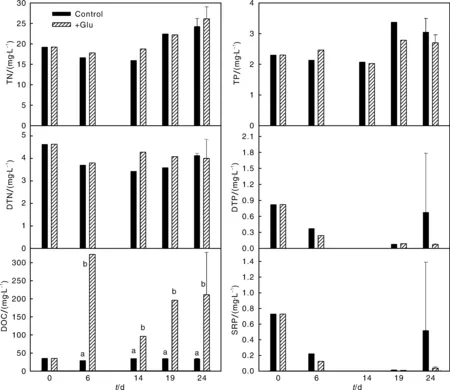
没有相同字母表明不同时间对照和处理间差异显著(P<0.05)。下同。The bars with different letters showed the significance between the control and the treatment different time (P<0.05). The same as below.图2 试验期间水体TN、TP、DTN、DTP、DOC 和SRP浓度的变化Fig.2 Changes in TN, TP, DTN, DTP, DOC and SRP during the experiment
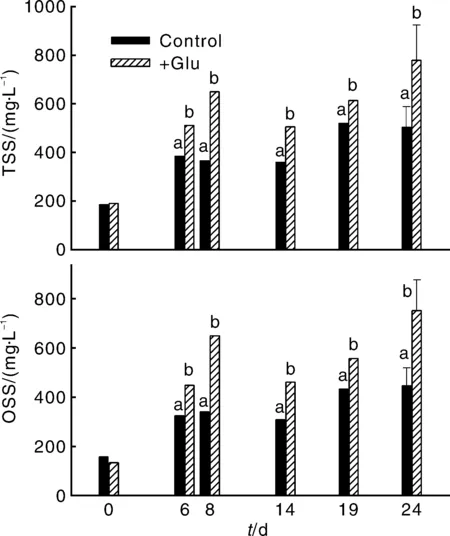
图3 试验期间水体TSS和OSS浓度的变化Fig.3 Changes in TSS and OSS during the experiment

*表明不同时间对照和处理间差异显著(P<0.05)。* represents the significance between the control and the treatment different time (P<0.05).图4 试验期间水体Chl-a浓度的变化Fig.4 Changes in Chl-a during the experiment
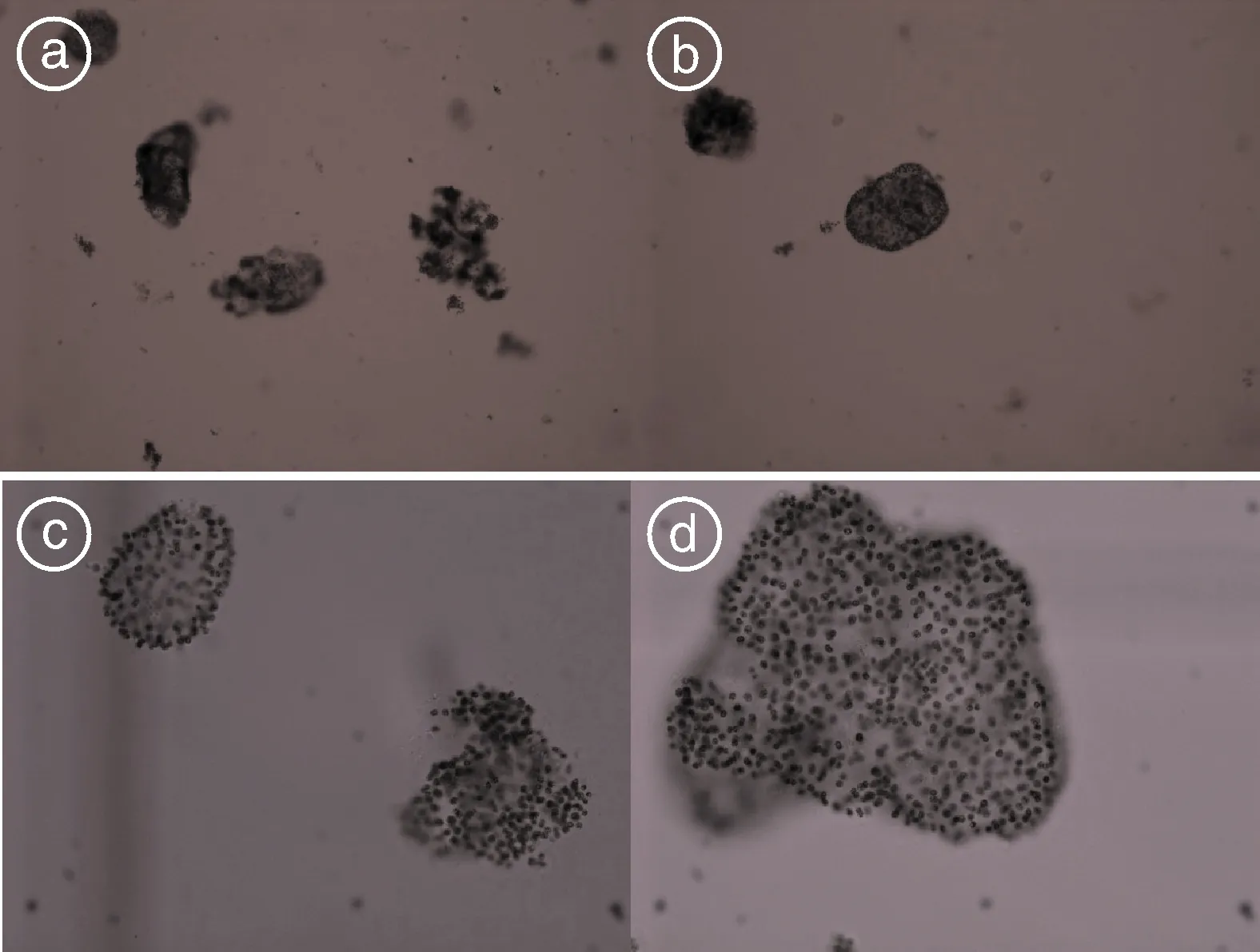
图5 试验初始时水体微囊藻群体(a、b为×100倍,c、d为×400倍)Fig.5 The initial Microcystis colonies of the experiment (a, b is under ×100, and c, d is under ×400)

图6 第18天(9月22日)时3个对照瓶混合样(a)中及3个处理瓶混合样(b)中微囊藻在400倍下的形态Fig.6 The Microcystis in the control (a) and the treatment (b) on 18th day (22 September) under ×400

其中横坐标图注中Ctrl和Glu分别表示的是对照和处理。The signal of Ctrl and Glu means the control and the treatment, respectively.图7 试验过程中第0、6、14、19、24天处理和对照的微生物群落在属水平上的相对丰度分布Fig.7 The relative abundance of the microorganisms at the genus level both in the control and the treatment on day 0, 6,14,19,24 during the experiment
本试验中,对照在上午和下午的pH值、DO、ORP均高于处理(P<0.05),表明在相同的曝气强度下,处理中添加了葡萄糖而增加了水体耗氧,这与Schveitzer等[35]在养殖箱中进行有机碳添加形成生物絮团时,异养微生物加快水体溶氧消耗的情况一致。而对照中应该仍然以蓝藻光合作用为主,其耗氧较少,从而DO较高,并引起pH值、ORP也较高,这与浮游植物光合作用比较强的室外水体容易出现高DO、高pH值的现象一致[36]。并且对照的Chl-a含量也显著高于处理(P<0.05)(图4),这验证了对照中水体pH值、DO、ORP比处理的高是由于其中浮游藻类生长更好、光合作用更强的原因;同时也说明处理中葡萄糖的添加有效地控制了其中浮游藻类的生长。由对照和处理水样在显微镜下的照片可见(图5、图6),在本试验条件下,添加葡萄糖更容易使蓝藻门微囊藻属细胞的形态由大群体态转变为小群体甚至是双细胞、单细胞状态,表明葡萄糖添加促进了大群体微囊藻的变小或解体。
在水体中添加适量的碳源后,往往形成生物絮团,导致水体的总悬浮物浓度增加[32]。本试验中对照的TSS与OSS随着时间也有升高,应该与对照中DOC浓度较高有关(在28.01~34.23 mg·L-1),而处理中TSS与OSS增加更显著(P<0.05)(图3)。这表明,添加葡萄糖有利于处理中总悬浮物浓度尤其是有机态悬浮物浓度的升高。但是处理中的Chl-a含量显著低于对照(P<0.05),这表明处理中升高的OSS不是由于浮游植物含量的升高引起的。而相应关于碳源添加研究表明,碳源添加能促进水体异养细菌的生长[37-38],而本试验中添加葡萄糖的处理中微生物群落不同于对照,主要是处理中出现了大量的化能异养、好氧性的固氮细菌——固氮菌属Azotobacter,因此处理中OSS的升高是由于异养细菌生长导致的。
浮游植物和细菌的生长都需要营养物质,因此理论上可以通过藻菌竞争的途径进行蓝藻水华的控制。Daufresne等[39]对浮游植物和细菌的共存研究表明,浮游植物生长受氮和(或)磷的限制,而细菌则同时受有机碳与氮和磷的限制。并且,水体中添加溶解性有机碳得到适宜的碳氮比例后能够促进水体异养微生物的生长[40],水体中无机氮磷便能够被蓝藻和异养微生物同时利用,即形成了蓝藻和异养微生物竞争营养物质的情况,从而达到对蓝藻的控制。本试验过程中,对照和处理间的TN、TP、DTN、DTP和SRP浓度均没有显著差异(P>0.05),表明仅从这几个氮磷指标不足以看出处理中异养微生物竞争性地利用氮磷元素的效果。这可能与本试验水体的氮、磷浓度均较高而看不出异养微生物利用后形成的浓度差异,尤其是其中TP浓度高达2.0~3.0 mg·L-1,这明显高于常见的蓝藻水华水体,如太湖[41]。但是处理中的DOC在添加后出现了明显的浓度降低(图2),表明DOC被细菌利用了,而理论上DOC被利用的同时会伴随氮和磷被利用[39]。而作者另外的试验发现添加葡萄糖可控制太湖来源水体中浮游植物,其主要通过降低水体中可被浮游植物利用的无机氮、磷浓度实现[22]。因此,联系本试验对照和处理的微生物变化及碳、氮、磷浓度,以及TSS、OSS、DOC、Chl-a情况,推断本试验中处理的Chl-a浓度降低,即其中微囊藻生长受到控制的原因是葡萄糖添加促进了异养微生物的生长,异养微生物与微囊藻竞争氮、磷,从而促进了微囊藻群体的解体。
微生物控藻是蓝藻的生物控制法中常见的一类,主要通过溶藻微生物作用于藻类细胞[42],从而破坏藻类细胞,达到抑制藻类细胞繁殖分裂的目的。由于溶藻后大量的氮、磷等无机营养素释放到水体中从而导致二次污染并且有时会导致藻毒素的突然释放,引起水体中藻毒素浓度增加,危害水体中的水生生物,从而导致新的生态问题。并且相应溶藻微生物自身的生长需要一定的理化环境,当理化环境不适宜溶藻微生物生长时,就不能培养大量微生物来控制藻类水华,从而限制了溶藻微生物的实际利用范围和效果。而本研究则从添加溶解性有机碳并曝气以提供较高浓度溶氧,培养能够与藻类竞争营养盐的微生物出发,达到控制蓝藻水华的目的,这为蓝藻水华的控制提供了一种新思路。
[1] GUO L. Doing battle with the green monster of Taihu Lake[J].Science, 2007, 317(5842): 1166-1166.
[2] QIN B, XU P, WU Q, et al. Environmental issues of lake Taihu, China[J].Hydrobiologia, 2007, 581(1): 3-14.
[3] REYNOLDS C S. Cyanobacteria in fish ponds[J].Aquaculture, 1990, 88: 1-20.
[4] 姚雁鸿,何文辉,余来宁. 池塘蓝藻水华的产生及对养殖的危害[J].江西农业学报,2007,19(4):98-100.
YAO Y H, HE W H, YU L N. Mechanism of forming of cyanobacteria bloom and its effects on aquaculture[J].ActaAgriculturaeJiangxi, 2007,19(4):98-100. (in Chinese with English abstract)
[5] EYNARD F, MEZ K, WALTHER J L. Risk of cyanobacterial toxins in Riga waters (Latvia)[J].WaterResearch, 2000, 34(11): 2979-2988.
[6] CODD G A, METCALF J S, BEATTIE K A. Retention ofMicrocystisaeruginosaand microcystin by salad lettuce (Latucasativa) after spray irrigation with water containing cyanobacteria[J].Toxicon, 1999, 37(8): 1181-1185.
[7] CRUSH J R, BRIGGS L R, SPROSEN J M, et al. Effect of irrigation with lake water containing microcystins on microcystin content and growth of ryegrass, clover, rape, and lettuce[J].EnvironmentalToxicology, 2008, 23(2): 246-252.
[8] 胡传林,万成炎,吴生桂,等. 蓝藻水华的成因及其生态控制进展[J]. 长江流域资源与环境,2010,19(12):1471-1477.
HU C L, WAN C Y, WU S G, et al. Progress in causes and ecological control of cyanobacterial bloom[J].ResourcesandEnvironmentintheYangtzeBasin, 2010,19(12):1471-1477. (in Chinese with English abstract)
[9] 黄廷林,柴蓓蓓. 水源水库水质污染与富营养化控制技术研究进展[J].地球科学进展,2009,24(6):588-596.
HUANG T L, CHAI B B. Advances in the study of controlling mechanics and technology for source water reservoir quality[J].AdvancesinEarthScience, 2009,24(6):588-596. (in Chinese with English abstract)
[10] NIXON S W. Coastal marine eutrophication: a definition, social causes, and future concerns[J].Ophelia, 1995, 41(1): 199-219.
[11] SMITH V H. Eutrophication of freshwater and coastal marine ecosystems a global problem[J].EnvironmentalScienceandPollutionResearch, 2003, 10(2): 126-139.
[12] 邓平. 三种沉水植物对浮游植物的化感效应研究[D].武汉:中国科学院水生生物研究所, 2007.
DENG P. Studies on allelopathic effects of three submerged macrophytes on phytoplankton[D]. Wuhan: Chinese Academy of Sciences (Institute of Hydrobiology), 2007. (in Chinese with English abstract)
[13] 陈德辉,刘永定,袁峻峰,等. 微囊藻和栅藻共培养实验及其竞争参数的计算[J]. 生态学报,1999,19(6):908-913.
CHEN D H, LIU Y D, YUAN J F, et al. Experiments of mixed culture and calculation of competitive parameters betweenMicrocystis (Cyanobacteria) andScenedesmus(Green algae)[J].ActaEcologicaSinica, 1999, 19(6):908-913. (in Chinese with English abstract)
[14] 周进,陈国福,朱小山, 等. 赤潮过程中“藻-菌”关系研究进展[J]. 生态学报,2014,34(2) :269-281.
ZHOU J, CHEN G F, ZHU X S, et al. A review of the relationship between algae and bacteria in harmful algal blooms[J].ActaEcologicaSinica, 2014,34(2) :269-281. (in Chinese with English abstract)
[15] 左新宇. 微囊藻与硝化细菌相互关系的初步研究[D].武汉:华中农业大学,2013.
ZUO X Y. Preliminary studies on relationship betweenMicrocystissp. and nitrifying bacteria[D]. Wuhan: Huazhong Agricultural University, 2013. (in Chinese with English abstract)
[16] 常会庆,王世华,寇太记. 固定化光合细菌对水体富营养化的去除效果[J]. 水资源保护,2010,26(3):64-67.
CHANG H Q, WANG S H, KOU T J. Effects of immobilized photosynthetic bacteria on eutrophic water[J].WaterResourcesProtection, 2010, 26(3):64-67.(in Chinese with English abstract)
[17] 龙波. 光合细菌对富营养化水体脱氮除磷研究[D].成都:西南交通大学,2013.
LONG B. Study on the treatment of photosynthetic bacteria to eutrophic water of nitrogen and phosphorus removal [D]. Chengdu: Southwest Jiaotong University, 2013. (in Chinese with English abstract)
[18] AOTA Y, NAKAJIMA H. Mathematical analysis on coexistence conditions of phytoplankton and bacteria systems with nutrient recycling[J].EcologicalModelling, 2000, 135(1): 17-31.
[19] WETZEL R G. Limnology: Lake and river ecosystems[M]. London: Academic Press, 2001:1006.
[20] THINGSTAD T F, PENGERUD B. Fate and effect of allochthonous organic material in aquatic microbial ecosystems: an analysis based on chemostat theory[J].MarineEcologyProgressSeries, 1985, 21(1/2): 47-62.
[21] CRAB R, DEFOIRDT T, BOSSIER P, et al. Biofloc technology in aquaculture: Beneficial effects and future challenges[J].Aquaculture,2012,356 (4) : 351-356.
[22] 王小冬,刘兴国,顾兆俊, 等. 葡萄糖添加对太湖水体浮游植物生长的影响[J]. 渔业现代化, 2016, 43(5):6-11, 41.
WANG X D, LIU X G, GU Z J, et al. Effect of glucose addition on the growth of phytoplankton from Lake Taihu[J].FisheryModernization, 2016, 43(5):6-11, 41. (in Chinese with English abstract)
[23] 夏耘,邱立疆,郁二蒙, 等. 生物絮团培养过程中养殖水体水质因子及原核与真核微生物的动态变化[J]. 中国水产科学,2014,21(1):75-83.
XIA Y, QIU L J, YU E M, et al. Dynamic changes of water quality factors and composition of prokaryotic and eukaryotic microorganisms during culturing of bio-floc[J].JournalofFisherySciencesofChina, 2014, 21(1):75-83. (in Chinese with English abstract)
[24] RIPPKA R, DERUELLES J, WATERBURY J B, et al. Generic assignments, strain histories and properties of pure cultures of Cyanobacteria[J].JournalofGeneralMicrobiology, 1979, 111:1-61.
[25] CAPORASO J G, KUCZYNSKI J, STOMBAUGH J, et al. QIIME allows analysis of high-throughput community sequencing data[J].NatureMethods, 2010, 7(5):335-336.
[26] EDGAR R C. Search and clustering orders of magnitude faster than BLAST[J].Bioinformatics, 2010, 26(19):2460-2461.
[27] AMATO K R, YEOMAN C J, KENT A, et al. Habitat degradation impacts black howler monkey (Alouattapigra) gastrointestinal microbiomes[J].TheISMEJournal, 2013, 7(7):1344-1353.
[28] GROSS A, BOYD C E. A digestion procedure for the simultaneous determination of total nitrogen and total phosphorus in pond water[J].JournalofWorldAquacultureSociety, 1998, 29(3):300-303.
[29] EATON A D, CLESCERI L S, GREENBERG A E. Standard methods for the examination of water and wastewater [M]. 19th ed. Washington DC: American Public Health Association, 1995.
[30] 徐耀阳,王岚, 韩新芹, 等. 三峡水库香溪河库湾春季水华期间悬浮物动态[J]. 应用生态学报, 2009, 20(4): 963-969
XU Y Y, WANG L, HAN X Q, et al. Dynamics of suspended solids in Xiangxi Bay of Three Gorges Reservoir during spring algal bloom period[J].ChineseJournalofAppliedEcology, 2009, 20(4): 963-969. (in Chinese with English abstract)
[31] CRAB R, LAMBERT A, DEFOIRDT T, et al. The application of bioflocs technology to protect brine shrimp (Artemiafranciscana) from pathogenicVibrioharveyi[J].JournalofAppliedMicrobiology, 2010,109(5): 1643-1649.
[32] 卢炳国,王海英,谢骏, 等. 不同C/N水平对草鱼池生物絮团的形成及其水质的影响[J]. 水产学报,2013,37(8):1220-1228.
LU B G,WANG H Y,XIE J, et al. Effect of C/N ratio on bioflocs formation and water quality in zero-water exchange grass crap tanks[J].JournalofFisheriesofChina, 2013, 37(8):1220-1228. (in Chinese with English abstract)
[33] ZHAO P, HUANG J, WANG X H, et al. The application of bioflocs technology in high-intensive, zero exchange farming systems ofMarsupenaeusjaponicus[J].Aquaculture, 2012, 354(2): 97-106.
[34] AVNIMELECH Y. Bio-filters: the need for an new comprehensive approach[J].Aquaculturalengineering, 2006, 34(3): 172-178.
[35] SCHVEITZER R, ARANTES R, COSTDIO P F S, et al. Effect of different biofloc levels on microbial activity, water quality and performance ofLitopenaeusvannameiin a tank system operated with no water exchange[J].AquaculturalEngineering, 2013, 56(3): 59-70.
[36] ANDERSSON G, BERGGREN H, CRONBERG G, et al. Effects of planktivorous and benthivorous fish on organisms and water chemistry in eutrophic lakes[J].Hydrobiologia, 1978, 59(1): 9-15.
[37] HARI B, MADHUSOODANA K, VARGHESE J T, et al. Effects of carbohydrate addition on production in extensive shrimp culture systems[J].Aquaculture, 2004, 241(1): 179-194.
[38] CRAB R, AVNIMELECH Y, DEFOIRDT T, et al. Nitrogen removal techniques in aquaculture for a sustainable production[J].Aquaculture, 2007,270(1): 1-14.
[39] DAUFRESNE T, LACROIX G, BENHAIM D, et al. Coexistence of algae and bacteria: a test of the carbon hypothesis[J].AquaticMicrobialEcology, 2008,53(3):323-332.
[40] SCHNEIDER O, SERETI V, EDING E H, et al. Analysis of nutrient flows in integrated intensive aquaculture systems[J].AquacultureEngineering, 2005,32(3): 379-401.
[41] XU H, PAERL H W, QIN B Q, et al. Nitrogen and phosphorus inputs control phytoplankton growth in eutrophic Lake Taihu, China[J].LimnologyandOceanography, 2010,55(1): 420-432.
[42] 赵以军,刘永定. 有害藻类及其微生物防治的基础:藻菌关系的研究动态[J]. 水生生物学报,1996,20(2):173-181.
ZHAO Y J, LIU Y D. Possible microbial control on the adverse impacts of algae: current information about the relationship between algae and microbes[J].ActaHydrobiologicaSinica,1996,20(2):173-181. (in Chinese with English abstract)

