黄连对链脲佐菌素诱导的2型糖尿病大鼠模型炎症因子的影响
王宏伟 苏轲 谢波
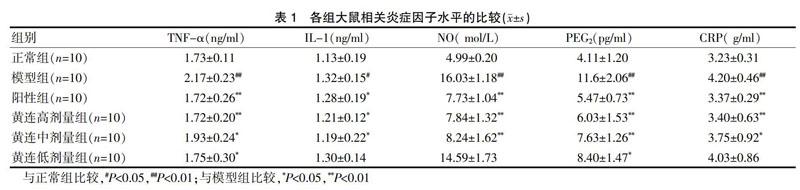
[摘要]目的 建立2型糖尿病大鼠模型,探討黄连对2型糖尿病大鼠炎症因子的影响。方法 利用高脂高糖饲料饲养诱导与链脲佐菌素(STZ)联合造模,将造模成功的60只雄性大鼠随机分为正常组、模型组、阳性组(二甲双胍0.097 g/kg)、黄连高剂量组(4.360 g/kg)、黄连中剂量组(2.910 g/kg)、黄连低剂量组(1.450 g/kg),每组各10只。给药组均灌胃给药3周,同时正常组、模型组灌胃等量0.5%羧甲基纤维素钠(CMC-Na)溶液。3周后分别测定各组的肿瘤坏死因子α(TNF-α)、白介素1(IL-1)、一氧化氮(NO)、前列腺素E2(PGE2)和急性期反应蛋白(CRP)相关炎症因子水平。结果 模型组的TNF-α、IL-1、NO、PEG2、CRP水平均高于正常组,差异有统计学意义(P<0.05);阳性组、黄连高、中剂量组的TNF-α、IL-1、NO、PEG2、CRP水平均低于模型组,差异有统计学意义(P<0.05);其中黄连高剂量组的TNF-α、IL-1、NO、PEG2、CRP水平与阳性组相当(P>0.05);黄连低剂量组的TNF-α、PEG2水平均低于模型组,差异有统计学意义(P<0.05);黄连低剂量组的IL-1、NO和CRP水平与模型组比较,差异无统计学意义(P>0.05)。结论 黄连可以降低2型糖尿病大鼠的炎症因子水平,为研究2型糖尿病的潜在发病机制及黄连的药理机制提供理论依据。
[关键词]黄连;2型糖尿病;炎症因子
[中图分类号] R56 [文献标识码] A [文章编号] 1674-4721(2018)12(c)-0035-03
[Abstract] Objective To establish the rat model of type 2 diabetes mellitus (T2DM) and explore the effect of Rhizoma Coptidis (RC) on inflammatory factors in T2DM rats. Methods The rats were fed with high-fat and high-sugar diet and induced by streptozotocin (STZ) for modeling. A total of 60 male rats were randomly divided into normal group, model group, positive group (0.097 g/kg Metformin), RC high-dose group (4.360 g/kg), RC middle-dose group (2.910 g/kg), and RC low-dose group (1.450 g/kg), with 10 rats in each group. The drug-administered groups were intragastrically administered for 3 weeks. At the same time, the identical amount of 0.5% sodium carboxymethylcellulose (CMC-Na) was gavaged in the normal and model group. The levels of tumor necrosis factor α (TNF-α), interleukin-1 (IL-1), nitric oxide (NO), prostaglandin E2 (PGE2), and C-reactive protein (CRP) at an acute stage after 3-week intervention were determined. Results The levels of TNF-α, IL-1, NO, PEG2 and CRP in the model group were higher than those in the normal group, and the differences were statistically significant (P<0.05). The levels of TNF-α, IL-1, NO, PEG2 and CRP in the positive group, RC high-dose group and RC middle-dose group were lower than those in the model group, and the differences were statistically significant (P<0.05). The levels of TNF-α, IL-1, NO, PEG2 and CRP in the RC high-dose group were similar to those in the positive group (P>0.05). The levels of TNF-α and PEG2 in the RC low-dose group were lower than those in the model group, and the differences were statistically significant (P<0.05). The levels of IL-1, NO and CRP in the RC low-dose group were not significantly different from those in the model group (P>0.05). Conclusion RC can reduce the levels of inflammatory factors in T2DM rats, and provide a theoretical basis for studying the potential pathogenesis of T2DM and the pharmacological mechanism of RC.
[Key words] Rhizoma Coptidis; Type 2 diabetes mellitus; Inflammatory factors
糖尿病是一种由遗传和环境因素相互作用而引起的慢性代谢性疾病,其主要病理特征是胰岛素分泌缺陷或作用障碍导致葡萄糖升高[1]。2型糖尿病具有胰岛素抵抗或分泌不足的特征,一般不需要依赖注射胰岛素[2]。其病理机制尚无统一定论,目前炎症学说是接受度较高的发病机制之一[3-4]。该学说认为炎症因子可抑制细胞膜上的葡萄糖转运蛋白,造成高胰岛素血症,从而诱发胰岛素抵抗。其次,过量炎症因子还可直接抑制胰岛素信号传导,引起胰岛素抵抗。另外,临床研究表明,2型糖尿病患者伴有持续的低度炎症反应,因此其属于慢性炎症性疾病[5]。其涉及到的炎症标志物有:肿瘤坏死因子α(TNF-α)、白介素1、6、8(IL-1、6、8)、急性期反应蛋白(CRP)、脂联素、干扰素(IFN)等。因此,改善体内的持续性炎症反应与糖尿病的治疗有密切关系。
黄连首载于《神农本草经》,《中国药典》(2015版)规定其为毛茛科植物黄连(Coptis Chinensis Franch)、三角葉黄连(Coptis Deltoidea C.Y.Chenget Hsiao)或云连(Coptis Teeta Wall.)的干燥根茎,其味苦、性寒,归心、脾、胃、肝、胆、大肠经[6]。在中医理论中,糖尿病属于“消渴病”范畴,发展早期以“湿热瘀阻”为主,治疗以清泄火热为主[7-8]。中药黄连被用作治疗“消渴病”具有悠久的历史[9]。《本草纲目》云:“治消渴,用酒蒸黄连”;《名医别录》亦云:“黄连止消渴”。基于以上理论指导,本研究拟采用链脲佐菌素(STZ)诱导的2型糖尿病大鼠模型,探讨黄连提取物对其炎症水平的影响,以期为研究2型糖尿病的潜在发病机制及黄连的药理机制提供理论依据。
1材料与方法
1.1仪器与试药
G-421型血糖仪(爱奥乐);分析天平[New Classic ML梅特勒-托利多(美国)];真空干燥箱(上海一恒DZF-6020);黄连(购于本地药材市场,经相关专家鉴定为毛茛科植物Coptis Chinensis Franch);STZ[Sigma公司(美国),批号:019k1022];羧甲基纤维素钠(CMC-Na上海康朗生物科技有限公司);二甲双胍(中美海施贵宝制药有限公司,批号:AAL3451);高脂高糖饲料(北京科澳协力饲料有限公司,批号:20161217);TNF-α检测试剂盒(天津九鼎生物技术有限公司,批号:20170325);IL-1检测试剂盒(南京建成生物技术有限公司,批号:20170215);PGE2 ELISA试剂盒(美国Cayman公司);NO试剂盒(碧云天生物公司);CRP试剂盒(北京利德曼生化股份有限公司);酶标仪(北京生物科技有限公司)。
1.2实验动物
SPF级SD大鼠60只,体重200~220 g,购自上海西普尔-必凯实验动物有限公司(合格证号码:201300 16007059),饲养于南京中医药大学实验动物中心屏障动物饲养室,按屏障环境内动物实验观察与操作规范进行实验。
1.3方法
1.3.1黄连提取物的制备 取黄连药材2 kg,加10倍量95%乙醇提取2次,每次2 h,过滤,滤液用旋转蒸发仪蒸发浓缩,真空干燥得到提取物。
1.3.2 2型糖尿病大鼠模型的建立 将60只雄性大鼠适应性饲养1周,随机取10只作为正常组,喂养普通饲料。其余大鼠用高脂高糖饲料喂养4周后,禁食不禁水12 h,腹腔注射STZ溶液(35 mg/kg),3 d后测定血糖,将2个星期后血糖依旧稳定,且空腹血糖>11.1 mmol/L的大鼠纳入2型糖尿病模型。
1.3.3分组与给药方案 将造模成功的SD大鼠随机分为模型组、阳性组(二甲双胍0.097 g/kg),根据临床用药剂量换算,将给药组分为黄连高剂量组(4.360 g/kg)、黄连中剂量组(2.910 g/kg)、黄连低剂量组(1.450 g/kg),每组各10只。正常组与模型组按0.010 ml/g给药体积给予0.5%的羧甲基纤维素钠(CMC-Na),各给药组分别给药,每天1次,连续给药3周。
1.3.4炎症因子水平测定 给药3周后,各组大鼠眼眶取血,3500 r/min离心10 min,分离血清,采用Griess法或ELISA等方法测定TNF-α、IL-1、NO、PGE2和CRP相关炎症因子的水平,具体操作参照试剂盒说明书进行。
1.4统计学方法
采用SPSS 17.0统计学软件进行数据分析,计量资料用均数±标准差(x±s)表示,两组间比较采用t检验,以P<0.05为差异有统计学意义。
2结果
模型组的TNF-α、IL-1、NO、PEG2、CRP水平均高于正常组,差异有统计学意义(P<0.05);阳性组、黄连高、中剂量组的TNF-α、IL-1、NO、PEG2、CRP水平均低于模型组,差异有统计学意义(P<0.05);其中黄连高剂量组的TNF-α、IL-1、NO、PEG2、CRP水平与阳性组相当(P>0.05);黄连低剂量组的TNF-α、PEG2水平均低于模型组,差异有统计学意义(P<0.05);黄连低剂量组的IL-1、NO和CRP水平与模型组比较,差异无统计学意义(P>0.05)(表1)。
3讨论
随着中国经济的发展,人们生活水平正逐步提高,糖尿病的发病人数(2型糖尿病为主)也逐年攀升,严重威胁着人类的健康[10]。2型糖尿病的发病机制复杂,目前其病因尚未完全阐明。近年来国内外学者对糖尿病作了大量研究[11-13],接受度较高的病理机制之一为炎症学说。糖尿病属于中医学“消渴”范畴,但中医药对其机制研究尚不够深入,这在一定程度上限制了中医药在临床的应用[14]。本研究将成功造模的2型糖尿病大鼠口服黄连提取物后检测其炎症因子水平,探究中药黄连对2型糖尿病的治疗作用,为研究2型糖尿病的潜在机制及黄连的药理机制提供依据。
本研究选取测定的炎症因子具有代表性且相对较全,结果显示,模型组大鼠5种炎症因子(TNF-α、IL-1、NO、PEG2、CRP)水平均显著高于正常组,而二甲双胍作为代表性降糖药,阳性组大鼠炎症因子水平显著低于模型组(P<0.05),其从正面和侧面均提示2型糖尿病和炎症发生具有一定的相关性,为研究其潜在的发生机制提供了理论依据。其次也提示2型糖尿病发病机制较为复杂,与体内多种信号通路有关,如和TNF-α、IL-1炎症因子相关的IKK/NF-κB通路[15]、NO相关的一氧化氮合酶(iNOS)/NO通路等有关[16]。黄连高剂量组的炎症因子水平与阳性组相当,而显著低于模型组,提示黄连对2型糖尿病具有一定的治疗作用。黄连低剂量组与黄连高剂量组比较,其炎症因子水平较高,与模型组无显著差别,提示黄连低剂量时对2型糖尿病的治疗效果相对较差,进而推测黄连治疗2型糖尿病存在一定的量-效相关性,这将为黄连在临床上的应用提供参考。
综上所述,黄连可以降低2型糖尿病大鼠的炎症因子水平,为研究2型糖尿病的潜在发病机制及黄连的药理机制提供理论依据。
[参考文献]
[1]Zimmet PZ,Magliano DJ,Herman WH,et al.Diabetes:a 21st century challenge[J].Lancet Diabetes Endocrinol,2014,2(1):56-64.
[2]Chamberlain JJ,Herman WH,Leal S,et al.Pharmacologic therapy for type 2 diabetes:synopsis of the 2017 American Diabetes Association Standards of Medical Care in Diabetes[J].Ann Intern Med,2017,166(8):572-578.
[3]Marchetti P.Islet inflammation in type 2 diabetes[J].Diabetologia,2016,59(4):668-672.
[4]Hameed I,Masoodi SR,Mir SA,et al.Type 2 diabetes mellitus:from a metabolic disorder to an inflammatory condition[J].World J Diabetes,2015,6(4):598.
[5]段雨函,李宗清.2型糖尿病患者血清抵抗素水平與血糖及炎症因子的相关性研究[J].标记免疫分析与临床,2016, 23(9):1045-1048.
[6]国家药典委员会.中华人民共和国药典[S].2015年版一部.北京:中国医药科技出版社,2015.
[7]罗清艳.有关中医药治疗糖尿病消渴症的研究进展[J].现代养生,2017,(18):153.
[8]文颖娟.消渴病症研究述评[J].时珍国医国药,2014,25(1):156-159.
[9]仝小林.黄连为主药系列经方在糖尿病辨治中的运用[J].中医杂志,2013,54(3):209-211.
[10]Yang L,Shao J,Bian Y,et al.Prevalence of type 2 diabetes mellitus among inland residents in China (2000-2014):a meta-analysis[J].J Diabetes Invest,2016,7(6):845-852.
[11]Koffler M,Ramirez LC,Raskin P.Insulin resistance and diabetes,mechanism and possible intervention[J].Diabetes Res Clin Pr,2015,7(2):83-98.
[12]Al-Goblan AS,Al-Alfi MA,Khan MZ.Mechanism linking diabetes mellitus and obesity[J].Diabetes Metab Syndr Obes,2014,7:587-591.
[13]Han JL,Lin HL.Intestinal microbiota and type 2 diabetes:from mechanism insights to therapeutic perspective[J].World J Gastroenterol,2014,20(47):17737-17745.
[14]陈芳,刘东波.中药活性成分降血糖作用机制研究进展[J].中医药学报,2012,40(4):123-127.
[15]Fu J,Shi Q,Song X,et al.Tetrachlorobenzoquinone exhibits neurotoxicity by inducing inflammatory responses through ROS-mediated IKK/IκB/NF-κB signaling[J].Environ Toxicol Pharmacol,2016,41(1):241-250.
[16]郑海崇,曾勉,何婉媚,等.Ghrelin对脓毒症大鼠肺泡巨噬细胞炎症信号通路Akt、NF-κB和iNOS的影响[J].中山大学学报(医学科学版),2018,39(1):1-8.

