术中保温干预减少老年股骨转子间骨折围手术期失血量
210011南京医科大学第二附属医院骨科
围手术期控制性低体温对于需要体外循环的患者、大血管手术必须阻断动脉主干的患者、神经外科需阻断脑循环的患者,有利于降低机体组织的耗氧量,减少血流再灌注后所引起的损伤,减轻脑水肿。在临床工作中常常被采用。但围手术期非控制性低体温在外科手术时,也常常发生。有研究发现[1],围手术期低体温在外科手术中发生率高达50%。老年患者髋部骨折发病率高,保守治疗卧床牵引时间长、卧床并发症多、生活质量差,手术治疗能够早期下床活动,减少并发症的发生,提高患者生存率和生活质量。股骨转子间骨折围手术期的失血量大是无法避免的,失血量的多少常常在一定程度上影响着患者病情的恢复速度、住院时间的长短等。老年患者因其生理特点,恢复更加缓慢,为了达到快速康复的目的,减少围手术期失血是目前临床研究的一个方向。本研究发现采用术中保温干预措施,防止术中低体温,可减少老年股骨转子间骨折围手术期失血,促进患者快速康复。
资料与方法
病例纳入和排除标准。①病例纳入标准:老年股骨转子间骨折行髓内固定手术治疗的患者(≥65岁)。术中采用保温干预措施且中心体温≥36.0℃或未采用保温干预措施且中心体温<36.0℃。②排除标准:手术时间>1.5 h、凝血功能障碍、术前贫血(Hb<90 g/L)、多发伤、合并其他部位骨折、病理性骨折、开放性骨折、陈旧性骨折、长期使用抗凝药物、术前发热(体温>37.5℃)、术前检查出深静脉血栓等患者。
本研究共纳入52例患者,按照术中中心体温分为保温干预组和低体温组。其中男20例,女32例;年龄65~92岁,平均78.1岁。致伤原因:均为低能量损伤意外跌倒、坠床等。所有患者均行手术髓内内固定治疗(PFNA或interTan)。33例患者合并高血压、糖尿病、冠心病等慢性基础病。受伤至手术时间1~9 d,平均3.7 d。
手术方法及保温措施:患者采用全身麻醉或蛛网膜下腔阻滞联合硬膜外麻醉,手术方式为股骨近端微创入路PFNA或InterTan内固定。术中体温干预组采用输液加热器(设定加热温度39℃)、热风保温毯、加盖毛毯等保温措施。低体温组,常规盖毛毯保温。并在麻醉前、手术中、麻醉复苏期使用直肠内体温探头检测中心体温。
术后处理:术后24 h内预防性使用抗生素,术后1 d复查血常规,根据红细胞压积,决定是否输血治疗。术后1周再次复查血常规。所有患者术后12 h后开始使用低分子肝素抗凝治疗,如有出血倾向则停用低分子肝素。术后常规使用下肢梯度弹力袜和踝泵训练预防下肢深静脉血栓,并复查下肢深静脉B超。
收集资料:①记录患者的身高、体重和术前、术后血常规检查中Hb、Hct的数值,术中中心体温、输血量、受伤至手术时间、住院时间。②通过公式求出患者围手术期的总失血量。假定患者血容量保持基本恒定,患者的血容量可通过公式计算:男性PBV(L)=0.366 9×H3(m)+0.032 19×W(kg)+0.604 1;女性PBV(L)=0.356 1×H3(m)+0.033 08×W(kg)+0.183 3。通过Hct和血容量来计算总失血量。总失血量(mL)=[PBV(L)×(Hct术前-Hct术后)×1 000+输血量(mL)]/[1/2×(Hct术前+Hct术后)]。
表1 两组一般资料比较(±s)

表1 两组一般资料比较(±s)
组别 例数 年龄 性别 BMI 骨折AO分型(例) 术前Hb(g/L) 术前Hct(%)合并内科疾病(例)受伤至手术时间(d)(岁) 男 女 (kg/m2) A1 A2 A3 A B C保温干预组 28 73.9±12.1 11 17 21.53±2.83 13 13 0 108.62±18.73 31.7±3.8 18 11 10 4.2±1.6低体温组 24 69.8±14.4 9 15 21.72±2.46 12 14 0 111.19±16.35 32.4±3.7 12 10 12 3.6±1.8 P 0.612 0.873 0.759 0.726 0.672 0.483 0.528注:A:高血压;B:糖尿病;C:脑血管病变。
表2 两组指标比较(±s)
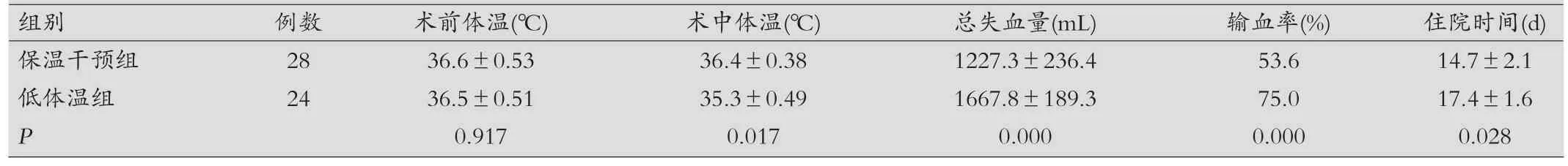
表2 两组指标比较(±s)
组别 例数 术前体温(℃) 术中体温(℃) 总失血量(mL) 输血率(%) 住院时间(d)保温干预组 28 36.6±0.53 36.4±0.38 1227.3±236.4 53.6 14.7±2.1低体温组 24 36.5±0.51 35.3±0.49 1667.8±189.3 75.0 17.4±1.6 P 0.917 0.017 0.000 0.000 0.028
统计分析:应用SPSS 17.0分析,计量资料采用(±s)表示,采用t检验;计数资料采用%表示,采用χ2检验。P<0.05差异有统计学意义。
结 果
保温干预组和低体温组患者的一般情况,包括年龄、性别、BMI、骨折AO分型、术前Hb和Hct、合并内科疾病、受伤到手术时间等,比较差异无统计学意义(P>0.05),具有可比性,见表1。
两组体温情况:术前两组患者体温,保温干预组(36.6±0.53)℃,低体温组(36.5±0.51)℃,两者统计学比较差异无统计学意义(P>0.05)。手术开始后,由于麻醉药物、保温措施等影响,患者体温开始下降,待体温趋于平稳,体温干预组(36.4±0.38)℃,常规处理组(35.3±0.49)℃,两组体温差异有统计学意义(P<0.05)。
两组失血量比较:保温干预组的失血量(1 227.3±236.4)mL,低体温组失血量(1 667.8±189.3)mL,保温干预组的失血量明显少于低体温组(P<0.05)。
住院时间比较:术前住院时间,保温干预组(4.2±1.6)d,低体温组(3.6±1.8)d,两者差异无统计学意义(P>0.05)。住院时间,保温干预组(14.7±2.1)d,低体温组(17.4±1.6)d,两者差异有统计学意义(P<0.05)。
输血率比较:保温干预组53.6%,低体温组75.0%,差异有统计学意义(P<0.05)。
两组指标比较,见表2。
术后并发症比较:两组患者均未发生切口感染、肺炎、深静脉血栓、肺栓塞等术后并发症。
讨 论
围手术期非控制性低体温是一种非常常见的麻醉后手术的并发症。轻微的体温降低(中心温度在34~36℃)也会增加心脏不良事件的发生率、术后感染的风险、麻醉复苏时间及住院时间等。故本研究按中心体温是否<36℃分为两组进行研究。世界卫生组织关于手术安全的指导方针里强调了围手术期保持患者正常核心体温对手术安全的重要性,这一点也让很多骨科医生意识到围手术期保持正常体温对手术成功的关键性。有研究发现[2],术中保持正常体温可减少术中出血量。术中出血量的计量会受到冲洗液和按湿纱布数量估计出血等因素影响,不是特别精确。并且没有考虑到术中低体温可能影响围手术期隐形失血量。故本研究考察的是围手术期失血量。这样能够反映术中体温对于围手术期失血的总体影响。
围手术期低体温常由麻醉药物使用,身体暴露于寒冷的手术室环境热量丢失增加,热量的重新分配,代谢产热的减少等多因素引起。低体温使凝血酶原与部分促凝血酶原激时间延长,血小板功能和凝固机制发生异常使术中出血量明显增加[3]。这可能是低体温导致围手术期出血量增大的主要原因。
在术中保温干预实施中曾有报道术中循环温毯仪保导致患者皮肤热损伤[4],本研究中采用热风循环保温毯安全性好,未发生皮肤热损伤。并且术中调节温度方便,有利于防止术中低体温的发生。也有研究者使用普通电热毯进行术中保温[5],虽然也能起到保温效果。但术中电热毯有浸湿导致漏电的风险,危及患者生命安全。普通电热毯温度调节也不方便,一般只有高、中、低档的选择,不能设定工作温度。故还是推荐使用热风循环保温毯,用于术中保温干预,当然适当提高手术室环境温度,减少皮肤暴露面积,术中输液、输血的加热等措施也很重要。
股骨转子间骨折髓内固定技术日益成熟,具有手术创伤小、术中出血少、固定符合生物力学等优势,其近期及远期的疗效已得到广泛的认可。股骨转子间骨折手术的围手术期失血特别是隐性失血也越来越被大家所重视。目前临床上已使用多种方式来达到减少围手术期失血的目的,比如使用止血药物氨甲环酸、控制性降压等。有研究提示术前静脉应用氨甲环酸对髓内固定治疗股骨转子间骨折有减少失血的作用[6],且不增加下肢深静脉血栓形成的风险。还有研究提示术中髓腔内给予3.0 g氨甲环酸可显著降低PFNA术后失血量[7]。围手术期失血过多会导致贫血,贫血会影响患者的康复速度。并且贫血会增加手术导致的输血的风险,从而增加血液传染性疾病的风险。目前临床血资源紧张,虽然在围手术期使用促红细胞生成素(EPO)和铁剂可以减少外科术后贫血发生率,促进患者快速康复。但是减少围手术期失血同样也很总要。在老年患者骨折内固定手术中低体温很常见。术中保温干预,方法简单,减少围手术期失血效果明显,可作为促进骨科老年手术患者快速康复的一项措施推广。

