胃癌组织E1AF、MMP-7表达变化及其意义
马长庚,王丽娟,孙兴盛,翟瑞仁
(1潍坊医学院附属医院,山东潍坊261031;2阳光融合医院)
2018年全世界大约有1 810万例新发癌症患者,约960万例癌症患者死亡,病死率为8.2%,居所有死亡原因的第5位[1]。根据2018年国家癌症中心发布的最新数据显示,我国胃癌的发病率已经居所有恶性肿瘤的第2位[2]。胃癌的发生是一个多步骤、多因素进行性发展过程,需要多种因子的参与。E1A转录因子(E1AF)是ETS癌基因转录因子家族的成员[3],可参与机体的多种生理过程,如细胞增殖、分化、迁移、凋亡及组织发育、新生血管生成和器官形成等。此外,E1AF还与恶性肿瘤的发生密切相关,在肿瘤的浸润、转移过程中发挥重要作用。E1AF是激活多种基质金属蛋白酶(MMPs)亚型的启动因子,在肿瘤细胞突破基底膜屏障进而浸润、转移过程中具有重要作用[4]。MMPs是一类高度同源的蛋白水解内肽酶,以酶原形式分泌,能降解细胞外基质中的各种蛋白成分,可破坏影响肿瘤细胞浸润和转移的组织学屏障,在恶性肿瘤的侵袭和转移中起着关键性作用。MMP-7是降解基底膜和细胞外基质最重要的蛋白水解酶,与多种肿瘤细胞的浸润和转移密切相关。本研究观察了胃癌组织E1AF、MMP-7表达变化,并探讨其意义。现报告如下。
1 材料与方法
1.1 材料 选取潍坊医学院附属医院2015年1月~2016年6月手术切除的胃癌组织及其配对的癌旁正常组织标本各52例份(分别作为观察组和对照组),男35例,女17例;年龄32~79岁、平均53.1岁,其中≤50岁20例、>50岁32;肿瘤直径:≤5 cm 29例,>5 cm 23例;肿瘤部位:胃底22例,胃体30例;临床分期(2010年美国癌症联合委员会推荐的胃癌分期标准):Ⅰ、Ⅱ期30例,Ⅲ、Ⅳ期22例;浸润深度:T1、T2期32例,T3、T4期20例;有淋巴结转移34例,无淋巴结转移18例。所有标本经术后组织病理检查明确诊断,且患者术前未接受任何抗肿瘤治疗。本研究经潍坊医学院附属医院医学伦理委员会批准,患者或其家属知情同意。
1.2 E1AF、MMP-7表达检测 E1AF、MMP-7多克隆抗体,通用型SP系列工作液试剂盒(SP-9000),DAB显色试剂盒(AR1022),均购自武汉博士德生物工程有限公司。取手术切除的组织标本,制作石蜡切片。将切片置于0.01 mol/L枸橼酸缓冲液(pH 6.0)中,煮沸(98 ℃,15~20 min)抗原修复。以PBS代替一抗作为阴性对照。E1AF、MMP-7阳性染色定位于细胞质,呈黄色或黄褐色颗粒。每张切片随机选取5个视野,每视野观察100个细胞,计数阳性染色细胞数。阳性细胞所占比例评分:<5%计0分,5%~25%计1分,>25%~50%计2分,>50%计3分;评价每张切片阳性染色强度评分,无着色计0分,淡黄色计1分,棕黄色计2分,棕褐色计3分。根据两项评分之和综合判断阳性表达。二者评分之和≥3分为阳性表达,<3分为阴性表达[5]。
1.3 统计学方法 采用SPSS17.0统计软件。计量资料比较采用χ2检验或Fisher确切概率检验。相关性分析采用Spearman等级相关分析法。P<0.05为差异有统计学意义。
2 结果
2.1 两组E1AF、MMP-7表达比较 观察组与对照组E1AF阳性表达率分别为61.5%(32/52)、9.60%(5/52),MMP-7阳性表达率分别为73.1%(38/52)、21.1%(11/52)。两组比较P均<0.05。
2.2 胃癌组织E1AF、MMP-7阳性表达与患者临床病理特征的关系 胃癌组织E1AF、MMP-7阳性表达与淋巴结转移、浸润深度、临床分期有关(P均<0.05)。见表1
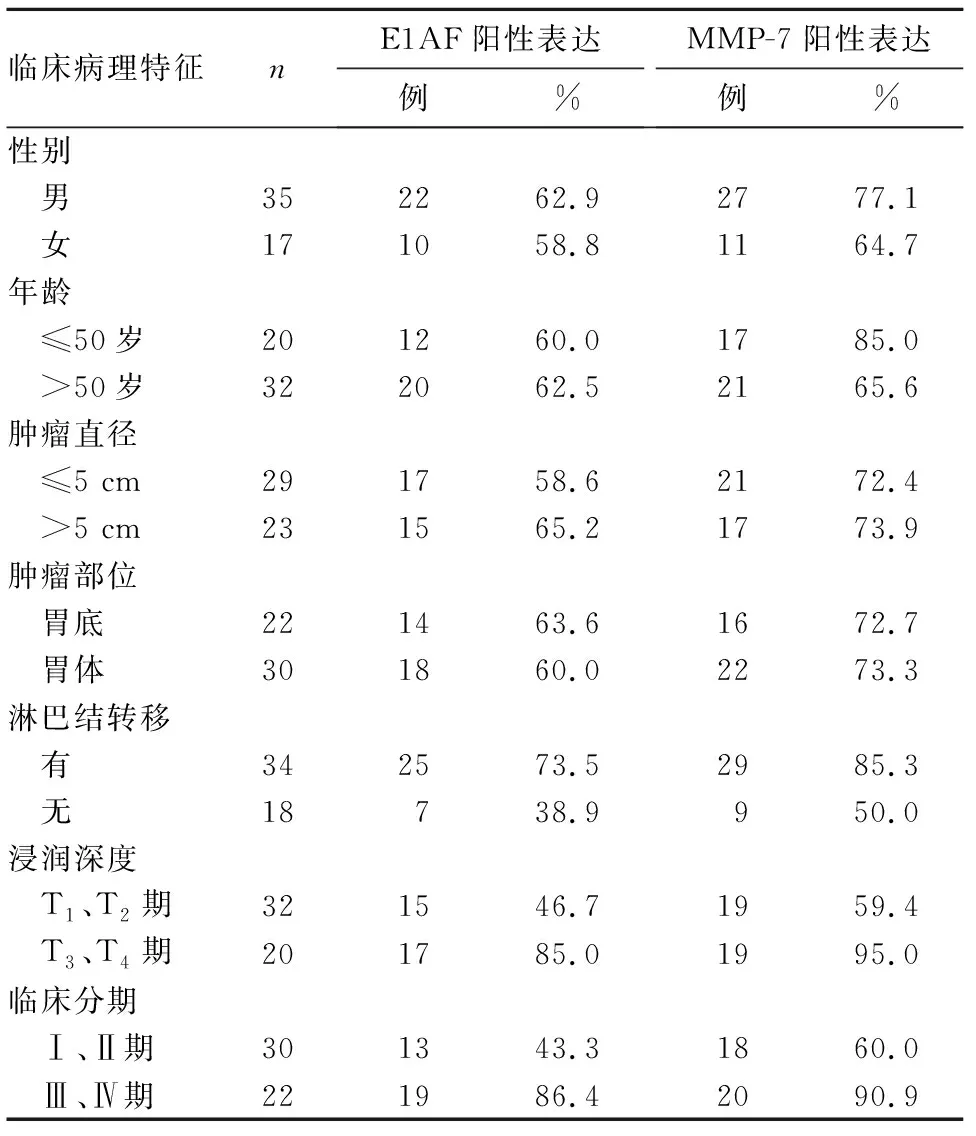
表1 胃癌组织E1AF、MMP-7阳性表达与患者临床病理特征的关系
2.3 胃癌组织E1AF阳性表达与MMP-7阳性表达的关系 胃癌组织E1AF阳性表达与MMP-7阳性表达呈正相关关系(r=0.500,P<0.05)。
3 讨论
胃癌是临床常见的恶性肿瘤之一,其发病率居于我国消化系统恶性肿瘤的首位,并且近年来发病呈低龄化趋势。尽管胃癌的早期诊断和综合治疗取得了很大进步,但其仍为我国现阶段发病率最高的消化系统恶性肿瘤,每年有超16万人死于胃癌[6,7]。胃癌的浸润和转移是影响患者生存质量和预后的主要因素。浸润和转移是恶性肿瘤的重要特征,其中肿瘤新生血管生成和肿瘤周围基质破坏,在肿瘤的浸润转移过程中具有关键性作用。
E1AF是小鼠PEA3基因的人类同源基因。E1AF基因定位于染色体17q21,有两个主要功能区,即酸性区和ETS区,分别由3个外显子编码[8]。ETS区位于ETS蛋白C区,由85个氨基酸组成。ETS区能特异性识别结合嘌呤的DNA靶心序列GGAA/T[9]。ETS区域作为一个特异性DNA结合区域,存在于大多数病毒的DNA调控序列中,还存在于与细胞外基质降解及血管生成相关多种基因的5′-侧翼调节区,具有反式活化功能[10]。E1AF在组织分化程度高的肿瘤细胞中低表达,而在组织分化程度低的肿瘤细胞中高表达[11]。E1AF是ETS癌基因家族的成员[3],是各种MMPs亚型的启动因子,可上调与肿瘤发生相关许多基因的启动子[12]。Yamamoto等[13]发现,胃癌组织E1AF阳性表达与肿瘤浸润深度、淋巴结转移、脉管侵犯和pTNM分期等临床病理特征相关,且与MMPs阳性表达密切相关,在胃癌的发生、发展中具有关键性作用。
MMPs是一类锌依赖性内肽酶,活性部位都含有一个Zn+,能降解一种或几种细胞外基质,在血管壁的穿透以及促进肿瘤细胞转移和基质降解过程中起主导作用。目前发现的MMPs至少有28种[14],根据其作用底物不同及片段同源性,可分为五类[15]。MMP-7是MMPs家族中的最小成员,是恶变上皮细胞特异性表达的酶类。MMP-7不但能参与胃癌的浸润、转移,而且与患者预后有关[16~18]。有研究显示,肿瘤瘤体体积大小是淋巴结转移的独立危险因子[19]。Grigioni等[17]发现,胃肠道肿瘤组织MMPs含量明显高于正常组织,且表达强度与胃癌分期、淋巴结转移呈正相关关系。Yamamoto等[13]将E1AF反义转染胃癌细胞MKN-45,结果显示MMP-7表达下降,而且其侵袭性比模拟转染的MKN-45细胞亦明显降低。Keld等[20]研究也发现,胃癌组织E1AF表达与MMP-7表达具有相关性。文献报道,MMPs的活性可被MMP-7抗体抑制[21]。因此,E1AF被认为是MMP-7的上游调控因子,通过调节MMP-7,上调胃腺癌相关蛋白和mRNA表达。
本研究显示,观察组E1AF、MMP-7阳性表达率高于对照组,并且E1AF、MMP-7阳性表达与胃癌浸润深度、淋巴结转移及临床分期相关;胃癌组织E1AF阳性表达与MMP-7阳性表达呈正相关关系。由此推测,E1AF、MMP-7可能协同促进胃癌的发生、发展;E1AF有可能成为预测胃癌发生的一个生物标志物和治疗靶点。
总之,胃癌组织E1AF、MMP-7表达升高,二者表达变化与胃癌浸润深度、淋巴结转移及临床分期有关;二者可能协同促进胃癌的发生、发展。

