高浓度尿酸对肾小球内皮细胞氧化应激及炎症反应的影响
张泉,周奕奕,樊星,韩鸿玲
(1 天津医科大学总医院,天津300052;2 天津市第四中心医院)
中国高尿酸血症相关疾病诊疗多学科专家共识将血尿酸水平>7 mg/dL定义为高尿酸血症,并指出其与心血管疾病、高血压、代谢综合征等密切相关[1]。既往研究发现,高尿酸水平不仅能导致动脉血管内皮细胞舒张功能受损[2],还可通过诱导氧化应激反应、激活肾素-血管紧张素系统导致血管内皮功能障碍,引起动脉粥样硬化。但目前高尿酸血症对肾小球内皮细胞影响的报道较少,其作用机制尚不完全清楚。2016年5月~2017年2月,我们观察了体外高浓度尿酸对肾小球内皮细胞的影响,并探讨其可能的作用机制。现报告如下。
1 材料与方法
1.1 材料 人肾小球内皮细胞(HRGEC),购自北京北纳创联生物技术研究院。尿酸(U2625-25G,≥99%),美国Sigma公司;实验前用不含血清的RPMI 1640培养液配制成4、8、16 mg/dL的尿酸溶液。所有引物由上海生工生物工程股份有限公司设计合成。倒置荧光显微镜,美国BD公司;多功能酶标仪,美国Thermo Scientific公司;实时荧光定量PCR仪,瑞士Roche公司;垂直电泳仪、电转移装置,美国Bio-Rad公司。TRIzol,美国Invitrogen公司;CCK-8细胞增殖及毒性检测试剂盒,上海BestBio贝博生物公司;活性氧(ROS)检测试剂盒,江苏碧云天生物技术研究所;RNA逆转录试剂盒、RT-PCR试剂盒,大连宝生物工程有限公司;核因子-κB(NF-κB) p65、细胞间黏附分子1(ICAM-1)一抗,英国Abcam公司;内皮型一氧化氮合酶(eNOS)一抗,美国CST公司;单核细胞趋化蛋白1(MCP-1)一抗,美国BD公司;β-actin二抗,美国Absci公司。
1.2 实验分组处理 HRGEC常规传代培养,取传5~15代、对数生长期、生长状态良好细胞,接种于含10% FBS RPMI 1640培养基的6孔板,每孔4×105个,随机分为阴性对照组、生理浓度尿酸组、中浓度尿酸组、高浓度尿酸组,每组设3个复孔。然后将6孔板置于37 ℃、5% CO2、饱和湿度的细胞培养箱中至少培养24 h。当孔内细胞呈均匀单层生长时,更换新的培养基,各组分别加入0、4、8、16 mg/dL的尿酸溶液,置于37 ℃、5% CO2、饱和湿度的细胞培养箱继续培养24 h。
1.3 细胞活性检测 采用CCK-8法。各组继续培养24 h,每孔加入CCK-8溶液10 μL,37 ℃、5% CO2、饱和湿度的细胞培养箱继续培养4 h。酶标仪于450 nm波长处检测各孔的光密度(OD)值。以OD450值代表细胞活性。
1.4 eNOS、ICAM-1、MCP-1、NF-κB p56表达检测 ①eNOS、ICAM-1、MCP-1、NF-κB p56 mRNA表达:采用RT-PCR法。收集各组继续培养24 h细胞,采用TRIzol法提取细胞总RNA,经紫外-可见光分光光度计鉴定,提取的总RNA纯度和浓度合格,符合后续实验要求。按PrimeScriptTMRT Reagent Kit试剂盒说明将总RNA逆转录为cDNA,以cDNA为模板进行PCR扩增。引物序列:eNOS上游引物5′-GGAGAAGATGCCAAGGCTGCT-3′,下游引物5′-CTTCCAGTGTCCAGACGCACC-3′;ICAM-1上游引物5′-TCTTCCTCGGCCTTCCCATA-3′,下游引物5′-AGGTACCATGGCCCCAAATG-3′;MCP-1上游引物5′-ACCTGGACAAGCAAACCCAA-3′,下游引物5′-AGGGTGTCTGGGGAAAGCTA-3′;NF-κB p65上游引物5′-AAAAACGCATCCCAAGGTGC-3′,下游引物5′-AAGCTCAAGCCACCATACCC-3′;内参GAPDH上游引物5′-GCTCGTTCTACGGCACAGG-3′,下游引物5′-GCACGTAGTCTCCACGACAT-3′。PCR反应体系共20 μL:2×SYBR®Premix Ex TaqTM10 μL,10 μmol/L上下游引物各0.5 μL,cDNA 1 μL,RNase-free ddH2O 8 μL;反应条件:94 ℃预变性30 s,94 ℃变性10 s、62 ℃退火30 s共40个循环。以GAPDH为内参,采用2-ΔΔCT法计算目的基因相对表达量。实验重复3次,取平均值。②eNOS、ICAM-1、MCP-1、NF-κB p56蛋白表达:采用Western blotting法。收集各组继续培养24 h细胞,采用蛋白裂解液提取细胞总蛋白,BCA法蛋白定量合格。100 ℃水浴10 min,使蛋白充分变性。取变性蛋白10 μg进行10% SDS-PAGE,先以70 V电压跑胶至Marker胶充分分离,再调整电压至120 V,直至电泳结束,然后将蛋白电泳产物转印至PVDF膜上。用5% BSA室温封闭2 h,分别加入eNOS一抗(稀释比1∶1 000)、ICAM-1一抗(稀释比1∶100)、MCP-1一抗(稀释比1∶1 000)、NF-κB p56一抗(稀释比1∶1 000)及β-actin一抗(稀释比1∶3 000),4 ℃孵育过夜;次日,TBST冲洗10 min×3次,加入相应二抗(稀释比均为1∶5 000),室温孵育2 h。TBST冲洗10 min×3次,ECL发光、显影。采用Image J软件分析各蛋白电泳条带灰度值。以β-actin为内参,以目的蛋白电泳条带灰度值/内参蛋白电泳条带灰度值作为目的蛋白相对表达量。实验重复3次,取平均值。
1.5 ROS含量检测 采用荧光探针法。收集各组继续培养24 h细胞,接种于24孔板,加入1∶1 000稀释的ROS阳性对照试剂Rosup,37 ℃、5% CO2、饱和湿度的细胞培养箱中避光孵育30 min。吸弃培养液,用无菌PBS彻底清洗3次,加入1∶1 000稀释的荧光探针DCFH-DA(终浓度10 μmol/L),37 ℃、5% CO2、饱和湿度的细胞培养箱中避光孵育30 min。用无血清的培养液洗涤3次,去除未进入细胞内的DCFH-DA。倒置荧光显微镜下随机选取含有HRGEC的视野(200倍),在488 nm激发波长、525 nm发射波长下观察细胞内DCF相对荧光单位,根据相对荧光单位计算细胞内ROS相对含量。实验重复3次,取平均值。
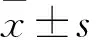
2 结果
2.1 各组细胞活性比较 阴性对照组、生理浓度尿酸组、中浓度尿酸组、高浓度尿酸组细胞活性分别为0.302±0.035、0.302±0.027、0.295±0.013、0.300±0.036。各组细胞活性比较P>0.05。
2.2 各组eNOS、ICAM-1、MCP-1、NF-κB p65表达比较 见表1。
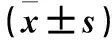
表1 各组eNOS、ICAM-1、MCP-1、NF-κB p65 mRNA相对表达量比较
注:与对照组比较,*P<0.05;与生理浓度尿酸组比较,#P<0.05。
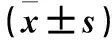
表2 各组eNOS、ICAM-1、MCP-1、NF-κB p65蛋白相对表达量比较
注:与对照组比较,*P<0.05;与生理浓度尿酸组比较,#P<0.05。
2.3 各组ROS含量比较 阴性对照组、生理浓度尿酸组、中浓度尿酸组、高浓度尿酸组ROS相对含量分别为1.006±0.000、0.910±0.003、4.746±0.004、7.047±0.003。中浓度尿酸组、高浓度尿酸组ROS相对含量明显高于阴性对照组、生理浓度尿酸组(P均<0.05),而阴性对照组与生理浓度尿酸组、中浓度尿酸组与高浓度尿酸组ROS相对含量比较P均>0.05。
3 讨论
随着社会经济发展,高尿酸血症的患病率正逐年升高,据美国国家健康和营养调查显示,其患病率较30年前提高了3.2%[3]。临床研究证实,高尿酸血症与心血管疾病、代谢综合征、高血压等疾病的发生、发展和预后密切相关[4]。高尿酸水平不仅能导致动脉血管内皮细胞舒张功能受损,还可通过诱导氧化应激反应、激活肾素-血管紧张素系统导致血管内皮功能障碍,引起动脉粥样硬化。已有研究证实,高尿酸血症是血管内皮细胞受损的危险因素之一。但目前高尿酸血症对肾小球内皮细胞影响的报道较少,其作用机制尚不完全清楚。
本研究观察了0、4、8、16 mg/dL尿酸对肾小球内皮细胞活性的影响,结果发现,各浓度尿酸作用下HRGEC活性无明显变化,表明尿酸在此浓度范围内无明显细胞毒性,可用这些浓度进行后续实验。
NO是内皮细胞产生的舒张血管因子,由eNOS作用于L-精氨酸生成[5],在维持肾脏血管张力、调节肾脏血压等方面具有重要作用。但在高尿酸环境下,血管内皮细胞释放NO的能力降低,可造成内皮细胞损伤[6];同时,高尿酸还可抑制内皮细胞增殖和迁移,并抑制NO产生。因此认为,尿酸有可能是导致内皮细胞功能障碍的介质之一[7]。Kang等[8]研究发现,尿酸可通过降低eNOS与钙调蛋白的结合,降低精氨酸向NO的转化速率,从而使eNOS活性降低、NO生成减少,导致内皮细胞功能障碍[6]。有研究证实,高尿酸还可导致线粒体内Ca2+超负荷、升高O2-,并通过miR-155下调eNOS表达,引起内皮细胞功能障碍,进而加重肾损伤[9]。ROS是需氧细胞在代谢过程中产生的一系列活性氧簇,正常状态下,ROS具有平衡血管收缩和舒张功能,可通过调节细胞相关信号通路,维持细胞正常生长。但高浓度ROS可通过氧化应激反应导致细胞凋亡和坏死[10]。既往研究证实,高浓度尿酸可通过氧化应激反应,导致动脉血管壁和毛细血管内皮细胞功能障碍,最终引起动脉粥样硬化。高尿酸水平下,ROS可激活诱导型NOS,使NO的生物利用度降低,阻断NO信号通路,从而损害血管舒张功能[11]。本研究结果发现,中浓度尿酸组、高浓度尿酸组eNOS mRNA与蛋白相对表达量明显低于阴性对照组、生理浓度尿酸组,而阴性对照组与生理浓度尿酸组、中浓度尿酸组与高浓度尿酸组eNOS mRNA与蛋白相对表达量比较差异均无统计学意义。表明尿酸浓度升高可导致eNOS mRNA和蛋白表达降低,从而引起ROS生成增多,继而引起肾小球内皮细胞损伤。
在应激状态下,肾小球内皮细胞可产生ICAM-1、MCP-1、NF-κB等炎症因子或趋化因子[12]。ICAM-1属于黏附分子中免疫球蛋白超家族的成员,通过与其受体特异性结合,使炎症细胞与内皮细胞间的黏附作用增强,从而参与细胞间的信号转导与活化、炎症反应等病理生理过程。生理状态下,ICAM-1在内皮细胞低表达。罗海清[13]研究发现,动脉粥样硬化合并高尿酸血症患者血清CRP、ICAM-1水平较尿酸正常者明显升高。动物研究亦发现,高尿酸血症可引起肾脏血管内皮细胞ICAM-1表达升高。MCP-1作为一种促炎细胞因子,可趋化和激活单核细胞,促进炎症因子表达[14]。生理条件下,肾小球系膜细胞MCP-1低表达。当MCP-1过表达时,肾小球系膜细胞可释放ICAM-1等多种炎症因子,造成肾组织损伤;过量的MCP-1还可参与氧化应激反应等途径,激活单核巨噬细胞系统,诱导炎症细胞聚集,导致局部组织炎症级联反应,损伤内皮细胞功能[15]。NF-κB是从B淋巴细胞的细胞核抽提物中发现的一种转录因子,能与免疫球蛋白κ轻链基因的增强子B序列GGGACTTTCC特异性结合,促进κ轻链基因表达。迄今共发现NF-κB2(p52)、NF-κB1(p50)、c-Rel、RelA(p65)、RelB五种NF-κB蛋白家族成员。这些蛋白可通过与多种基因的启动子和增强子序列位点特异性结合,调节基因的转录和表达,参与免疫反应、炎症反应和应激反应等,还能参与调控细胞增殖、分化、凋亡等过程。有研究已证实,在MCP-1、ICAM-1的基因启动子存在NF-κB的结合位点[16]。临床研究发现,高浓度尿酸可激活NF-κB通路,使人脐静脉内皮细胞ICAM-1、MCP-1过表达[17]。本研究结果发现,中浓度尿酸组、高浓度尿酸组ICAM-1、MCP-1、NF-κB p65 mRNA和蛋白相对表达量均明显低于高于阴性对照组、生理浓度尿酸组,而阴性对照组与生理浓度尿酸组、中浓度尿酸组与高浓度尿酸组ICAM-1、MCP-1、NF-κB p65 mRNA和蛋白相对表达量比较差异均无统计学意义。表明随着尿酸浓度升高,ICAM-1、MCP-1 mRNA和蛋白表达增加,从而促进内皮细胞炎症反应,导致肾小球内皮细胞损伤;而且NF-κB p65表达上调与ICAM-1、MCP-1表达上调一致,由此推测高尿酸对肾小球内皮细胞的损伤与NF-κB经典炎症通路的激活有关。但生理浓度尿酸组MCP-1、ICAM-1表达与阴性对照组比较差异无统计学意义,与以往报道不符,可能与最低尿酸浓度设定过高或取值单一有关,后期进一步完善0~4 mg/dL尿酸对炎症因子表达的影响。
综上所述,高浓度尿酸可能通过增加氧化应激途径中ROS产生和抑制eNOS表达,以及激活NF-κB信号通路促进炎症因子分泌等,导致肾小球内皮细胞损伤。

