根箱种植下不同水肥管理模式对小麦生育后期根系氮代谢酶活性及产量的影响
姜丽娜,朱娅林,张雅雯,赵凌霄,李春喜
(河南师范大学 生命科学学院,河南新乡453007)
粮食安全为人类生存和发展提供最根本的保障,在国民经济中发挥着至关重要的作用[1-2]。中国粮食作物产量的1/4左右来自河南省,河南省位于黄淮麦玉两熟区的关键地带,已经成为中国粮食作物生产中举足轻重的主产区之一[3]。由于基础地力和栽培管理水平等方面的差异,在河南不少地区种植的小麦都没有充分发挥其应有的潜力,其中水分与肥料的管理是实现小麦优质高效的一项重要栽培管理措施[4]。
氮代谢是植物体内的重要物质代谢,在生命活动中具有特殊作用。氮素不仅影响植物新陈代谢而且影响体内的资源分配以及所有水平上的发育[5-8]。以往的研究偏重于小麦地上部分氮代谢,因其与地上部分生物产量和经济产量密切相关。但是,对吸收水分和土壤养分以及活性物质合成的重要器官——根系的研究则比较少[9]。不仅如此,关于小麦栽培中不同管理模式对氮代谢的影响,前人的研究多集中在某个单方面因素,例如品种基因型、灌水以及肥料等[10-11]。已有研究认为,控水条件下水分亏缺降低了小麦籽粒谷氨酰胺合成酶、谷氨酸合成酶、谷丙转氨酶以及旗叶谷氨酰胺合成酶、谷氨酸合成酶活性,并且影响了小麦籽粒谷丙转氨酶活性的变化趋势[12];增施氮肥可以有效提高小麦根系谷氨酰胺合成酶和硝酸还原酶活性,促进植株体内的氮素同化,但氮素用量过高,小麦根系生长反而受到抑制[13-15];生育后期增施氮肥能使小麦保持较高的根系活力,增强氮素同化能力[16];小麦根系内部的谷氨酰胺合成酶活性在抽穗期之前始终呈上升趋势,抽穗期达到最大,之后逐渐下降,乳熟期最低[17];小麦根系谷氨酰胺合成酶和硝酸还原酶活性在开花期时较叶片低,并在开花后持续下降[18]。
可见,关于水肥控制及管理技术等多因素有机结合的栽培模式对氮代谢影响的研究相对较少[19],尤其是对小麦生育中后期根系内多种氮代谢相关酶活性的研究还不够全面和深入。因此,本试验从多因素结合的不同管理模式出发,将着重点放在小麦根系的氮代谢方面,探究从水分控制、肥料管理等方面集成的3种管理模式下根箱冬小麦不同土层根系的4种氮代谢相关酶活性,以期为提高黄淮麦玉两熟区小麦氮素利用效率和实现高产优质提供理论依据和技术支持。
1 材料和方法
1.1 试验材料与设计
试验于2016~2017年在中国农业科学院新乡综合试验站(E113°45′,N35°09′)进行,试验区属北温带大陆性季风气候,光照充足,降雨适中。土壤类型为黏壤质潮土,前茬播种夏玉米,收获后秸秆不还田。供试小麦品种为‘矮抗58’,种子由河南科技学院小麦中心提供。

表1 3种产量水平的水肥管理模式信息
本课题组前期根据肥料水平、肥料配比、灌水次数、灌水时期等管理措施,集成设计了3个不同产量水平的技术模式,通过对小麦群个体生长、植株氮素转运、产量形成、光温潜力等的系统研究,将其分别确定为:超高产模式(SH)、高效模式(HE)和高产高效模式(HH)。试验采用根箱(长110 cm,宽50 cm,高60 cm)种植,2016年10月20日播种,根据根箱尺寸,纵向6行等行距(20 cm)人工开沟播种,不同栽培模式下的种植密度、灌水次数和肥料水平如表1所示,每种栽培模式设置9个根箱。
1.2 测定项目及方法
1.2.1根样采集及指标测定分别于开花期(2017年4月23日)、花后7 d(2017年5月1日)、花后14 d(2017年5月9日)、花后21 d(2017年5月17日)和花后28 d(2017年5月25日)进行根系取样(0~20 cm和20~40 cm)。取得的根系样品充分浸泡后于100目筛中冲洗干净,选取保持较完整的植株根系,擦干后置于冰盒中待测。谷氨酰胺合成酶(GS)活性采用王小纯等[20]的方法测定;硝酸还原酶(NR)活性采用张志良[21]的方法测定;谷氨酸合成酶(GOGAT)活性采用郑朝峰等[22]的方法测定;谷丙转氨酶(GPT)活性采用吴良欢等[23]的方法测定。
1.2.2产量及其构成因素的测定于成熟期(6月6日)在各栽培模式下未进行根系取样的根箱内调查有效穗数,之后于各处理取15株进行考种,测定穗粒数、千粒重等产量构成因素,最后实收完整根箱的小麦以计算产量。
1.3 数据整理与分析
运用Excel2010和SPSS17.0对数据进行整理分析,多重比较采用LSD法。
2 结果与分析
2.1 水肥管理模式对根箱种植小麦根系GS活性的影响
谷氨酰胺合成酶具有将NH3从无机氮转化为有机氨的中心作用,是处于氮代谢中心的多功能酶和参与氨同化过程的关键酶[24-25]。3种管理模式下上层和下层小麦根系的GS活性随着生育期的推进均呈现出“降-升-降”的变化趋势(图1),即从开花期到花后7 d先降低,花后7 d到花后14 d又上升,之后又一直降低;在整个生育期,HH模式的GS活性始终显著(P<0.05)高于SH和HE模式,而SH和HE模式的根系GS活性仅在开花期的2个土层以及花后28 d 的下层存在显著差异(P<0.05),其余时期两者之间均没有显著差异。对于HH模式而言,除了花后7 d,其余时期下层根系的GS活性始终显著高于上层,并且在花后14 d到花后28 d,下层根系的GS活性下降比较缓慢。在SH和HE模式下,从开花期到花后14 d的上层根系GS活性始终显著高于下层,然而在花后14 d之后,下层根系的酶活性反倒显著高于上层,也即下层根系的GS活性在花后14 d之后下降比较缓慢。以上结果表明,小麦开花后的不同时期内,HH模式下2个土层根系的GS活性均显著高于SH和HE模式,且综合来看,下层根系的GS活性虽然在开花后2周内低于上层,但在花后14 d到花后28 d却高于上层根系,所以在生产上采取栽培措施增加中、下层根系的数量和比例,或许对提高灌浆期根系的氮同化能力有重要意义。
2.2 水肥管理模式对根箱种植小麦根系GOGAT活性的影响
GOGAT也是氮素同化过程中的关键酶,在无机氮转化为有机氮的过程中起着至关重要的作用,它与GS耦联形成的循环是高等植物氨同化的主要途径[26-27]。图2显示,就上层根系而言,小麦开花期的GOGAT活性表现为HH模式显著高于SH和HE模式,而SH和HE模式之间差异则不显著;开花期到花后7 d的根系GOGAT活性在3种管理模式下均剧烈下降,但HH模式始终显著高于SH和HE模式;SH和HE模式的GOGAT活性在花后7 d到花后14 d逐渐增强,之后又持续下降,而HH模式的酶活性在花后7 d到花后21 d持续增强,之后急速下降,且始终显著高于另外2种模式,这说明HH模式能够维持较长时间和较高强度的根系GOGAT活性;在花后28 d时,3种管理模式下根系的GOGAT活性无显著差异。3种管理模式下层根系的GOGAT活性从开花期到花后28 d的变化趋势与上层根系相同;HH模式下层根系的酶活性在每个时期均显著高于上层根系。在整个生育过程中,除了花后7 d的上层和花后28 d的下层根系,SH 和HE模式的根系GOGAT活性之间始终无显著差异;除了花后28 d的上层根系,HH模式下的根系酶活性始终显著高于SH和HE模式。以上结果表明,相对于SH和HE栽培模式来说,HH栽培模式下小麦根系的GOGAT活性在花后7 d降至最低后,未来2周内又有较大幅度持续增强,而SH和HE模式下的酶活性仅在花后7 d到14 d的1周时间内呈缓慢上升趋势,其酶活性强度及维持时间均不及HH模式,这可能是生育后期不同水肥管理模式氮素利用和代谢差异的基础。
2.3 水肥管理模式对根箱种植小麦根系GPT活性的影响
谷丙转氨酶是植物体内一种重要的转氨酶,负责有机和无机氮之间的氨基转移,其活性的高低反映了植物体内氮代谢强度的变化[9]。从图3来看,在整个过程中,HH和SH栽培模式下2个土层小麦根系的GPT活性变化趋势较一致,即从开花期到花后7 d缓慢下降,开花1周后迅速下降,2周后保持在一定水平,且HH模式的酶活性显著高于SH模式;而HE栽培模式下2个土层的根系GPT活性一直呈缓慢下降趋势。对于HH和SH模式而言,开花期到花后7 d的上层根系GPT活性始终显著高于下层,然而在花后7 d之后,下层的根系酶活反倒显著高于上层,这说明下层根系的GPT活性在花后7 d之后下降比较缓慢。可见,HH和SH栽培模式下2个土层小麦根系GPT活性的最大变化出现在花后1~2周内,说明灌浆初期是小麦氮代谢的一个重要时期;开花后的不同时期内,HH模式下2个土层根系的GPT活性均显著高于SH和HE模式,且HH和SH模式下层根系的GPT活性在灌浆期前后较上层根系强,这或许是由于下层根系在生育后期对氮素的利用和同化能力比在生育前期和中期更强。

不同小写字母表示同一生育时期不同栽培模式间的酶活性差异达到显著(P<0.05)水平,下同图1 不同水肥管理模式下小麦根系GS的活性变化 Different normal letters within the same growth stage indicate significant difference among patterns at 0.05 level, the same as belowFig.1 GS activity in wheat roots under different water and fertilizer management models
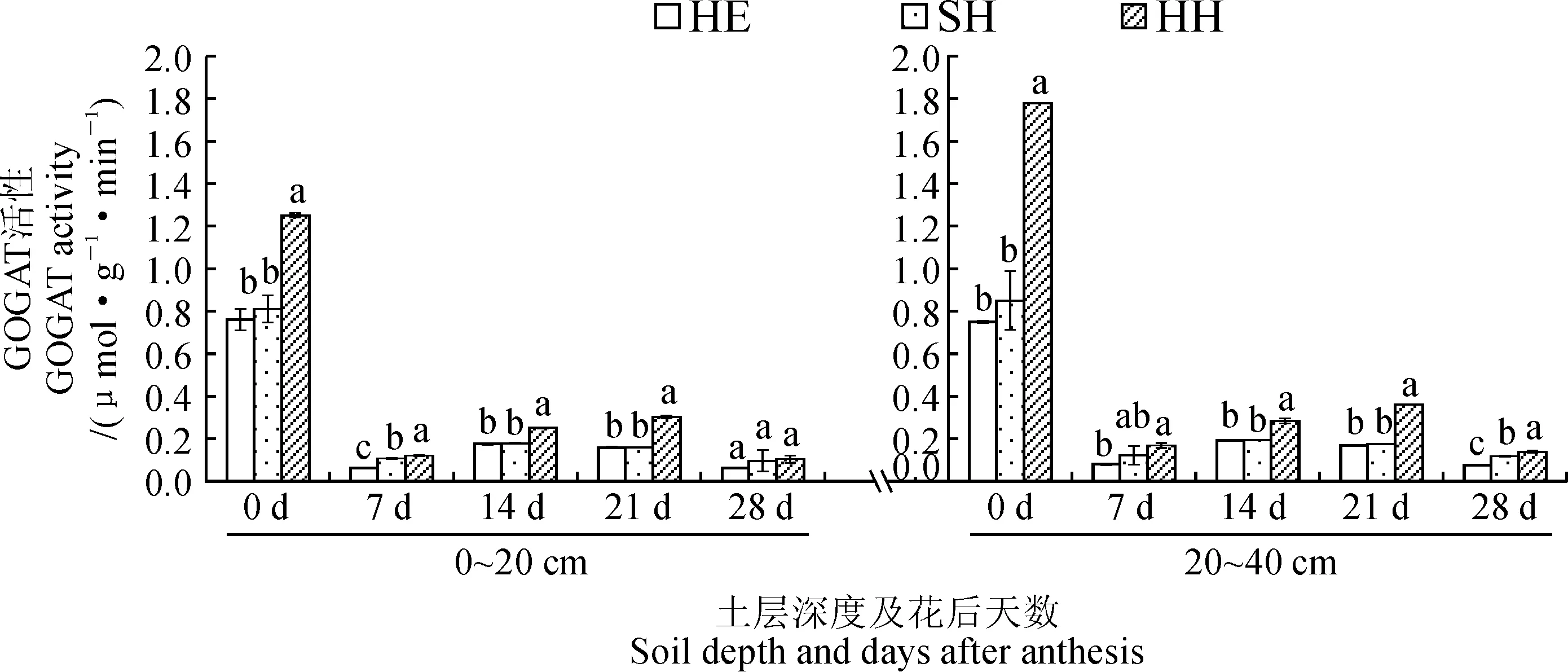
图2 不同水肥管理模式下小麦根系GOGAT的活性变化Fig.2 GOGAT activity in wheat roots under different water and fertilizer management models
2.4 水肥管理模式对根箱种植小麦根系NR活性的影响
NR作为小麦氮素代谢过程中的关键酶,对植株硝态氮的吸收和转化有重要影响[28]。由图4可知,3种管理模式下2个土层的小麦根系NR活性在开花期时最高,后随着生育进程的推进而逐渐降低,且在开花期到花后21 d下降比较缓慢,在花后21 d到花后28 d下降迅速。对于SH和HE模式而言,除了花后28 d,其余时期2个土层的根系NR活性在两模式间没有显著差异,但两模式均显著低于HH模式。下层根系的NR活性在每种模式下的每个时期均显著高于上层根系,且其在整个过程中的下降趋势较上层根系缓慢。以上结果表明,下层根系的NR活性较上层根系强,并随着生育期的推进下降趋势较为缓慢,且每种管理模式下2个土层根系的NR活性从开花期开始便逐渐下降,这也许是小麦进入生殖生长阶段后,根系对硝酸盐的还原能力逐渐减弱,需要地上部加强氮素同化来满足生殖需要,氮素同化中心由根系转移至地上部所致。
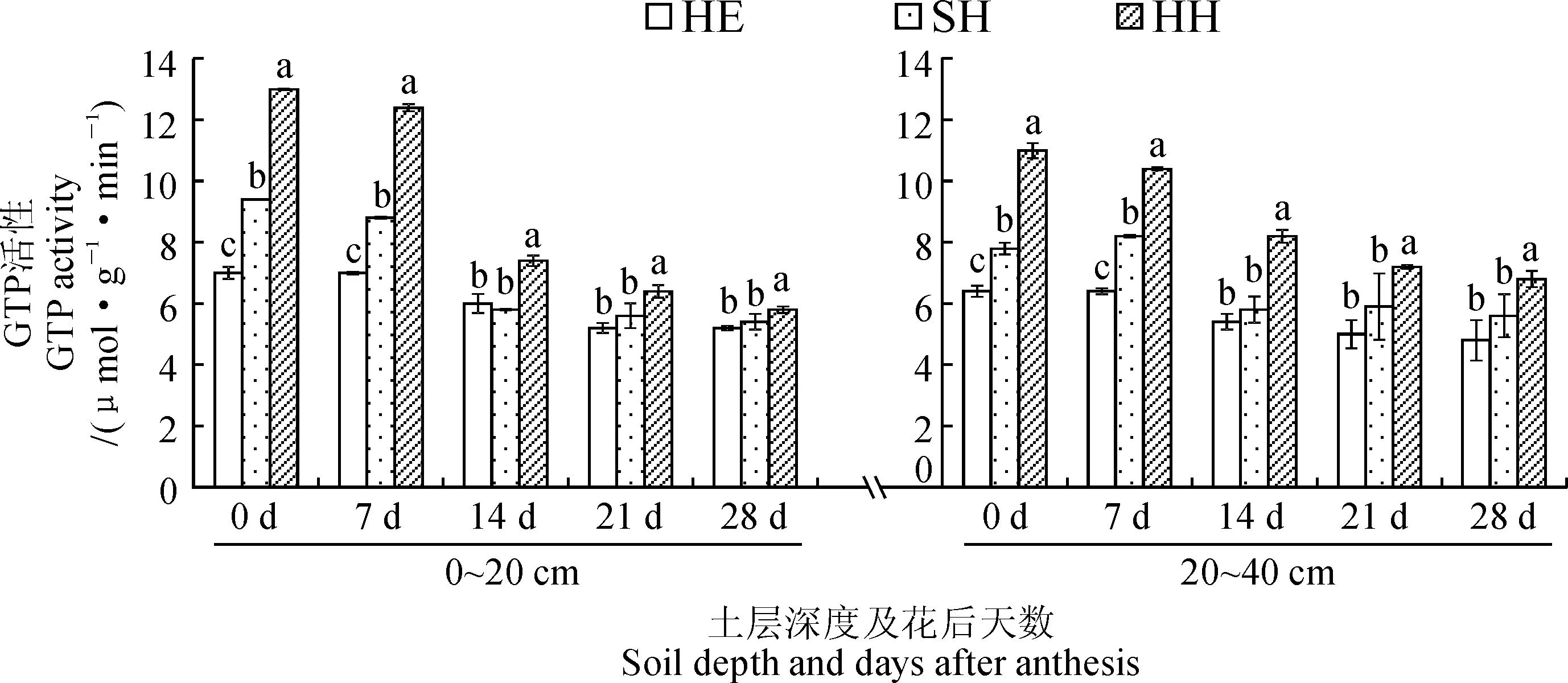
图3 不同水肥管理模式下小麦根系GPT的活性变化Fig.3 GPT activity in wheat roots under different water and fertilizer management models
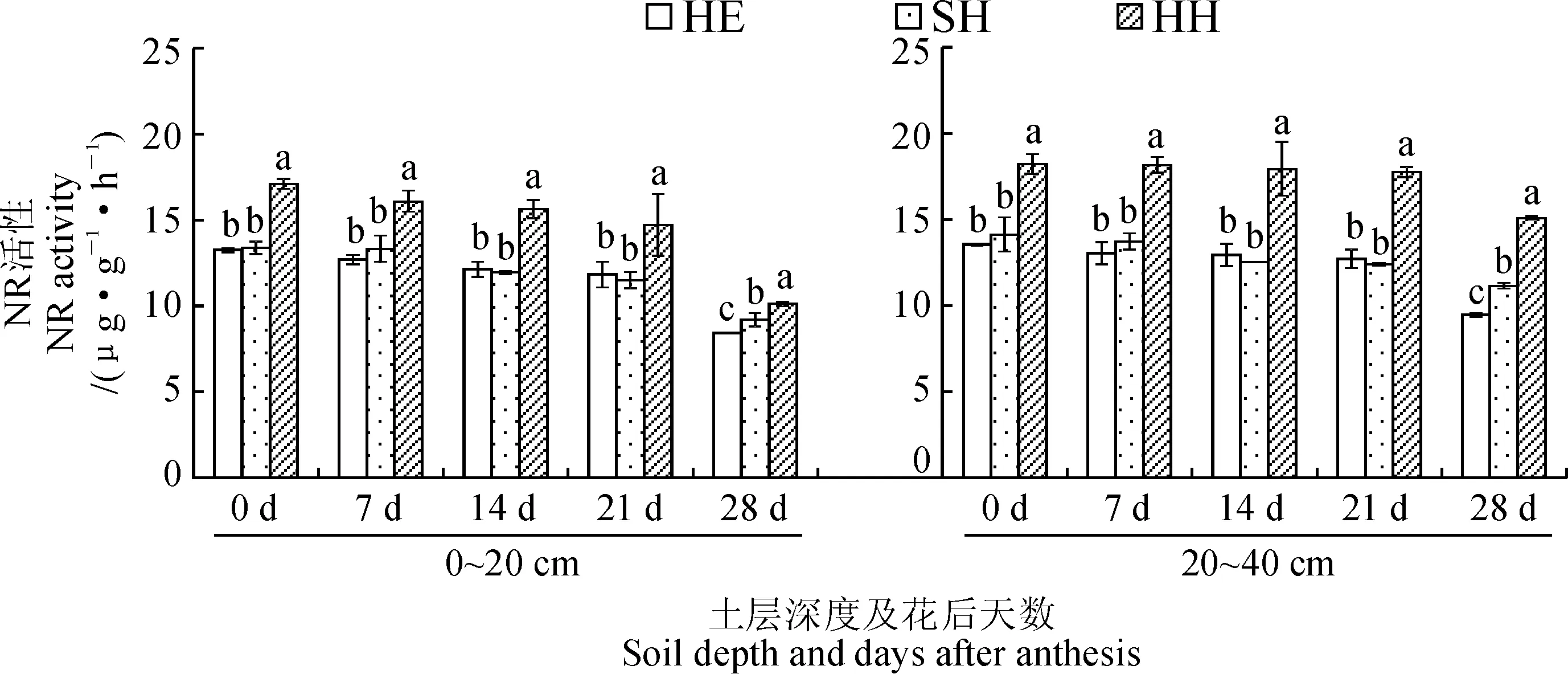
图4 不同水肥管理模式下小麦根系NR的活性变化Fig.4 NR activity in wheat roots under different water and fertilizer management models

模式Pattern穗数Spike number (ears/box)穗粒数Grain per spike (particle/spike)千粒重1 000-grain weight/g产量Yield (g/box)SH316.80b24.20c40.28c334.11cHE336.60a27.87b47.43a422.80bHH339.35a35.07a44.31b487.24a
注:同列不同字母表示栽培模式间在0.05水平存在显著性差异
Note: The different normal letters within the same column indicate significant difference among patterns at 0.05 level
2.5 水肥管理模式对根箱种植小麦籽粒产量及其构成因素的影响
表2显示,小麦的穗粒数与籽粒产量在不同水肥管理模式间均呈显著性差异,均表现为HH模式>HE模式>SH模式;HE与HH模式下的小麦成穗数显著高于SH模式,且其两者之间无显著性差异;不同栽培模式下小麦千粒重的差异性也较为显著,表现为HE模式>HH模式>SH模式。小麦产量的形成绝大部分归结于氮肥,结合3种管理模式下的施氮措施与小麦产量及其构成因素可知,SH模式过高的氮肥施用量以及过早的追氮时期对小麦产量及其构成因素的提高没有起到积极作用;随着施氮量的增加,小麦千粒重反而逐渐减小;适宜的氮肥用量及适当加大后期追肥比例能够显著提高小麦穗粒数和籽粒产量。
3 讨 论

本研究结果表明,小麦根系4种氮代谢酶活性在不同管理模式下花后不同时间的变化趋势不尽相同。3种水肥管理模式下2个土层小麦根系的GS活性呈现出“降-升-降”的趋势,在花后14 d有一个小高峰,然后又下降,这与张营武[20]和王小纯等[24]对小麦花后旗叶和籽粒GS活性的研究结果一致。由于GS不仅参与氨基酸的合成,也与蛋白质的分解有关,故小麦花后14 d根系GS活性的小高峰可能是与籽粒形成后根系中贮存的蛋白质大量分解成氨基酸有关。而王月福的研究则表明,小麦根系内的GS活性从开花期后便一直降低[18],与本研究的结论不一致。宁书菊通过对水稻生育后期根系内部GS变化的研究认为,不同作物品种在花后不同时间的根系GS活性变化不尽相同[9]。同时,HH模式下小麦根系的GOGAT活性在花后7 d降至最低后,未来2周内酶活性又较大幅度地持续增强,而SH和HE模式仅在花后7 d到14 d的1周时间内呈缓慢上升趋势,这说明根系对氮素的同化能力不仅取决于氮代谢相关酶的活性强弱,还取决于高酶活维持的时间长短。研究[33-34]认为,GOGAT的作用主要体现在与GS耦联的GS-GOGAT循环中,因此它的活力与GS的活力以及与作物的氮同化能力呈显著正相关,但在本研究中,HH模式下根系的GS和GOGAT活性并没有显著相关性。由于目前对小麦生育后期根部GOGAT活性变化的相关研究较少,该研究所得结果仅对黄淮麦玉两熟区的相关研究和水肥指导有重要借鉴作用。另外,在小麦整个后期发育过程中,HH模式和SH模式下2个土层的根系GPT活性变化趋势较一致,开花期到花后7 d酶活性无明显变化,开花1周后酶活性迅速下降,两2后保持在一定水平,说明GPT活性的最大变化出现在花后1~2周内,这代表花后的灌浆初期是植物氮代谢的一个重要时期,这与宁书菊对水稻生育后期根系内GPT活性的研究结果一致[9]。此外,本研究中每种水肥管理模式下2个土层小麦根系的NR活性从开花期开始便逐渐下降,且在开花期到花后21 d酶活性下降比较缓慢,花后21 d到花后28 d酶活性下降迅速,这与杜瑛和王月福的研究结果一致[17-18,28],这种现象也许是氮素同化中心由根系转移至地上部所致,生育中后期同化中心的转变可使氮素同化更加高效。
从3种水肥管理模式来看,本研究中HH模式2个土层小麦根系的4种氮代谢酶活性均显著高于SH和HE 模式,而它们在SH和HE 模式间则在大部分时期都没有显著差异。这一现象的出现可能是,在充分灌水的基础上,HH模式的追施氮肥比例较高,大大满足了小麦生育后期生殖生长的氮同化需求。李双双研究表明,生育后期增施氮肥能够使小麦根系保持较高的活力[16]。而SH和HE 模式的酶活性之间之所以没有明显差异,可能跟两者的水氮综合管理措施有关。其中,SH模式的施氮量和灌水量均较HE模式大, 这一点弥补了SH模式在氮肥分配时期及比例方面的缺点,而HE模式虽然在氮肥的分配施用方面具有较大的优越性,但其总的氮素施用量太低,这些因素可能就是造成2种模式下小麦根系4种氮代谢相关酶活性变化没有明显差异的原因。
从2个土层根系的氮代谢相关酶活性总体变化来看,在小麦生育后期,下层根系的酶活性往往高于上层根系,这可能是由于下层根系在生育后期比在生育前期和中期对氮素的利用和同化能力强,而上层根系的氮代谢则在生育前、中期比较强。Hurkman 等认为,在根系中,一般来说根尖区正在扩展的细胞中NR活性较高,而越靠近根基部酶活性越低[35],由此可以推断其他3种氮代谢酶在不同土层的酶活性差异可能也与此有关。潘庆民通过研究小麦开花后不同土层根系的衰老情况认为,开花8 d后,上层根系活力迅速降低,中、下层根系活力虽然也有所降低但降低幅度较小以至于高于上层根系[36]。
氮肥施用时期对小麦单位面积穗数的影响较大,不同的追氮量、氮肥基追比例对茎蘖状态有显著地调节效应[37],充足的氮肥能够满足植株分蘖生长的需要,有利于小麦得到较高的成穗数,有助于小麦高产稳产[38-39]。本试验条件下,SH模式下的小麦有效穗数显著低于HE和HH模式,可能是由于SH模式追施氮肥过早导致小麦生育前期分蘖过多,生育后期无效分蘖死亡率高,拔节期后群体数下降迅速,最终成穗数不是很高。相反HE和HH模式调整了氮肥基追时期及比例,使无效分蘖提前死亡,保证生育中后期的养分和水分供应,最终获得了较高的群体数,有利于提高小麦成穗率,保证产量的形成。穗粒数和千粒重是小麦产量构成的2个关键要素,小麦穗粒数主要在拔节期后形成,千粒重则在灌浆期形成[40]。有研究表明,适宜的氮肥追施可以促进植株对各营养元素的协调平衡吸收,维持花后较高的光合速率,提高结实率和穗粒数,从而提高产量[41-42],然而穗粒数随着氮肥用量在适宜范围内的增加而提高时,千粒重却在下降[43]。本研究结果表明,不论是穗粒数还是千粒重,在3种水肥管理模式之间均有显著性差异,且分别表现为HH模式>HE模式>SH模式和HE模式>HH模式>SH模式,这与前人研究结果一致。小麦产量的形成绝大部分归结于氮肥,本试验条件下的小麦籽粒产量表现为HH模式>HE模式>SH模式,这说明一味地增施氮肥并不能提高粮食产量,氮肥的施用时期与比例也是关键的调控因素。
根系对植物的重要性显而易见,生育后期的根系生理活性对整体生理尤为重要,保证后期地上部分旺盛生理活性的重要措施之一是保持旺盛的根系生理活性,因此探讨不同水肥管理模式对不同土层根系氮代谢的影响,显得至关重要。搞清楚不同管理模式下不同土层根系在生育后期的氮代谢变化和生理调控,可获得地上部分调节所不能达到的效果。本研究中,小麦不同土层根系的各氮代谢相关酶活性均以HH模式最强,产量也以HH模式最高,也即根系氮同化能力最强的管理模式获得的产量也最高,这说明采用合理的管理模式可以更好地协调小麦地上与地下部的生理活动,进而保障小麦高产。本试验的不足在于,只研究了有关开花期到花后28 d的根系氮代谢,后期的氮素同化情况还有待今后继续进一步探讨。

