哈密瓜种质资源苗期细菌性果斑病抗性鉴定
韩宏伟,刘会芳,韩盛,庄红梅,佘建华,王强,王浩
(1.新疆农业科学院园艺作物研究所,乌鲁木齐 830091;2.新疆农业科学院植物保护研究所,乌鲁木齐 830091)
0 引 言
【研究意义】近年来,由燕麦嗜酸菌西瓜亚种(Acidovoraxavenaesubsp.citrulli,Aac)侵染引起的细菌性果斑病[1]在新疆哈密瓜产区为害逐年加重,严重制约了新疆哈密瓜产业的持续发展。细菌性果斑病是由国外或区外传入新疆[2],可侵染哈密瓜叶片、茎和果实,也可种子带菌传播,是一种毁灭性病害。目前,细菌性果斑病在新疆[3,4]、内蒙古[5]等地哈密瓜主产区发生较为普遍,对哈密瓜的种植和生产造成较大影响。杨小丽等[6]在哈密和北疆哈密瓜产区调查发现,轻病田发病率8%~15%,重病田发病率已高达80%以上,哈密瓜受损率5%~15%。生产上主要采用化学防治和生物防治等方法控制该病害的发生为害,尚没有理想的防治药剂,且化学防治与环境不友好。种子带菌是该病害传播的主要方式,对带菌种子进行药剂处理可有效减少病原菌传播,但仍不能彻底清除种子上的病原菌[7,8]。筛选抗病种质资源,培育和利用抗病品种是控制哈密瓜细菌性果斑病的最根本有效的措施。目前,研究人员多采用苗期室内喷雾法接种,通过调查供试材料植株叶片病斑面积占叶片总面积的比例来统计病情指数,确定不同甜瓜材料之间的抗性,较能准确的反映出不同材料之间的抗性差异。【前人研究进展】胡俊等[9]通过调查研究,发现不同哈密瓜品种温室人工接种与田间自然条件下的抗病性完全一致,能间接的反映出田间抗性表现。李俊阁等[10]对136份甜瓜材料苗期进行细菌性果斑病抗性鉴定,没有筛选出免疫的材料,髙抗的材料有14份,中抗材料91份,中感材料25份,感病材料有6份。李威等[2]对新疆的主要的15个哈密瓜品种(品系)、2个籽瓜及15个西瓜品种进行苗期抗病性鉴定,没有发现抗病品种。张亮等[11]对25份不同甜瓜材料苗期抗细菌性果斑病鉴定,结果表明,没有高抗和免疫的材料,中抗和中感材料各8份,感病材料9份。【本研究切入点】不同品种对细菌性果斑病抗性存在明显差异,但不同研究者所采用的接种时期、接种病原菌浓度及抗性分级标准有所区别,不同研究者所鉴定的品种之间的抗性不能直接进行比较。研究筛选出高抗细菌性果斑病的甜瓜资源。【拟解决的关键问题】研究采用室内喷雾法接种,用两种抗性分级标准对17份哈密瓜材料苗期细菌性果斑病抗性进行评价,分析不同分级标准对品种抗性评价的影响,筛选出高抗或免疫的哈密瓜种质资源,为抗病品种选育奠定基础。
1 材料与方法
1.1 材 料
供试哈密瓜资源由新疆农业科学院园艺作物研究所提供,共17份,其中自交系材料14份,杂交种3份。接种用细菌性果斑病病原菌(BFB)由新疆农业科学院植物保护研究所瓜类病害研究室提供,该病原菌分离自新疆昌吉州蔡家湖镇哈密瓜集中种植区甜瓜细菌性果斑病典型病株。表1
表1 供试甜瓜及其来源
Table 1 The name and source of the experimental muskmelon

材料编号Material number材料Material name材料类型Source of materialJM17-1炮台红新疆哈密瓜地方品种JM17-2皇后哈密瓜常规种JM17-3JM17-1×JM17-2F1JM17-4K1-1自交系材料JM17-5黄旦子新疆地方品种JM17-6JM17-4×JM17-5F1JM17-7早黄蜜♀自交系材料JM17-8新86♀新疆哈密瓜地方品种JM17-9西州密17号♀自交系材料JM17-10伽师瓜新疆晚熟地方品种JM17-11V4自交系材料JM17-12JM17-10×JM17-11F1JM17-13M1607自交系材料JM17-14K5-6-2自交系材料JM17-15M10-6自交系材料JM17-16M1-2自交系材料JM17-17M1605-1自交系材料
1.2 方 法
1.2.1 鉴定材料准备
供试甜瓜材料幼苗培育在新疆农业科学院园艺作物研究所安宁渠试验基地进行。试验所用的甜瓜种子采用干热法灭菌,具体方法参考周贤达等[12]的方法,即30℃恒温干燥12 h、65℃干热灭菌48 h。育苗基质采用进口SOLVIKA Peat Moss,消毒后装入规格为4×8穴的育苗盘中,每个品种播8穴,每穴2~3粒,播之前浇足水,设3次重复,以感病品种炮台红幼苗为对照。分别在出苗后第10、18 d叶面喷施1次营养液,其余时间视基质墒情只浇清水。两片真叶完全展开时,准备接种。试验所用器材均用5%的次氯酸钠溶液浸泡消毒30 min,再用自来水冲洗2遍。
1.2.2 接种菌液制备
将保存的细菌性果斑菌液于NA固体培养基划线活化培养72 h后,挑取活化的单菌落接种于装有150 mL NA液体培养基的玻璃三角瓶中,再将接种菌株的三角瓶放于28℃、150 RPM的恒温摇床中震荡培养24 h,取少量菌液用紫外分光光度计于600 nm波长条件下测定OD600吸光度值,当菌液OD600吸光度值为0.5时,菌液浓度即可达1×108CFU/mL以上,以该菌液作为接种菌液。
1.2.3 接种
2017年8月在新疆农业科学院植物保护研究所人工气候室内采用叶面喷雾法接种。将培养的供试甜瓜幼苗移至人工气候室内,高压钠灯补光,设置恒温30℃,光照12 h,黑暗12 h,适应2 d后开始接种,喷雾接种后,用塑料薄膜覆盖保湿24 h,创造利于发病条件。接种时以感病材料炮台红(JM17-1)叶面喷施等量的清水为空白对照,以接种病原菌的炮台红为感病对照。
1.2.4 抗性鉴定及评价标准
接种15 d后,开始调查发病情况。调查时剪去顶部嫩叶,只保留最下部4片真叶,统计病斑与叶片的面积比。分别采用金岩[13]和Hopkins[14]2种分级标准进行发病情况调查。
病情指数(DI)=Σ(各级病叶数×发病级数)×100/(调查总叶数×最高发病级数)。
相对病情指数=鉴定品种平均病情指数/对照品种平均病情指数(病情指数最高者为对照品种)。
相对抗病指数=1-相对病情指数。
采用相对抗病指数来评价其抗病程度[15],抗病程度分为免疫I(1.00)、高抗HR(0.80~0.99)、中抗MR(0.40~0.79)、中感 MS(0.20~0.39)、感病S(0.20以下)5类。表2
表2 细菌性果斑病病情分级标准
Table 2 Grading standard of bacterial fruit blotch
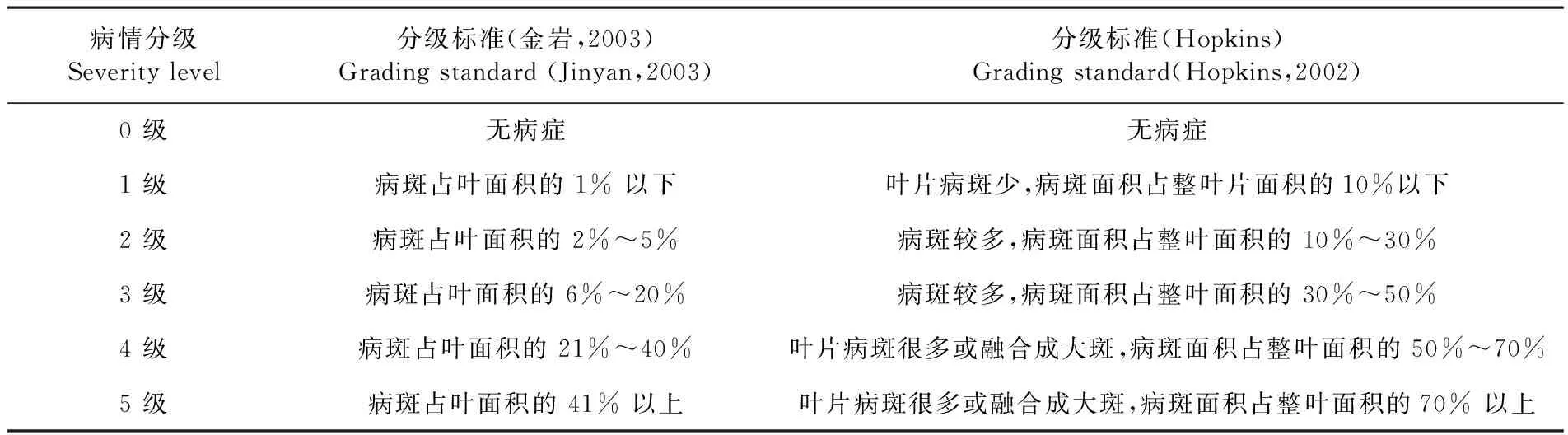
病情分级Severity level分级标准(金岩,2003)Grading standard (Jinyan,2003)分级标准(Hopkins)Grading standard(Hopkins,2002)0 级无病症无病症1 级病斑占叶面积的 1% 以下叶片病斑少,病斑面积占整叶片面积的10%以下2 级病斑占叶面积的 2%~5%病斑较多,病斑面积占整叶面积的 10%~30%3 级病斑占叶面积的 6%~20%病斑较多,病斑面积占整叶面积的 30%~50%4 级病斑占叶面积的 21%~40%叶片病斑很多或融合成大斑,病斑面积占整叶面积的 50%~70%5 级病斑占叶面积的 41% 以上叶片病斑很多或融合成大斑,病斑面积占整叶面积的70% 以上
2 结果与分析
2.1 参试甜瓜材料的抗性
喷雾接种5 d后,感病材料JM17-1和JM17-10的真叶和子叶开始出现水渍状病斑,接种15 d左右,开始大量发病,病斑多呈圆形或多角形,叶缘起初呈“V”字形,随时间推移,病斑中间慢慢变薄、干枯(图1A),抗病材料JM17-1在接种15 d后只有个别叶片有零星病斑出现(图1B)。喷清水的感病对照叶片无病斑出现。图1
17份供哈密瓜试品种(系)之间抗性表现差异显著。采用金岩等的抗性分级标准,在17份供试材料中,没有对果斑病免疫的材料,表现高抗的材料有1份,为JM17-14,占供试材料的5.9%;表现为中抗的有11份,占比64.7%,中感材料有3份,占比17.6%;感病材料2份,为JM17-1和JM17-10,占比11.8%。采用Hopkins的抗性分级标准,17份供试甜瓜材料中,没有对果斑病免疫或高抗的材料,对果斑病抗性最高的为JM17-14,相对抗病指数为0.76,属于中抗水平。表现中抗的材料共有14份,占供试材料的82.4%,2份材料表现为中感,占比11.8%,感病材料1份,为JM17-1。
供试材料中F1代植株抗性多介于其亲本抗性之间。以金岩的抗性分级标准为例,如,JM17-3为JM17-1×JM17-2的F1代,JM17-3的相对抗病指数为0.31,介于其亲本JM17-1的0.00和JM17-2的0.54之间。同样,F1代JM17-6的相对抗病指数介于其亲本JM17-4和JM17-5之间。但F1代JM17-12的相对抗病指数为0.60,高于其双亲JM17-10和JM17-11,表现为超亲优势。表1

注:A为感病材料JM17-1接种15 d后的发病情况;B为高抗材料JM17-14接种15 d后的发病情况
Note: A: The morbidity of susceptible cultivar JM17-1 after 15 days of inoculation; B: The morbidity of resistant cultivar JM17-14 after 15 days of inoculation
图1 甜瓜不同抗性材料接种15 d后的症状表现
Fig.1 The morbidity of different resistant material after 15 days of inoculation
2.2 不同的抗性分级标准抗性鉴定
采用2种不同的抗性分级标准对17份供试甜瓜材料进行苗期抗性鉴定,2种抗性分级标准都能将17份供试材料的抗性水平区分开,且其抗性强弱顺序基本一致。采用2种抗性分级标准,17份供试材料中,抗性评价一致的有13个,其中JM17-2等11个品种表现为中抗水平(MR),JM17-1和JM17-9分别表型为感病和中感,有3个品种抗性评价水平不同。同一品种采用Hopkins的抗性分级标准所得的相对抗病指数普遍高于采用金岩的抗性分级标准所得结果。表3
表3 两种抗性分级标准对17份供试甜瓜材料的抗性鉴定结果
Table 3 Results of identification of resistance toAcidovoraxavenaesubsp.Citrulliamong 17 melon (CucumisSPP.) at seedling stage using 2 grading standard
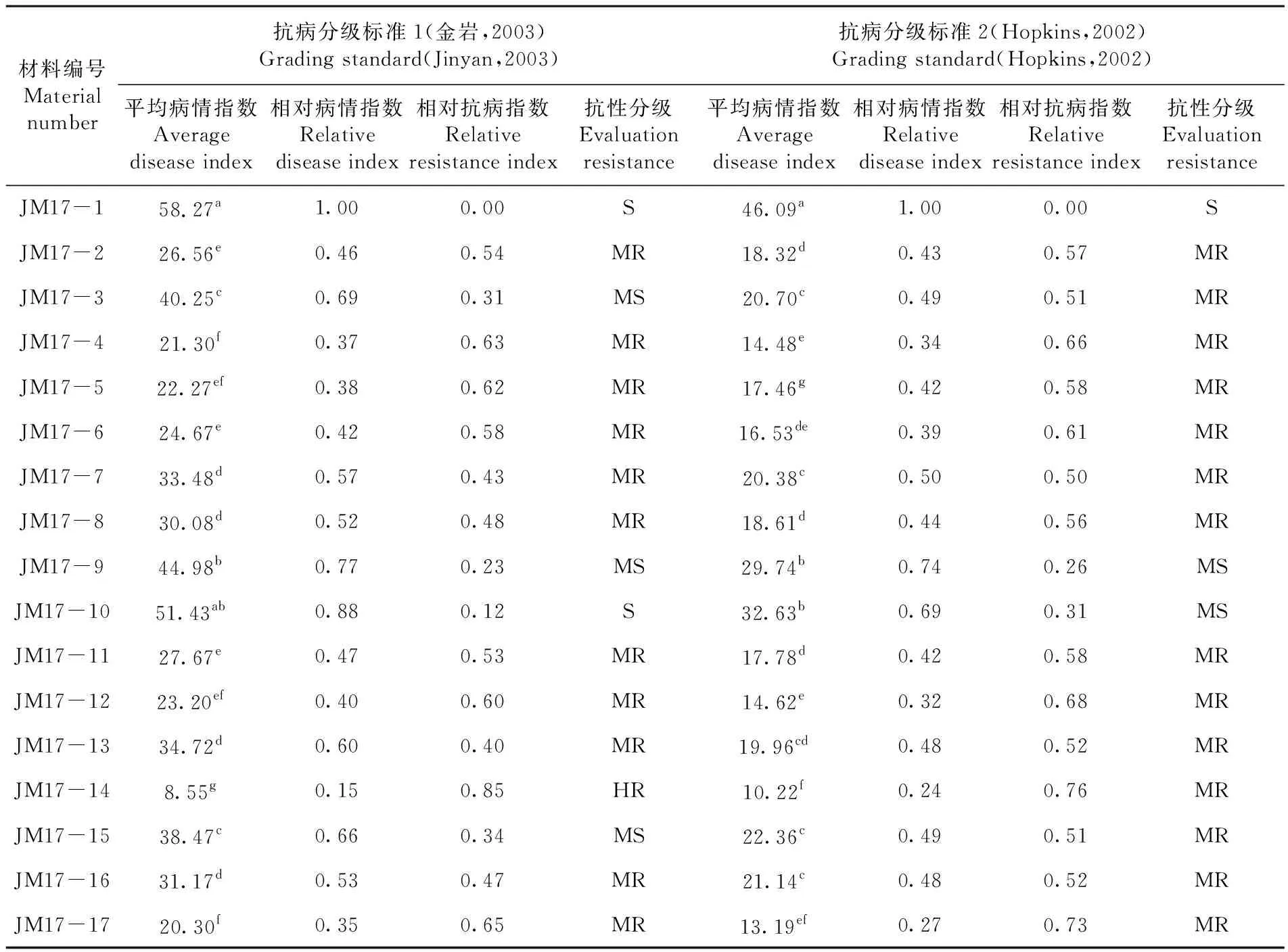
材料编号 Material number抗病分级标准1(金岩,2003)Grading standard(Jinyan,2003)抗病分级标准2(Hopkins,2002)Grading standard(Hopkins,2002)平均病情指数Average disease index相对病情指数Relative disease index相对抗病指数Relative resistance index抗性分级Evaluation resistance平均病情指数Average disease index相对病情指数Relative disease index相对抗病指数Relative resistance index抗性分级Evaluation resistanceJM17-158.27a1.000.00S46.09a1.000.00SJM17-226.56e0.460.54MR18.32d0.430.57MRJM17-340.25c0.690.31MS20.70c0.490.51MRJM17-421.30f0.370.63MR14.48e0.340.66MRJM17-522.27ef0.380.62MR17.46g0.420.58MRJM17-624.67e0.420.58MR16.53de0.390.61MRJM17-733.48d0.570.43MR20.38c0.500.50MRJM17-830.08d0.520.48MR18.61d0.440.56MRJM17-944.98b0.770.23MS29.74b0.740.26MSJM17-1051.43ab0.880.12S32.63b0.690.31MSJM17-1127.67e0.470.53MR17.78d0.420.58MRJM17-1223.20ef0.400.60MR14.62e0.320.68MRJM17-1334.72d0.600.40MR19.96cd0.480.52MRJM17-148.55g0.150.85HR10.22f0.240.76MRJM17-1538.47c0.660.34MS22.36c0.490.51MRJM17-1631.17d0.530.47MR21.14c0.480.52MRJM17-1720.30f0.350.65MR13.19ef0.270.73MR
3 讨 论
3.1 采用室内苗期喷雾法接种进行抗性鉴定,因接种量的大小、浓度、温度与湿度条件一致,能客观的反映出不同材料之间的抗性差异[11]。但不同研究者在对甜瓜进行抗细菌性果斑鉴定时,采用的接种菌液浓度及接种时期存在较大差异。如杨小丽等[6]采用的接种菌液浓度为1×105~1×106CFU/mL,接种时期为第4 片真叶完全展开,张亮等[11]接种菌悬液浓度为5×108CFU/mL,在2~4片真叶完全展开时接种,刘欣欣等[16]将菌液浓度调至1×108CFU/mL,在3片真叶时接种。而有研究发现,甜瓜的抗病性不仅取决于自身的抗性,也与接种量、接种菌液浓度、接种时期和接种方法等因素有关[10];不同研究者所采用的抗性分级标准也不尽相同。较常用的抗病分级标准有2个[13-14](金岩,2003),(Hopkins,2002)。研究采用这2种分级标准,均能把供试品种资源的抗性区分开,抗性强弱顺序基本一致,但采用不同分级标准,对供试品种资源的抗性水平评价存在差异,如研究中供试材料JM17-14,采用金岩的抗性分级标准,可被划分到高抗水平,而采用Hopkins的抗性分级标准,其抗性水平仅为中抗。
有必要制定甜瓜抗病性鉴定技术标准,通过统一抗性分级标准、接种量、接种菌液浓度、接种时期和接种方法等指标,使不同研究者之间的研究结果具有可比性,则更具有应用价值。
3.2 不同哈密瓜品种资源对果斑病菌(Acidovoraxavenaesubsp.citrulli,Aac)抗性差异显著。17份供试哈密瓜材料中,没有对果斑病菌表现免疫的材料,这与李俊阁等[10]、张亮等[11]的研究结果一致。可见,对细菌性果斑病免疫、高抗的甜瓜资源匮乏是限制甜瓜抗病新品种选育的关键因素,除了继续开展抗病资源鉴定、筛选以外,还需要收集、引进野生抗病资源或利用现有高抗材料,精细定位、克隆抗病基因,研究哈密瓜抗细菌性果斑病的分子机制,创制哈密瓜抗病资源,培育抗病品种。
3.3 研究中杂交F1代的抗性多介于其双亲之间,但也有超亲优势存在。不同甜瓜材料配置的杂交组合,表现出不同的抗性,其抗性遗传规律也不尽相同,可能是甜瓜细菌性果斑病抗性由多基因控制,这与胡俊等[9]的研究结果一致。目前,国内关于甜瓜细菌性果斑病的抗性遗传机制研究较少,遗传规律并不清楚。还需要通过构建极端抗病×极端感病的F2和BC1遗传分离群体,进一步研究哈密瓜细菌性果斑病抗性遗传规律,为抗性基因定位与挖掘奠定基础。
4 结 论
苗期室内喷雾法接种,可以用于甜瓜细菌性果斑病抗性鉴定;供试17份哈密瓜材料中,没有对细菌性果斑病菌表现免疫的材料,表现高抗的自交系材料有1份,为JM17-14,可以用于哈密瓜细菌性果斑病抗性育种及抗性基因定位;采用2种抗性分级标准,供试哈密瓜资源的抗性强弱顺序基本一致,但抗性水平评价有差异,即同一供试材料,采用Hopkins的抗性分级标准所得的相对抗病指数普遍高于采用金岩的抗性分级标准所得结果。

