EM菌对NaCl胁迫下核桃幼苗生长、光合特性及抗氧化系统的影响
艾尔买克·才卡斯木,钟海霞,张雯,张付春
(新疆农业科学院园艺作物研究所/农业部新疆地区果树科学观测试验站,乌鲁木齐 830091)
0 引 言
【研究意义】土壤盐碱化是绿化过程中常遇到的逆境之一[1]。土壤次生盐渍化加重直接影响到植物的生长发育。新疆南疆喀什地区存在土壤碱性大和盐碱地育苗出圃率低的问题,制约了南疆盐碱地核桃产业的健康发展。提高核桃耐盐性对南疆盐碱地改良与培育优良核桃苗木繁育技术研究具有实际意义。【前人研究进展】近年来,通过生物途径改良盐渍化环境,提高植物在盐渍土壤中的生产力已成为改良盐渍土的新方向[2-3]。生物有机肥是指特定功能微生物与动植物残体为源并经无害化处理、腐熟的有机物料复合而成的一类兼具微生物肥料和有机肥效应的肥料,可提高作物产量和品质,提高土壤肥力和改善土壤理化性状, 增强土壤酶活性和微生物活性及多样性,增强作物抗逆性,降低环境污染等[4-5]。目前已在西瓜[6]、 辣椒[7]、芥蓝[8]等作物上应用研究。EM(Effective Microorganisms)生物菌肥是近些年研制出来的化肥替代肥料,能增加土壤有益微生物,促进土壤养分转化,促进植株生长发育,增强植株的抗逆性[9-10]。EM菌是以光合细菌、乳酸菌、酵母菌和放线菌为主的10个属80余个微生物复合而成的一种微生活菌制剂[11]。EM 菌能把氧化的土壤重新恢复为抗氧化状态,无机元素全部活化,溶解后被根吸收, 能疏松土壤,减少土壤板结[12]。菌丝在土壤里活动,促进团粒结构形成,酸性和碱性土变成中性土,盐分含量多的能缓解,使土壤中的小动物重新增多,土壤更肥沃[13]。【本研究切入点】有关EM真菌提高植物耐盐性的作用机制尚需进一步系统研究。目前尚没有有关EM菌对核桃幼苗生长的影响方面的研究。研究EM菌对在不同盐浓度下核桃幼苗生长发育及耐盐性的影响。【拟解决的关键问题】采用盆栽试验,分析不同 NaCl浓度(0、0.4%、0.8%和1.2%)持续胁迫下,接种EM真菌对和田厚皮实生核桃幼苗耐盐性的影响。为利用菌根制剂培育菌根化核桃苗以减轻土壤盐碱胁迫提供理论依据。
1 材料与方法
1.1 材 料
试验在新疆农科院安宁区试验站温室内进行,供试核桃品种为和田厚皮实生核桃,在综合性状表现良好的母树上采集完全成熟当年生优质厚皮实生核桃种子。共试EM菌(Effective Microorganisms,是以光合细菌、乳酸菌、酵母菌和放线菌为主的10个属80余个微生物复合而成的一种微生活菌制剂)由新疆农业科学院微生物研究所提供。
1.2 方 法
1.2.1 育苗
采用清水对实生核桃种子进行为期7 d的浸泡,到大部分出现裂株苗开为止,每天换水2次。单株单盆栽植,栽植于棕色硬质塑料盆中,盆高40 cm,上口径25 cm,下口径20 cm,盆底带孔,盆下垫有托盘。每盆基质相同且质量为2 kg,始终保持盆内土壤基质田间持水率在70%左右。核桃苗培育分为不接种 EM菌(CK)和接种 EM 真菌2个处理,每个处理60株。
1.2.2 盐胁迫处理
核桃苗长至4~5片真叶时开始盐胁迫处理,共设4个处理,对照(自来水,不加NaCl),0.4%(占每次浇水质量的百分数,下同),0.8%,1.2%,每个处理重复3次,每个重复5株苗。为防止盐分流失,每次浇水后将托盘中的水倒回花盆中去。每3 d处理一次,处理后0和15 d各取一次样,分别测定相关指标。
1.2.3 测定指标
处理15 d时,测量10株幼苗株高相对生长量和叶面积;分别取幼苗地上部和地下部分,用清水冲洗表面杂物,再用去离子水冲洗干净,擦干水分后,分别称鲜样质量,105℃杀青15 min,75℃烘至恒重,称干样质量。
膜透性:用电解质外渗法测定相对电导率[14]。丙二醛(MDA)含量的测定:采用硫代巴比妥酸法(TRA法)测定丙二醛含量[14]。SOD、POD酶活性的测定:采用分光光度法,分别在560nm、240 nm和290 nm处比色[14]。
光合速率的测定:处理 15 d 时,10:30~12:30采用Li-6400型便携式光合仪(LI-COR Inc., Lincoln, NE, USA)测定各处理标记叶片的净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(E)、胞间CO2浓度(Ci)。
1.3 数据处理
所有数据采用Excel 2010和 SPSS 16.0 软件进行处理,显著水平P<0.05。
2 结果与分析
2.1 AM真菌对NaCl胁迫下核桃幼苗生物量的影响
研究表明,根鲜重、根干重、冠茎鲜重、冠茎干重、相对株高生长量和叶面积随着NaCl 盐浓度的增加呈下降趋势,与NaCl 浓度成反比。相反,根冠比随NaCl 盐浓度升高而升高,两者之间成正比。随着胁迫浓度的升高,核桃幼苗生物量化越大。NaCl 质量分数达到1.2%时,相对根鲜重、相对根干重、相对冠茎鲜重、相对冠茎干重、相对株高生长量、叶面积只有对照的 74%、52%、61%、59%、76%、75%。
虽然EM菌处理过的幼苗生物量也下降,但EM菌处理起到明显的缓冲作用,整个实验过程中,EM菌处理过的幼苗生物量显著高于未处理过的幼苗。与对照相比,EM菌处理后,相对根鲜重、相对根干重、相对冠茎鲜重、相对冠茎干重、相对株高生长量、叶面积分别增加12%、14%、11%、17%、17%和29%,EM菌处理显著增加幼苗的耐盐性。表1
表1 AM真菌在不同NaCl胁迫下核桃幼苗生物量变化
Table 1 Effects of EM fungi on phytomass of walnut seedlings under NaCl stress
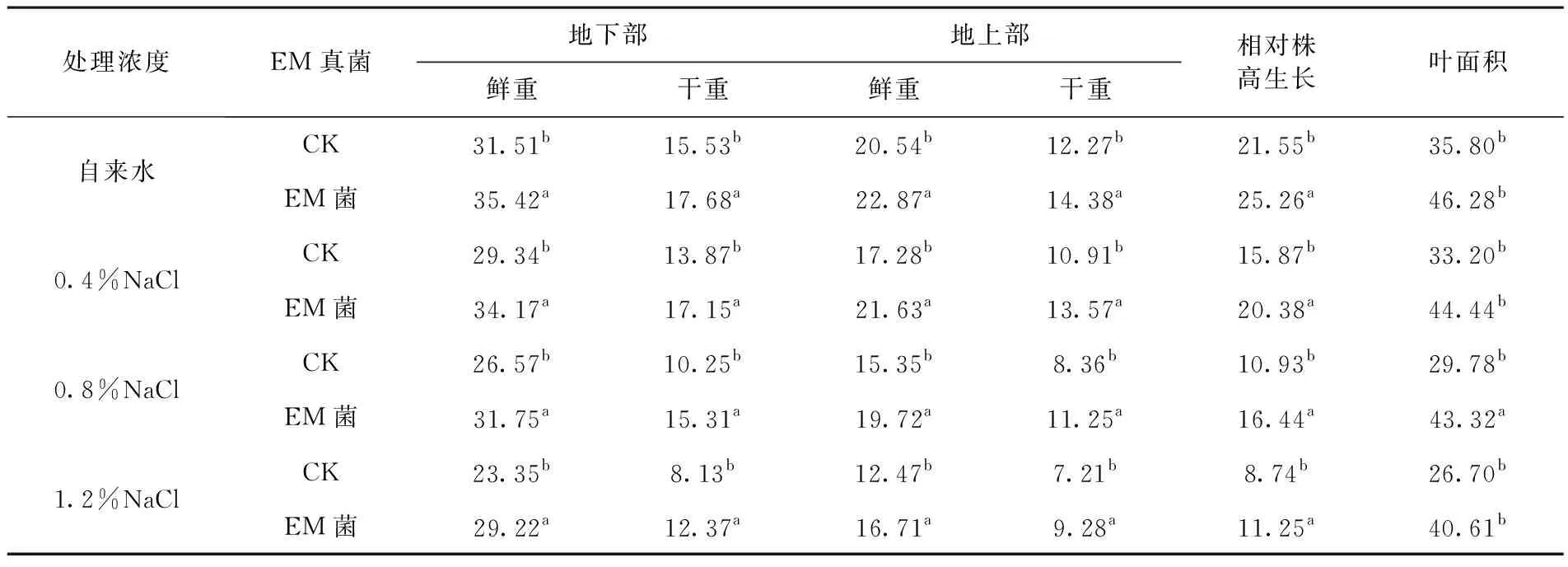
处理浓度EM真菌地下部地上部鲜重干重鲜重干重相对株高生长叶面积自来水CK31.51b15.53b20.54b12.27b21.55b35.80bEM菌35.42a17.68a22.87a14.38a25.26a46.28b0.4%NaClCK29.34b13.87b17.28b10.91b15.87b33.20bEM菌34.17a17.15a21.63a13.57a20.38a44.44b0.8%NaClCK26.57b10.25b15.35b8.36b10.93b29.78bEM菌31.75a15.31a19.72a11.25a16.44a43.32a1.2%NaClCK23.35b8.13b12.47b7.21b8.74b26.70bEM菌29.22a12.37a16.71a9.28a11.25a40.61b
2.2 EM菌对NaCl胁迫下核桃幼苗光合特性的影响
研究表明,在受到盐胁迫的第15 d,无论是低盐胁迫或高盐胁迫,幼苗叶片的净光合速率和气孔导度都明显下降。净光合速率和气孔导度下降的幅度随盐浓度的增加而增大。NaCl 质量分数达到1.2%时,叶片净光合速率、气孔导度只有对照的56%和61%,核桃叶片净光合速率和气孔导度对盐胁迫较敏感。整个胁迫过程中,叶片胞间CO2浓度和蒸腾速率变化幅度不是很大,NaCl 质量分数达到1.2%时,叶片胞间CO2浓度和蒸腾速率分别占对照的83%和83%,说明,核桃叶片胞间CO2浓度和蒸腾速率对盐胁迫不是很敏感。EM菌处理显著提高核桃幼苗光合能力,接种EM菌的核桃幼苗叶片净光合速率、气孔导度、胞间CO2浓度和蒸腾速率显著高于未接种的核桃幼苗。与对照相比,分别提高15%、13%、11%和25%。即使是在重度盐胁迫条件下,接种EM菌的核桃幼苗净光合速率和气孔导度仍相对较高,分别占对照的71%和77%。图1
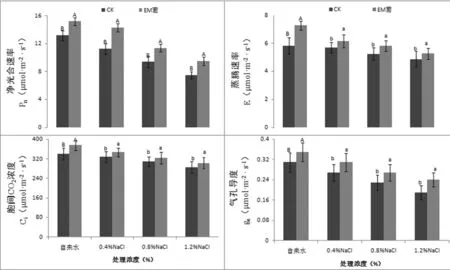
图1 EM菌对不同NaCl胁迫下核桃幼苗光合特性变化
Fig.1 Effects of EM fungi on photosynthetic characteristics of walnut seedlings under NaCl stress
2.3 EM真菌对NaCl胁迫下核桃幼苗叶片抗氧化系统的影响
随着胁迫浓度的升高,各处理叶片相对电导率、MAD含量、SOD和POD酶活性总体呈上升趋势,且上升的幅度随盐浓度的增加而增大。未接种EM菌的幼苗叶片相对电导率和MAD含量显著高于接种EM菌的幼苗。与自来水处理相比,未接种EM菌的幼苗叶片相对电导率和MAD含量分别提高了19%、33%、56%和16%、26%、44%;接种EM菌的幼苗叶片相对电导率和MAD含量分别提高了13%、31%、50%和9%、26%、38%。盐胁迫后没有接种EM菌的幼苗叶片细胞质膜透性发生了严重损害。与之相反,EM菌处理显著提高核桃幼苗抗氧化酶活性,低盐胁迫和高盐胁迫接种EM菌的幼苗叶片SOD和POD活性显著高于未接种EM菌的幼苗。与自来水处理相比,未接种EM菌的幼苗叶片SOD和POD酶活性分别提高了64%、157%、230%和13%、31%、42%,接种EM菌的幼苗叶片SOD和POD酶活性分别提高了49%、101%、162%和15%、26%、45%。
盐胁迫后,未接种EM菌的幼苗叶片相对电导率、MAD含量、SOD和POD酶活性变化幅度明显大于接种EM菌的幼苗。EM菌处理提高幼苗叶片抗氧化能力,未接种EM菌的幼苗叶片受胁迫程度重于接种EM菌的幼苗。图2
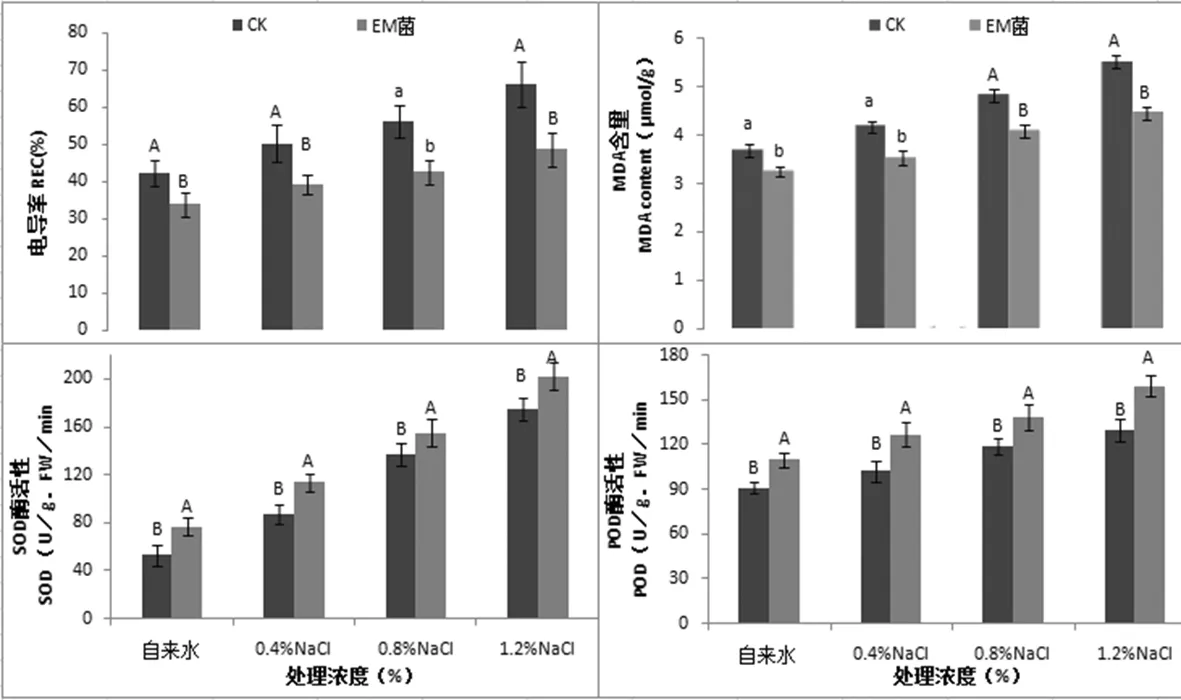
图2 EM菌对NaCl胁迫下核桃幼苗抗氧化系统变化
Fig.2 Effects of EM fungi on antioxidant system of walnut seedlings under NaCl stress
3 讨 论
生物量的改变是植物对盐胁迫的综合反映,也是评估植物盐胁迫程度和植物抗盐能力的比较可靠的标准[15-16]。研究结果表明,NaCl浓度为0.4%时,核桃幼苗生物量就开始下降,并且下降的幅度随盐浓度的增加而增大。NaCl浓度达到1.2%时,幼苗生长缓慢,相对根鲜重、相对根干重、相对冠茎鲜重、相对冠茎干重、相对株高生长量、叶面积占对照的 74%、52%、61%、59%、76%、75%,这表明核桃幼苗对盐胁迫比较敏感。当植物受到盐胁迫时,植物往往改变自身的细胞膜透性、气孔大小、叶片中色素含量等,来减轻或避免对自身的伤害。研究结果表明,盐胁迫条件,EM菌根化植株体内的生物量显著高于非菌根植物。虽然EM菌根化的幼苗生物量也随着盐胁迫浓度的增加而下降,但EM菌明显提高了幼苗的耐盐性,起到明显的缓冲作用。这可能是因为EM中的光合菌以植物根部的分泌物、土壤中的有机物等为基质,合成有利于植物生长的生理活性物质,提高土壤活力, 从而促进幼苗的生长[17]。
通常认为植物在胁迫条件下光合作用降低的原因包括两个方面:其一是气孔导度降低,进入气孔的CO2减少,不能满足光合作用的要求,称为光合作用的气孔限制,用气孔限制值Ls表示;另一方面由于叶片温度的增高,叶绿体活性与Rubiso活性降低、RuBP羧化酶再生能力降低,导致叶片光合作用能力降低,称为光合作用的非气孔限制[18-19]。研究发现,盐胁迫降低了核桃幼苗光合能力。在NaCl质量分数小于等于0.4%时,实生核桃苗可正常生长;当 NaCl质量分数超过0.4%时,NaCl对幼苗生长及光合生理具有明显的抑制作用,且随着 NaCl质量分数的增大其抑制越明显。当NaCl质量分数大于0.4%时,Ls随NaCl质量分数增大而升高(数据未列出)。光合速率降低主要是受气孔限制。接种EM菌的核桃幼苗叶片净光合速率、气孔导度、胞间CO2浓度和蒸腾速率显著高于未接种的核桃幼苗。即便是在重度盐胁迫条件下,EM菌根化幼苗的光合能力也维持在较高水平。EM菌参与调节植物的光合作用,缓解盐胁迫对核桃幼苗叶片光合作用的破坏,这可能是因为EM菌中的放线菌群从光合细菌中获取氨基酸、氮素等作为基质,产生出各种抗生物质、各种维生素、各种生化酶、促生长因子,提高果树的免疫功能。
植物受到盐胁迫后,主动调动保护系统来调节细胞内活性氧的产生速率和MDA的形成,从而减轻细胞膜脂过氧化的伤害[20-21]。SOD和 POD活性越高,消除氧自由基的能力越强,植物的抗盐能力越强。研究盐胁迫下,幼苗叶片相对电导率电导率、丙二醛含量、SOD和POD酶活性明显升高,这说明叶片细胞膜的通透性受到损伤,加速了 MDA 的积累,细胞自身的活性氧清除系统遭受破坏。 盐胁迫后EM菌根化植株的SOD和POD活性显著高于非菌根化植株,而作为生物在逆境条件下膜脂过氧化的终产物的丙二醛(MDA)含量和电导率则显著低于非菌根化植株。EM菌处理降低了核桃幼苗叶片的活性氧水平,减少了膜脂过氧化产物 MDA 的积累。采用培育菌根化核桃苗进行育苗移栽可减轻盐碱胁迫对核桃植株造成的伤害并有效促进核桃产量,实际应用中能否发挥抗盐和促进生物量增加的作用,还需要进一步开展相关研究。
4 结 论
核桃苗接种EM菌根真菌后地上部鲜/干重、地上部鲜/干重、株高生长量和叶面积分别增加12%、14%、11%、17%、17%和29%。与对照相比,重盐胁迫下,接种EM菌根真菌的幼苗叶片MDA 的积累降低15.7%;SOD、POD酶的活性分别提高44% 和23.2%;叶片净光合速率和气孔导读分别提高26.6%和26.3%。

