黑藻对沉积物上覆水及间隙水中磷垂直浓度变化的影响
黄立章, 许 超, 陈 涛, 周小华
(1.江西省水利规划设计研究院/江西省水工结构工程技术研究中心,江西南昌 330029;2.中国科学院亚热带农业生态研究所/亚热带农业生态过程重点实验室,湖南长沙 410125)
沉水植物是浅水湖泊的主要生物类群,是水生态系统的重要组分,占据着浅水水体生态系统的关键界面,以其自身的形态、群落结构特征及生理活动影响着其周围环境,对水体生产力及生物地球化学循环具有重要的影响,在维持湖泊生态平衡中发挥着重要的作用,近年来被广泛用于富营养化水体的修复[1]。沉水植物对磷在沉积物-水界面之间的迁移转化有着重要的影响,相关研究表明,沉水植物丰富的水域往往水土中总氮、总磷明显降低,水质清澈、藻类密度低,生物多样性高[2-4]。包先明等研究表明,沉水植物正常生长下对沉积物间隙水中磷含量有一定影响,但其影响作用不明显[5]。沉水植物生长过程中会改变沉积物-水界面环境因子,从而影响着沉积物中磷的释放与吸收[6-8]。研究表明,环境因子pH值、氧化还原电位等能够影响沉积物-水界面磷的循环过程,沉水植物通过提高上覆水中的溶解氧(DO)、氧化还原电位和pH值及沉积物氧化还原电位的方式影响上,覆水和沉积物之间磷的迁移转化[9]。苦草在生长过程中减缓了沉积物磷的相对释放速率,使上覆水中总磷、溶解性活性磷、溶解性有机磷、颗粒态总磷均呈现不同程度的下降,苦草主要通过吸收上覆水和间隙水中的磷及对环境因子的影响,使得上覆水中各形态磷保持在较低的水平,降低沉积物向水体释放磷的速率[10]。种植沉水植物可使上覆水总磷含量显著降低,且伊乐藻对总磷的净化效果优于菹草[11]。目前,沉水植物对上覆水磷浓度的影响主要是从水质净化和上覆水磷形态变化的角度进行了探讨,而采用通过培育沉水植物来探讨沉水植物生长中对间隙水中磷变化的影响的研究较为缺乏。
黑藻(Hydrillaverticillata)属于单子叶植物纲水鳖科黑藻属,是长江中下游浅水湖泊中重要的沉水植物之一,在浅水湖泊富营养化治理中应用较为广泛[5]。本研究以黑藻作为沉水植物的代表,研究沉水植物生长过程中沉积物-水系统中磷在上覆水及间隙水垂直浓度的变化情况,以期为利用沉水植物修复富营养湖泊提供科学基础。
1 材料与方法
1.1 材料
供试沉积物为采自南昌市城市湖泊艾溪湖0~10 cm层的沉积物,于通风阴凉处自然风干,研磨,过10目筛,于密实塑料袋中存放备用。沉积物基本理化性质见表1。
试验所用沉水植物黑藻(Hydrillaverticillata)购自广州花草市场,购回后用自来水浸泡,把杂质和腐烂根叶剔除,隔段时间更换自来水驯化。

表1 南昌市艾溪湖沉积物基本理化性质
1.2 试验装置与仪器
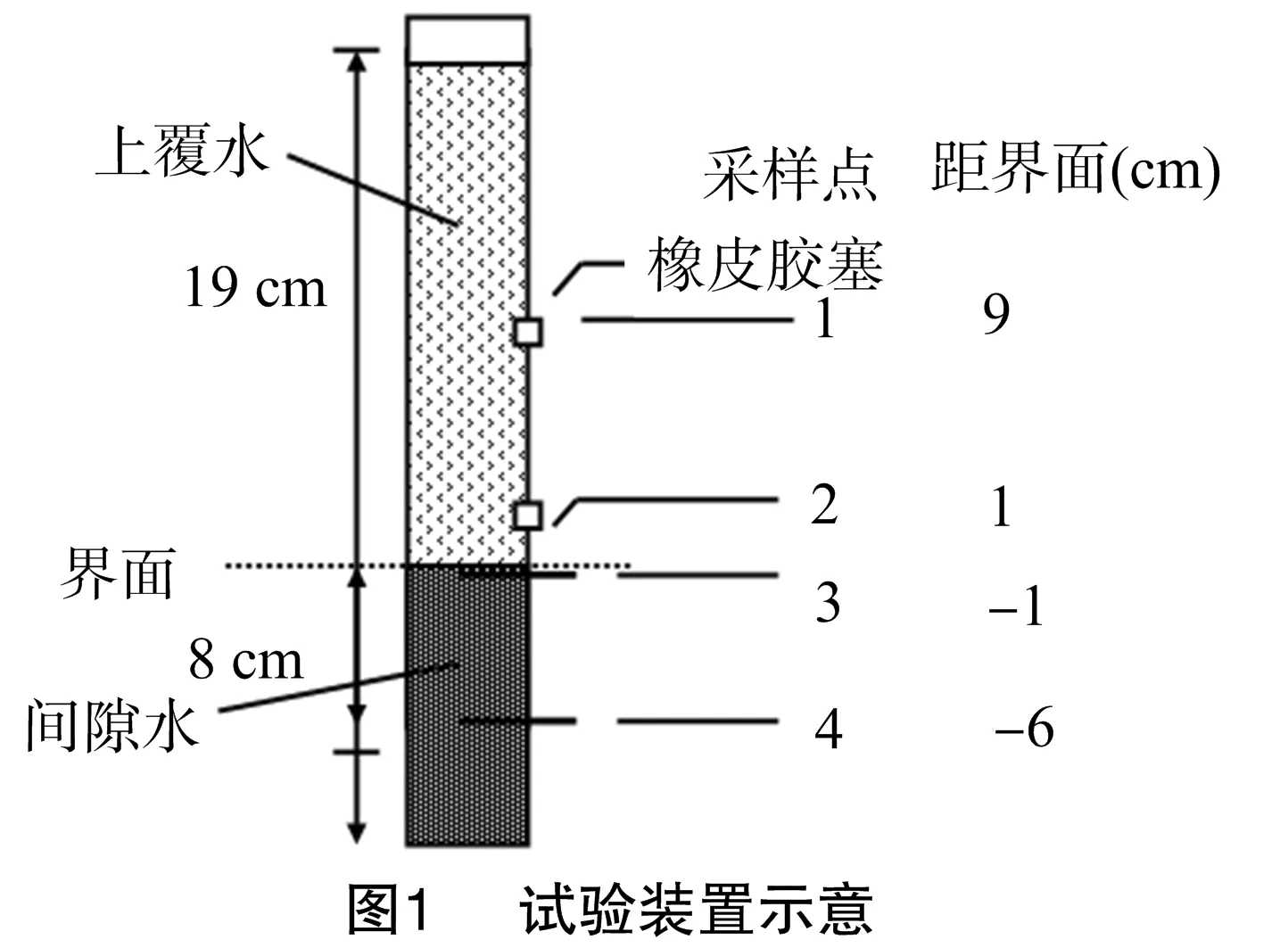
用塑料桶制作沉积物模拟装置(图1),塑料桶开口直径32.5 cm,底直径24.0 cm,高30.0 cm,每桶装5.5 kg、高度 8 cm 过筛的沉积物,在试验装置的一侧不同间隔位置开了4个小孔以作采样口,上覆水和间隙水取样口各占2个,它们距离沉积物-水界面的距离分别为9、 1、-1、-6 cm(负号表示界面以下)。在小孔中安装土壤溶液Rhizon-SMS土壤水分采样器(型号19.21.xx)。
1.3 试验方法
试验设计2个处理,分别为种植沉水植物、不种植沉水植物处理,每个处理添加磷1 g/kg,以KH2PO4固态的形式添加,搅拌均匀,并设3个重复。试验时分别取4株生长一致的健壮沉水植物(5.3 g/株),用纯水洗净,称鲜质量后植入试验桶中。试验开始时,向桶内缓缓加入蒸馏水至水面高度19 cm(距界面),在水面处作标记。分别在处理后7、15、30、45、60、75、90、105、120、135、150、165、180 d,自上而下抽取各层水样。每次采样后沿管壁缓缓加入蒸馏水至水面初始刻度(t=0 h时)以补充采样和蒸发消耗的水量。
本试验期于2013年5月7日至2013年11月4日在华南农业大学塑料大棚内进行。
1.4 测定方法
沉积物pH值用MARTINI便携式pH值测试仪(型号MI106)测定,土水质量比为1 ∶2.5(风干土);有机质用水合热重铬酸钾氧化-比色法测定[12]。水样pH值用MARTINI便携式pH值测试仪(型号MI106)测定;氧化还原电位用奥立龙ORP检测仪(型号320P-83A)测定;水中可溶性磷酸盐采用钼锑抗分光光度法测定[13-15]。土壤有效铁、有效锰用DTPA浸提,原子吸收分光光度计(日本HITACHI公司,Z-2300)测定[12]。实验室所用器皿均用稀盐酸浸泡过夜,所用药品均为分析纯。
1.5 数据分析
数据采用Excel 2007和SPSS统计软件包(19.0版本)进行分析处理。
2 结果与分析
2.1 上覆水和间隙水不同采样点可溶性磷酸盐变化动态
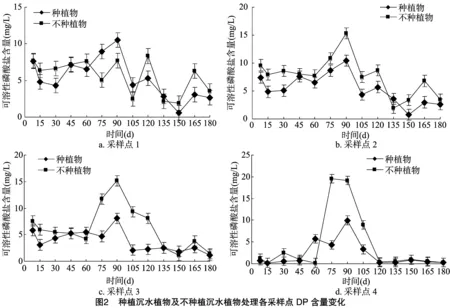
试验开始阶段水体磷浓度较高,这主要是由于沉积物短暂的磷释放导致,沉积物总磷含量较高,而上覆水是自来水,因此形成较大的浓度梯度,开始向上覆水释放磷。但是随着上覆水体高的溶解氧逐渐进入沉积物,使得沉积物-水体系由还原态向氧化态转变,在氧化状态下,Fe2+向Fe3+转变,同时,水体的pH值在后期也逐渐升高(图2),产生[Fe(OH)s]胶体还会对水中溶解性磷进行吸附,从而抑制磷的释放。从图2可以看出,种植沉水植物和不种植沉水植物处理上覆水采样点1、采样点2和间隙水采样点3处可溶性磷酸盐含量在试验期间均呈下降趋势;间隙水采样点4处可溶性磷酸盐含量在60~120 d有较大波动,其他时间变化不明显。在 60~105 d期间,种植沉水植物处理和不种植沉水植物处理可溶性磷酸盐含量呈现先上升后下降的变化,说明在此期间,沉积物存在一个明显的向水中释放磷的过程。上覆水采样点1处种植沉水植物处理可溶性磷酸盐浓度上升程度大于不种植沉水植物处理,上覆水采样点2处、间隙水采样点3处、间隙水采样点4处不种植沉水植物处理可溶性磷酸盐浓度的上升程度大于种植沉水植物处理。
在大部分时间内,种植沉水植物处理上覆水采样点1、采样点2处和间隙水采样点3、采样点4处可溶性磷酸盐浓度小于不种植沉水植物处理。纵向变化上,种植沉水植物处理中,上覆水采样点1和采样点2处可溶性磷酸盐浓度值相差并不大,间隙水采样点4处可溶性磷酸盐浓度值除60~105 d外,其他时间要小于采样点3处,而上覆水磷浓度总体要高于间隙水磷浓度。不种沉水植物处理中的可溶性磷酸盐含量纵向变化规律与种沉水植物处理不同,上覆水采样点1处可溶性磷酸盐浓度值要小于采样点2处,而间隙水采样点3处除75~105 d 外,其他时间可溶性磷酸盐浓度大于采样点4处。上覆水采样点2处和间隙水采样点3处可溶性磷酸盐浓度相比,采样点3处在75~105 d可溶性磷酸盐浓度明显大于采样点2处,此外的大部分时间里,采样点3可溶性磷酸盐浓度值小于采样点2。
2.2 pH值变化动态
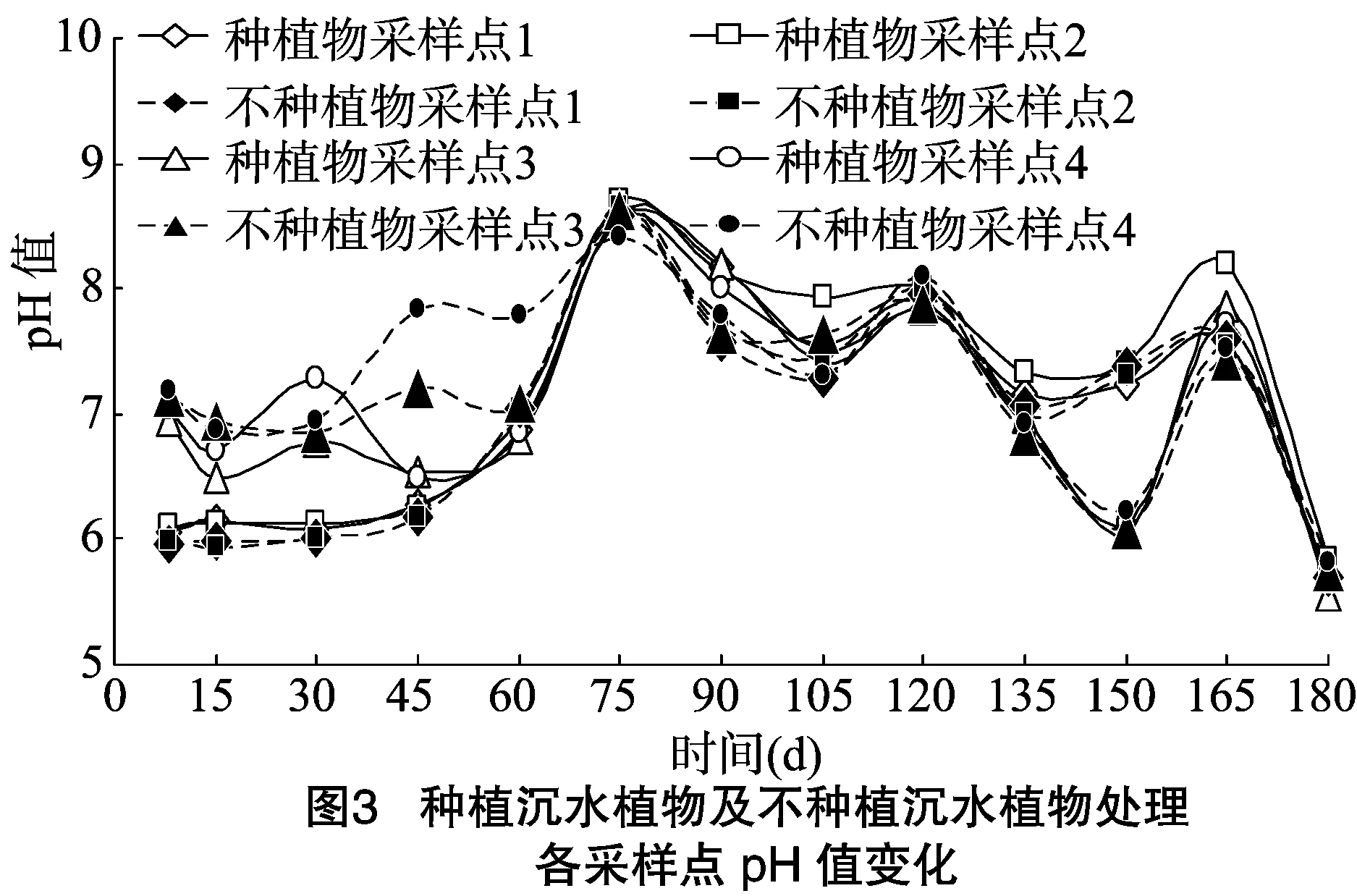
从图3可以看出,在试验开始时,种沉水植物处理上覆水的pH值明显低于间隙水。上覆水和间隙水pH值在0~75 d呈上升趋势,在75 d达到峰值,之后呈下降趋势。与不种沉水植物处理相比,种沉水植物处理上覆水pH值升高,而间隙水pH值则变化较大,在8~60 d升高,60~90 d、105 d时降低,之后相差不明显。纵向变化上,种沉水植物处理上覆水采样点1和采样点2处pH值差异不大,而间隙水中深度较深的采样点4处pH值大多高于采样点3处,说明间隙水pH值大小与深度有关。采样点2和采样点3处,即上覆水和间隙水在距沉积物-水界面等距离点处相比,在8~45 d,上覆水采样点2处pH值小于间隙水采样点3处,而60 d以后,采样点2处pH值要大于间隙水采样点3处。不种沉水植物处理纵向变化的规律与种沉水植物处理大致相同。
2.3 氧化还原电位变化动态
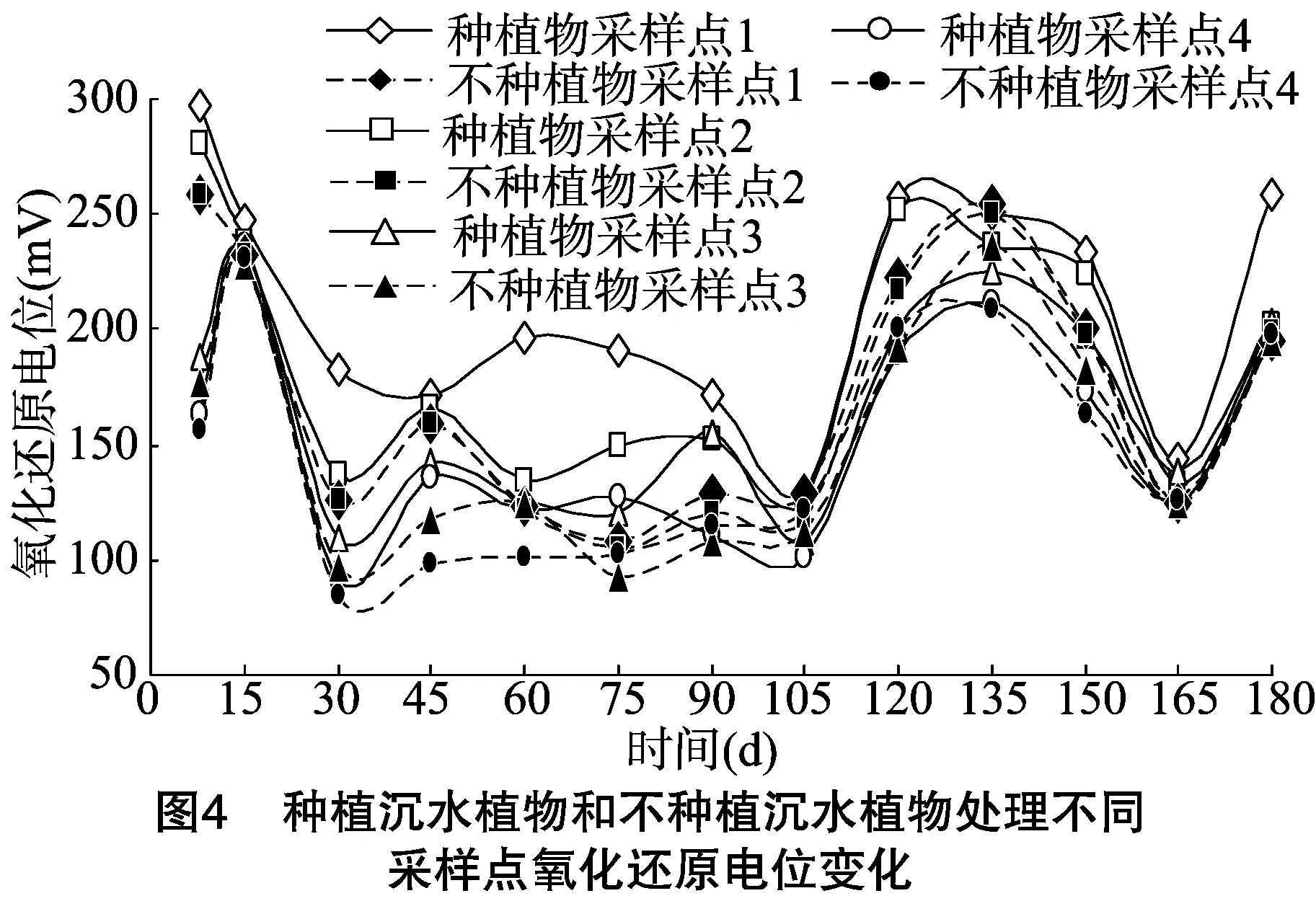
氧化还原电位变化动态见图4,种植沉水植物处理上覆水和间隙水各层次氧化还原电位值都大于不种植沉水植物处理。在试验开始时种植沉水植物处理上覆水氧化还原电位值明显大于其间隙水。不种植沉水植物处理和种植沉水植物处理氧化还原电位值在试验时间内的变化规律相似。上覆水和间隙水氧化还原电位值在0~165 d总体呈下降趋势,之后升高。
纵向变化上,种植沉水植物处理上覆水采样点1处氧化还原电位值大于采样点2处,而间隙水采样点3处氧化还原电位值大于采样点4处,采样点2处氧化还原电位值大于采样点3处。表明种植沉水植物处理氧化还原电位值大小与采样点的深度有关,随着采样点深度的增加其氧化还原电位值减小。不种植沉水植物处理上覆水采样点1和采样点2处氧化还原电位值无明显差异;在8~60、135~150 d间隙水采样点3处氧化还原电位值大于采样点4处,75~120 d则小于采样点4处,其他时间无差异。
2.4 可溶性磷酸盐与环境因子参数之间的关系
从表2可以看出,种植沉水植物处理和不种植沉水植物处理上覆水的pH值和氧化还原电位之间呈极显著负相关,pH值和可溶性磷酸盐呈显著正相关。种植沉水植物处理可溶性磷酸盐和氧化还原电位无显著相关性,不种植沉水植物处理二者间呈显著负相关。

表2 种沉水植物和不种沉水植物处理pH值、氧化还原电位和可溶性磷酸盐相关性分析
3 讨论与结论
3.1 沉水植物对上覆水和间隙水磷浓度的影响
沉水植物在生长过程中可以通过茎叶和根系来吸收上覆水和沉积物中的磷,以合成植物体内的物质。在本试验条件下,种植沉水植物和不种植沉水植物处理上覆水可溶性磷酸盐浓度均在105 d左右出现一个波峰,此后随着试验的进行均呈现降低的趋势,主要原因可能是刚开始培育的时候,上覆水和沉积物之间存在一个磷的浓度差,沉积物此时充当“源”的角色向上覆水释放磷,当沉水植物进入生长旺盛期的时候,沉积物中磷向上覆水的扩散逐渐下降并趋于稳定。因为沉水植物直接与沉积物接触,不仅能直接吸收沉积物释放的磷,也能直接从沉积物中吸收营养盐;沉水植物光合作用产生氧气提高水体及根系周边的溶解氧,从而抑制沉积物磷的释放。种植沉水植物处理上覆水可溶性磷酸盐浓度总低于不种植沉水植物处理。本试验系统中,处于一个相对封闭的环境,没有外源磷的输入,上覆水中的磷只来自于沉积物,因此可推断沉水植物存在可降低上覆水中磷的浓度,特别对沉积物-水界面附近上覆水可溶性磷酸盐浓度影响显著。
3.2 上覆水环境因子的改变对磷释放的影响
影响内源磷释放的因素包括理化性质和外部环境因子,理化性质包括沉积物中磷的含量和赋存状态、氧化还原电位、沉积物的组成等;外部环境因子包括上覆水的溶解氧、pH值、温度、生物作用、扰动等。沉水植物对水环境条件如溶解氧、氧化还原电位、pH值等都有重要影响[16]。在本试验条件下,种植沉水植物处理上覆水、间隙水中pH值和氧化还原电位均高于不种植沉水植物处理。
本试验中种植沉水植物处理水样pH值较高,一般认为,沉水植物因其根、茎、叶完全沉没于水中,在白天光照充足时,会因其强烈的光合作用消耗水中的CO2,导致水中pH值提高[17]。众多研究也观察到,具有沉水植物生长的水体,水中的pH值较高[18-19]。Jin等研究发现,pH值升高时将促进沉积物磷释放[20];Jensen等调查了丹麦不同湖泊pH值与PO43-含量之间的关系,发现部分湖泊高pH值明显促进溶解活性磷的释放[21]。金相灿等研究,通过添加酸碱控制试验水体pH值,室内模拟研究太湖不同湖区沉积物的磷释放量,提出水体磷的含量与pH值存在明显的呼应关系,高pH值条件下,促进NaOH-P的释放,而在低pH值条件下,促进HCl-P的释放[22]。本试验表明,在沉水植物存在的条件下,沉水植物生长所引起的pH值升高并未导致沉积物磷的释放增加。
本试验中种植沉水植物处理上覆水和间隙水各层次氧化还原电位值都大于不种植沉水植物处理。相关研究表明,当氧化还原电位较高时,金属离子与磷酸盐结合成不溶的磷酸盐,可溶性磷也被氢氧化物吸附而逐渐沉降,从而起到抑制沉积物磷的释放,本研究结论与这些研究结果[23-24]一致。
沉积物中的磷释放是在各种因素共同作用下产生综合影响效应的结果。本试验中,仅仅研究了上覆水pH值和氧化还原电位的变化显然是不够的,其他因素如沉积物的性质、沉积物磷形态、温度、沉水植物生理状况等因素也起着重要作用。沉积物与水体之间磷的迁移转化是一个很复杂的过程,上覆水中磷浓度的变化是否显著是各种环境因子综合作用的结果,而不能单考虑pH值或氧化还原电位,可能是居于主导作用的因素决定磷吸附还是释放,因此,在这样一个封闭的系统里,哪种影响因子对沉积物磷的转化和释放产生决定因素还需要进一步研究阐明。
在沉水植物影响下,上覆水和间隙水的磷含量均有所降低,沉水植物对于水中可溶性磷酸盐含量影响的程度与采样点和沉积物-水界面的距离有关,即距离越小,影响越明显,所以如果利用沉水植物来修复湖泊富营养化时,在成本允许的情况下,可适当考虑缩短沉水植物的株距。
致谢:特别感谢华南农业大学环境与资源学院杨哲同学在试验过程中给予的帮助。
——以武汉紫阳湖为例

