滨海不同湿地类型土壤微生物功能多样性
顾国海, 李梦莎
(1.苏州农业职业技术学院,江苏苏州 215008; 2.黑龙江省科学院自然与生态研究所,黑龙江哈尔滨 150040)
土壤微生物是生态系统中的重要组成部分之一[1],是土壤元素循环与转化的主要动力之一[2-3],在生态系统功能以及全球生态系统地球化学循环中发挥着重要的作用[4-5]。土壤微生物群落多样性反映了土壤微生物群落组成和结构的变化[6],而通过对土壤微生物群落组成和结构变化进行分析,能够为解决生态系统功能的变化,制定保护和合理利用湿地资源的措施提供理论基础[7-9]。因此,研究土壤微生物群落结构及其功能多样性,对评价土壤质量、生态系统功能和土壤元素循环具有重要意义[10-11]。
滨海湿地是我国重要的湿地之一,具有显著的区域特性。本试验选择3个典型的湿地类型-芦苇湿地、碱蓬湿地、互花米草湿地分别设立样地,采集表层0~20 cm的土壤,采用Biolog-ECO微平板检测法分析土壤微生物群落功能多样性的变化规律,探讨其差异的形成机制,以期全面了解和评价滨海湿地土壤微生物的分布特点。研究结果将为进一步阐明滨海不同类型湿地土壤微生物分布特征提供理论基础,为滨海湿地生态系统保护与管理提供理论参考。
1 材料与方法
1.1 试验材料
本试验样地位于江苏省盐城国家级自然保护区内。总面积约为247 260 hm2,其中核心区面积22 596 hm2,缓冲区面积56 742 hm2,试验区面积167 922 hm2。保护区位于江苏省盐城市境内,范围在119°53′45″~121°18′12″E,32°48′47″~34°29′28″N 之间。保护区地处暖温带与北亚热带过渡地带,主要受海洋与大陆性气候影响,年平均气温为 13.7~14.6 ℃,年平均降水量1 000 mm,雨量集中在夏季,冬天多干旱。夏季(3月至8月份)凉爽,冬季(9月至次年2月)温暖。
1.2 试验设计
在实验站内选择3个20 m×20 m代表样地,分别为芦苇湿地(LW)、碱蓬湿地(JP)以及互花米草湿地(MC)。于2014年8月采集土壤样品,用直径为4 cm的土钻按混合采样法采集0~20 cm土层,每个土样由5个采集点的土壤混合,混匀后用四分法取适量于封口袋中,用冰盒带回实验室。采集的土样一部分保存在4 ℃条件下,用于分析土壤微生物群落功能多样性;另一部分风干、磨细,过100目筛用于测定土壤理化性质(表1)。
1.3 试验方法
本试验采用Biolog-ECO微平板法对不同类型滨海湿地土壤微生物功能多样性进行分析。具体方法参照Classen等的方法[11]。首先土壤样品在25 ℃活化24 h,称取约10 g烘干土的新鲜土样加入内有90 mL灭菌生理盐水的三角瓶中,加无菌棉花塞后,将三角瓶在旋涡振荡器上震荡1 min,然后置于冰水浴中1 min,反复3次。静置2 min后按逐步稀释法,依次稀释为10-2和10-3的土壤悬浮液。用八通道移液器向ECO板每孔中加入10-3的土壤悬浮液,接种量为150 μL,将接种好的微孔板放在(25±1) ℃下连续培养13 d,每隔 24 h 用酶标仪测定590 nm处的吸光度。
土壤pH值测定时水土比为2.5 mL ∶1 g;土壤含水率采用烘干法测定;土壤有机碳利用碳氮分析仪测定(耶拿-2100S, 德国耶拿分析仪器股份公司); 土壤中全氮采用半微
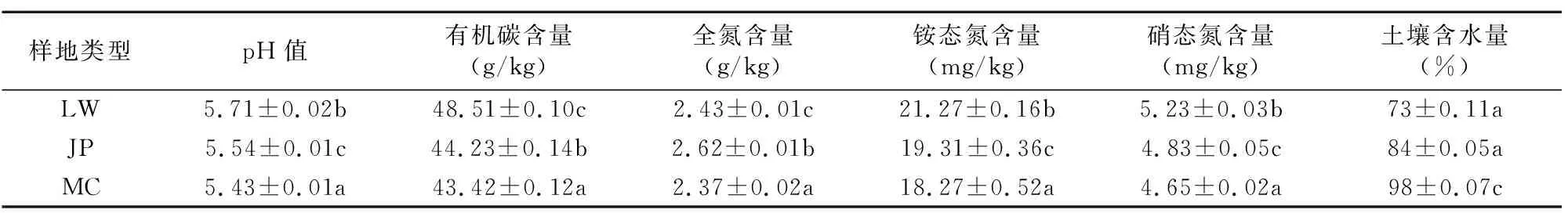
表1 不同湿地类型下的土壤理化性质
量凯氏定氮法测定;硝态氮采用酚二磺酸比色法测定;铵态氮采用氯化钾浸提-靛酚蓝比色法测定。
1.4 数据处理
微生物代谢强度采用平均颜色变化率(average well color development,简称AWCD)来描述,是利用单一碳源能力的重要指标。采用Biolog微平板培养168 h的数据进行数据统计,此时即使生长较慢的微生物也已参与碳源的代谢过程,因此能较全面地反映微生物群落的信息。采用Shannon多样性指数、Simpson多样性指数和McIntosh多样性指数来表征土壤微生物群落代谢功能多样性。
平均颜色变化率[12-14]:AWCD=∑(Ci-R)/31;
Shannon多样性指数[15-16]:H=PilnPi;
Simpson多样性指数[16]:D=1-∑(Pi)2;
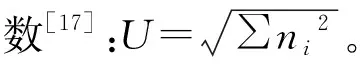
式中:Ci为第i个碳源孔吸光度;R为对照孔吸光度,若Ci-R≤0,计为0;ni是第i孔的相对吸光度;Pi为ni与整个平板相对吸光度总和的比率。
采用SPSS 19.0软件进行主成分分析(PCA)和单因素方差分析(one-way ANOVA),用S-N-K法进行差异显著性检验,显著性水平设为α=0.05;绘图采用Sigmaplot 12.5软件。
2 结果与分析
2.1 土壤微生物对碳源利用的动力学特征
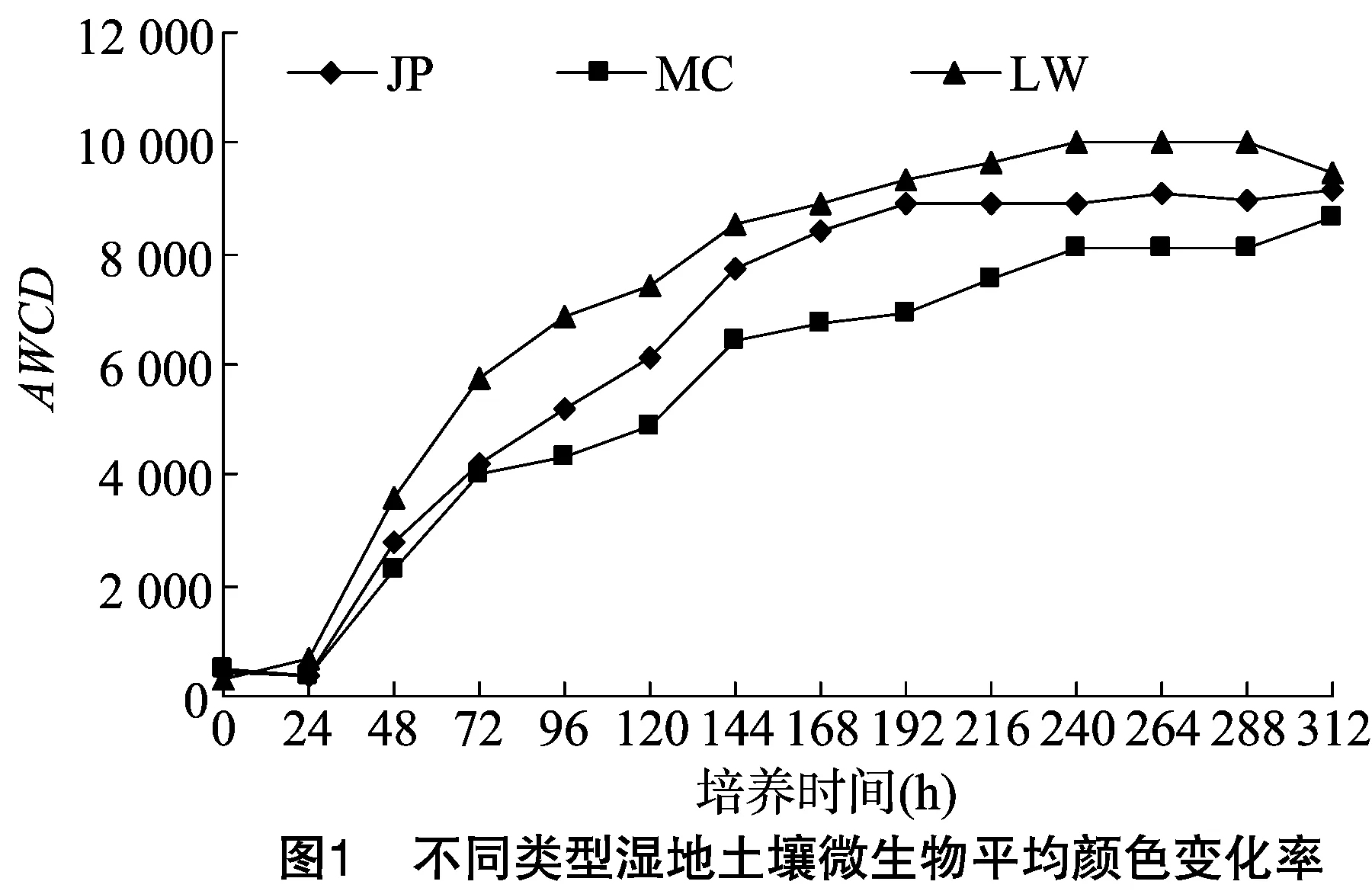
从图1可以看出,培养期间AWCD随着培养时间的延长而升高,其中,24~168 h期间AWCD值快速增加,说明微生物不断适应ECO板各孔的环境,处于对数生长期,大量碳源被利用,此时微生物代谢活性旺盛;随着培养时间的进一步延长,168 h以后土壤微生物缓慢步入稳定期。比较不同湿地类型土壤微生物群落AWCD发现,芦苇湿地>碱蓬湿地>互花米草湿地,说明随着陆-海湿地类型的改变土壤微生物碳代谢活性逐渐降低。
2.2 土壤微生物群落多样性指数分析
土壤微生物群落对不同碳源的利用情况可以用多样性指数表示。表2中显示了土壤微生物在培养168 h时的Shannon、Simpson和McIntosh多样性指数,可在数量特征上相对反映土壤微生物群落物种组成和个体数量分布的情况。结果显示,在3个类型的湿地中,随着由陆-海湿地类型的转变,土壤微生物Shannon多样性指数和McIntosh多样性指数均表现为下降趋势。其中,芦苇湿地的土壤微生物Shannon指数和McIntosh指数均最高,碱蓬湿地次之,互花米草湿地最低,从Shannon指数来看,芦苇湿地仅与碱蓬湿地差异显著,而与互花米草湿地差异不显著;从McIntosh指数来看,芦苇湿地仅与互花米草湿地差异显著,与碱蓬湿地差异不显著。而不同类型湿地的Simpson指数间差异不显著。

表2 土壤微生物群落多样性指数
2.3 土壤微生物群落对不同类型碳源的利用强度
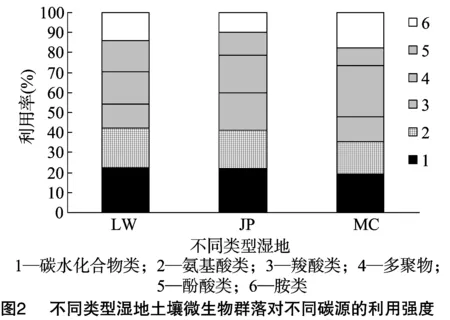
Biolog-ECO板中含有31种碳源,包括碳水化合物类(10种)、氨基酸类(6种)、羧酸类(7种)、多聚物(4种)、酚酸类(2种)和胺类(2种)。由图2可知,不同类型湿地土壤微生物群落对不同类型碳源的利用强度明显不同,植被类型是影响不同碳源利用强度的重要因素。随着湿地植被类型的变化,滨海湿地对不同类型碳源的利用强度呈现出不同的趋势。其中,芦苇湿地对于碳水化合物类、氨基酸类、多聚物的利用率最大;碱蓬湿地对碳水类利用率最大;互花米草湿地对多聚物类利用强度最大。整体来看,土壤微生物对碳水化合物类利用最多,其次是氨基酸类和多聚物,对羧酸类、酚酸类、胺类的利用则相对较少,可见滨海湿地土壤微生物比较偏好的碳源类型为碳水化合物类、氨基酸类和多聚物。
2.4 不同类型湿地土壤微生物群落功能主成分分析
对培养168 h的AWCD值进行微生物群落功能主成分分析(principal component analysis,简称PCA),其中第一主成分(PC1)和第二主成分(PC2)的方差贡献率分别为82.18%和10.82%,累积方差贡献率为93.00%,说明PC1和PC2是微生物群落碳源利用变异的主要来源,可以解释变异的绝大部分信息。从图3可以看出,不同类型湿地土壤微生物群落在碳源利用上有明显的空间分异,而且在PC1和PC2上的得分系数均有明显差异,可见土壤微生物群落碳代谢特征受到不同湿地类型的明显影响。在PC2轴上,各样地土壤微生物碳源利用的主成分分析得分排序为互花米草湿地>碱蓬湿地>芦苇湿地,与AWCD值和多样性指数的分析结果一致,总体呈现随不同湿地类型的改变碳源利用活性呈现下降的趋势。不同类型湿地土壤微生物群落明显分为3簇。
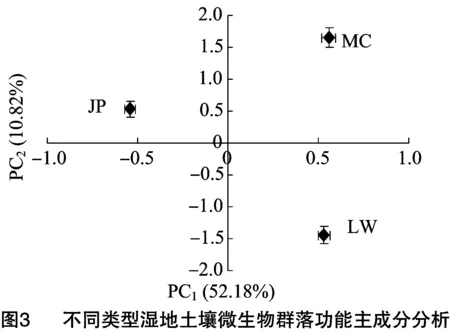
按照相关性系数绝对值大于0.85的标准对PC1和PC2进行分析,从表3可以看出,与PC1具有较高相关性的碳源有13种,其中碳水化合物类6种、氨基酸类1种、羧酸类3种、多聚物1种、酚酸类2种;与PC2具有较高相关性的碳源有6种,包括碳水类1种、氨基酸类2种、羧酸类2种、胺类1种。综合PC1和PC2结果可知,不同类型湿地中对土壤微生物群落代谢功能起作用的主要碳源类型为碳水化合物类、氨基酸类和羧酸类,不同类型湿地的差异主要体现在对碳水化合物类、氨基酸类和羧酸类碳源的利用上,其中碳水化合物类最为突出。
2.5 土壤微生物代谢特性与土壤理化性质相关性分析
将土壤有机碳含量、全氮含量、硝态氮含量、铵态氮含量、含水率和pH值与土壤微生物群落多样性指数进行相关性分析。由表4可知,Shannon多样性指数与pH值呈正相关关系,而与有机碳含量呈负相关关系;Simpson多样性指数与有机碳含量呈负相关关系;Mclntosh多样性指数与全氮含量正相关;微生物的代谢活性(用AWCD表示)与pH值、有机碳含量和全氮含量正相关。
3 讨论
土壤微生物群落多样性是反映土壤肥力、土壤环境变化过程的重要指标之一,可以很好地揭示不同生态系统在微生物上的功能差异,在生态系统功能中具有重要的意义。在本研究中,随着培养时间的延长,AWCD值逐渐上升,且随着芦苇湿地-碱蓬湿地-互花米草湿地的变化,AWCD值呈现下降趋势,这与郑华等研究不同森林土壤微生物群落多样性变化的结果一致[18]。说明土壤养分的差异是影响土壤微生物功能活性的主要因素之一。
Shannon多样性指数、Simpson多样性指数和McIntosh多样性指数分别表征土壤中微生物群落的丰富度、优势度以及均匀度[6]。在3个不同湿地类型中,芦苇湿地与碱蓬湿地Shannon多样性指数差异显著;芦苇湿地与互花米草湿地McIntosh多样性指数差异显著。这说明土壤理化性质影响了微生物的群落结构组成,这与很多研究的结果[19-20]一致。也就是说,土壤理化性质对土壤微生物的活性以及结构都具有重要的影响。

表3 31种碳源与PC1、PC2的相关系数

表4 土壤微生物多样性指数与理化性质的相关性
土壤微生物群落对不同类型碳源的利用强度存在一定的差异,3个不同湿地类型中,土壤微生物对碳水化合物类的利用率最高,为优势碳源,主要包括β-甲基-D-葡萄糖苷、D- 半乳糖酸-γ-内脂、D-木糖、N-乙酰-D-葡萄糖胺、D-纤维二糖、α-D-乳糖;3个不同湿地类型微生物功能多样性的差异主要体现在对碳水化合物类、氨基酸类和羧酸类碳源的利用上,这与左平等的研究结论[21],即不同生境条件下土壤微生物对碳源的利用率有所不同,不同湿地土壤微生物功能上的差别是由各微生物群落对碳源的总体利用率产生的差别[21]。本研究发现,互花米草湿地胺类的利用效率也占到了20%以上,且对碳源的利用率具有很强的选择性,这都说明在淹水环境中土壤微生物的多样性比较低,对碳源的利用具有选择性;而芦苇湿地和碱蓬湿地土壤微生物对碳源的利用率比较均衡。这说明土壤微生物所表现出的对碳源利用的不一致性是受到植物多样性和土壤性质的影响,受到多因素控制。
由土壤微生物对31种碳源的利用主成分分析得知,3个不同湿地类型的土壤微生物对碳源的利用特征差异比较明显,这一点可能和样地的生境特征有一定的关系。随着湿地类型的变化,湿地的物种多样性发生了变化,因此作为主要输入碳源的凋落物的组成和含量发生了比较明显的变化,进而使土壤微生物代谢特征发生一定的改变,使其对碳源利用的种类和强度均发生变化。左平等指出,地上植物的多样性会通过凋落物的差异对土壤微生物功能代谢产生重要影响[21-22]。此外,通过对土壤微生物的多样性指数和AWCD值进行主成分分析,3个不同湿地类型明显出现分化,更有力地证明了湿地条件下物种多样性的组成会对土壤微生物的组成和功能活性产生重要的影响。
综上所述,不同类型湿地土壤微生物群落代谢特征具有较为明显的地带性差异。不同类型湿地由于其生境的差异,导致土壤理化以及植物群落组成发生了变化,这些是影响土壤微生物代谢活性的主要因素。由于Biolog-Eco微平板技术的局限性,仅采用此技术很难完整地反映不同滨海湿地土壤微生物群落功能多样性的变化规律。目前随着其他技术手段的快速发展,结合多种微生物学研究方法,如磷酸脂肪酸(phospholipid fatty acid,简称PLFA)谱图分析法和分子生物学技术(如宏基因组技术),将为完整了解盐城滨海湿地微生物群落结构和功能等信息提供很好的方法。

