NaCl胁迫下木槿嫁接苗及其砧木海滨木槿的生理响应
包学文, 李和平, 施 钦, 华建峰, 芦治国
(1.南京森林警察学院,江苏南京 210023; 2.江苏省中国科学院植物研究所,江苏南京 210014)
我国约有0.2亿hm2盐碱地,主要分布在西北、华北、东北内陆和沿海地区[1]。在盐碱土中,土壤渗透压较大,土壤通气性、透水性差,表层土壤养分有效性通常较低,因此盐碱地区植物的生长和发育受到较大影响。据报道,我国华东沿海地区滩涂土壤表层剖面含盐量以氯化物为主,整体含盐量较高,超过常规绿化树种的生长极限(低于0.3%)[2]。随着沿海开发国家战略的实施,盐碱地区的植物绿化建设越来越受到重视。作为绿化建设的重要途径,筛选适生的耐盐绿化植物不仅能帮助人们科学地恢复植被,更能最大程度地发挥盐碱地区的生态和经济效益。
海滨木槿(Hibiscushamabo)为木槿属(Hibiscus)落叶树种,树高可达4~5 m,原产于浙江、福建和广东沿海的部分地区。该树种根系发达,具有耐盐、抗风和抗旱等特点。木槿(H.syriacus)同为木槿属树种,相比于海滨木槿,木槿因其较高的园艺观赏、药用和食用价值在热带和亚热带地区应用颇为广泛。在设施栽培中,通过异根嫁接可有效提高接穗的产量和品质,如以葫芦(Lagenariasiceraria)为砧木嫁接西瓜(Citrulluslanatus)可解决土壤盐害导致的西瓜减产[3];以南瓜(Cucurbitamoschata)为砧木嫁接黄瓜(C.sativus)可有效提高黄瓜的耐盐性进而提高产量[4]。已有研究表明,以海滨木槿为砧木对木槿进行嫁接,嫁接亲和力很强且植株生长良好[5]。因此,引种不同用途的木槿,并以海滨木槿为砧木进行嫁接,同时开展耐盐试验测定和容器育苗技术等研究,扩大木槿适栽区域并形成规模化生产能力,能在很大程度上丰富沿海绿化的树木种类及品种,为沿海产业带生态环境建设提供必要的技术保障措施。
前期海滨木槿和嫁接木槿耐盐试验在生长以及Na+、K+分布等方面已有研究[6-7],因此本试验选择海滨木槿并以海滨木槿为砧木的嫁接木槿,研究不同程度盐胁迫下其光合、叶绿素荧光、内源激素、酶系统和养分等的变化,为进一步研究嫁接木槿在盐胁迫下的响应提供试验依据。
1 材料与方法
1.1 材料和试验设计
供试海滨木槿和木槿来源于南京中山植物园试验苗圃,其中海滨木槿为一年生扦插苗,木槿枝条采自白花木槿(H.syriacus‘Notwood’)。2016年5月进行木槿嫁接,砧木采用海滨木槿,每株海滨木槿上嫁接1个木槿插穗,栽培基质由黄土、泥炭土、珍珠岩按体积比5 ∶1 ∶1混合而成,每盆(直径25 cm、高度35 cm)1株,嫁接完成后将木槿嫁接苗与海滨木槿一起置于自然光照下并每周充分灌溉2次,前期适应4个月。
2016年9月选取生长良好、长势均匀的植株移放至温室开始进行NaCl胁迫处理。设置0(CK,自来水)、0.3%、0.5%、0.7% NaCl溶液浇灌基质处理,每天16:00浇1次,每盆浇 100 mL。为防止NaCl胁迫下的应激效应,前3次浇灌先用各处理1/2浓度的对应NaCl溶液浇灌,随后正式开始试验,共连续浇灌30 d。试验采用随机排列,每个处理4次重复。
1.2 指标测定

内源激素脱落酸(ABA)和生长素(IAA)的测定采用酶联免疫吸附法。称取0.5 g样品用5 mL 80%甲醇提取,4 ℃、10 000 r/min 离心10 min,上清液过C18柱后取50 μL样液,按照说明书进行操作,试剂盒由南京建成生物工程研究所提供。参照汤章城的方法,抗坏血酸(ASA)含量采用草酸-EDTA(乙二胺四乙酸)比色法测定;超氧化物歧化酶(SOD)活性的测定采用氮蓝四唑光还原法;过氧化物酶(POD)活性的测定采用愈创木酚法,过氧化氢酶(CAT)活性的测定采用紫外分光光度法[8]。
在第30天完成测定和采样后,测定所有植株株高,然后收获并分成茎和叶2部分,采用烘干法测定各部分干物质质量。株高相对生长率=(试验后株高-试验前株高)/试验前株高×100%。最后,采用H2SO4-H2O2法消煮,称取粉碎的叶片干样0.1 g,加入5 mL浓硫酸放置过夜后消煮,消煮液中全氮(TN)含量测定采用凯氏定氮法,全磷(TP)含量测定采用钼锑抗比色法[9]。
1.3 数据处理
通过SPSS 19.0对海滨木槿以及嫁接木槿各个处理间的数据进行单因素方差分析(One-way ANOVA),采用Duncan’s法(P<0.05)进行多重比较。作图软件采用Origin Pro 9.1。
2 结果与分析
2.1 NaCl胁迫下光合荧光的变化
NaCl胁迫第30天,海滨木槿和嫁接木槿都存活,但是不同浓度处理下的光合和荧光特性有所差异。从表1可以看出,0.3%、0.5% NaCl胁迫对于海滨木槿以及嫁接木槿的Pn、Gs、Tr并没有明显影响,但是在0.7% NaCl胁迫下,所有参数都显著(P<0.05)降低。相对于海滨木槿,嫁接木槿的Pn在0.7% NaCl胁迫下被抑制程度大于海滨木槿,相比CK降低62.37%。因此,在0.5% NaCl胁迫下,海滨木槿和嫁接木槿均能有效维持叶片光合作用的功能,而在高浓度NaCl胁迫(0.7%)下2种植物的光合作用都受到抑制。
Fv/Fm值能反映植物的潜在最大光合能力,ΦPSⅡ同时反映在光照下PSⅡ反应中心部分关闭情况下的实际光化学效率。NaCl胁迫过程中植物Fv/Fm和ΦPSⅡ变化如表2所示。在盐胁迫处理第30天,0.3%、0.5% NaCl胁迫下海滨木槿及嫁接木槿的Fv/Fm相比于CK均没有显著差异。而在 0.7% NaCl胁迫下,海滨木槿Fv/Fm、ΦPSⅡ相比于CK分别显著降低12.5%、12.2%,嫁接木槿的Fv/Fm、ΦPSⅡ相比于CK分别显著降低16.9%、10.5%。与Fv/Fm和ΦPSⅡ变化趋势相反,在0.7% NaCl胁迫下海滨木槿、嫁接木槿的NPQ相比于CK分别显著增加16.7%、11.1%。

表1 不同浓度NaCl胁迫下海滨木槿和嫁接木槿叶片光合参数变化

表2 不同浓度NaCl胁迫下海滨木槿和嫁接木槿叶片荧光参数变化
2.2 NaCl胁迫下叶片养分的变化
NaCl胁迫对海滨木槿和嫁接木槿叶片养分的影响见图1。海滨木槿经过近30 d的胁迫,相比于CK只有0.7% NaCl处理下TN含量显著降低41.0%(P<0.05)。而嫁接木槿在 0.7% NaCl胁迫下,叶片TN、TP含量与CK相比分别降低30.2%、39.0%(P<0.05)。0.3% NaCl胁迫对2种植物的叶片TN和TP含量均没有影响。
2.3 NaCl胁迫下内源激素含量和抗氧化酶活性的变化
经过近30 d的胁迫,嫁接木槿各个处理间的株高增长率并没有表现出显著差异,平均维持在2.6%,而海滨木槿平均增长率为1.9%,其中0.7% NaCl胁迫下的株高增长率显著降低,仅为CK的68.2%(表3),可见嫁接木槿在NaCl胁迫下生长速率并未受到较大影响,在生长方面有较大的耐盐胁迫潜力。不同浓度NaCl胁迫对2种植物内源激素含量的影响各不相同,总体看来,海滨木槿和嫁接木槿ABA含量随着NaCl浓度的提高表现为上升趋势,且在0.7% NaCl胁迫下显著高于CK。IAA在海滨木槿内的含量在0.3% NaCl胁迫时最低,为15.4 ng/g,在0.5% NaCl胁迫时最高,为 52.5 ng/g;在0.7% NaCl胁迫下IAA含量和CK持平。相反,IAA在嫁接木槿中的含量最高时为92.2 ng/g,此时的NaCl胁迫浓度为0.3%,而其余NaCl浓度下IAA含量均没有显著差异。
由表4可知,在0.3%、0.5% NaCl胁迫下海滨木槿和嫁接木槿叶片POD、CAT活性均没有显著变化,而在0.7%浓度下(除嫁接木槿CAT活性外)均显著大于CK组,说明低浓度NaCl并未影响2种植物的抗氧化酶系统,而高浓度下2种植物的保护酶系统发挥作用,能较大程度清除细胞膜中的过氧化物质。与SOD、POD和CAT不同,ASA是非酶促活性氧清除剂,在0.3%、0.5% NaCl处理时,ASA在2种植物内的变化趋势一致,与CK相比均显著上升,不同的是,在0.7% NaCl胁迫下,海滨木槿ASA活性较CK增长78.5%(P<0.05),而嫁接木槿较CK却降低34.6%(P<0.05)。上述变化表明,在 0.3%、0.5% NaCl胁迫下海滨木槿和嫁接木槿叶片酶促抗氧化剂能保持稳定,在0.7%NaCl胁迫下嫁接木槿酶活性变化与海滨木槿一致,酶活性升高抵御氧化胁迫,但是嫁接木槿在非酶促抗氧化系统方面,相比于海滨木槿还有待进一步提升。
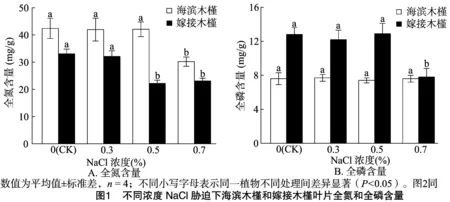
表3 不同浓度NaCl胁迫下海滨木槿和嫁接木槿内源激素和株高增长率变化

表4 不同浓度NaCl胁迫下海滨木槿和嫁接木槿抗氧化酶活性与ASA含量的变化
2.4 气孔导度与内源激素含量的相关性分析
2种植物的Gs和ABA以及IAA含量的相关性分析如图2所示。海滨木槿和嫁接木槿的Gs与ABA含量均呈显著负相关(P<0.05),表明气孔导度随着ABA含量的增加而减少。而Gs与IAA的相关分析表明,气孔导度与IAA含量均没有显著相关性(图2)。

3 讨论与结论
植物的正常生长发育在盐胁迫下受到影响,这种伤害作用在植物各种生理生化活动中表现出来,其中最直观的就是生长情况。在本试验中3个NaCl浓度下,胁迫第30天海滨木槿和嫁接木槿并没有死亡,其中嫁接木槿的株高增长率平均维持在2.6%,而海滨木槿平均株高增长率为1.9%,可见嫁接木槿在NaCl胁迫下生长速率并未受到较大影响。王秀丽等的研究表明,在12月份落叶期,经过400 mmol/L NaCl处理近30 d,海滨木槿存活率为100%,而木槿则全部死亡[10]。因此,本试验短期高浓度盐胁迫表明,以海滨木槿为砧木嫁接木槿,木槿耐盐性得到提高,这与芦治国等的研究结果[6]一致。
光合是植物生长的基础,耐盐植物的主要特征之一就是在盐胁迫下维持正常的Pn。但是植物的光系统Ⅱ反应中心的活性在盐胁迫下比较脆弱,是盐胁迫影响植物光合作用的关键部位[11]。在正常生理状态下,植物叶片叶绿素吸收的光能主要通过光合作用、叶绿素荧光和热耗散3种途径消耗掉,这3种途径变化共同构成了植物整个完整的光合系统。在0.3%、0.5% NaCl胁迫下,海滨木槿和嫁接木槿的Pn均保持在CK水平,同时最大光化学效率维持稳定,可见光反应中心的光能捕获情况未受到影响。在0.7% NaCl胁迫下,嫁接木槿的Pn、Gs、Tr显著降低,此时嫁接木槿气孔关闭,蒸腾作用减缓,碳同化过程受到影响,最大光化学效率显著降低,叶片类囊体中的三磷酸腺苷(ATP)和还原性辅酶(NADPH)等同化力在努力维持光合效率。此时2种植物的光合作用都受到抑制,同时植物热耗散增加。2种植物的光系统Ⅱ反应中心部分关闭,上游电子传递情况受到阻碍。盐胁迫下植物气孔关闭的原因较多,一般认为渗透胁迫可能引起水势及气孔导度降低,限制CO2同化。相关分析表明,NaCl胁迫下海滨木槿和嫁接木槿的气孔开放程度与ABA含量呈显著负相关,与IAA含量没有显著相关性。因此本试验中高浓度NaCl胁迫引起海滨木槿和嫁接木槿中的渗透胁迫,进而导致气孔部分关闭,植物内源激素ABA与细胞上的激素受体结合,在细胞代谢和信号传导层面发挥作用[12]。
在盐碱土中,土壤基本理化性质失衡导致植物所需的必要元素(N和P等)因淋溶或分配不均等原因流失,最后养分变得极其匮乏。不仅如此,大量的Na+、Cl-与NH4+、NO3-竞争,在造成离子毒性的同时也会造成养分短缺[13]。本研究表明,在0.7% NaCl胁迫下,海滨木槿和嫁接木槿叶片中的N和P浓度显著降低,这一方面可能与高浓度NaCl浇灌导致盆中养分有效性显著降低有关,另一方面在于植株维持光合能力将光能转变为化学能过程中消耗了ATP,而ATP的产生依赖于相关含N和P的合成酶[14]。0.3% NaCl胁迫对2种植物的叶片TN和TP含量均没有影响,但是长期盐胁迫下海滨木槿和嫁接木槿叶片养分浓度变化有待进一步验证。
除了降低养分的生物有效性,盐胁迫也会激起植物体内防御活性氧毒害的保护机制(酶促抗氧化保护系统和非酶促抗氧化保护系统),它们共同在清除氧自由基以及减少羟基自由基形成等方面起着重要作用[15]。有关盐胁迫下SOD、POD、CAT在海滨木槿以及嫁接木槿中的表达已有报道[16-18]。耐盐品种比盐敏感品种具有较高的保护酶活性。本研究结果表明,在NaCl胁迫下,海滨木槿和嫁接木槿在抗氧化适应性方面类似,通过保持相对较高的SOD、POD、CAT活性清除高浓度NaCl胁迫下活性氧,降低膜系统受害程度。ASA作为非酶促抗氧化保护系统的重要组成部分,在0.3%、0.5% NaCl盐胁迫下都显著积累。可见,ASA与其他同工酶抗氧化剂共同调节着2种植物细胞内的活性氧水平。但是在0.7% NaCl胁迫下,嫁接木槿叶片内ASA活性显著降低,表明海滨木槿非酶促抗氧化系统比嫁接木槿稳定。ASA也是一些关键性酶的反应底物,与植物内源激素一起维持细胞正常的分裂和生长,在植物对环境胁迫响应的过程中起着重要作用[19]。上述气孔研究结果显示,相比于IAA,ABA更能作为胞间信号从根系传递至叶片,开启相关离子通道[20-22],而相关的通路挖掘需要后续通过分子生物学研究证明。
综上所述,海滨木槿和嫁接木槿都不同程度地受到NaCl胁迫的影响,尤其是在0.7%NaCl胁迫下,表现为植物叶片气孔关闭,蒸腾作用降低,光合能力减弱,N和P的吸收受到一定影响。同时盐胁迫也引发了植物体内的非酶促抗氧化系统,并与内源激素一起维持细胞内生理生化活动的稳定。总体而言,以海滨木槿为砧木嫁接木槿可在一定程度上提高接穗的耐盐性,嫁接木槿在株高增长率方面优于海滨木槿。后续可以通过以不同抗性的海滨木槿为砧木,嫁接更多木槿栽培品种和变型,可进一步丰富木槿的园艺观赏、药用和食用价值。

