针刺内关、水沟对脑缺血再灌注大鼠大脑皮层Caspase-3、PARP-1表达的影响
程莹莹,倪光夏,狄忠
针刺内关、水沟对脑缺血再灌注大鼠大脑皮层Caspase-3、PARP-1表达的影响
程莹莹1,倪光夏2,狄忠1
(1.浙江中医药大学附属第三医院,杭州 310005;2.南京中医药大学第二临床医学院,南京 210023)
探讨针刺内关、水沟抑制脑缺血再灌注大鼠大脑皮层Caspase-3、PARP-1 mRNA和蛋白表达的影响。40只雄性SD大鼠,随机分为正常组、假手术组、模型组、针刺组。采用改进的Longa线栓法制备大脑中动脉梗塞模型。参考Bederson6级5分法进行神经功能评分,运用Real-time PCR、Western Blot检测脑缺血后24 h大鼠大脑皮层Caspase-3、PARP-1的mRNA及蛋白表达量变化。与模型组相比,针刺组可改善缺血再灌注大鼠神经功能缺损症状(<0.01);针刺可下调Caspase-3、PARP-1的mRNA及蛋白表达,与模型组比较差异具有统计学意义(<0.05,<0.01;<0.05,<0.05)。针刺内关、水沟可下调脑缺血再灌注大鼠大脑皮层Caspase-3、PARP-1的mRNA及蛋白表达。
针刺;细胞凋亡;再灌注损伤;Real-time PCR;Western Blot;Caspase-3;PARP-1;大鼠
缺血再灌注引起脑组织损伤的机制众多,神经细胞凋亡是目前研究较多的机制之一,它是梗死周围区神经细胞死亡的主要方式[1-4]。脑缺血后介导神经细胞凋亡的通路有Caspase依赖性的内源性线粒体通路和外源性死亡受体通路;非Caspase依赖性凋亡通路[5-6]。本研究通过运用实时荧光定量聚合酶链反应(Real- time PCR)、蛋白免疫印迹法(Western Blot)检测mRNA及蛋白表达技术,以Caspase依赖性凋亡通路中Caspase-3、非Caspase依赖性凋亡通路中PARP-1 mRNA及蛋白表达变化为观察指标,探讨针刺抑制急性脑缺血神经细胞凋亡的可能分子机制。
1 材料和方法
1.1 实验材料
1.1.1 实验动物及分组
选用上海西普尔必凯实验动物有限公司提供的健康成年雄性SPF级SD大鼠40只(合格证号为SCXK2008-0016),体重(260±20)g,随机分为正常组、假手术组、模型组、针刺组,每组10只。
1.1.2 主要仪器和设备
一次性针灸针,规格为0.30 mm×25 mm(苏州医疗用品厂有限公司);电子天平,CP512型(上海奥豪斯公司);4℃冰箱(西门子公司);VXE380超低温冰箱(Thermo公司);高速冷冻离心机,KendroBiofuge (Germany生产);电动匀浆器、移液器(EPPendorf公司);紫外可见分光光度计(德国Eppendorf BioPhotometer);基因扩增仪MJ-mini(BIO-RAD公司);实时荧光定量PCR仪(MX3000P,Stratagene公司);超净工作台(苏净集团);TY-80S脱色摇床(普阳科学仪器研究所);垂直电泳系统、电转膜仪、制胶器(BIO-RAD公司产品)。
1.1.3 试剂、耗材
水合氯醛(上海国药集团化学试剂有限公司); Trizol(Invitrogen公司);异丙醇、无水乙醇、氯仿(南京宁试化学试剂有限公司);反转录试剂盒(First Strand cDNA Synthesis Kit,Thermo公司);Real- time PCR试剂盒(Promega公司);引物(上海捷瑞生物工程有限公司);BCA法检测蛋白浓度试剂盒(Thermo公司);封闭蛋白干粉(武汉博士德公司);单克隆抗体(Abcam公司)。
1.2 方法
1.2.1 模型制备
采用改进的Longa线栓法[7],SD大鼠用10%水合氯醛(0.35 mL/100 g体重腹腔注射)麻醉,仰卧固定。颈部正中备皮后切开皮肤,钝性分离左侧颈总动脉、颈外动脉、颈内动脉,仔细分离避免损伤迷走神经。结扎颈外动脉远心端,动脉夹夹闭颈总动脉近心端及颈内动脉,靠近颈总动脉分叉处在颈外动脉上剪一小口,将直径0.26 mm尼龙钓丝沿小口插入颈总动脉,移去颈内动脉的动脉夹,经颈总动脉分叉处将鱼线缓慢向颈内动脉入颅脑方向推进约(18±2)mm,微遇阻力时停止,使鱼线头端到达较细的大脑中动脉起始处。于缺血2 h后拔出栓线,建立缺血再灌注模型。假手术组大鼠只分离暴露颈总动脉、颈外动脉、颈内动脉,结扎颈外动脉;正常组不进行手术处理。
再灌注2 h进行神经行为学评分。评分标准参考Bederson 6级5分法,正常为5级(0分);对侧上肢不能完全伸展为4级(1分);向对侧推时抵抗力下降为3级(2分);提尾时向对侧转圈为2级(3分);自动转圈为1级(4分);无自发性活动、意识障碍为0级(5分)。神经行为学评分达到2~4分视为造模成功,模型成功率大约50%。
1.2.2 干预方法
针刺组取内关(双)、水沟。根据中国针灸学会实验针灸研究会制定的“动物针灸穴位图谱”选取。在动物模型制备成功1 h后固定大鼠(各组均需固定,除针刺组其他组不进行针刺治疗),选用华佗牌0.30 mm×25 mm针灸针进行一次针刺。先针刺双侧内关穴,直刺,行捻转提插泻法1 min;继刺水沟穴,在鼻中隔下部向上斜刺,施雀啄手法刺激10次。
1.2.3 标本处理
确认各组模型已建立。造模后24 h断头处死大鼠,置于冰盘快速剥离手术侧大脑皮层中段1/3,迅速置于液氮冷冻,稍后移至﹣80℃超低温冰箱冷冻保存备用。
1.3 指标检测
1.3.1 大脑皮层总RNA和蛋白的提取
大脑皮层总RNA和蛋白提取具体步骤严格按照说明书操作。得到总RNA和蛋白质,﹣80℃冰箱冷冻保存备用。
1.3.2 Real-time PCR检测mRNA的表达
1.3.2.1 RNA逆转录
用紫外分光光度计在260 nm和280 nm波长处测定总RNA溶液的吸光度,进行RNA浓度和纯度分析, 1.0%琼脂糖凝胶电泳分析RNA完整性。RNA纯度和完整性满足要求后,采用二步法进行RNA逆转录。取样品RNA 2mg,加入random hexamer primer 1mL,再加入无酶水,使得总体积为11mL,65℃,5 min后放置冰上。加入5X Reaction Buffer 4mL、RiboLock TM RNase Inhibitor(20m/mL)1mL,10 mM dNTP Mix 2mL, M-MuLV Reverse Transcriptase(20m/mL)2mL混匀, 25℃、5 min;37℃、60 min,终止反应,cDNA置﹣20℃保存备用。
1.3.2.2 引物设计
引物由PubMed中,通过Nucleotide查找获得,并由上海捷瑞生物工程有限公司合成。引物序列及长度见表1(其中GAPDH为内参)。
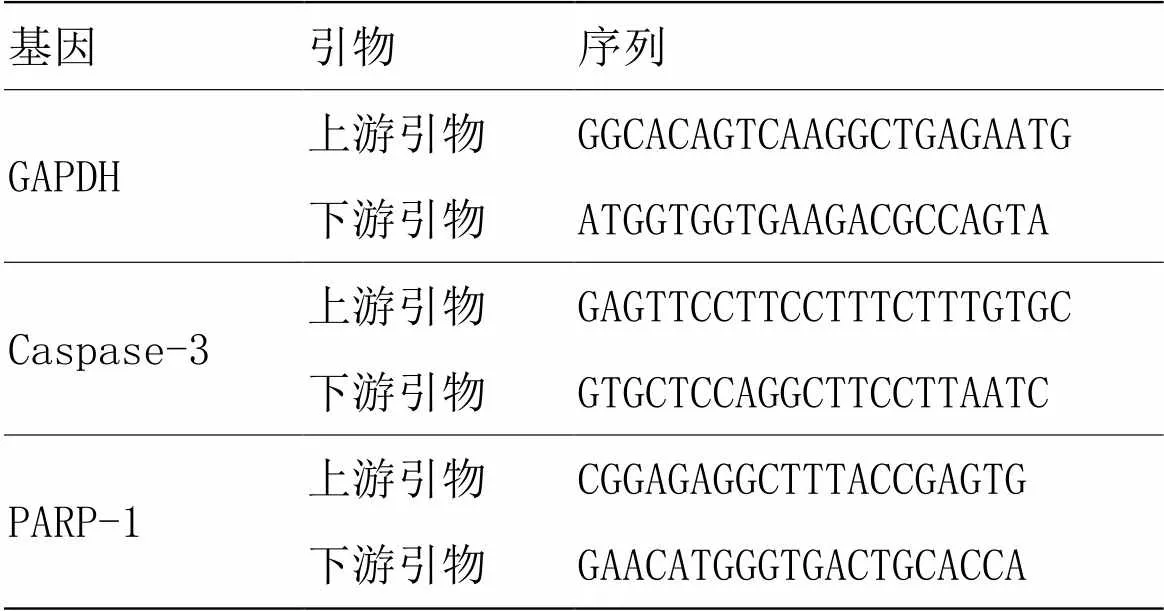
表1 基因引物及序列
1.3.2.3 Real-time PCR
以GAPDH为内参,采用SYBR Green荧光染料法。反应体系中包括cDNA 100 ng、Real-time PCR Master Mix 10mL、上下游引物各0.5mL,加无酶水至20mL。反应步骤为95℃预变性10 min;95℃变性15 s,60℃退火延伸30 s,扩增40个循环;72℃ 1 min。55℃、30 s读取荧光强度。
1.3.3 Western Blot法检测蛋白表达
1.3.3.1 BCA法检测蛋白浓度
根据试剂盒说明书配制标准品和待测样品,95℃变性5 min,通过分光光度计获得吸光值。绘制标准曲线并计算出样品蛋白浓度。
1.3.3.2 Western Blot
定量蛋白浓度后,取20mg溶解在6×loading Buffer中,加入1%SDS定容至20mL,95℃煮沸5 min。蛋白上样20mL,12%的分离胶、5%浓缩胶电泳。湿法转印蛋白至PVDF膜上,30 mA,4℃过夜。根据分子量大小将膜裁成3份,分别加兔抗鼠b-actin、Caspase-3、PARP-1一抗(稀释浓度分别为1:2500、1:2500、1:5000)孵育,4℃过夜。加羊抗兔二抗(稀释浓度为1:3000)孵育,常温2 h。凝胶成像仪扫描结果后进行灰度分析。
1.4 统计学方法
运用SPSS18.0统计软件,检测结果以均数±标准差表示,多组间差异的显著性采用单因素方差分析(检验),法进行组间的两两比较。同组治疗前后比较用配对样本检验。以<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠治疗前后神经功能评分比较
与正常组、假手术组比较,模型组神经功能评分差异具有统计学意义(<0.01)。模型组治疗前后神经功能评分比较差异无统计学意义(>0.05)。针刺组治疗前后神经功能评分比较差异具有统计学意义(<0.01)。治疗后针刺组神经功能评分与模型组比较差异具有统计学意义(<0.01)。详见表2。
表2 各组大鼠治疗前后神经功能评分比较 (±s,分)
注:与正常组、假手术组比较1)<0.01;与模型组比较2)<0.01;与同组治疗前比较3)<0.01
2.2 各组大脑皮层Caspase-3、PARP-1的mRNA表达比较
与正常组比较,假手术组Caspase-3、PARP-1的mRNA表达量差异无统计学意义(>0.05),模型组Caspase-3、PARP-1的mRNA表达量差异具有统计学意义(<0.01)。与模型组比较,针刺组Caspase-3的mRNA表达量差异具有统计学意义(<0.05),针刺组PARP-1的mRNA表达量差异具有统计学意义(<0.01)。详见表3。
2.3 大脑皮层Caspase-3、PARP-1的蛋白表达结果
与正常组比较,假手术组Caspase-3、PARP-1的蛋白表达量差异无统计学意义(>0.05),模型组Caspase-3、PARP-1的蛋白表达量差异具有统计学意义(<0.05)。与模型组比较,针刺组Caspase-3、PARP-1的蛋白表达量差异具有统计学意义(<0.05)。详见图1、表4。
表3 各组大鼠大脑皮层Caspase-3、PARP-1的mRNA表达量比较 (±s)
注:与正常组比较1)<0.01;与模型组比较2)<0.05,3)<0.01
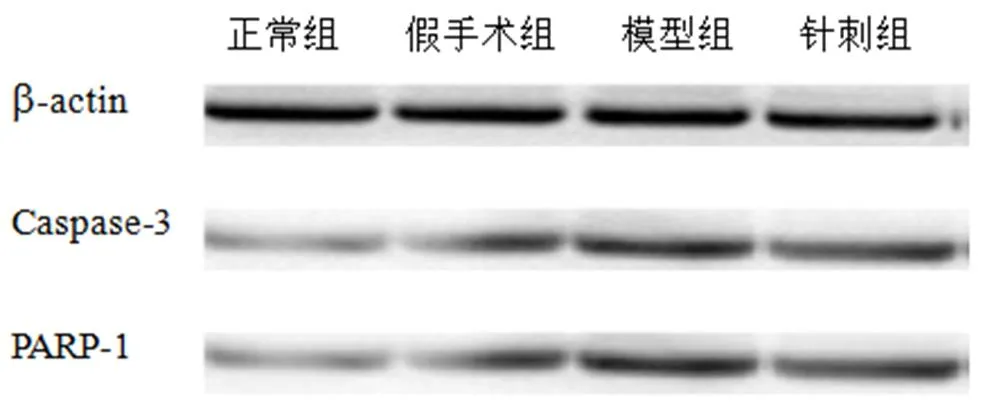
图1 各组大鼠大脑皮层Caspase-3、PARP-1的蛋白表达灰度条带图
表4 各组大鼠大脑皮层Caspase-3、PARP-1的蛋白表达量比较 (±s)
注:与正常组比较1)<0.05;与模型组比较2)<0.05
4 讨论
缺血再灌注以后会出现广泛的神经细胞凋亡[8-11]。研究表明[12-14],缺血中心区神经细胞的坏死和缺血半暗带神经细胞的凋亡是缺血再灌注损伤后神经细胞死亡的主要表现形式。然而,缺血半暗带的脑组织损伤具有可逆性,有效干预缺血半暗带区神经细胞的凋亡已然成为研究的契合点[15-16]。本研究结果证实,针刺内关可下调缺血再灌注损伤大鼠大脑皮层Caspase-3、PARP-1的表达,从而发挥缺血再灌注后脑保护的作用。
半胱氨酸蛋白酶(Caspase)是Caspase依赖性细胞凋亡通路中最重要的蛋白酶,它直接水解激活与DNA断裂等凋亡特征改变有关的蛋白,从而导致凋亡。其中,Caspase-3是参与凋亡的Caspase级联反应最终效应子,是凋亡过程最重要的蛋白酶,是细胞凋亡蛋白级联反应的必经之路[17-19]。研究表明抑制Caspase-3 的活性对缺血性脑损伤具有较明显的神经保护作用[7]。
非Caspase依赖性细胞凋亡通路机制是一个繁杂的过程,其中PARP-1/AIF介导的凋亡通路研究诸多[20-23]。多聚ADP核糖聚合酶(PARP-1)是一种DNA修复酶,参与DNA的复制、转录和修复。在经典的细胞凋亡途径中,PARP-1被Caspase-3和Caspase-7切割为p89和p21两个片段,抑制其DNA修复功能[24-27]。然而PARP-1并不仅仅作为死亡底物被动地参与细胞凋亡,PARP-1过度激活能通过引起线粒体损伤和AIF释放,诱发非Caspase依赖性细胞凋亡[28-29]。
本实验通过运用Real-time PCR技术检测mRNA表达变化,发现缺血再灌注后脑梗死区域Caspase-3、PARP-1表达增加,针刺内关、水沟能下调Caspase-3、PARP-1表达,抑制Caspase-3介导的Caspase依赖性凋亡和PARP-1/AIF介导的非Caspase依赖性凋亡,从而减轻缺血再灌注损伤。
[1] 程莹莹,倪光夏.脑缺血后细胞凋亡通路及针刺调节作用研究概况[J].中国中西医结合杂志,2014,34(4): 499-502.
[2] 张雯,宋俊科,杜冠华.缺血再灌注损伤与细胞凋亡信号转导通路[J].中国药学杂志,2015,50(7):565-569.
[3] 王莉莉,张拥波.急性缺血性脑卒中血管内治疗进展[J].神经损伤与功能重建,2017,12(2):139-141.
[4] 黄丹,屈云.缺血后处理对脑缺血保护作用的实验研究进展[J].中国康复医学杂志,2017,32(5):599-602.
[5] Broughton BR, Reutens DC, Sobey CG. Apoptotic mech- anisms after cerebral ischemia[J]., 2009,40(5): e331-e339.
[6] 宋修云,胡金凤,陈乃宏.神经细胞凋亡与脑缺血疾病[J].中国药理学通报,2012,28(3):307-310.
[7] Longa EZ, Weinstein PR, Carlson S,. Reversible mi- ddle cerebral artery occlusion without craniectomy in rats[J]., 1989,20(1):84-91.
[8] Tang YH, Vital S, Russell J,. Interleukin-6 mediates enhanced thrombus development in cerebral arterioles following a brief period of focal brain ischemia[J]., 2015,271:351-357.
[9] Liu Y, Zhang L, Liang J. Activation of the Nrf2 defense pathway contributes to neuroprotective effects of phloretin on oxidative stress injury after cerebral ischemia/reperfusion in rats[J]., 2015,351 (1-2):88-92.
[10] 苏建华,陈玉芳,唐金荣,等.甲钴胺对大鼠缺血-再灌注损伤神经细胞凋亡及Caspase-3 mRNA表达的影响[J].医药导报,2016,35(6):574-578.
[11] 娄峥,周雅倩,徐献,等.丹参乙酸镁减轻脑缺血/再灌注诱导的神经细胞凋亡作用及机制[J].中南医学科学杂志,2017,45(5):465-470.
[12] 张红明,曾子玲,李晓燕.线粒体依赖的凋亡通路与缺血性脑卒中[J].中华老年心脑血管病杂志,2013,15 (7):778-780.
[13] 蒋崇贵,黄光富.PARP-1/AIF通路在大鼠实验性蛛网膜下腔出血后早期细胞凋亡中的作用和意义[J].实用医院临床杂志,2013,10(5):38-41.
[14] 赵丹,贺莉芳,刘晖,等.线粒体、细胞色素C、Caspase与细胞凋亡[J].医学动物防制,2012,28(12):1337- 1340.
[15] 刘怀军,杨冀萍,刘瑞春,等.神经生长因子和血管内皮生长因子联合应用对兔局灶性脑缺血再灌注损伤神经元的保护时间窗[J].中国临床康复,2006,10(21): 66-70.
[16] 孙美艳,赵晓勇,吕海港,等.异氟醚预处理对局灶性脑缺血再灌注损伤大鼠缺血半暗带TLR4-MyD88信号通路的影响[J].中华麻醉学杂志,2012,(7):870-873.
[17] Zhou L, Bondy SC, Jian L,. Tanshinone ⅡA attenuates the cerebral ischemic injury-induced increase in levels of GFAP and of caspases-3 and -8[J]., 2015,288:105-111.
[18] 王鹏琴,白丽,蔡虹,等.眼针对局灶性脑缺血再灌注大鼠脑组织半暗区Caspase-8、Caspase-3 mRNA表达的影响[J].针灸临床杂志,2010,26(9):51-54.
[19] 李琴,郭云良,李震,等.胡黄连苷Ⅱ对大鼠脑缺血/再灌注损伤Caspase-3和PARP表达的影响[J].中国药理学通报,2010,26(3):342-345.
[20] 高维娟,张霞,刘莎莎.大鼠脑缺血再灌注后海马CA1区Caspase-3的表达及细胞凋亡的动态变化[J].中国老年学杂志,2013,33(24):6202-6204.
[21] Hu G, Wu Z, Yang F,. Ginsenoside Rd blocks AIF mitochondrio-nuclear translocation and NF-kB nuclear accumulation by inhibiting poly (ADP-ribose) polymerase-1 after focal cerebral ischemia in rats[J]., 2013,34(12):2101-2106.
[22] Wang Y, Kim NS, Haince JF,. Poly (ADP-ribose) (PAR) binding to apoptosis-inducing factor is critical for PAR polymerase-1-dependent cell death (parthanatos)[J]., 2011,4(167):ra20.
[23] Virág L, Robaszkiewicz A, Rodriguez-Vargas JM,. Poly (ADP -ribose) signaling in cell death[J]., 2013,34(6):1153-1167.
[24] 张军,胡大海.AIF诱导细胞凋亡[J].医学分子生物学杂志,2008,31(1):87-90.
[25] 胡珀,宋丽君,王飏,等.聚腺苷二磷酸核糖聚合酶抑制剂的临床研究进展[J].中国新药与临床杂志,2012,32 (1):1-6.
[26] 张卫宁,王江雁,王政民,等.大鼠脑损伤PARP降解与DNA片段化的时序关系[J].中华神经外科疾病研究杂志,2003,3(4):351-353.
[27] Kuzhandaivel A, Nistri A, Mladinic M. Kainate-mediated excitotoxicity induces neuronal death in the rat spinal cord in vitro via a PARP-1 dependent cell death pathway (Parthanatos)[J]., 2010,30(7):1001 -1012.
[28] Yu SW, Wang H, Poitras MF,. Mediation of poly (ADP-ribose) polymerase-1 dependent celldeath by apoptosis-inducing factor[J]., 2002,297(5579): 259-263.
[29] Matsuura S, Egi Y, Yuki S,. MP-124, a novel poly (ADP-ribose) polymerase-1 (PARP-1) inhibitor, ameliorates ischemic brain damage in a non-human primate model[J]., 2011,1410:122-131.
Effect of Acupuncture at Points Neiguan(PC6) and Shuigou(GV26) on Caspase-3 and PARP-1 Expressions in the Cerebral Cortex in Rats with Cerebral Ischemia-reperfusion
-1,-2,1.
1.,310005,; 2.,210023,
To investigate the inhibiting effect of acupuncture at points Neiguan(PC6) andShuigou(GV26) on caspase-3, and PARP-1 mRNA and protein expressions in the cerebral cortex in rats with cerebral ischemia-reperfusion.Forty male SD rats were randomized to normal, sham operation, model and acupuncture groups. A model of middle cerebral artery infarction was made by modified Longa thread occlusion. Neurological function was scored using a 6-grade 5-point Bederson’s scale. Caspase-3, and PARP-1 mRNA and protein expressions in rat cerebral cortex were determined using real-time PCR and Western Blot at 24 hrs after cerebral ischemia.Neurological deficit was reduced in the acupuncture group of rats with cerebral ischemia-reperfusion compared with the model group (<0.01). Acupuncture could down-regulate caspase-3, and PARP-1 mRNA and protein expressions and there was a statistically significant difference compared with the model group (<0.05,<0.01;<0.05,<0.05).Acupuncture at points Neiguan and Shuigou can down-regulate caspase-3, and PARP-1 mRNA and protein expressions in the cerebral cortex in rats with cerebral ischemia-reperfusion.
Acupuncture; Apoptosis; Reperfusion injury; Real-time PC; Western Blot; Caspase-3; PARP-1; Rats
1005-0957(2018)02-0234-05
R2-03
A
10.13460/j.issn.1005-0957.2018.02.0234
国家自然科学基金面上项目(81674067);浙江省自然科学基金一般项目(LY17H270009)
程莹莹(1986—),女,住院医师,硕士,Email:cyysince@163.com
倪光夏(1964—),男,主任医师,博士生导师,Email:xgn66@163.com
2017-05-20

