芳香烃受体信号通路在皮肤肿瘤中的表达
潘展砚 陈佳 胡婷婷等

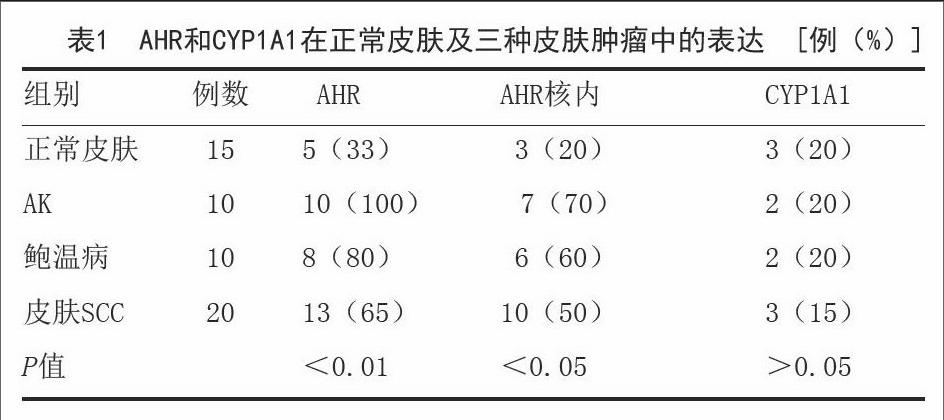
[摘要]目的:探索正常皮肤、目光性角化(AK)、鲍温病和皮肤鳞状细胞癌(SCC)组织中芳香烃受体通路相关蛋白AHR及CYP1A1的表达。方法:采用免疫组织化学法检测15例正常皮肤,10例AK,10例鲍温病以及20例皮肤SCC中AHR及CYP1A1蛋白表达情况。结果:AHR在正常皮肤、AK、鲍温病和皮肤SCC中表达于细胞浆和细胞核,阳性率分别为33%,100%,80%,65%;AHR在细胞核表达中阳性率分别为20%,70%,60%,50%;CYP1A1在正常皮肤、AK、鲍温病和皮肤SCC中表达于细胞浆,阳性率分别为20%,20%,20%,15%。结论:AHR的高表达和激活与皮肤SCC的发生有关,值得进一步研究其在皮肤肿瘤中的作用。
[关键词]芳香烃受体;AK;鮑温病;鳞状细胞癌
[中图分类号]R739.5 [文献标志码]A [文章编号]1008-6455(2017)08-0080-03
芳香烃受体(aryl hydrocarbon receptor,AHR),又称为二噁英受体,是一种配体激活的转录因子,可以激活外源性代谢酶细胞色素P450家族(CYP),调节多种环境污染物如二噁英(TCDD)和多环芳烃类(polycyclic aromatic hydrocarbons,PAHs)在细胞内的代谢过程。AHR参与环境污染物的代谢,会导致某些致癌中间代谢物的产生,从而引起肿瘤的产生。最新研究显示,AHR可以被中波紫外线激活,并对细胞增殖、凋亡和炎症因子产生影响,从而参与日光性皮肤肿瘤的发生。
虽然有细胞和动物研究推测AHR的表达和激活与皮肤肿瘤的形成有关,但AHR与临床皮肤肿瘤的相关性研究还未见相关报道。本研究拟通过免疫组织化学技术分析AHR在正常皮肤、日光性角化病(actinic keratosis,AK)、鲍温病(Bowen Disease)、皮肤鳞状细胞癌(Squmous cell carcinoma,SCC)的表达差异。
1材料和方法
1.1标本来源:标本来自于上海市皮肤性病医院2013年1月2015年7月活检存档蜡块,其中正常皮肤15例,AK标本10例,鲍温病10例,皮肤SCC20例。以上标本均经病理检查及免疫组织化学检查证实,且所有病例病理检查均未经过化疗、放疗及其他免疫治疗。
1.2试剂:兔抗人AHR抗体和CYP1A1抗体购买自美国Santa Cruz Biotechnology公司;即用型快捷免疫组化MaxVisionTM试剂盒(鼠/兔)、粉剂型柠檬酸抗原修复液、粉剂型PBS磷酸盐缓冲液购自福建迈新公司。
1.3免疫组织化学染色:将所有标本以4μm厚度连续切片,将组织切片常规脱蜡。用PBS缓冲液代替一抗作为阴性对照;用试剂公司提供的已知阳性切片作为阳性对照。所有标本用柠檬酸修复抗原,滴加一抗,37℃孵育60mim PBS缓冲液冲洗3min×3次;滴加二抗,室温孵育30min,PBS缓冲液冲洗3min×3次;滴加新鲜配制的DAB显色,镜下控制显色时间,及时终止显色;依次苏木素复染,乙醇脱水,二甲苯透明,风干,树脂封片。
1.4结果判定:染色结果判定以胞浆、细胞核现清晰的黄褐色至黄色颗粒者为阳性。按400倍视野阳性细胞百分值(0%:0分;1%~25%:1分;26%~50%:2分;>50%:3分)和细胞着色强度(阴性:0分;淡黄色:1分;棕黄色:2分;棕褐色:3分)评分。两分值相加,0~2分为阴性,3~6分为阳性。
1.5统计学分析:采用SPSS13.0统计软件进行相关分析,正常皮肤的阳性率与三种皮肤肿瘤的阳性率比较采取2检验,P<0.05为差异有统计学意义。
2结果
2.1 AHR在正常皮肤、AK、鲍温病和皮肤SCC中的表达测定结果:AHR在正常皮肤、AK、鲍温病和皮肤SCC中表达于细胞浆和细胞核,总阳性率分别为:33%,100%,80%,65%。AHR在三种皮肤肿瘤中表达显著高于正常皮肤(X2=9.41,P<0.01);AHR在AK中的表达高于皮肤SCC(X2=4.57,P<0.05);AHR在细胞核表达中阳性率分别为:20%,70%,60%,50%(图1),AHR在三种皮肤肿瘤细胞核表达阳性表达率显著高于正常皮肤(X2=6.15,P<0.05)。见表1。
2.2 CYP1A1在正常皮肤、AK、鲍温病和皮肤SCC中的表达测定结果:CYP1A1在正常皮肤、AK、鲍温病和皮肤SCC中表达于细胞浆,阳性率分别为20%,20%,20%,15%;CYP1A1在三种肿瘤表达的阳性率与正常皮肤无差异(X2=0.05,P>0.05)。见表1。
3讨论
AHR及下游信号通路与皮肤肿瘤的发病相关。研究显示环境污染物如PAHs,TCDD,苯并芘、二苯并咔唑(DBC)、煤焦油及香烟混合物等均是AHR强激活配体,它们在动物模型均可引发皮肤SCC。AHR作为皮肤环境污染物的受体在皮肤癌变的过程中发挥重要作用。AHR被激活后其下游细胞色素代谢酶(CYP1A1,CYP1A2,CYP1B1等)随后被激活,环境污染物经过代谢后水溶性增加,在这过程中污染物的毒性可能增强,特别是芳香烃类的代谢物可以直接攻击DNA形成突变。AHR与日光性皮肤肿瘤发生也有相关性。Fritsche等发现UVB照射角质形成细胞后,细胞内的色氨酸产生的光产物6甲酰基吲哚并[3,2-b]咔唑(FICZ),FICZ能够激活AHR。AHR被UVB激活后能够抑制紫外线诱导的皮肤角质形成细胞的凋亡过程,在动物实验中证实,AHR敲除的小鼠相比正常小鼠,同样剂量的UVB长期照射后,皮肤SCC生成数量减少50%。但是AHR与临床皮肤肿瘤的相关性研究尚未见相关报道。
本研究收集了临床皮肤SCC皮损以及其两种早期病变进行了研究。AK与日晒相关,是老年人群中发病率最高的皮肤肿瘤,也是典型的癌前病变。由AK发展生成的皮肤SCC恶性程度较高,容易早期转移。鲍温病是原位鳞状细胞癌,转变为皮肤SCC的几率很高。AHR在AK组织和鲍温病中的阳性率高达100%和80%,处于高表达状态;AHR在这两种皮肤肿瘤细胞核表达中阳性率为70%和60%,显示AHR信号通路在这两种皮肤肿瘤中处于激活状态;AHR在AK组织中的表达高于皮肤SCC;这些结果提示AHR高表达和激活与皮肤SCC生成的起始事件相关。相关细胞学研究也表明,AHR的激活可以导致细胞膜FEGFR的异常激活,还与NF-κB信号通路的激活有关,提示了AHR参与皮肤细胞增殖和炎症等肿瘤发生的早期事件。
本研究显示AHR下游经典基因CYP1A1的阳性率在正常皮肤和三种皮肤肿瘤细胞之间未有明显差异,而AHR在三种皮肤肿瘤细胞核内的表达均明显高于正常皮肤,显示AHR处于激活状态。这提示,AHR在皮肤肿瘤细胞中被激活后没有启动经典的TCDD/AHR/ARNT/CYP1A1途径,而是启动了不依赖ARNT的蛋白磷酸化信号转导途径。其下游激活的靶位基因可能包括β-连环蛋白、原癌基因c-Myc、表皮生长因子受体等。这条信号通路下游可能与细胞增殖和分化、免疫调节等相关,需要进一步探讨,以期为皮肤肿瘤的发病研究带来新的突破。endprint

