对流实时荧光定量PCR系统设计
翁振宇,闵小平,王 海,卓之豪,葛胜祥
(1.厦门大学公共卫生学院,福建厦门361102;2厦门大学信息科学与技术学院, 福建厦门361005;3.国家传染病诊断试剂与疫苗工程技术研究中心(厦门大学),福建厦门361102)
实时荧光定量PCR技术是一种在DNA扩增反应中以荧光化学物质检测每次PCR循环后产物总量的方法.由于其简便高效,又具有较高的敏感性、重复性和特异性,在生物医学领域有着广泛的应用[1].
对于传统的实时定量PCR仪,核酸扩增通常是在热循环系统中进行.目前市场上PCR仪的热循环系统都是用温控金属块加热塑料制成的PCR反应管,热循环系统对反应管重复地进行加热和冷却,以此来达到核酸扩增所需温度.然而常规的热循环系统都是由高热导率的金属块和低热导率的塑料多孔板构成,通常具有较大的体积和热容,采用这类热循环系统的PCR系统完成40次循环一般需要2~3 h.因此,时间都耗费在控制仪器的温度变化上,而不是用于核酸扩增.
为了解决这一问题,实现快速扩增,Krishnan等[2]首次报道了自然对流 PCR 技术.该方法是将PCR反应液置于一个封闭的圆柱腔体内,分别在其上、下表面进行恒温控制,上端为60 ℃,下端为 97 ℃,即通过上、下表面的温差所产生的对流驱动液体经过不同的温区,完成PCR的变性、退火和延伸3个步骤,从而实现PCR扩增.该方法不需要改变器件的温度,也不需要外加驱动来实现样品的流动,只需要一个反应腔,并控制其上、下两端的温度为恒温,就可以实现PCR扩增[3].自然对流可以将扩增时间从数个小时降低到30 min,并且不再需要精密且昂贵的热循环仪[4].
本研究结合实时荧光定量技术和自然对流技术设计了对流实时荧光定量PCR系统.该系统使用比例-积分-微分温度控制器控制上、下端铝块的温度,形成上、下表面的恒温控制,使嵌入铝块中的PCR扩增管经过不同的温区,从而促使其中的PCR反应液形成自然对流,实现扩增.本系统采用双通道荧光激发与检测结构,采用光纤作为收发光的通道,LED作为激发光源,使用电荷耦合元件(CCD)工业相机作为荧光采集系统拍照采集荧光的变化,可实现对两种不同的荧光进行检测和定量分析.整个系统实现扩增和采集只需30 min,满足了快速扩增的需求.
1 对流实时荧光定量PCR系统硬件设计
实时荧光定量PCR仪集成了先进的定量PCR技术和实时PCR技术[5],由荧光检测系统和计算机组成.荧光检测系统部分包括激发光源、热循环系统、信号采集与处理等部分;计算机部分包括数据采集和系统分析软件[6].通过荧光检测系统检测每经过一次循环的荧光强度信号,再通过计算机对荧光强度变化进行分析,可得到一条荧光扩增曲线,最后通过与标准曲线进行对比,就可对模板浓度进行定量分析[7].
对流实时荧光定量PCR系统的设计由硬件和软件组成,硬件设计分为温度控制系统设计和荧光激发与检测系统设计两部分:温度控制系统由温度控制器和热循环模块组成,为反应提供所需的温度;荧光采集系统由荧光激发模块和检测模块组成,可检测反应中荧光的变化程度.硬件整体结构图如图1所示.软件设计分为荧光采集软件设计和图像处理软件设计.
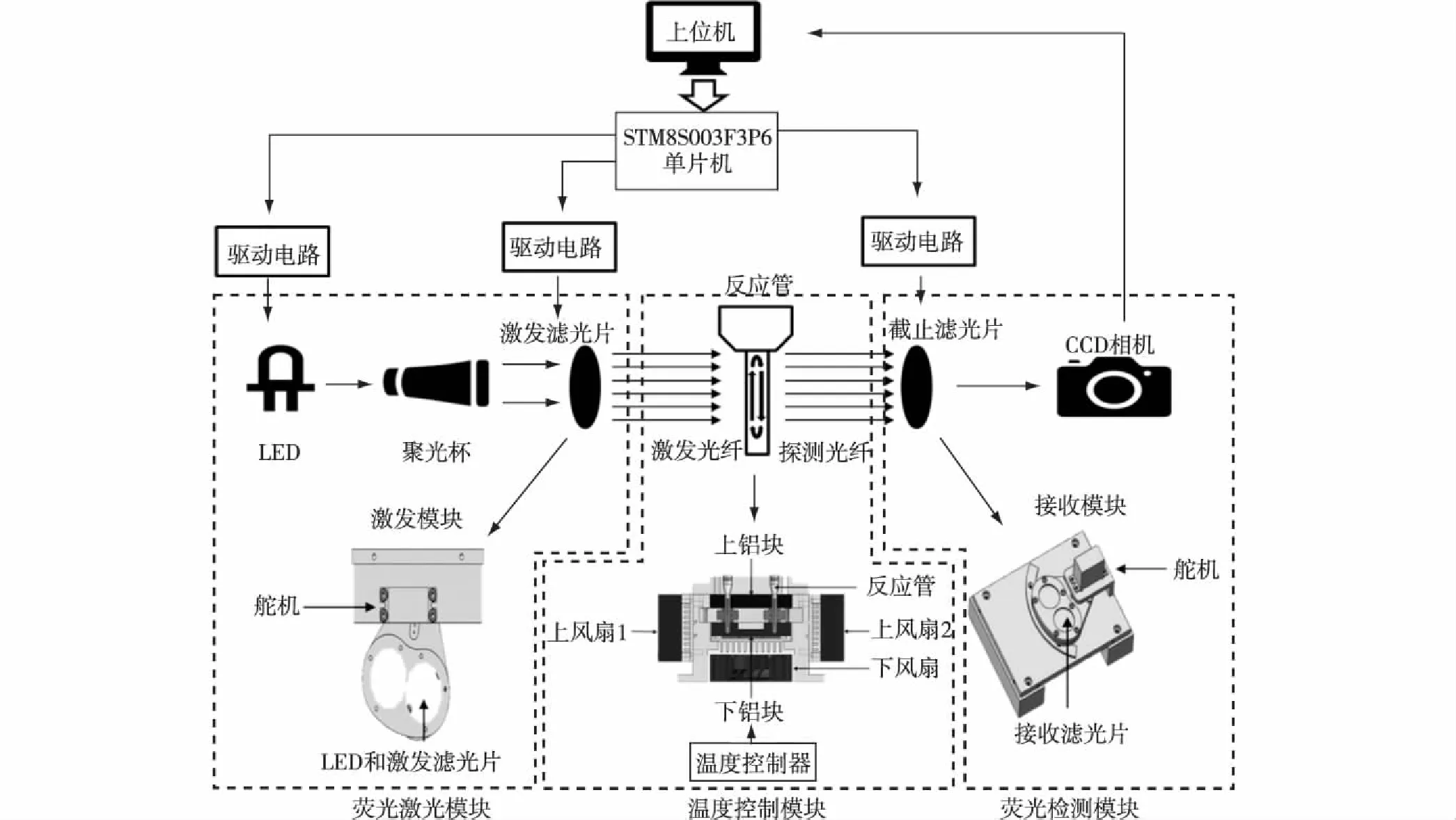
图1 硬件整体结构图 Fig.1Diagram of integral hardware structure
1.1 温度控制系统设计
热循环系统是传统的荧光定量PCR中最关键的部分[8],因此,对流荧光定量PCR系统中温度控制系统便是系统的核心.本系统中,温度控制系统包括上、下两块84 mm×68 mm×10 mm的铝块、陶瓷加热片、风扇、温度传感器、继电器和温度控制器(FY400,中国台湾TAIE)组成.上、下铝块分别用于控制反应管上、下端的温度.上铝块由2片陶瓷加热片从两侧对其进行加热,下铝块由1片陶瓷加热片从正下方对其进行加热.加热片的温度由测温线实时监测并传递给温度控制器,温度控制器根据当前温度和设置温度的区别通过继电器控制加热片或风扇运转.
1.2 双通道荧光激发与检测系统设计
荧光激发与检测系统是荧光定量PCR系统中另一个核心模块,用于荧光的激发和采集,是实现定量的基础.系统一般分为激发模块和检测模块,其具体构成在下文介绍.为了增强光传输,提高反应管的透光性,反应管的材料选用透光性较好的聚甲基丙烯酸甲酯(PMMA).为了对不同种荧光进行检测,形成校正,也为进一步研发多通道的荧光检测,本系统采用了双通道荧光检测的设计,在激发模块中可切换2种不同的激发光源对反应管中不同荧光物质进行激发.相应地,在检测模块中通过切换波段不同的两个截止滤光片,对2种不同荧光物质产生的荧光进行采集.
1.2.1 LED荧光激发模块设计
LED荧光激发模块由LED、聚光杯、激发滤光片、舵机、激发光纤(GOFC-S1H-300-P1,南京鸿照科技有限公司)和LED驱动电路组成.由于采用双通道切换的形式,在实验中选用羧基荧光素(FAM)和六氯荧光素(HEX)作为荧光标记基团,因此为了匹配荧光基团的激发光谱,分别使用功率为3 W的475 nm蓝光和540 nm绿光LED作为激发光源.LED由恒流源(KC24H-500RX3,广州金升阳科技)驱动,效率高达97%,输出电流精度达到3%,输出电流稳定度<1%.为使激发光以最大效率传递到反应管上,先采用专用的聚光杯(SS口径,嘉兴新光照明)激发光汇聚成平行光束,用以减少光在传输中的损失.为了减少外界环境光对激发光的干扰,最大程度地衰减进入光纤的杂光,在聚光杯与光纤之间插入滤光片,其具体参数见1.2.3节.过滤后的光束经过入射光纤投射到反应管上,激发荧光基团发出荧光.其中,激发光纤由12根长300 mm,通光孔直径1 mm,点状投光,对FAM和HEX的激发光和发射荧光的透射效率能达到70%.2种激发光源和与之对应的聚光杯和滤光片分别嵌入在设计的两个切换通道中,通道的切换由一个舵机进行控制.
表1 激发滤光片特性参数
Tab.1 Characteristic parameters of the excitation filter

表2 接收滤光片特性参数Tab.2 Characteristic parameters of the receiver filter
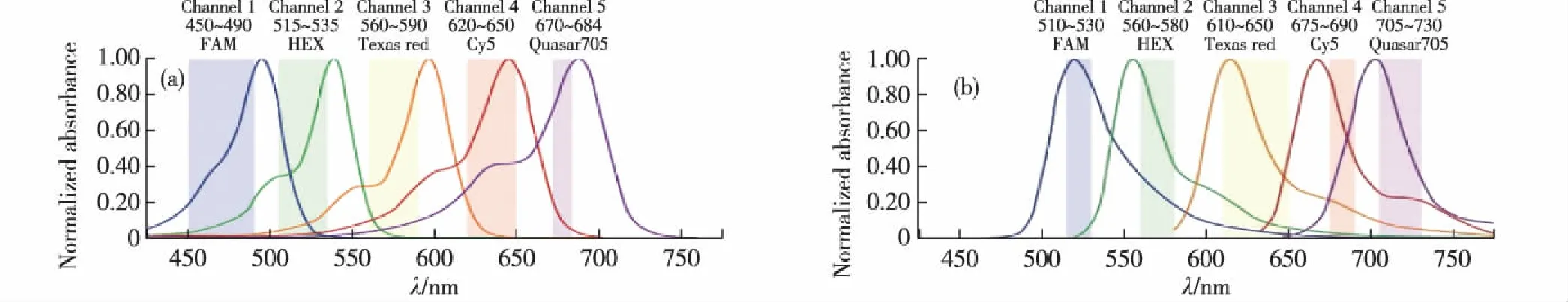
图2 荧光基团的激发光谱(a)和发射光谱(b) Fig.2Excitation spectrum (a) and emission spectrum (b) of fluorophores
1.2.2 荧光采集与检测模块设计
检测模块由接收光纤、舵机、截止滤光片和CCD(ICX205AL,深圳度申科技有限公司)构成.荧光物质产生的荧光经接收光纤和滤光片后被CCD采集,传入主处理器STM8S003F3P6.接收光纤的参数与激发光纤相同,截止滤光片的参数见1.2.3节.通道的切换由舵机控制完成,能将对应的滤光片切换到CCD相机镜头的正下方,使发射光信息由CCD相机实时拍照保存.本系统所选用的ICX205AL黑白显微镜相机在波长450~600 nm之间相对灵敏度较高,包含了荧光标记基团发射荧光的波段;具有可以改变曝光时间的电子快门,可通过改变曝光时间来提高采集图像的灵敏度和图像的信噪比;还适用于程序控制,可直接将采集的图像保存于计算机中,便于后期的图像分析.
1.2.3 滤光片的选择
滤光片是整个荧光激发与检测系统中非常重要的一环,正确的滤光片能确保得到目标荧光,滤除其他杂光,从而提高获取图像的对比度和信噪比,为后续定量分析提供良好基础.常用的5种荧光基团的激发和发射光谱如图2(a)和(b)所示.本设计中选取FAM和HEX作为荧光标记基团.结合激发光源和2种荧光基团的激发光谱,最终分别选择了中心波长为470和540 nm的窄带滤光片,其特性参数如表1所示.接收滤光片选取的原则是要使检测装置获取低背景值、高信噪比的图像.综合以上原则和2种荧光基团的发射光光谱,分别选择了中心波长为520和570 nm的窄带滤光片,其特性参数如表2所示.
1.3 相关电路设计
对流实时荧光定量PCR系统下位机驱动电路采用STM8S003F3P6单片机作为主处理器,其内置有8 000字节Flash、640字节只读存储器EEPROM和1 000字节RAM存储器,支持2.95~5.50 V工作电压;拥有16 MHz CPU时钟频率,有节电休眠、停止和待机等低功耗模式可以选择,可以提高整个系统的执行效率,增强系统的稳定性,降低功耗和成本.本研究自主设计了处理器复位电路、主处理器驱动电源电路、LED恒流源驱动电路等,保证微处理器和其他功能模块的正常运行.图3为主处理器控制电路示意图,主处理器的电源电路采用的12 V直流电源为整个电路供电,并设计降压电路为不同元器件提供需要的工作电压.在降压电路中,为了提高仪器的抗干扰能力,系统设计了5 V的数字和模拟降压输出电路.其中模拟输出电路中,采用LM2596S-5.0开关型降压调节器.该器件内部集成频率补偿和固定频率发生器,开关频率为150 kHz,与低频开关调节器相比较,可以使用更小规格的滤波元件.因此使用此器件能极大地简化开关电源电路的设计;同时具有很好的线性和负载调节特性,能够输出3 A的驱动电流和5 V的输出电压.在数字输出电源设计电路中,采用了IB1205S-2W隔离稳压电源芯片,该芯片是专门针对线路板上分布式电源系统中需要产生一组与输入电源隔离的电源应用场合而设计,适用于纯数字电路,一般低频模拟电路,绝缘栅双极型晶体管(insulated gate bipolar transistor,IGBT)等功率器件驱动电路等.
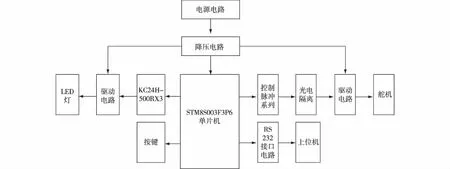
图3 主处理器控制电路示意图 Fig.3Schematic diagram of drive circuit
2 软件设计
2.1 荧光采集软件设计
荧光采集软件是在Windows系统下的Visual Studio 2013环境中开发的,可实现串口的开关并通过发送串口通信协议控制下位机工作.在控制相机方面,该软件可在启动相机拍照之前,检测相机是否存在,如检测相机存在,便可控制相机进行拍照,并将照片保存在自行设定的文件夹中.设定每10 s进行一次荧光通道的切换,切换完成后进行拍照采集,以此循环完成对双通道发射荧光的采集.实验共进行30 min,最终上位机将收集到180张图片,两个通道各90张.图4为拍照软件的流程图.

图4 拍照软件流程图 Fig.4Flow chart of camera software
2.2 图像处理软件设计
图像处理软件同样是在Windows系统下的Visual Studio 2013环境中开发的,在CCD采集完荧光图像,便可把采集荧光的图片导入图像处理软件,计算每张图片中反应孔的荧光亮度值,以此做出荧光扩增曲线,计算循环阈值(Ct).在软件中,通过计算选定区域的灰度值来表示荧光亮度值.在处理前可按设定对图片进行压缩处理,防止原始图片过大和内存占用过多.当读入图片后,可以选择图片中的指定区域并分析其灰度值总和,计算出的灰度值最后保存到Excel文件中,生成扩增曲线.图5为图像处理软件的流程图.
3 实验与结果
实时荧光定量PCR数据分析方法有绝对定量法和相对定量法[9],而关于定量最重要的参数是循环阈值Ct.研究表明,每个模板的Ct与该模板的起始拷贝数的对数存在线性关系,起始拷贝数越多,Ct越小.因此,两种方法都必须保证扩增曲线求得的Ct值稳定.根据系统特性,将采用相对定量法对系统进行评估.在系统通量的设计上,利用数控机床在铝块上加工了12个反应孔,可同时对12个反应管进行扩增.
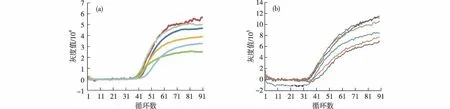
图中曲线为随机迭取的6个孔进行扩增后荧光采集的结果.图6 FAM(a)和HEX(b)通道的荧光采集结果 Fig.6Fluorescence collection results of FAM channel(a) and HEX channel(b)
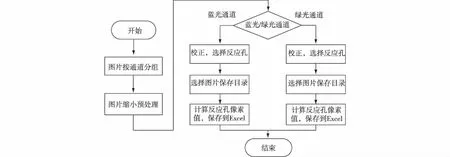
图5 图像分析软件流程图 Fig.5Interface of image analysis software
实验中,在验证系统能够正常采集荧光的情况下,为减小孔间差异对最终定量效果的影响,引入了内标校正靶标的方法.最后在校正的基础上,对系统的定量的效果进行分析和描述.
3.1 系统荧光采集的验证
为验证系统能否实现正常的荧光采集,采用巨细胞病毒(CMV)的基因作为靶标基因和λ噬菌体(λDNA)的基因作为内标基因进行扩增验证.在体系中,对原始CMV的基因模板浓度进行10倍梯度稀释(至稀释1 000倍),并选用固定浓度的λDNA的基因模板配制PCR体系.在荧光基团的选择上,将FAM用于CMV体系,HEX用于λDNA体系,并分别用470 nm的蓝光和530 nm的绿光激发.实验中,随机选用6个孔进行扩增后荧光采集.通过切换LED光源,同时对两个荧光通道进行检测,扩增完成后,使用图像分析软件对荧光采集的图像进行分析,得出扩增曲线,如图6(a)和(b)所示.从图中可以看出,系统可以对两个通道的荧光变化实现采集.
3.2 内标校正靶标的验证
在实验中发现,由于铝块加热不均一,造成反应孔间存在温度差异,使系统扩增结果的孔间一致性较差.为了减小孔间差异对最终定量结果的影响,引入了内标校正靶标的方法,使两个通道分别对扩增的靶标和内标基因进行检测,由同孔中已知浓度的内标基因求出的Ct去校正求得靶标基因的Ct,将孔间的差异趋于一致.这也是设计双通道系统的目的.
随机选定一个反应孔进行多次实验,比较靶标扩增结果的Ct和内标扩增结果的Ct,两者成线性关系,结果如图7所示.

图7 靶标与内标Ct线性关系 Fig.7Linear relationship between Ct of target and internal standard
由图7可知,靶标内标之间呈线性关系(y=1.003 6x-0.116 9,R2=0.997 6),说明内标对靶标有较强校正趋势,所以可以利用内标求得的Ct校正靶标求得的Ct,降低孔间差异导致的最终数据处理误差.
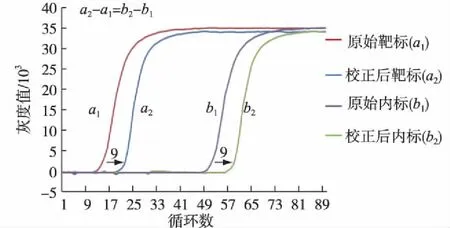
图8 曲线校正方式 Fig.8Curve correction method
为了验证校正方法的效果,将CMV的基因模板在原始浓度的基础上进行10倍梯度稀释,得到梯度1(10-1),梯度2(10-2),梯度3(10-3),然后分别与已知浓度λDNA的内标基因模板配制PCR体系,随机选定多个反应孔进行实验,分别采用原始和校正的方法计算Ct并进行比较,结果如表3所示.
由表3可以看出,校正后的数据相对于原始数据,各浓度梯度的孔间均一性都有一定的改善,说明校正有效果.
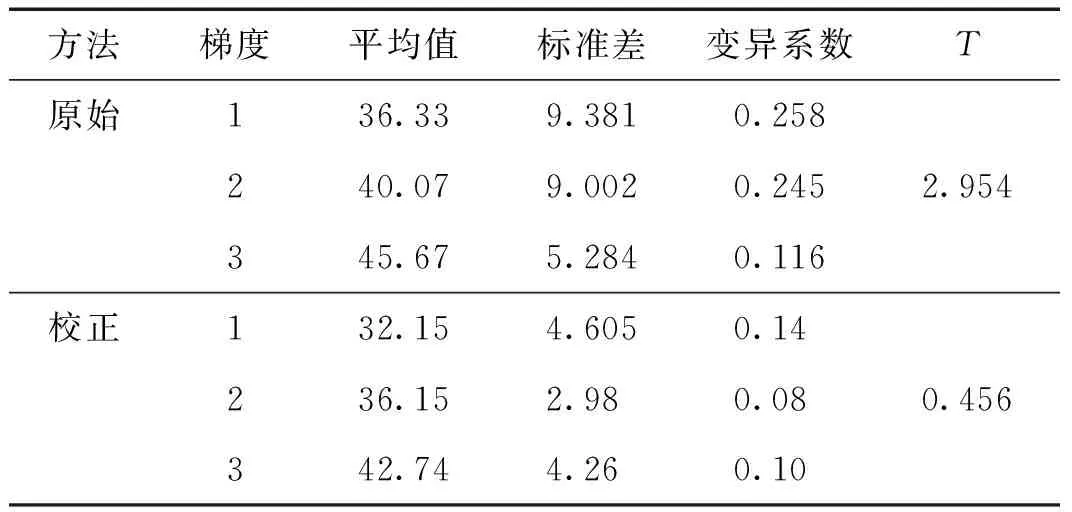
表3 2种方法下Ct结果的比较Tab.3 Compare result of Ct with two methods

3.3 系统定量结果分析
在实现荧光采集和曲线校正的基础上,对系统实现定量效果分析.在实验材料上,采用CMV基因为靶标基因,用FAM荧光基团进行标记,然后分别将原始模板浓度进行10-2,10-3,10-4,10-5的梯度稀释,并配制阴性对照组,每组两管重复验证.反应管中还加入已知浓度的带有HEX荧光基团标记的λDNA内标基因进行扩增.经校正后,FAM通道扩增曲线如图9所示.可以看出:原始模板浓度较高时的扩增曲线求得的Ct较小;原始模板浓度较低时的Ct较大;而阴性对照组扩增曲线平稳,不存在Ct.因此,本系统展现出初步相对定量的趋势,且检测浓度下限达到10-5.
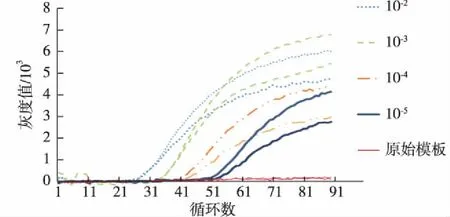
图9 FAM通道定量分析结果 Fig.9Result of quantitative analysis of FAM channel
但是由于扩增时靶标和内标存在竞争关系,使系统检测的线性范围较窄,只能在有限的梯度范围内有较好的校正效果,目前还无法达到商用仪器要求.未来将对系统中的加热铝块和荧光采集系统进行优化,进一步提高系统的孔间均一性和稳定性.
4 结 论
本研究结合实时荧光定量技术和自然对流技术设计了一种新型对流实时荧光定量PCR系统,该系统能实现双通道的荧光激发与检测,并展现出多通道荧光检测的潜力.通过对不同核酸浓度的扩增证明了该PCR扩增系统能初步实现核酸的相对定量.相比传统使用热循环PCR系统,该系统实现了核酸的快速扩增,将原来的2~3 h的扩增时间缩减至30 min.该系统在核酸定量扩增结果的重复性和孔间的均一性上还需要做进一步的优化,未来将对铝块加热的均一性和荧光采集系统进行优化,使用均一性更好的滤光片和LED光源,以此来提高仪器的稳定性和孔间均一性.
[1] HEID C,STEVENS J,LIVAKK,et al.Real time quantitative PCR[J].Genome Research,1996,6(10):986-994.
[2] KRISHNAN M,UGAZ V M,BURNS M A.PCR in a Rayleigh-Bénard convection cell[J].Science,2002,298(5594):793.
[3] 吴叶枫.自然对流型微流控PCR系统应用效能的研究[D].沈阳:中国医科大学,2007,9-12.
[4] CHOU W P,CHEN P H,MIAO M J,et al.Rapid DNA amplification in a capillary tube by natural convection with a single isothermal heater[J].Bio Techniques,2011,50(1):52-57.
[5] SARIKA M,WEI S H.A kinetic model of quantitative real-time polymerse chain reaction[J].Biotechnology and Bioengineering,2005,91(7):848-860.
[6] 曹仙春.荧光定量PCR仪的设计[J].山西电子技术,2005(4):38-40.
[7] 郑沁春.实时荧光定量PCR仪原理与技术关键点分析[J].中国医疗器械信息,2012(6):55-58.
[8] 郭琛.荧光定量PCR监控系统的设计与实现[D].上海:上海交通大学,2005:15-23.
[9] 易健民,屈武斌,张成岗.实时荧光定量PCR的数据分析方法[J].生物技术通讯,2015,26(1):140-145.

