山东无棣贝壳堤岛保护区维管束植物的生态位特征
肖 兰,杨盛昌*,侯 蕊,刘长安,卢伟志,陈鹏飞
(1.厦门大学环境与生态学院,福建厦门361102;2.国家海洋环境监测中心,辽宁大连116023)
贝壳堤岛是淤泥质或粉砂质海岸所特有的,由砂粒和贝壳及其碎屑经波浪搬运并在高潮线附近堆积而成的脊滩[1-2].山东省滨州市贝壳堤岛全长76 km,贝壳总储量达3.6×109t,为世界三大贝壳堤岛之一.因其保存完整且结构特殊,2006年建立了无棣贝壳堤岛与湿地国家级自然保护区.对于无棣贝壳堤岛,在其地质结构和形成、植物多样性及适应性、动物种类区系组成、土壤特性等方面已开展了相关的研究[3-9],但目前未见有关植物生态位方面的研究报道.
物种生态位可以反映物种对资源的利用能力以及物种间的相互关系,对于研究物种的生存机制、生存策略和生物多样性保护等具有一定应用价值[10].本研究通过样方调查等方法对无棣贝壳堤岛保护区的维管束植物生态位和植被动态进行比较分析,以期为山东无棣贝壳堤岛的保护工作提供参考.
1 研究区概况
研究区位于山东省滨州市无棣县贝壳堤岛与湿地国家级自然保护区内,从汪子岛至大口河沿岸之间,地理坐标为38°02′51″~38°21′06″ N,117°46′58″~118°05′43″ E.海拔高度在5 m以下,地势较平坦,为暖温带东亚季风大陆性半湿润气候,年均气温12.36 ℃,年均降水量550 mm,年均蒸发量2 430 mm,蒸降比4.4∶1.土壤主要为贝壳砂土和滨海盐土,贝壳砂平均厚度1.1~2.5 m,土壤孔隙度小,有机质和氮含量低.植物以灌木和草本为主[6-7].
2 研究方法
2.1 调查方法
2014年5—7月,在踏查的基础上,于汪子岛贝壳堤岛设置了4条垂直于海岸线的样线,样线间隔距离约100 m,每条样线长150 m左右[11],如图1所示,左上部的样线由于受积水水坑影响,向陆侧和向海侧的样线有所偏移.在样线上每隔10 m设置一样方,并对样方进行GPS(GPSMAP 62sc)定位.图1中圆圈内为典型植物群落样方(样方中某一优势种的多度达80%以上),共6个.总样方设置包含4条样线的样方及典型植被群落样方,具体分布如图1所示,其中黑点为草本样方,三角形为灌木样方,从左向右各样线设置草本样方数分别为11,11,13,12,灌木样方数分别为4,3,2,0.草本群落样方面积为1.0 m×1.0 m,调查项目包括植物种名、盖度、平均高度、多度等;灌木群落样方面积为2.0 m×2.0 m,调查项目包括植物种名、株数、平均高度、基茎等.
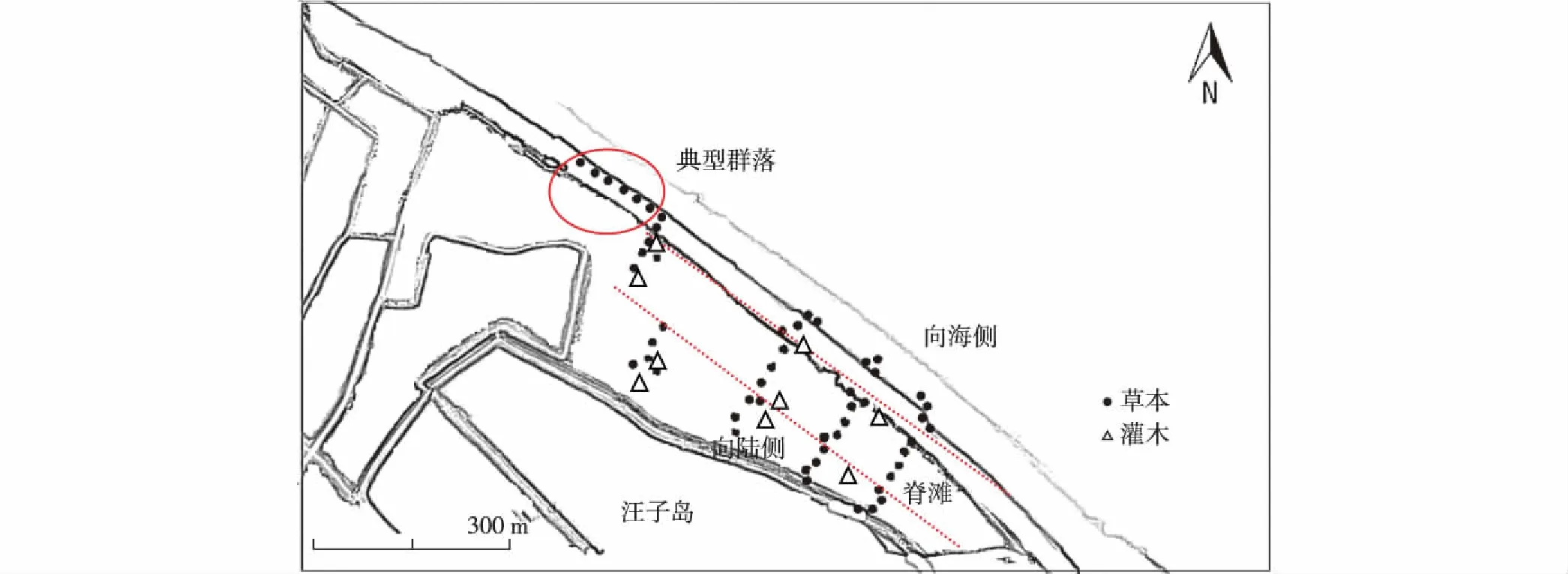
图1 汪子岛贝壳堤岛样方分布 Fig.1Distribution of quadrates at Wangzidao chenier island
2.2 统计方法
根据样方调查资料统计研究区维管束植物的科属种区系组成,计算物种的重要值[7],并以重要值为基础数据,分别测算向海面、脊滩、陆面区和研究区全域的维管束植物的物种多样性指数[7]和生态位宽度.其中重要值为(相对高度+相对盖度+相对频度)/3,生态位宽度分别采用Levins公式[12]和Hurlbert公式[13]计算,生态位重叠值采用Pianka公式[14]计算.数据计算和统计分析采用Excel 2007软件和SPSS 20.0软件.
3 结果与分析
3.1 植物多样性
综合2次踏查和样方调查结果,汪子岛和大口河贝壳堤岛共计有维管束植物74种,分别隶属30科63属(见附录表S1,http:∥jxmu.xmu.edu.cn/upload/html/20180112.html).按照生长型划分,乔木、灌木、藤本和草本植物分别为3,3,4和64种,以草本植物数量最多,占总种数的86.49%.其中盐生植物共计22属24种,分别占维管束植物总属数和总种数的34.92%和32.43%.根据在群落中具有最大密度、盖度和生物量的物种来确定优势种,从群落成员型分析得贝壳堤岛优势种有4种,分别为柽柳(Tamarixchinensis)、酸枣(Ziziphusjujubavar.spinosa)、蒙古蒿(Artemisiamongolica)和芦苇(Phragmitesaustralis),说明该群落为共优种群落,占总种数的5.41%;亚优势种19种,占25.68%;伴生种和偶见种分别为26和25种,合计占68.92%.
无棣贝壳堤岛仍以乡土植物为主.在74种植物中,有乡土植物65种,外来入侵植物9种[15],分别占总数的87.84%和12.16%,表明无棣贝壳堤岛保持了较好的乡土植被类型.对比田家怡等[7]调查数据统计的维管束植物种类,本研究调查中共计17种(14种草本和3种乔木)先前未见报道,增加的主要是人工种植种类,如华凤仙(Impatienschinensis)、白蜡树(Fraxi-nuschinensis)和冬瓜(Benincasahispida)等;但本研究调查未发现文献[7]记载的野生罗布麻(Apocynumvenetum)和野大豆(Glycinesoja)等重要资源植物种类.
表1 无棣贝壳堤岛及各断面植被的物种多样性指数
Tab.1 Index of species diversity between different sections at Wudi chenier island
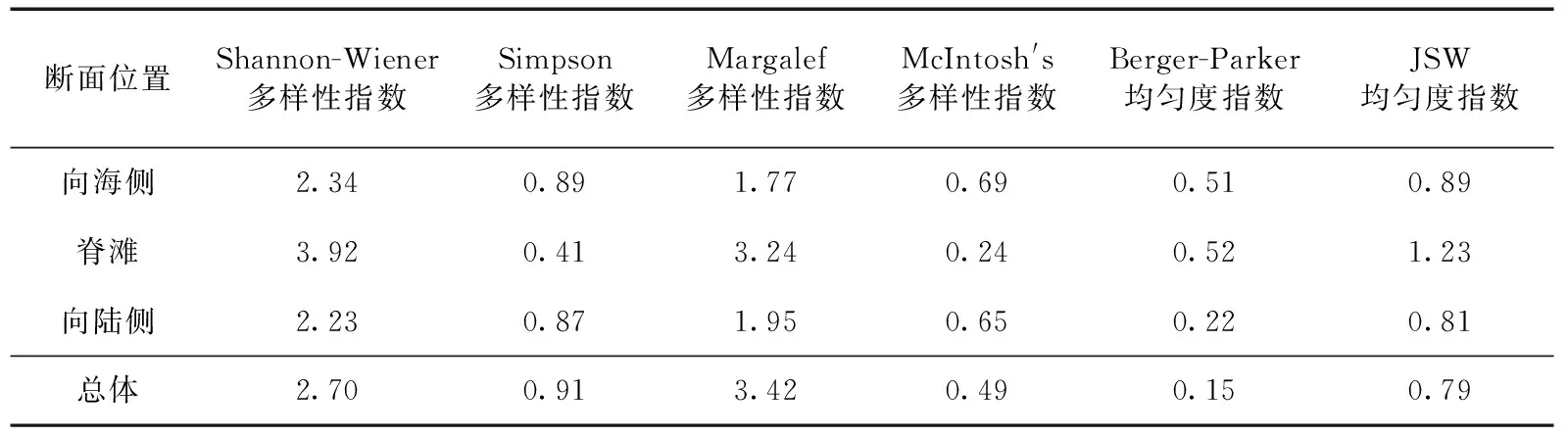
断面位置Shannon-Wiener多样性指数Simpson多样性指数Margalef多样性指数McIntosh's多样性指数Berger-Parker均匀度指数JSW均匀度指数向海侧2.340.891.770.690.510.89脊滩3.920.413.240.240.521.23向陆侧2.230.871.950.650.220.81总体2.700.913.420.490.150.79
根据4条样线的样方所处位置,分别统计向海侧、脊滩和向陆侧植被的植物多样性指数,结果见表1,从中可以看出:Shannon-Wiener多样性指数总体为2.70,3个不同断面间脊滩的多样性指数最大,为3.92,向陆侧最小,为2.23;从Margalef多样性指数来看,脊滩的多样性指数也最大,为3.24;Simpson多样性指数总体为0.91,其中脊滩的多样性指数最小,且与向海侧和向陆侧差异明显;McIntosh′s多样性指数与Simpson多样性指数的变化趋势一致;Berger-Parker均匀度指数和JSW均匀度指数都表明脊滩的均匀度最大,其次为向海侧和向陆侧.在现场调查中发现,向陆侧断面的土壤盐渍化现象严重,而向海侧断面风沙较大,相较而言脊滩的生境更稳定,较适合植物的生存.因此,脊滩的Shannon-Wiener多样性指数、Margalef多样性指数及均匀度指数都最大.
据已有文献报道,2008年无棣贝壳堤岛共有高等维管束植物25科56属64种[16-17],数量略低于本研究调查结果(2014年).从属种系数(一个地区植物总属数占总种数的百分比)[7]来看均较高,2008年属种系数为87.5%,本研究中为85.1%,表明该地区的单种属或少种属较多,也反映出该区域生境条件较恶劣,适宜生长的植物种类有限.
赵艳云等[17]的研究结果(2008年)表明不同断面植物多样性变化趋势为向陆侧>脊滩>向海侧,这与本研究结果差异较大,本研究中不同断面植物的多样性指数明显更高,究其原因可能与断面的选择与划定标准有关;也可能由于本研究调查时间为7月下旬,降水少,向陆侧土壤含水量减少,盐度增大.据早年航拍照片显示,原成片生长的碱蓬(Suaedaglauca)均消失,大面积裸露于地面,只在零星分布的水坑旁有几簇碱蓬,另稀疏分布着白刺(Nitrariatangutorum)、天门冬(Asparaguscochinchinensis)、少数芦苇、鹅绒藤(Cynanchumchinense)等草本植物,而无灌木存在.向陆侧地势低洼,海水倒灌后难排出,加之距向陆侧100 m左右新建堤坝,海水滞留向陆侧低洼地,土壤盐度进一步增大,导致不同年份或季节的断面植物多样性有所差异.
3.2 主要物种的生态位特征
3.2.1 生态位宽度
生态位宽度是一个物种所利用资源的综合反映,体现在物种对环境资源的利用状况上[18].生态位宽度越大的物种,越能充分利用资源,对环境的适应能力越强;反之,生态位宽度小的物种对环境的适应能力弱.重要值大于1.0的主要物种生态位宽度统计结果见表2.
从表2可以看出:除茵陈蒿、蒙古蒿、狗尾草、天门冬、杠柳少数物种外,不同物种的Levins和Hurlbert生态位宽度指数大小顺序基本一致;其中鹅绒藤的生态位宽度最大,说明鹅绒藤对环境的适应能力最强;此外,生态位宽度较大的还有芦苇、砂引草和酸枣.鹅绒藤广泛分布在贝壳堤岛的向海侧、脊滩和向陆侧,耐贫瘠,种子具毛,质轻,易随风传播,因此可在贝壳堤岛各处成功定居,生态幅大.芦苇广泛分布在汪子岛向海侧和向陆侧,作为水生或湿生植物的代表物种,其根状茎十分发达,对贝壳堤岛盐化贫瘠的土壤环境具有较强的适应能力.砂引草适应滨海砂地、干旱荒漠生境条件,贝壳堤岛的沙地环境适合砂引草生长,因此其生态位宽度较大.酸枣是贝壳堤岛灌丛植被的重要优势种,广泛分布于脊滩和向陆侧,其鱼尾型根系[19]分布广,生态位宽度也较大.
3.2.2 生态位重叠
生态位重叠是不同种群通过利用食物、空间、营养成分等同一资源或是共同占据某一资源,从而在生态位上所产生的重叠状态[18].从表3可以看出:芦苇(序号2)和天门冬(序号12)之间的生态位重叠值最大(0.469).天门冬为攀缘植物常附生于芦苇上,虽然两者间生态位重叠值大,但它们之间可能不存在强竞争关系,多数芦苇群落中均伴生有天门冬.本研究调查发现在芦苇群落中天门冬的更新苗较多,而且对芦苇生长的影响不明显,由此可见,在长期的生物进化适应过程中,两者在该区域形成了资源共享的生态关系.菟丝子(序号8)和肾叶打碗花(序号9)间的生态位重叠值次之(0.452).菟丝子寄生于肾叶打碗花上,与寄主植物形成较强的光照、营养等资源竞争关系,导致肾叶打碗花表现出黄化现象,致使其光合作用受到严重影响.鹅绒藤(序号1)几乎与所有物种都存在生态位重叠,其常攀附于酸枣、柽柳、芦苇、蒙古蒿、杠柳等植物生长,加之其适应能力强,与被附着植物之间在光照、营养等方面形成竞争关系.本研究调查发现,由于受鹅绒藤缠绕,80%树龄在5年以上的酸枣虽能大量结实,但更新苗数量少.多数草本植物间生态位重叠较少,例如苣荬菜(序号15)、白刺(序号11)、白蔹(序号18)等只与少数几个物种存在生态位重叠,通过典型植被样方调查可知这些物种常形成单优种群丛,说明这些物种对环境资源的要求不一致,生境存在差异.
表2 贝壳堤岛主要植物的生态位宽度
Tab.2 Niche breadth of dominant species at Wudi chenier island
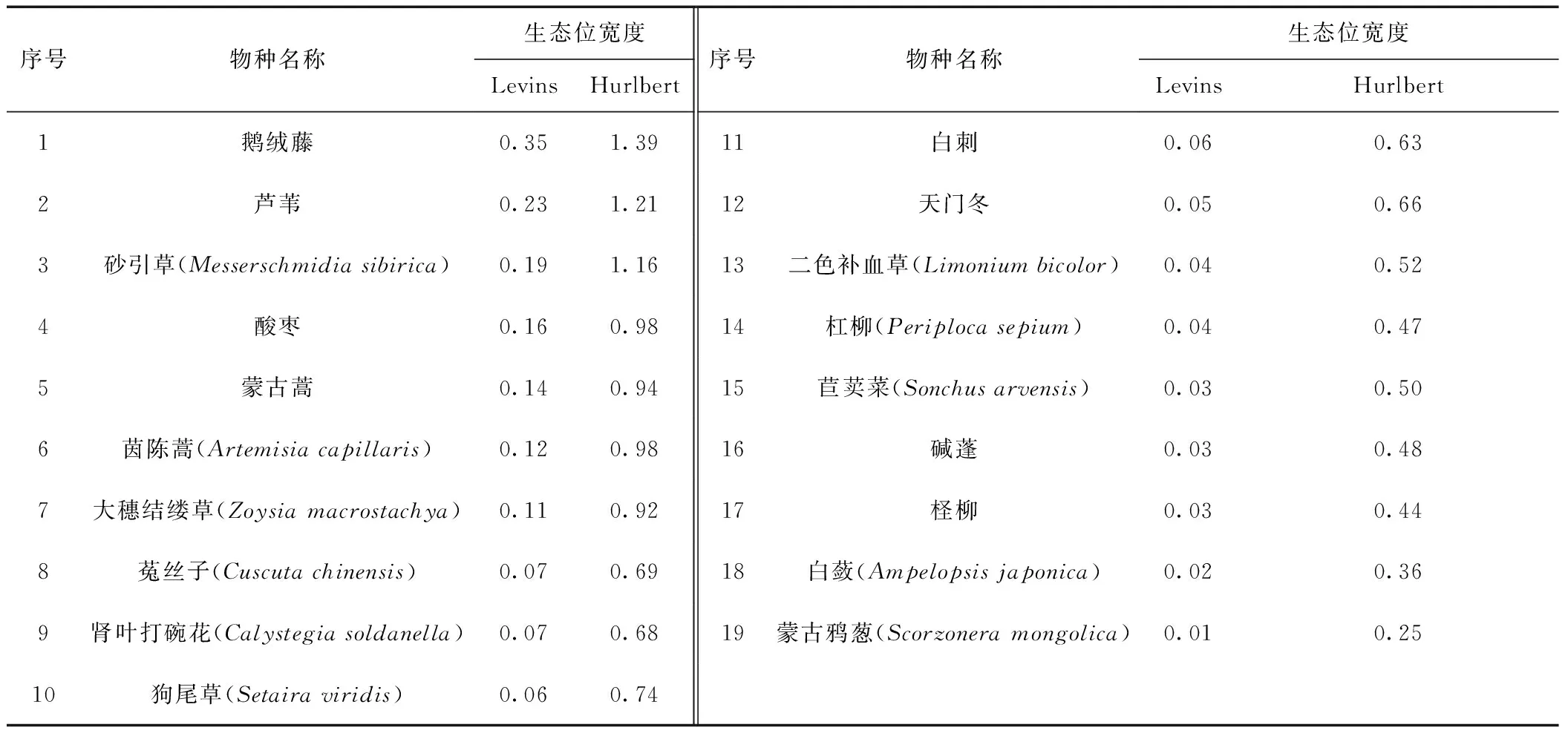
序号物种名称生态位宽度LevinsHurlbert序号物种名称生态位宽度LevinsHurlbert1鹅绒藤0.351.3911白刺0.060.632芦苇0.231.2112天门冬0.050.663砂引草(Messerschmidiasibirica)0.191.1613二色补血草(Limoniumbicolor)0.040.524酸枣0.160.9814杠柳(Periplocasepium)0.040.475蒙古蒿0.140.9415苣荬菜(Sonchusarvensis)0.030.506茵陈蒿(Artemisiacapillaris)0.120.9816碱蓬0.030.487大穗结缕草(Zoysiamacrostachya)0.110.9217柽柳0.030.448菟丝子(Cuscutachinensis)0.070.6918白蔹(Ampelopsisjaponica)0.020.369肾叶打碗花(Calystegiasoldanella)0.070.6819蒙古鸦葱(Scorzoneramongolica)0.010.2510狗尾草(Setairaviridis)0.060.74
注:各序号对应物种名称见表2;表中未显示的物种对之间生态位重叠值均为0.
从表2和表3的生态位宽度和生态位重叠值可以看出:生态位宽度大的物种,其生态位重叠值也较大,如鹅绒藤、芦苇等.一般情况下,生态位宽度和生态位重叠值之间有着一定的关系,生态位宽度大的物种其适应能力较强,分布较广,与其他物种竞争资源的概率大,因此生态位重叠值也较大;而生态位宽度较小的物种,由于利用资源有限,彼此间产生竞争的概率小,生态位重叠值也小[20].贝壳堤岛多数草本植物生态位重叠值为0,可能是由于单种属和少种属较多,不同属的物种在长期进化过程中对空间资源利用形成了分化,所以生态位无重叠.
4 结论与讨论
无棣贝壳堤岛由于其特殊的气候水文特点以及恶劣的生境,导致贝壳堤岛群落的水平结构和垂直结构较为单一,草本植物数量多,生态系统脆弱.结合踏查和系统抽样的样方调查共记录到维管束植物有30科63属74种,在植被分类的群系水平上,主要分布有酸枣灌丛、柽柳灌丛、芦苇草甸、蒙古蒿草甸和鹅绒藤草甸.维管束植物生物多样性指数总体水平如下:Shannon-Wiener多样性指数为2.70,Simpson多样性指数为0.91,McIntosh′s多样性指数为0.49,Berger-Parker均匀度指数和JSW均匀度指数分别为0.15和0.79.在重要值大于1.0的植物种类中,鹅绒藤的生态位宽度最大,Levins和Hurlbert生态位宽度值分别为0.35和1.39;其次是芦苇、砂引草、酸枣等.芦苇和天门冬间的生态位重叠值最高,为0.469,其次为菟丝子和肾叶打碗花.酸枣受鹅绒藤缠绕,导致幼苗更新受阻.柽柳主要分布在向海侧,是向海侧目前唯一的木本植物,一旦遭遇破坏,生境亦可能进一步恶化.夏江宝等[21]的研究表明,灌木林比草地对土壤物理性质和蓄水保土功能改善作用更明显,因此应对酸枣和柽柳群落加以重要保护.同时,本研究从生态位的角度对无棣贝壳堤岛保护区维管束植物进行了分析,结果表明鹅绒藤生态位宽度大,且与多数物种均存在生态位重叠,甚至与有些物种形成强烈的竞争关系.寄生物种菟丝子覆盖于向海侧砂引草、肾叶打碗花、酸枣等物种上,覆盖度甚至高达90%,导致寄主黄化现象严重,极大地影响寄主生长.因此,应加强对鹅绒藤和菟丝子的管理.
[1] ZHAO X.Cheniers in China:an overview[J].Marine Geo-logy,1989,90(4):311-320.
[2] 杜廷芹,黄海军,王珍岩,等.黄河三角洲北部贝壳堤岛的近期演变[J].海洋地质与第四纪地质,2009,29(3):23-29.
[3] MORALES J A,BORREGO J,DAVIS R A.A new me-chanism for chenier development and a facies model of the Saltés Island chenier plain (SW Spain)[J].Geomorpho-logy,2014,204(4):265-276.
[4] NEAL A,RICHARDS J,PYE K.Structure and development of shell cheniers in Essex,southeast England,investigated using high-frequency ground-penetrating radar[J].Marine Geology,2002,185(3):435-469.
[5] 李世瑜.古代渤海湾西部海岸遗迹及地下文物的初步调查研究[J].考古,1962(12):652-657.
[6] 潘怀剑,田家怡,谷奉天.黄河三角洲贝壳海岛与植物多样性保护[J].海洋环境科学,2001,20(3):54-59.
[7] 田家怡,夏江宝,孙景宽.黄河三角洲贝壳堤岛生态保护与恢复[M].北京:化学工业出版社,2011:109-141.
[8] 谢桐音,谢桂林,赫福霞,等.黄河三角洲贝壳堤岛跳虫群落研究[J].东北农业大学学报,2011,42(9):92-96.
[9] 夏江宝,张淑勇,赵自国,等.贝壳堤岛旱柳光合效率的土壤水分临界效应及其阈值分级[J].植物生态学报,2013,37(9):851-860.
[10] 胡正华,钱海源,于明坚.古田山国家级自然保护区甜槠林优势种群生态位[J].生态学报,2009(7):3670-3677.
[11] 方精云,王襄平,沈泽昊,等.植物群落清查的主要内容、方法和技术规范[J].生物多样性,2009,17(6):533-548.
[12] LEVINS R.Evolution in changing environments:some theoretical explorations[M]∥Monographs in Population Biology,1968:1-132.
[13] HURLBERT S H.The measurement of niche overlap and some relatives[J].Ecology,1978,59(1):67-77.
[14] PIANKA E R.The structure of lizard communities[J].Annual Review of Ecology and Systematics,1973,4(1):53-74.
[15] 万方浩,刘全儒,谢明,等.生物入侵:中国外来入侵植物图谱[M].北京:科学出版社,2012:38-214.
[16] 赵丽萍,段代祥.黄河三角洲贝壳堤岛自然保护区维管植物区系研究[J].武汉植物学研究,2009,27(5):552-556.
[17] 赵艳云,田家怡,孙景宽,等.滨州北部贝沙堤生物多样性现状及影响因素的研究[J].水土保持研究,2010,17(2):136-140.
[18] 王刚,赵松岭,张鹏云,等.关于生态位定义的探讨及生态位重叠计测公式改进的研究[J].生态学报,1984,4(2):119-127.
[19] 赵艳云,陆兆华,夏江宝,等.黄河三角洲贝壳堤岛3种优势灌木的根系构型[J].生态学报,2015,35(6):1688-1695.
[20] 马晓勇,上官铁梁,庞军柱.太岳山森林群落优势种群生态位研究[J].山西大学学报(自然科学版),2004,27(2):209-212.
[21] 夏江宝,张淑勇,王荣荣,等.贝壳堤岛3种植被类型的土壤颗粒分形及水分生态特征[J].生态学报,2013,33(21):7013-7022.

