日本囊对虾G3选育群体生长性状的遗传参数评估
钟声平,毛 勇,王 军,苏永全
(1.广西壮族自治区海洋研究所,广西海洋生物技术重点实验室,广西北海536000; 2.厦门大学海洋与地球学院,福建厦门361102)
日本囊对虾(MarsupenaeusjaponicusBate,1888),英文名为Kuruma shrimp,旧称日本对虾,俗称斑节虾、竹节虾和沙虾[1],分布于中国和日本沿海.在我国主要分布于浙江、福建、广东和海南等省沿海,其肉质鲜嫩可口,个体大,营养丰富,具有耐低温、活力强、耐干露、适合鲜活销售等特点[2],是我国主要的养殖虾类之一.但迄今苗种生产所用的种虾大多数来自野生群体,所培育的苗种抗逆性差,生长速度缓慢,严重阻碍了日本囊对虾养殖产量的可持续增长.
经济性状的遗传评估是选择育种中的一项基础工作,遗传力和遗传相关性作为数量遗传学中的重要遗传参数,是育种值估计、选择指数估算和遗传进展预测中重要的参考指标[3-5].生长性状一般为数量性状,其遗传机制受生物内部微效多基因系统和生物外部环境因素共同影响,导致其表型变异呈连续、正态分布,同时不同的生长性状可能受相近的基因连锁群和相似的环境因素控制和影响,生长性状的表型不仅表现出多样的变异,相互之间还具有一定的联系[3].因此,对日本囊对虾的生长选育不能单独考察一个生长性状,而需要同时考察多个生长性状.目前,有关日本囊对虾遗传育种的理论研究较少,集中在少数性状如体质量及体长的遗传参数评估上[6],迄今未见多个生长性状遗传参数评估的报道.
遗传力不但由性状本身独有的特征决定,而且也受生物自身群体遗传结构及其所处环境的综合影响,不同选育世代的遗传力往往是动态变化的,依据遗传力和遗传相关变化调整选育方案是保障选育性状进展可持续累积的重要前提[7].本研究采用动物模型评估方法,构建了16个日本囊对虾家系,标记后在室外高位池中开展标准化生长性状对比测试,结合不同的固定效应和随机效应,评估了日本囊对虾第3世代(G3)选育群体生长性状的遗传力和遗传相关性,以期为开展日本囊对虾多性状复合育种提供理论依据和实践指导.
1 材料与方法
1.1 亲本交配及催产
实验所用亲本为厦门大学对虾选育课题组培育的日本囊对虾第2世代选育群体的后代,于2011年6月,挑选生长快的雌虾(体质量47~60 g)和雄虾(体质量35~53 g),分成8个组合,每个组合雌、雄各150尾,放入高位池中的8个30 m2围网中进行自然交尾.参考日本囊对虾亲虾催熟和育苗的方法[6],每个组合按体质量从大到小挑选最大的10尾交配过的雌虾,在一个月内共构建39个全同胞家系.
1.2 幼体培育及标记
参考日本囊对虾幼体培育及标记的方法[6]略作修改.在仔虾培育至30 d时,每个家系随机挑选300尾,体长4.4~4.9 cm,在其腹节处注射不同组合的荧光物(Northwest Marine Technology,红、褐、绿、黄、紫、蓝6种颜色)作为家系标记.在室内9 m2水泥池(每个家系单独一个水泥池)培育7 d后,从39个家系中挑选构建日期相近(4 d内)且存活率高、生长快(家系平均体质量1.29~1.67 g,总个体数4 537尾)的16个家系放入室外180 m2高位池混合养殖(25尾/m2),进行生长性状对比测试.
1.3 生长性状数据采集
混养在高位池的16个家系参考日本囊对虾室外高位池培育的方法[6],在养殖至60 d时,每个家系随机取50尾,使用游标卡尺(精度0.01 mm),参考蔡晓鹏等[8]绘制的日本囊对虾形态测定部位图(图1),测量体长(BL)、头胸甲长(CL)、头胸甲宽(CW)、头胸甲高(CH)、第一腹节宽(FSW)和第一腹节高(FSH),使用分析天平(精度1 mg)称量体质量(BW).

参考蔡晓鹏等[8]略作修改.图1 日本囊对虾形态参数测定示意图 Fig.1Sketch of measuration part of morphometric attributes for M. japonicus
1.4 数据处理及统计分析
通过SAS软件对BL、BW数据进行正态分布检验[9].采用约束最大似然法估计方差组分,其遗传参数评估的动物模型为
Yij=μ+bdi+aj+eij.
式中,Yij为个体性状测量值,μ为性状的总体均值,b为混养前BW对收获性状测试值的回归系数,di为第i个家系混养前的BW(协变量),aj为第j尾对虾的加性遗传效应(随机效应)值,eij为随机残差效应值.统计分析采用WOMBAT软件[10],计算生长性状的遗传力及表型、遗传相关性[11].
2 结果与分析
2.1 日本囊对虾生长性状数据统计
对日本囊对虾同池混养60 d后的16个家系800个个体的7个生长性状进行测量、统计,结果见表1.BW的变异系数最大,为27.36%,变异情况如图 2(a)所示;BL的变异系数最小,为9.84%,变异情况如图 2(b)所示.体尺性状的变异系数范围为9.84%~12.14%,其中FSH的变异系数最大.上述结果显示:日本囊对虾生长性状存在丰富的表型变异,其中称量性状BW的变异程度最高,可能受环境的影响较大;变异程度最低的为BL,可能受环境的影响较小.
2.2 生长性状间的表型相关分析及曲线拟合
对日本囊对虾7个生长性状进行表型相关分析,并使用不同曲线拟合估计性状间的曲线关系.结果如表2所示,7个生长性状的表型间均呈显著相关,属中、高度相关:BW和BL之间相关性最高,为0.947±0.016;其次是BL和CL之间,为0.925±0.018;再次是BW和CL之间,为0.873±0.035;CH和FSH之间相关性最低,为0.571±0.149.
表1 日本囊对虾生长性状数据统计特征
Tab.1 Descriptive statistics of growth traits of M. japonicus
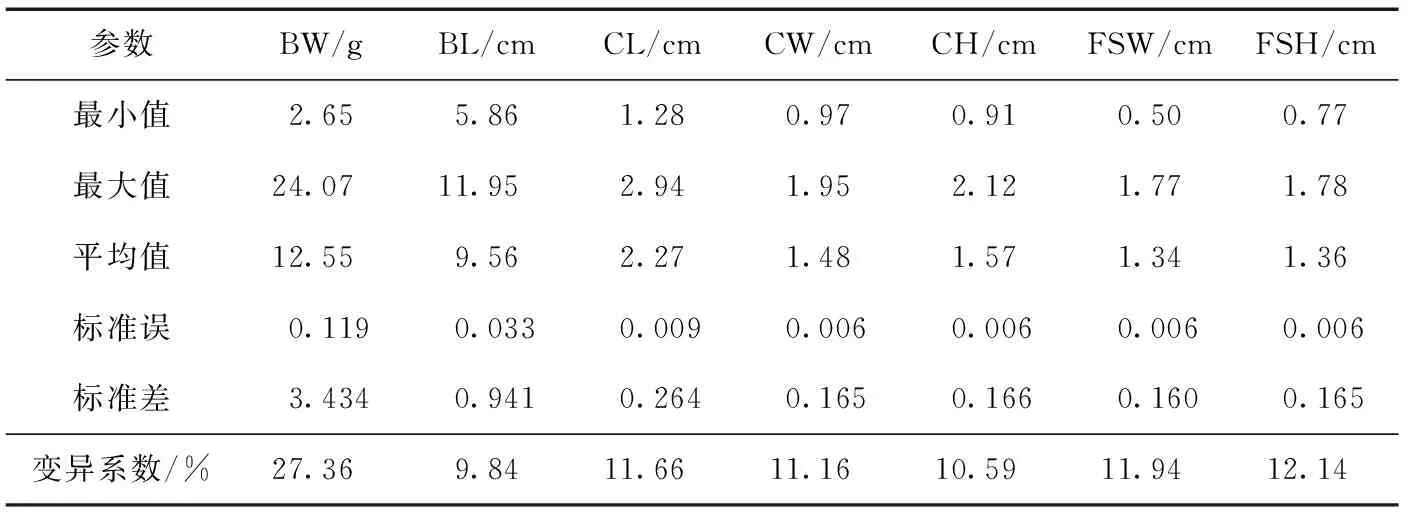
参数BW/gBL/cmCL/cmCW/cmCH/cmFSW/cmFSH/cm最小值2.655.861.280.970.910.500.77最大值24.0711.952.941.952.121.771.78平均值12.559.562.271.481.571.341.36标准误0.1190.0330.0090.0060.0060.0060.006标准差3.4340.9410.2640.1650.1660.1600.165变异系数/%27.369.8411.6611.1610.5911.9412.14
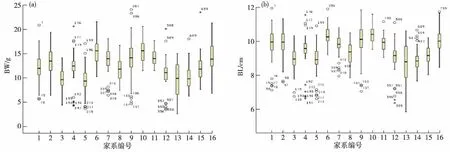
数字表示异常值个体编号;○表示温和异常值;★表示极端异常值.图2 日本囊对虾G3群体BW(a)和BL(b)的变异箱型图 Fig.2Box plots of BW(a) and BL(b) for the G3 population of M. japonicus
表2 日本囊对虾生长性状间的表型和遗传相关性
Tab.2 Phenotypic and genetic correlation of growth traits of M. japonicus
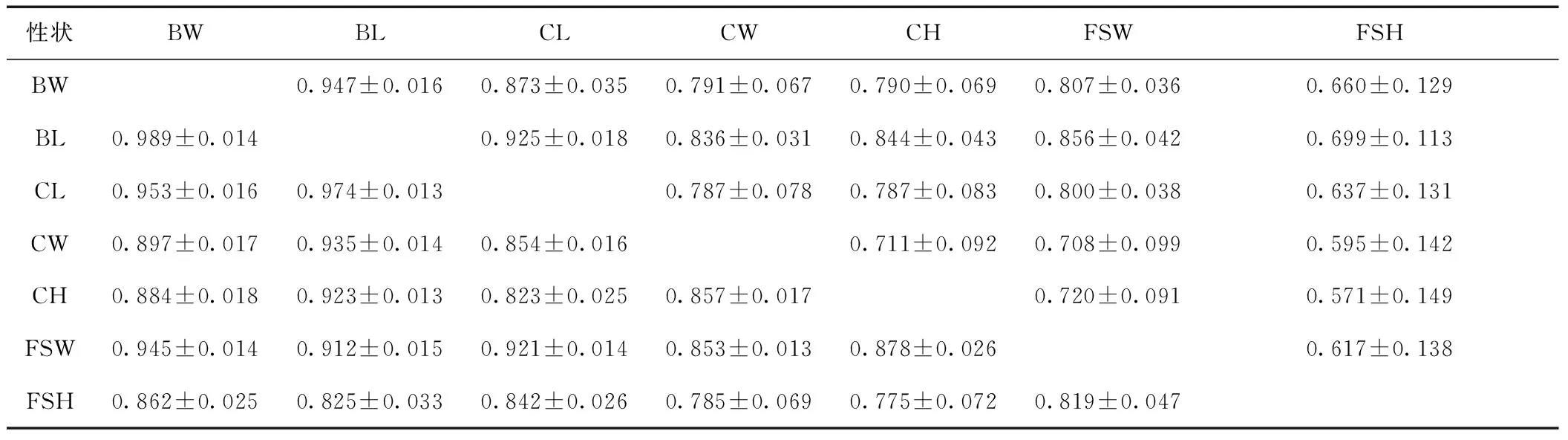
性状BWBLCLCWCHFSWFSHBW0.947±0.0160.873±0.0350.791±0.0670.790±0.0690.807±0.0360.660±0.129BL0.989±0.0140.925±0.0180.836±0.0310.844±0.0430.856±0.0420.699±0.113CL0.953±0.0160.974±0.0130.787±0.0780.787±0.0830.800±0.0380.637±0.131CW0.897±0.0170.935±0.0140.854±0.0160.711±0.0920.708±0.0990.595±0.142CH0.884±0.0180.923±0.0130.823±0.0250.857±0.0170.720±0.0910.571±0.149FSW0.945±0.0140.912±0.0150.921±0.0140.853±0.0130.878±0.0260.617±0.138FSH0.862±0.0250.825±0.0330.842±0.0260.785±0.0690.775±0.0720.819±0.047
注:对角线上方为表型相关性,下方为遗传相关性;数据均表示为平均值±标准差.
如表3所示,经不同曲线拟合,筛选得出日本囊对虾BW与6个体尺性状的曲线关系均以幂函数模型Y=aXb拟合最佳.其中BW和BL之间幂函数模型的R2最高,为0.934,拟合曲线如图3(a)所示;其次是BW和CL之间,幂函数模型的R2为0.806,拟合曲线如图3(b)所示;最低的是BW和FSH之间,幂函数模型的R2为0.488.
表3 日本囊对虾生长性状间拟合曲线参数
Tab.3 Parameters of the fit curves among growth traits of M. japonicus
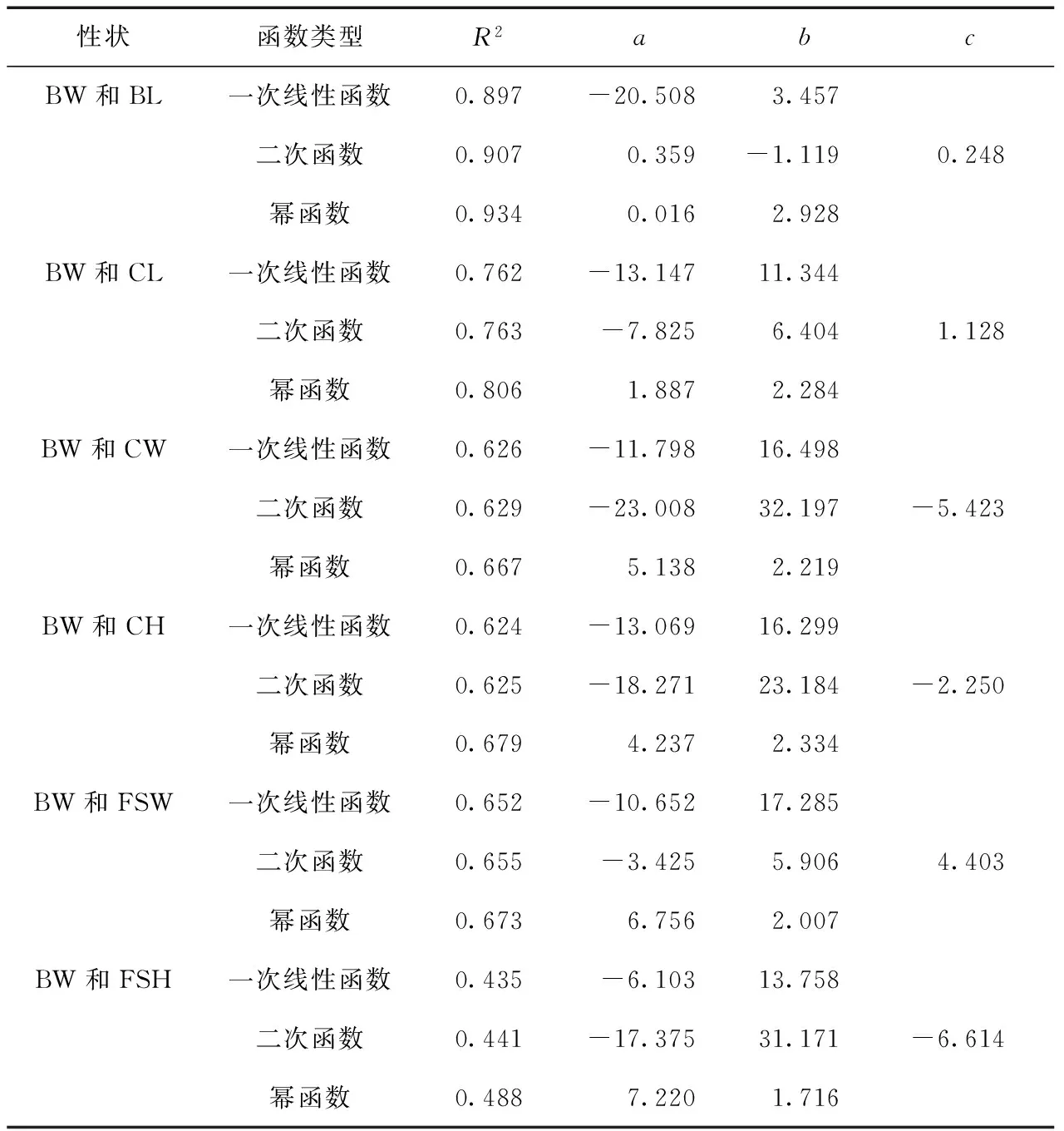
性状函数类型R2abcBW和BL一次线性函数0.897-20.5083.457二次函数0.9070.359-1.1190.248幂函数0.9340.0162.928BW和CL一次线性函数0.762-13.14711.344二次函数0.763-7.8256.4041.128幂函数0.8061.8872.284BW和CW一次线性函数0.626-11.79816.498二次函数0.629-23.00832.197-5.423幂函数0.6675.1382.219BW和CH一次线性函数0.624-13.06916.299二次函数0.625-18.27123.184-2.250幂函数0.6794.2372.334BW和FSW一次线性函数0.652-10.65217.285二次函数0.655-3.4255.9064.403幂函数0.6736.7562.007BW和FSH一次线性函数0.435-6.10313.758二次函数0.441-17.37531.171-6.614幂函数0.4887.2201.716
注:一次线性函数、二次函数、幂函数的表达式依次为a+bx,a+bx+cx2,axb.

图3 日本囊对虾BW和BL(a)以及BW和CL(b)的拟合曲线 Fig.3Fit curves between BW and BL(a) and between BW and CL(b) for M. japonicus
2.3 生长性状遗传参数及相关分析
应用多性状动物模型估计日本囊对虾7个生长性状的遗传参数,结果如表4所示:生长性状的遗传力范围是(0.202 7±0.087 1)~(0.423 3±0.138 5),属中、高度遗传力,并且统计检验结果显著(p<0.01),其中CL的遗传力最高,其次是FSW,FSH的遗传力最低.7个生长性状的随机残差方差均大于加性方差(两者之和为表型方差),表明生长性状受环境影响较大.遗传力评估的标准差范围为0.087 1~0.197 9,提示为了提高生长性状遗传力评估的准确性,有必要增加日本囊对虾的个体数.
表4 日本囊对虾生长性状遗传参数
Tab.4 Genetic parameters for growth traits of M. japonicus
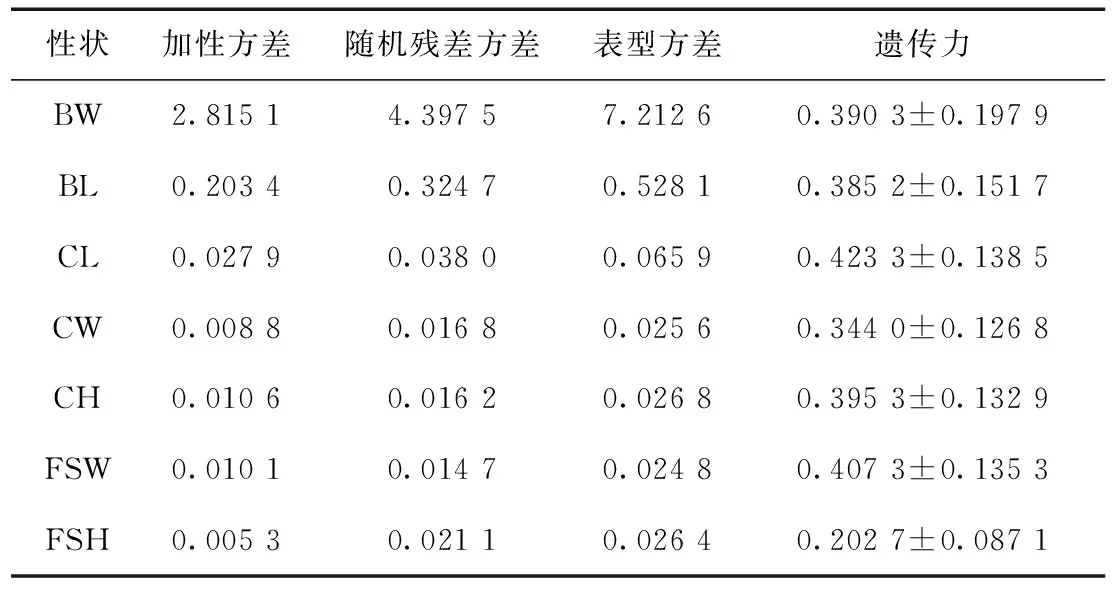
性状加性方差随机残差方差表型方差遗传力BW2.81514.39757.21260.3903±0.1979BL0.20340.32470.52810.3852±0.1517CL0.02790.03800.06590.4233±0.1385CW0.00880.01680.02560.3440±0.1268CH0.01060.01620.02680.3953±0.1329FSW0.01010.01470.02480.4073±0.1353FSH0.00530.02110.02640.2027±0.0871
遗传相关分析结果如表2所示,7个生长性状间均为高度正相关,且统计检验结果显著(p<0.01).其中BW和BL之间遗传相关性最高,为0.989±0.014;其次是BL和CL之间,为0.974±0.013;再次是BW和CL之间,为0.953±0.016;遗传相关性最低的是CH和FSH之间,仅为0.775±0.072.遗传相关性的标准差均小于0.1,表明遗传相关的评估准确度高.
3 讨 论
3.1 生长性状的遗传变异差异
日本囊对虾的生长性状可分为称量性状(如BW)和体尺性状(如BL、CL、CW和CH等).生长选育的基础是选育群体存在遗传变异,要求个体、家系间生长表型差异显著且变异丰富.本研究结果显示,日本囊对虾G3群体的BW、BL和CL等7个生长性状均具有较高的遗传变异水平,并且BW(称量性状)的变异程度高于BL、CL和CH等体尺性状,BW的变异系数大于25%,BL、CL和CH等的变异系数小于15%.凡纳滨对虾(Litopenaeusvannamei)、斑节对虾(Penaeusmonodon)、中国明对虾(Fenneropenaeuschinensis)和三疣梭子蟹(Portunustrituberculatus)等甲壳动物中也有相似的研究结果,其称量性状的变异程度均高于体尺性状[12-14].另有研究发现甲壳动物生长性状的遗传变异系数范围为20%~35%,远高于陆地养殖动物(7%~10%)[15].本研究发现日本囊对虾的生长性状具有较高的遗传变异水平,尤其是BW的变异程度最高,可获得较快的选育进展;但同时也显示其遗传调控机制较为复杂,选育改良稳定性较差,必须同时参考BL和CL等遗传变异相对稳定的体尺性状.
3.2 生长性状的表型相关性及生长特点
日本囊对虾属于甲壳动物,生长、发育和繁殖都与蜕壳活动密切相关,并且其生长模式为渐变式,BW和BL等生长性状通过蜕皮才能完成增长,同时在不同生长环境和不同生长阶段,其生长特点有明显不同[16].相关研究显示,中国明对虾、斑节对虾和凡纳滨对虾的BW、BL和CL等生长性状间相关性高,BL对BW影响显著,BL和BW的拟合曲线以幂函数模型Y=aXb拟合最佳[17-18].本研究结果显示:日本囊对虾的BW、BL和CL等7个生长性状的表型数据均呈中、高度正相关,对BW影响最显著的是BL和CL这2个衡量对虾身体长度轴的体尺性状.BL与BW拟合曲线的b值为2.928,接近3.0,表明日本囊对虾BW的增长速度稍快于BL的增长速度,接近匀速生长;CL与BW拟合曲线的b值为2.284,小于3.0,表明日本囊对虾BW的增长速度快于CL的增长速度,呈非匀速生长.有关凡纳滨对虾和日本囊对虾不同生长阶段的生长性状差异分析结果表明,在早期快速生长阶段以BL的增长为主,生长中后期逐渐转化为BW的增长,但温度、盐度和食物等环境因素对各生长性状影响较大[17,19].本研究结果显示,日本囊对虾G3选育群体中后期生长以BW最快,BL、CL等体长指标相对较慢,为了降低环境因素的影响,需要同时考察多个生长性状的选育潜力.
3.3 生长性状的多性状遗传参数评估
甲壳动物中多个生长性状遗传参数评估的研究工作开展得较晚,但近年来相关研究取得了较大的进展.应用动物模型对中国明对虾的BL、CL和BW等性状遗传力的研究结果显示,BL和BW的遗传力属于中度遗传力,其生长性状具有较大的遗传改良潜力,可通过持续选育以改良生长性状[5];应用全同胞、半同胞方差组分估计中国明对虾的BL、CL和BW的狭义遗传力结果显示,BL的遗传力估计值在0.36~0.51之间,BW的遗传力估计值在0.04~0.29之间,表明这些生长性状具有较高遗传力,生长改良潜力较大[20].类似地,应用全同胞、半同胞方差组分估计凡纳滨对虾的生长性状遗传力的研究结果显示,5月龄凡纳滨对虾的BW和BL等生长性状属中、高度遗传力水平,其显示出较高的选择育种潜力[13].在斑节对虾的BL和BW等性状的遗传力研究中,斑节对虾也表现出较高的生长选育潜力,BL和BW属中、高度遗传力水平,范围为0.25~0.39[21].本研究结果显示,日本囊对虾的BW、BL和CL等7个生长性状的遗传力范围是0.202 7~0.423 3,属中、高度遗传力水平,与已发现的对虾中生长性状评估群体具有较高遗传力水平相符.通过遗传力可以估计留种个体的育种值,再依据育种值选种:遗传力高的性状采用个体选育方式效果较好,遗传力低的性状采用家系选育方式效果较好;同时可采用纯种持续选育来改良遗传力高的性状,而遗传力低的性状则采用不同品系杂交选育改良效果较好[15].另外,相关研究显示,与陆地养殖动物相比,水产养殖动物繁殖力较大,选育过程中遗传近交导致性状衰退较快,为了控制近交衰退,适宜选用家系繁育的策略,有利于保障稳定的选育进展.据此,由于日本囊对虾的生长性状属中、高度遗传力水平,遗传改良潜力较高,为了控制近交以保证持续选育改良,适宜采用家系选育结合个体选育的策略.
已有研究表明,陆地养殖动物中生长、抗病和繁育性状间存在着复杂的相关性,生长性状间一般为正相关,生长、抗病和繁育性状间可能存在负相关[11].针对不同的选育目标,必须事先评估各性状间的遗传相关性,否则可能因为性状间存在较强的负相关导致选育失败.田燚等[5]对中国明对虾的生长性状间遗传相关性的研究显示:各性状间表现出高度正相关(0.82~1.00),遗传相关性最高的为CW和BL,最低的为FSL和第二腹节宽,表明在对BW进行性状改良的同时,BL和CW等生长性状可因遗传正相关而获得间接选育改良.何玉英[20]对中国明对虾的BL、CL、BW和腹节长等生长性状间遗传相关性的研究显示:各生长性状间存在高度遗传正相关(0.832~0.920),其中BW和腹节长的遗传相关性最高,BL和CL的最低.徐如卫等[13]对凡纳滨对虾的生长性状间遗传相关性的研究显示:各性状间表现出高度遗传正相关(0.750~0.976),遗传相关最高的为BW和全长,最低的为全长与第三腹节背高,表明凡纳滨对虾生长选育目标性状可以是BW或全长,其余生长性状会因遗传正相关同时获得改良.本研究结果显示:日本囊对虾的BW、BL和CL等7个生长性状间均存在高度遗传正相关,其中遗传相关性最高的BW和BL之间为0.989,最低的CH和FSH之间为0.775,符合对虾相关研究中生长性状间具有高度正相关的规律,提示以任一生长性状为选育参考目标,其他生长性状均可获得正向的间接选择,达到改良日本囊对虾生长的育种目标.
综上,本研究结果表明日本囊对虾G3群体的BW遗传变异水平最高,但也受外部环境因素影响较大,而BL则相对稳定,BW和BL之间具有很高的遗传正相关,可选择将BL和BW作为生长选育的重点性状纳入综合选择指数中.在日本囊对虾G1群体BW和BL的遗传评估结果[6]的基础上,本研究在对日本囊对虾G3群体的遗传评估中增加了反映对虾三维形态特征的数据(CL、CW、CH等),评估结果显示:G3群体的体尺生长性状为中、高度遗传力,对BW影响最显著的是BL和CL等衡量对虾身体长度轴的体尺性状.后续研究可根据市场需求进一步对体高、体宽性状开展多性状选育,以改良商品虾的形态丰满度;也可针对反映对虾可食用部分比例的生长性状(头胸甲质量和腹部质量)开展遗传评估,以增加可食用部分比例满足对虾食品加工的需求.
[1] 庄志猛,孔杰,石拓,等.日本对虾野生和养殖群体遗传多样性的RAPD分析[J].自然科学进展,2001,11(3):28-32.
[2] 李义军,李婷,王平,等.日本囊对虾(Marsupenaeusjaponicus)3个野生种群和1个养殖种群的形态差异与判别分析[J].海洋与湖沼,2010,41(4):500-504.
[3] 马爱军,王新安,雷霁霖.大菱鲆 (Scophthalmusmaximus) 不同生长阶段体重的遗传参数和育种值估计[J].海洋与湖沼,2009,40(2):187-194.
[4] 王照旗,韩学凯,白志毅,等.三角帆蚌紫色选育系1龄阶段内壳色及生长性状的遗传参数估计[J].水产学报,2014,38(5):644-650.
[5] 田燚,孔杰,栾生,等.中国对虾生长性状遗传参数的估计[J].海洋水产研究,2008,29(3):1-6.
[6] 钟声平,苏永全,王军,等.日本囊对虾G1群体生长性状遗传参数估计[J].厦门大学学报(自然科学版),2015,54(4):469-473.
[7] GJEDREM T,ROBINSON N,RYE M.The importance of selective breeding in aquaculture to meet future demands for animal protein:a review[J].Aquaculture,2012,350:117-129.
[8] 蔡晓鹏,游欣欣,曾凡荣,等.中国沿海日本囊对虾5个地理群体间形态差异比较分析[J].中国水产科学,2010,17(3):478-486.
[9] 冯国双.医学案例统计分析与 SAS 应用[M].北京:北京大学医学出版社,2011:14-22.
[10] MEYER K.WOMBAT:a tool for mixed model analyses in quantitative genetics by restricted maximum likelihood (REML)[J].Journal of Zhejiang University Science B,2007,8(11):815-821.
[11] GJEDREM T,BARANSKI M.Selective breeding in a-quaculture:an introduction[M].Berlin:Springer,2009:24-39.
[12] 高保全.三疣梭子蟹 (Portunustrituberculatus) 遗传参数评估及新品种培育的研究[D].青岛:中国海洋大学,2014:13-15.
[13] 徐如卫,钱昭英,刘小林,等.凡纳滨对虾生长性状遗传参数的估计[J].水产学报,2013,37(5):672-678.
[14] ANDRIANTAHINA F.凡纳滨对虾体重和体尺性状的遗传参数和选择育种效果研究[D].咸阳:西北农林科技大学,2011:43-45.
[15] 王清印,孔杰,江世贵,等.水产生物育种理论与实践[M].北京:科学出版社,2013:21-35.
[16] JUNG H,LYONS R E,HURWOOD D A,et al.Genes and growth performance in crustacean species:a review of relevant genomic studies in crustaceans and other taxa[J].Reviews in Aquaculture,2013,4:77-110.
[17] 何铜.凡纳滨对虾生长性状多元统计分析和遗传参数估计[D].咸阳:西北农林科技大学,2010:22-23.
[18] 刘博,李健,刘萍,等.中国对虾“黄海1号”生长性状对体重的影响效果分析[J].海洋科学集刊,2009,49:96-103.
[19] 李婷.高位精养模式日本囊对虾生长及浮游生物演替规律[D].湛江:广东海洋大学,2011:14-15.
[20] 何玉英.中国对虾生长性状和对高氨氮和高pH抗性的基础研究[D].青岛:中国海洋大学,2009:61-62.
[21] KENWAY M,MACBETH M,SALMON M,et al.Heritability and genetic correlations of growth and survival in black tiger prawnPenaeusmonodonreared in tanks[J].Aquaculture,2006,259:138-145.

