鲍鱼内脏多糖的提取、纯化及其抗氧化和抑菌活性
张瑞娟,柯莉娜,郑 静,石 艳,王 勤
(厦门大学生命科学学院,福建厦门361102)
人体正常代谢过程中会产生具有生物活性的自由基,这些自由基累积过多或清除过慢会加速机体的衰老进程,并诱发炎症、免疫失调、恶性肿瘤等多种疾病[1].人工抗氧化剂一般都有副作用,长期摄入会引起肝损伤、肿瘤等一系列病症[2-3],因此,亟待获取天然且安全的抗氧化物.从天然生物中提取的多糖类化合物,对于各种来源的多种活性氧都具有良好的清除效果,有望成为天然抗氧化剂[4-5].
鲍鱼价格昂贵,而约占其软体组织1/3的内脏在加工过程中则经常被当成废弃物或低值饲料,这大大降低了鲍鱼的使用价值,并且造成了环境污染[6].已有研究发现鲍鱼内脏多糖具有抗氧化、抗肿瘤、增强免疫力等生物学作用[7-10].王莅莎等[7]提取的鲍鱼内脏多糖具有较好的清除羟自由基的能力、较弱的还原能力和很弱的络合能力;苏永昌等[8]提取的鲍鱼内脏多糖同时具有清除羟自由基和还原超氧阴离子自由基的能力;朱莉莉等[9]提取的鲍鱼内脏多糖具有明显抑制H22肿瘤细胞生长的作用,肿瘤抑制率均大于50%,且有一定的剂量依赖性;王莅莎等[10]提取的鲍鱼内脏多糖对HeLa细胞和K562细胞生长具有一定的抑制作用,且在体外能够增强淋巴细胞的增殖、腹腔巨噬细胞的吞噬和自然杀伤细胞的杀伤能力.但目前的鲍鱼内脏多糖提取存在工艺复杂、得率较低等问题.为简化工艺,提高得率,本研究采用酶解法从鲍鱼内脏中提取并纯化多糖,通过体外抗氧化活性模型评价其抗氧化活性并测定其抑菌活性,以期为鲍鱼废弃物的综合加工利用提供依据.
1 材料与方法
1.1 实验材料及试剂
冷冻的皱纹盘鲍(HaliotisdiscushannaiIno)内脏由莆田汇龙食品有限公司提供;供试的金黄色葡萄球菌(Staphyloccocusaureus,菌株编号FJAT-12029)、鼠伤寒沙门氏菌(Salmonellatyphimurium,菌株编号FJAT-10334)、大肠杆菌(Escherichiacoil,菌株编号FJAT-7239)和铜绿假单胞菌(Pseudomonasaeruginosa,菌株编号FJAT-346)均来自福建省农业科学院.
碱性蛋白酶和中性蛋白酶为合肥博美生物科技有限责任公司产品,酶活力分别为200和100 U/mg;酸性蛋白酶为枣庄杰诺生物酶有限公司产品,酶活力为50 U/mg;胃蛋白酶和木瓜蛋白酶为上海生工生物工程有限公司产品,酶活力分别为3 000和3 500 U/mg;胰蛋白酶为无锡酶制剂厂产品,酶活力为250 U/mg;其他试剂均为国产分析纯试剂;使用的蒸馏水为去离子重蒸水.
1.2 实验方法
1.2.1 鲍鱼内脏的前处理
将冷冻的鲍鱼内脏解冻、洗净,按部位将其分成两部分:角状消化腺和生殖腺为一部分;嗉囊、胃和胃盲管为另一部分.洗净后真空冷冻干燥,粉碎机粉碎,过30目筛,于4 ℃保存待用.
1.2.2 鲍鱼内脏多糖得率的测定
以料液比(即溶质质量(g)与溶剂体积(mL)的比例)1∶20把鲍鱼内脏干粉溶于蒸馏水中,60 ℃反应1 h;1 400g离心10 min,弃去沉淀,上清液加3倍体积的95%(体积分数,下同)乙醇4 ℃醇沉过夜;1 400g离心10 min,弃去上清液,沉淀真空冷冻干燥,分别测定鲍鱼内脏不同部位样品的多糖得率.采用苯酚-硫酸法测定总糖含量[11],3,5-二硝基水杨酸比色法(DNS法)测定还原糖含量[12],总糖与还原糖含量之差即为多糖含量[13].计算提取后样品中多糖占所用鲍鱼内脏干粉的质量分数,即为多糖得率.
1.2.3 最适蛋白酶的选择
采用碱性蛋白酶、中性蛋白酶、酸性蛋白酶、胃蛋白酶、胰蛋白酶和木瓜蛋白酶6种蛋白酶对鲍鱼内脏干粉进行酶解,按照供应商提供的每种蛋白酶的最适酶解条件,参照文献[14]设计对比实验,选择多糖得率最高的酶作为后续实验使用的蛋白酶.具体操作如下:取0.5 g鲍鱼内脏干粉,配制相应pH的缓冲液作为溶剂,并设置一蒸馏水对照组;料液比为1∶20,加酶量为1.05×104U/g,酶解3 h后沸水浴灭活10 min,降温至室温,调节pH至中性;1 400g离心10 min,弃去沉淀,上清液加3倍体积的95%乙醇4℃醇沉过夜;1 400g离心10 min,弃去上清液,沉淀真空冷冻干燥,测定多糖得率.每种酶进行3次平行实验.
1.2.4 碱性蛋白酶单因素试验
以不同的加酶量(0.6×104,1.2×104,2.4×104,3.6×104,4.8×104,6×104U/g)、pH(9.0,9.5,10.0,10.5,11.0)、酶解温度(30,40,50,60,70 ℃)和料液比(1∶10,1∶20,1∶30,1∶40,1∶50)为考察因素进行反应,酶解结束后按1.2.3中操作步骤进行后续处理并测定多糖得率,每个因子进行3次平行实验.
1.2.5 碱性蛋白酶正交试验
根据单因素试验结果,选取不同因子水平进行正交试验,通过SPSS 17.0软件进行统计分析,得出最佳提取条件.
1.2.6 鲍鱼内脏粗多糖的抗氧化活性测定
1) 清除羟自由基能力的测定
量取1 mL不同质量浓度的粗多糖溶液,分别加入9 mmol/L硫酸亚铁溶液和9 mmol/L水杨酸-乙醇溶液各1 mL,再加入8.8 mmol/L过氧化氢(H2O2)溶液1 mL,混匀后在37 ℃下反应1 h,于510 nm处测定吸光度[15].通过式(1)计算粗多糖样品对羟自由基的清除率,绘制羟自由基清除率(Y)与样品质量浓度(X)的关系曲线.
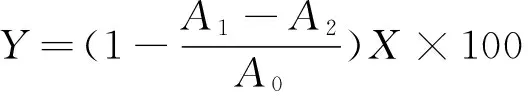
(1)
式中:A1为加入粗多糖溶液时的吸光度;A2为等体积的蒸馏水代替H2O2溶液时的吸光度;A0为等体积的蒸馏水代替粗多糖溶液时的吸光度.
2) 清除2,2-联氮基-双-(3-乙基苯并噻唑啉-6-磺酸)二氨盐(ABTS)自由基能力的测定
参照苏晓雨等[16]的测定方法,将7 mmol/L ABTS溶液与4.8 mmol/L亚硫酸钾溶液等体积混合,在室温下避光放置12~16 h,即得ABTS自由基储备液.把ABTS自由基储备液稀释到734 nm处的吸光度(A734)为0.700±0.001,作为工作液.在10 mL具塞试管中吸取不同质量浓度的粗多糖溶液0.2 mL,加入3.8 mL ABTS工作液,摇匀后于室温静置6 min,然后测定溶液的A734值.通过式(2)计算粗多糖样品对ABTS自由基的清除率,绘制ABTS自由基清除率(Y)与样品质量浓度(X)的关系曲线.
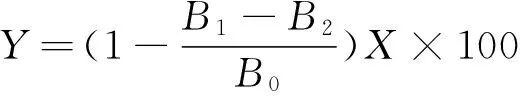
(2)
式中:B1为加入粗多糖溶液时的吸光度;B2为等体积的蒸馏水代替ABTS溶液时的吸光度;B0为等体积的蒸馏水代替粗多糖溶液时的吸光度.
3) 还原能力的测定
反应体系中依次加入0.2 mol/L 磷酸盐缓冲液(PBS,pH 6.6)1.0 mL,1%(质量分数)铁氰化钾溶液1.0 mL,不同质量浓度的粗多糖溶液0.25 mL,混匀后在50 ℃反应20 min.再加入10%(质量分数)三氯乙酸溶液1.0 mL,振荡混匀,4 000 r/min离心10 min.取上清2.5 mL,再加入2.5 mL蒸馏水与0.1%(质量分数)氯化铁溶液0.5 mL,静置10 min,待溶液由黄色变为蓝色后,测定700 nm处的吸光度(A700)[14].空白组以等体积蒸馏水代替粗多糖溶液.
利用线性回归方程y=0.054x+0.044(R2=0.997)计算出在上述测定方法下A700=0.485时对应的样品质量浓度,以此表示还原能力[14].
1.2.7 双酶解提取鲍鱼内脏粗多糖
采用中性蛋白酶、酸性蛋白酶、胃蛋白酶、胰蛋白酶和木瓜蛋白酶5种蛋白酶对碱性蛋白酶酶解所得的鲍鱼内脏粗多糖干粉再次酶解,方法参照1.2.3中所述,选择多糖含量最高、抗氧化能力最强的酶作为后续实验使用的蛋白酶.
1.2.8 鲍鱼内脏粗多糖的纯化
采用Sevage法和反复冻融法去除蛋白[17],H2O2脱除色素[18],进一步纯化粗多糖.
将三氯甲烷和正丁醇按体积比3∶1混合制备成Sevage溶液,再与等体积的50 mg/mL粗多糖溶液混合,剧烈振荡2 min,1 000 r/min离心10 min,去除下层有机相和中间层蛋白,取上清反复进行此操作直至中间层无明显蛋白出现.粗多糖溶液冷冻干燥后再反复冻融去除蛋白:将粗多糖样品配成50 mg/mL的溶液,-80 ℃冷冻后解冻,10 000 r/min离心10 min,取上清反复进行此操作直至离心后无明显沉淀出现.
多糖溶液冷冻干燥后,采用H2O2进行脱色处理:以不同的H2O2体积分数(0.5%,1%,2%,3%,4%,5%)、脱色温度(30,40,50,60,70,80 ℃)和脱色时间(10,20,30,40,50,60,80,100,120 min)为考察因素,反应结束后测定560 nm处的吸光度(A560),每个因子进行3次平行实验.
将脱色处理后的提取液转移到截留分子质量为3 500 ku的透析袋中,在4 ℃下透析24 h.将透析后的多糖溶液在45 ℃下旋转蒸发浓缩,然后真空冷冻干燥制得高纯度的鲍鱼内脏多糖样品备用.
1.2.9 鲍鱼内脏多糖对细菌的抑制活性测定
采用琼脂扩散法测量抑菌圈大小[19].将-20 ℃冷冻保存的供试菌种在LB固体培养基上划线,置于30 ℃下活化培养24 h.挑取单菌落接种于25 mL LB液体培养基中,30 ℃下200 r/min摇菌培养24 h,制备成菌悬液.将灭菌的15 mL含1%(质量分数)琼脂的LB培养基倒入灭菌后的平皿中,制成下层培养基.将灭菌的含0.7%(质量分数)琼脂的LB培养基冷却至50 ℃,接种供试菌,菌密度为106mL-1,摇匀后制成上层培养基.用打孔器在平板上打孔,孔的直径为0.8 cm,每个平板上打6个孔,分别对应于4个多糖处理浓度、1个阴性对照(蒸馏水)和1个阳性对照(1 000 U/mL链霉素和卡那霉素的混合液),在37 ℃恒温培养24 h后测量抑菌圈大小.
2 结果与分析
2.1 鲍鱼内脏不同部位的多糖得率
经测定,角状消化腺和生殖腺部位的多糖得率为3.15%,嗉囊、胃和胃盲管部位的多糖得率为0.19%.因此,后续实验中提取鲍鱼内脏多糖时,事先除去多糖得率很底的嗉囊、胃和胃盲管等部位,以简化后续除杂工艺.
2.2 鲍鱼内脏酶解最适蛋白酶的选择
鲍鱼内脏按照各蛋白酶相应的最适酶解条件进行反应,反应条件如表1所示,其中缓冲液浓度为0.2 mol/L.以多糖得率为指标,选取酶解效果最佳的蛋白酶.
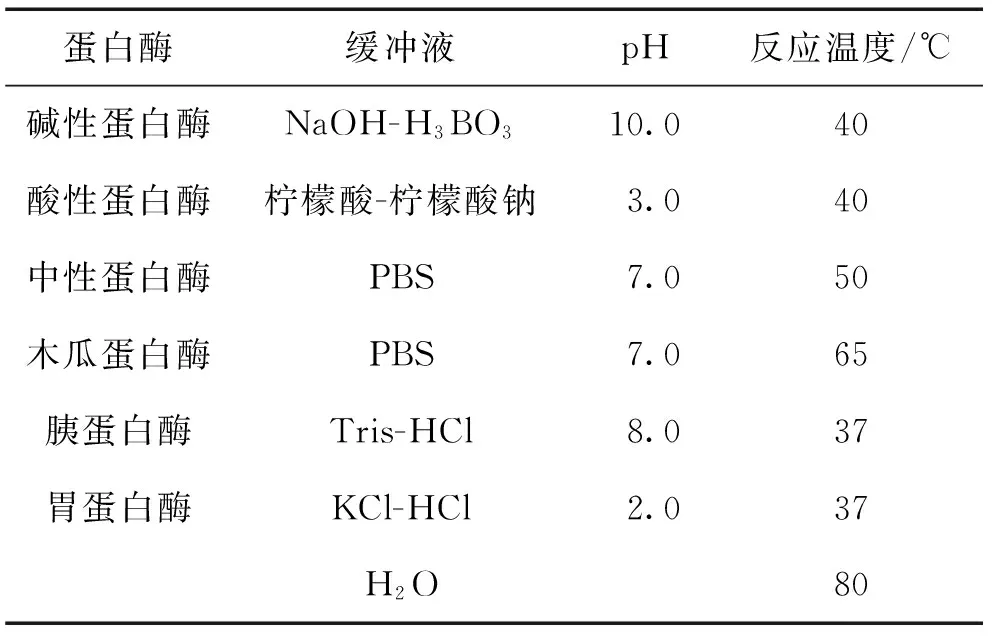
表1 鲍鱼内脏蛋白酶酶解条件Tab.1 Conditions for protease enzymolysis of abalone viscera
6种蛋白酶酶解提取鲍鱼内脏多糖的得率如图1所示,可见采用碱性蛋白酶酶解时多糖得率最高,为6.66%,且显著高于木瓜蛋白酶、胰蛋白酶和胃蛋白酶(p<0.05),故后期选用碱性蛋白酶酶解提取鲍鱼内脏多糖.
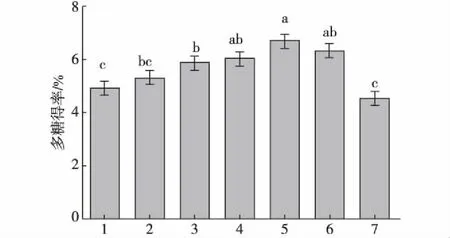
1.蒸馏水;2.木瓜蛋白酶;3.胰蛋白酶;4.中性蛋白酶; 5.碱性蛋白酶;6.酸性蛋白酶;7.胃蛋白酶. 不同字母表示差异显著(p<0.05),下同.图1 不同蛋白酶酶解对鲍鱼内脏多糖得率的影响 Fig.1The enzymolysis effects of different proteases on the yield of polysaccharides from abalone viscera
2.3 碱性蛋白酶酶解条件单因素试验
碱性蛋白酶酶解的单因素试验结果如图2所示.以多糖得率为指标,获得的最佳酶解条件为:加酶量1.2×104U/g,pH 10.5,温度40 ℃,料液比1∶30.
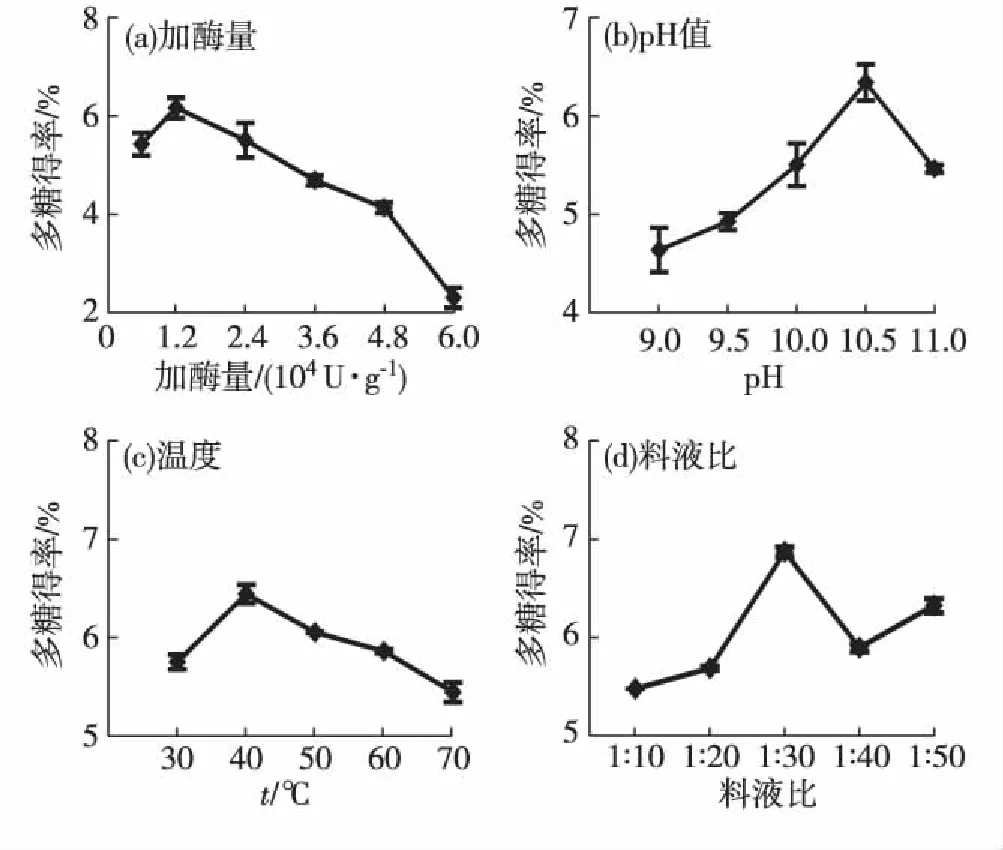
图2 碱性蛋白酶酶解的不同因素对 鲍鱼内脏多糖得率的影响 Fig.2Effects of different factors of alkaline protease enzymolysis on the yield of polysaccharides from abalone viscera
2.4 碱性蛋白酶酶解条件正交试验
正交试验结果如表2所示:各因素对多糖质量浓度的影响大小次序为加酶量>料液比>温度>pH;最佳因素组合为加酶量0.6×104U/g,温度50 ℃,pH 11.0,料液比1∶40.
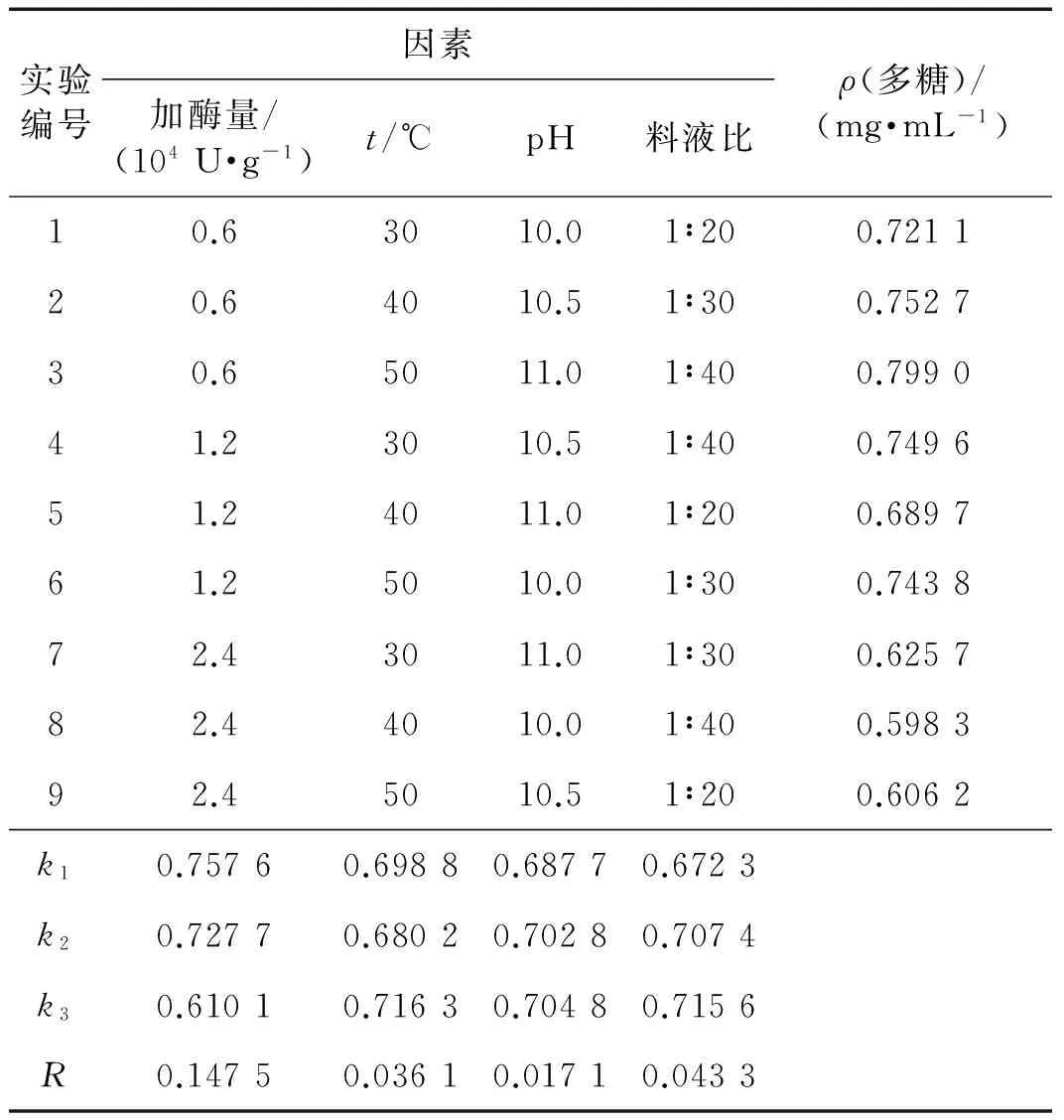
表2 正交试验结果Tab.2 Result of the orthogonal test
注:k1,k2,k3分别表示不同水平多糖质量浓度的平均值,R表示极差.
2.5 鲍鱼内脏粗多糖的抗氧化活性测定
将得到的鲍鱼内脏粗多糖进行体外抗氧化活性测定,结果如图3所示.100%清除羟自由基、100%清除ABTS自由基以及还原能力(A700=0.485)对应的鲍鱼内脏粗多糖质量浓度分别为9.6,7.5和8.2 mg/mL,表明所得粗多糖具有较好的抗氧化活性.
2.6 鲍鱼内脏粗多糖的二次酶解提取
为了进一步释放多糖链,对提取的鲍鱼内脏粗多糖进行二次酶解提取,提取条件参照表1.如图4所示,在采用的5种蛋白酶中,胃蛋白酶二次酶解提取的多糖含量最高,为(24.18±1.85)%.因此,在碱性蛋白酶酶解后选用胃蛋白酶二次酶解效果较好.
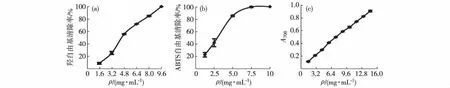
(a)清除羟自由基的能力;(b)清除ABTS自由基的能力;(c)还原能力.图3 鲍鱼内脏粗多糖的抗氧化活性 Fig.3Antioxidant activities of primary abalone viscera polysaccharides
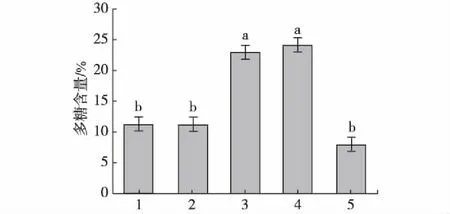
1.木瓜蛋白酶;2.中性蛋白酶;3.胰蛋白酶; 4.胃蛋白酶;5.酸性蛋白酶.图4 不同蛋白酶二次酶解鲍鱼内脏多糖的多糖含量 Fig.4Contents of abalone viscera polysaccharides derived from secondary emzymolysis by different proteases
2.7 双酶解提取所得鲍鱼内脏多糖的抗氧化活性测定
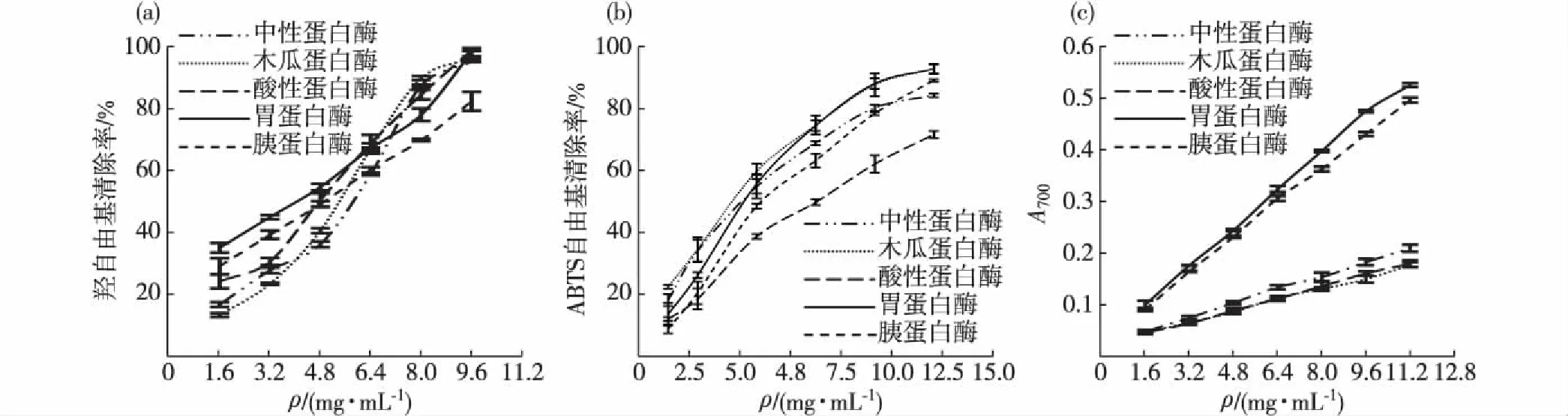
(a)清除羟自由基的能力;(b)清除ABTS自由基的能力;(c)还原能力.图5 不同蛋白酶二次酶解所得鲍鱼内脏多糖的抗氧化活性 Fig.5Antioxidant activities of abalone viscera polysaccharides derived from secondary emzymolysis by different proteases
将双酶解得到的鲍鱼内脏多糖分别进行体外抗氧化活性测定,结果如图5所示.5种酶二次酶解所得多糖样品清除羟自由基的能力如图5(a)所示,随着酶浓度的增加,5种酶的羟自由基清除率均有所提高,其中胃蛋白酶效果最好,9.6 mg/mL胃蛋白酶二次酶解所得鲍鱼内脏多糖的羟自由基清除率为100%,优于中性蛋白酶、酸性蛋白酶、胰蛋白酶、木瓜蛋白酶二次酶解所得多糖样品(分别为96.00%,99.85%,83.04%,97.16%);5种酶二次酶解所得多糖样品清除ABTS自由基的能力如图5(b)所示,均呈现浓度效应,且胃蛋白酶和木瓜蛋白酶处理组效果最好,10.0 mg/mL胃蛋白酶和木瓜蛋白酶二次酶解所得鲍鱼内脏多糖的ABTS自由基清除率分别为88.13%和87.64%,优于中性蛋白酶、酸性蛋白酶、胰蛋白酶二次酶解所得多糖样品(分别为80.16%,61.95%,78.37%);5种酶二次酶解所得多糖样品的还原能力如图5(c)所示,均呈现浓度效应,且胃蛋白酶和胰蛋白酶处理组效果最好,用11.2 mg/mL胃蛋白酶和胰蛋白酶二次酶解所得鲍鱼内脏多糖测定还原能力时,A700分别为0.525和0.496,优于中性蛋白酶、酸性蛋白酶、木瓜蛋白酶二次酶解所得多糖样品(分别为0.208,0.178,0.176).
综合比较上述结果,胃蛋白酶二次酶解得到的鲍鱼内脏多糖在清除羟自由基、清除ABTS自由基和还原能力方面均具有较好的抗氧化活性.
2.8 H2O2脱除鲍鱼内脏多糖色素
H2O2脱除鲍鱼内脏多糖色素的结果如图6所示,H2O2的体积分数为4%,温度为60 ℃,时间为120 min时多糖色素脱除率最高.因此确定最优脱色工艺为:将鲍鱼内脏多糖样品配成质量分数为5%的溶液,调节pH至9左右,加入4%(体积分数)H2O2溶液,60 ℃脱色2 h.此时鲍鱼内脏多糖的色素脱除率达到88.49%.
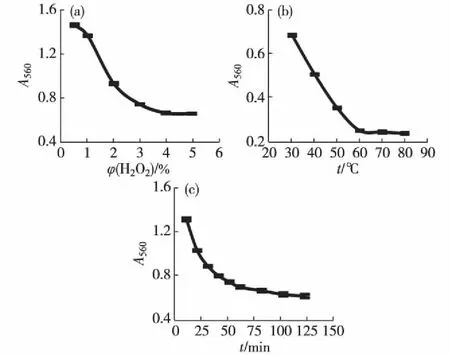
图6 H2O2体积分数(a)、脱色温度(b)和 脱色时间(c)对脱除鲍鱼内脏多糖色素的影响 Fig.6Effects of H2O2content (a),temperature (b) and time (c) on depigment of abalone viscera polysaccharides
2.9 鲍鱼内脏多糖的抑菌作用
鲍鱼内脏多糖对金黄色葡萄球菌、鼠伤寒沙门氏菌、大肠杆菌和铜绿假单胞菌的抑制效果如表3所示,可见随着多糖浓度增加,4种常见细菌的抑菌圈直径均增大,表现出明显的浓度效应.当多糖质量浓度达到25 mg/mL时,其对4种细菌的抑菌圈直径分别为11.62,11.39,11.00和7.83 mm,效果比阳性对照(链霉素和卡那霉素混合液)更好.
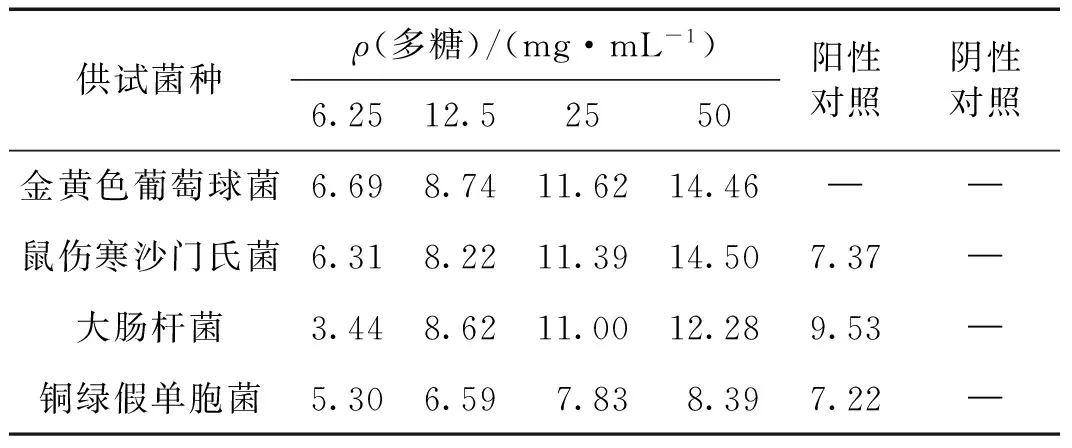
表3 鲍鱼内脏多糖的抑菌圈直径Tab.3 Diameters of the antibacterial circles of abalone visceral polysaccharides mm
注:-表示无抑菌圈;数据为3次平行实验的平均值.
3 讨 论
本研究通过碱性蛋白酶提取单因素试验和正交试验确定了酶解提取鲍鱼内脏粗多糖的最佳工艺条件,并测定了在该条件下提取所得粗多糖的抗氧化活性.罗晓航等[6]采用高压脉冲电场酶法辅助提取鲍鱼内脏多糖,当多糖质量浓度为10 mg/mL时对羟自由基的清除率为25.25%,而本研究中提取的鲍鱼内脏多糖样品在多糖质量浓度为9.6 mg/mL时,羟自由基清除率就达到100%.王莅莎等[7]采用碱性蛋白酶和胃蛋白酶分别酶解雌、雄皱纹盘鲍,再经Sephadex G-100洗脱共分离出4种成分,分别测定过柱前的2种样品和过柱后的4种成分的抗氧化活性,结果显示过柱前雌、雄鲍鱼内脏多糖样品清除羟自由基的半数有效质量浓度分别为0.14和0.08 mg/mL,效果更优,但过柱后成分清除羟自由基的能力都有不同程度的下降.过柱前雌、雄鲍鱼内脏多糖样品的还原能力(A700=0.2)分别为9.25和8.17 mg/mL,过柱后多糖质量浓度高的成分还原能力显著下降,质量浓度低者则略微加强[7],但都低于本研究中碱性蛋白酶酶解所得多糖样品的还原能力(A700=0.485)8.16 mg/mL.类似地,也有其他文献[20-22]报道纯化后的多糖化合物抗氧化活性较粗多糖更弱.出现这种现象的原因可能是单酶解所得鲍鱼内脏粗多糖样品中含有较多具有较好抗氧化活性的小分子物质,如低聚糖、多肽、氨基酸、脂肪酸、脂蛋白和一些重金属离子,而这些小分子物质在双酶解的过程中被去掉了一部分.综合分析表明,本研究中提取得到的鲍鱼内脏多糖具有较好的抗氧化活性,因此具有很好的应用前景.
本研究结果还表明纯化后的鲍鱼内脏多糖对4种供试菌都有良好的抑制效果,在25 mg/mL质量浓度下,其效果明显优于阳性对照.因此,鲍鱼内脏多糖具有较好抗氧化活性的同时,又能对常见的细菌产生抑制效果,该结果为鲍鱼内脏多糖在食品保鲜、医药保健等方面的应用提供了理论基础.
[1] BUTTERFIELD D A,CASTENG A A,POCERNICH C B,et al.Nutritional approaches to combat oxidative stress in Alzheimer′s disease[J].Journal of Nutritional Bioche-mistry,2002,13(8):444-461.
[2] GRICE H C.Safety evaluation of butylated hydroxyanisole from the perspective of effects on forestomach and oesophageal squamous epithelium[J].Food and Chemical Toxicology,1998,26(8):717-723.
[3] BECKER G L.Preserving food and health:antioxidants make functional,nutritious preservatives[J].Food Processing,1993(12):54-56.
[4] CHEN H X,ZHANG M,QU Z S,et al.Antioxidant acti-vities of different fractions of polysaccharide conjugates from green tea (Camelliasinensis)[J].Food Chemistry,2008,106(2):559-563.
[5] CHEN Y,XIE M Y,NIE S P,et al.Purification,composition analysis and antioxidant activity of a polysaccharide from the fruiting bodies ofGanodermaatrum[J].Food Chemistry,2008,107(1):231-241.
[6] 罗晓航,余鑫,卢晓燕,等.鲍鱼脏器粗多糖体外抗氧化活性研究[J].中国海洋药物杂志,2012,31(6):10-16.
[7] 王莅莎,朱蓓薇,周大勇,等.鲍鱼脏器多糖的抗氧化活性研究[J].食品与机械,2009,24(4):65-68.
[8] 苏永昌,刘淑集,王茵,等.鲍鱼内脏多糖的提取及其抗氧化活性研究[J].吉林农业,2010(10):170-171.
[9] 朱莉莉,孙黎明,李冬梅,等.鲍鱼内脏蛋白多糖体内对H22肝癌的抑制作用[J].营养学报,2009,31(5):478-481.
[10] 王莅莎,朱蓓薇,孙黎明,等.鲍鱼内脏多糖的体外抗肿瘤和免疫调节活性研究[J].大连工业大学学报,2008,27(4):289-293.
[11] ZHU B W,LI D M,ZHOU D Y,et al.Structural analysis and CCK-releasing activity of a sulfated polysaccharide from abalone (HaliotisdiscushannaiIno) viscera[J].Food Chemistry,2011,125(4):1273-1278.
[12] 张永勤,王哲平,宋雨梅,等.还原糖测定方法的比较研究[J].食品工业科技,2010,31(6):321-323.
[13] 程迪,于洁,董丽.河南产牡丹皮中多糖含量的测定[J].安徽农业科学,2008,36(2):518.
[14] 宿玮.高品质海地瓜多糖制备工艺研究[D].青岛:中国海洋大学,2012:26.
[15] 贾彦明,闵伟红.海带多糖的分离纯化及体外抗氧化作用的研究[J].农产品加工学刊,2010(8):26-29.
[16] 苏晓雨,王振宇.红松子种皮提取物活性成分及抗氧化作用研究[J].林产化学与工业,2010,30(4):99-102.
[17] 刘春燕.鲍鱼内脏多糖的结构和活性研究[D].长春:东北师范大学,2011:9.
[18] 陈健,耿安静,徐晓飞.香菇多糖的过氧化氢脱色工艺研究[J].食品工业科技,2010,31(3):293-295.
[19] ZHU Y J,SONG K K,LI Z C,et al.Antityrosinase and antimicrobial activities of trans-cinnamaldehyde thiosemicarbazone[J].Journal of Agricultural and Food Chemistry,2009,57(12):5518-5523.
[20] WANG Z J,LUO D H.Antioxidant activities of different fractions of polysaccharide purified fromGynostemmapentaphyllumMakino[J].Carbohydrate Polymers,2007,68(1):54-58.
[21] TSENG Y H,YANG J H,MAU J L.Antioxidant properties of polysaccharides fromGanodermatsugae[J].Food Chemistry,2008,107(2):732-738.
[22] LI X M,LI X L,ZHOU A G,et al.Evaluation of antioxidant activity of the polysaccharides extracted fromLyciumbarbarumfruitsinvitro[J].European Polymer Journal,2007,43(2):448-497.

