CD147对阿尔茨海默病模型大鼠学习记忆能力的干预作用
霍会永 ,刘冰 ,曹凌 ,赵现 ,曹妍 ,薛靖 ,王如科 ,李军涛 △
阿尔茨海默病(Alzheimer’s disease,AD)是老年人群中常见的一种中枢神经系统退行性病变,临床上以记忆力减退,语言功能障碍和认知能力降低为主要表现,部分患者甚至出现行为和人格改变,严重影响了患者生活质量[1]。随着我国逐渐步入老龄化社会,AD患者的发病人数也呈逐年增加之势。有关AD的发病机制尚不十分清楚,其主要病理改变为大脑皮质和海马区老年斑形成[2]。β-淀粉样蛋白(βamyloid protein,Aβ)是具有强自聚性的难溶蛋白,是构成老年斑的主要成分,降低脑内Aβ的蓄积能够有效延缓病程进展[3]。γ-分泌酶是调节Aβ生成的限速酶,对体内Aβ的平衡具有重要的调节作用[4]。近年来有研究发现,细胞外基质金属蛋白酶诱导因子(extracellular matrix metalloproteinase inducer,CD147)可通过调节γ-分泌酶的生物活性,调节Aβ的生成,从而参与AD的发生、发展[5-6]。本文通过对AD模型大鼠脑室注射CD147 cDNA,以观察其对模型大鼠学习记忆能力的干预,以及对大鼠脑组织Aβ和γ-分泌酶表达的影响,从而为AD的临床治疗提供思路。
1 材料与方法
1.1 实验动物与试剂 Sprague-Dawley二级健康雄性大鼠60只,月龄5~6个月,均购自中国科学院北京斯莱克实验动物中心(SCXK京2011-0012)。大鼠适应性饲养2周后用于实验。CD147 cDNA委托上海吉玛制药技术有限公司设计合成。TRIzol总RNA提取试剂购自美国Invitrogen公司。逆转录试剂盒、实时荧光定量PCR试剂盒均购自美国ABI Applied Biosystems公司。兔抗大鼠一抗(抗Aβ、抗γ-分泌酶),辣根过氧化物酶标记的羊抗兔IgG二抗,DAB显色试剂盒均购自美国Santa Cruz公司。
1.2 实验方法
1.2.1 动物分组、模型制备及给药 采用随机数字表法将60只大鼠分为假手术组、模型组及CD147组,每组20只。参照文献[7]制备AD大鼠模型,取模型组和CD147组大鼠,10%水合氯醛(0.3 g/kg)腹腔注射麻醉,俯卧固定于鼠脑立体定位仪上。参照鼠脑立体定位仪图谱,于前囟门后3.5 mm和中线右侧2 mm处垂直进针,通过微量注射器于双侧海马CA1区注入10µg的Aβ1~40,假手术组大鼠双侧海马CA1区注入10µg生理盐水,其余操作同模型组和CD147组。CD147组大鼠术后48 h,通过微量注射器于双侧脑室注射CD147 cDNA,模型组和假手术组大鼠于同一部位注射等量生理盐水。术毕,牙科泥封住颅骨孔,抗生素预防感染。
1.2.2 大鼠学习记忆能力测试 采用Morris水迷宫实验进行学习记忆能力测试。水迷宫为一圆形水池,直径1.8 m,高0.55 m。距池壁0.35 m处放一圆形平台,直径0.1 m,高0.29 m。所有大鼠训练5 d,每天上午训练2次,下午训练2次,相邻两次训练间隔1 min。训练时将大鼠面向池壁放入水中,观察其爬上圆形平台所需时间(即逃避潜伏期)。如果2 min内仍未找到圆形平台,则将其引导至圆形平台,潜伏期记为2 min。训练5 d后,撤除圆形平台,在训练时的同一入水点,大鼠面向池壁入水,观察其在2 min内跨过原圆形平台所在位置的次数。
1.2.3 Western blot检测蛋白表达 Morris水迷宫实验结束后,3组大鼠各取15只,腹腔麻醉后处死,取出包含海马组织的脑组织,置入玻璃匀浆器碾碎,冰浴下加裂解液。裂解30 min,转移至离心管,4℃下10 000 r/min离心5 min,取上清蛋白液。BCA法测定蛋白浓度,-20℃保存备用。100µg蛋白上样,经8%的SDS-PAGE电泳分离,转至PVDF膜。TBST漂洗,5%脱脂奶粉室温封闭1 h,兔抗大鼠一抗(抗Aβ、抗γ-分泌酶)工作液,4℃孵育过夜。TBST漂洗,加入辣根过氧化物酶标记的羊抗兔二抗工作液,37℃孵育1 h。TBST漂洗,暗室内ECL显色、曝光。Image J软件分析条带光密度(OD)值,目的蛋白相对表达量=目的蛋白光密度值/内参βactin光密度值。
1.3 统计学方法 采用SPSS 19.0统计学软件进行分析,符合正态分布的计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组内比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠逃避潜伏期时间比较 各组大鼠逃避潜伏期时间随着训练时间的增加均缩短。从第3天开始,模型组大鼠逃避潜伏期时间较假手术组延长,而CD147组较模型组减少,差异有统计学意义(P<0.05),见表1。
Tab.1 The comparison of escape latencies between three groups表1 各组大鼠逃避潜伏期时间比较(n=20,s,±s)
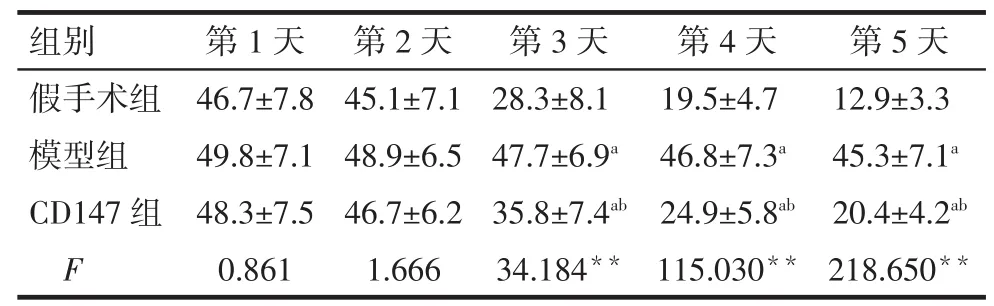
Tab.1 The comparison of escape latencies between three groups表1 各组大鼠逃避潜伏期时间比较(n=20,s,±s)
**P<0.01;a与假手术组比较,b与模型组比较,P<0.05;表2、3 同
2.2 各组大鼠空间探寻能力比较 模型组大鼠经过平台次数和经平台停留时间较假手术组减少,而CD147组较模型组均增加,差异有统计学意义(P<0.05),见表2。
2.3 各组脑组织Aβ和γ-分泌酶表达比较 模型组大鼠脑组织Aβ和γ-分泌酶表达较假手术组增加(P<0.05),而CD147组较模型组减少,差异有统计学意义(P<0.05),见表3、图 1。
Tab.2 The comparison of spatial searching abilities between three groups表2 各组大鼠空间探寻能力比较(±s)

Tab.2 The comparison of spatial searching abilities between three groups表2 各组大鼠空间探寻能力比较(±s)
Tab.3 ComparisonofexpressionsofAβandγ-secretasein brain tissues of rats between three groups表3 各组大鼠脑组织Aβ和γ-分泌酶表达比较 (±s)
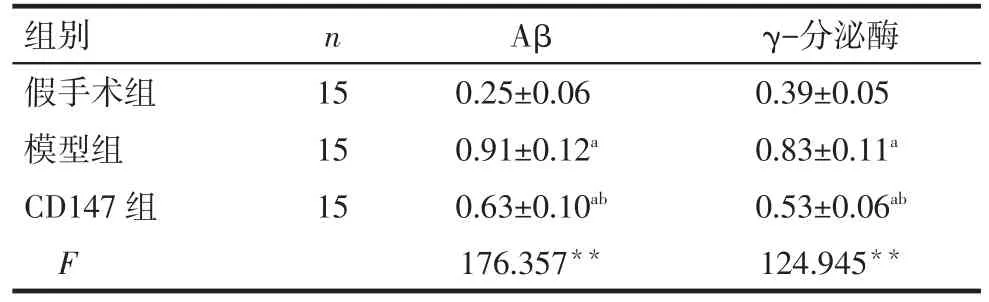
Tab.3 ComparisonofexpressionsofAβandγ-secretasein brain tissues of rats between three groups表3 各组大鼠脑组织Aβ和γ-分泌酶表达比较 (±s)
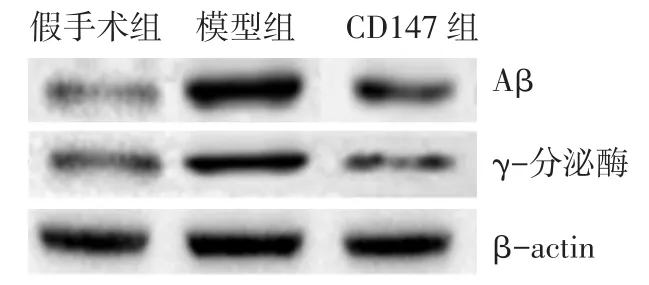
Fig.1 Comparison of expressions of Aβ and γ-secretase in brain tissues of rats between three groups图1 各组大鼠脑组织Aβ和γ-分泌酶表达比较
3 讨论
学习记忆能力下降是AD患者早期认知功能损害的主要临床特征。本研究通过海马区注射Aβ1~40,制备 AD 模型大鼠,Morris水迷宫实验结果显示,AD模型大鼠逃避潜伏期时间较假手术组显著延长,经过平台次数和经平台停留时间较假手术组明显减少,表明AD模型大鼠出现明显的学习记忆能力减退。通过对AD模型大鼠双侧脑室注射CD147 cDNA,观察其对AD模型大鼠学习记忆能力的影响,结果发现,CD147组大鼠逃避潜伏期时间较模型组大鼠显著减少,经过平台次数和经平台停留时间较模型组大鼠显著增加,表明外源性CD147 cDNA能够显著提高AD模型大鼠记忆学习能力,减轻Aβ1~40所致的学习记忆障碍。
有关AD的病因迄今尚不明确,一般认为AD是由于遗传、免疫、环境等多种因素所致的复杂性病变。研究指出,Aβ在大脑皮质和海马区沉积是引起AD发病的关键因素[8]。Aβ由39~43个氨基酸残基形成,其C-末端存在12个疏水氨基酸残基,N-末端存在28个氨基酸残基位于细胞膜外,所以具有很强的自聚性,易在脑组织形成难溶性的淀粉样纤维沉积物[9]。Aruoma 等[10]研究显示,脑组织 Aβ 沉积可引起淀粉样血管炎,直接引起脑组织血供、氧供障碍。谭展望等[11]认为Aβ可促进Bax表达而抑制Bcl-2表达,从而诱导神经元细胞凋亡。Arora等[12]研究显示,Aβ可损害胆碱能神经,而后者与人类学习和记忆功能紧密相关。本研究结果显示,模型组大鼠脑组织Aβ表达较假手术组显著增加,这也证实了Aβ可能参与了AD的发生、发展;而CD147组大鼠脑组织Aβ表达较AD模型大鼠显著降低,说明外源性CD147 cDNA可显著减少脑组织Aβ表达,减轻Aβ沉积所引起的大鼠记忆学习障碍。
γ-分泌酶主要参与体内多个重要跨膜蛋白的切割,可切割C99而生成Aβ,是调节Aβ生成的限速酶[13]。所以γ-分泌酶的生物活性对Aβ的生成和AD的发病均至关重要。CD147是一种跨膜糖蛋白,在多种组织和细胞中均有表达,与肿瘤的发生、视网膜功能和多种神经退行性疾病等密切相关。有研究认为CD147参与了对γ-分泌酶生物活性的调控。Zhou等[14]干扰 HeLa细胞 CD147表达,发现细胞γ-分泌酶表达显著增加,而Aβ的生成亦明显增加。张锦巍等[15]过表达小鼠胚胎成纤维细胞CD147,发现细胞γ-分泌酶表达下降,同时Aβ的生成明显减少。智孔亮等[16]通过CD147 cDNA转染人神经母细胞瘤细胞,结果发现γ-分泌酶和Aβ的表达均明显减少。本研究结果显示,CD147组大鼠脑组织γ-分泌酶表达较AD模型大鼠显著降低,这也证实了在AD模型大鼠脑组织中存在同样的表达调控,即CD147对γ-分泌酶的活性起着负调节作用。
综上所述,外源性CD147能够显著改善AD模型大鼠学习记忆能力,其具体机制可能与调节γ-分泌酶活性和下调Aβ的表达有关。
[1]田金洲,时晶,苗迎春,等.阿尔茨海默病的流行病学特点及其对公共卫生观念的影响[J].湖北中医学院学报,2009,11(1):3-7.Tian JZ,Shi J,Miao YC,et al.Epidemiological characteristics of Alzheimer’s disease and its effect on public health[J].J Hubei College TCM,2009,11(1):3-7.
[2]何颖,王超,王德才.阿尔茨海默病的非治疗药物及新靶点研究进展[J].中国医药导报,2014,11(6):162-166.He Y,Wang C,Wang DC.Research progress for non-treatment drug and new targets in Alzheimer disease[J].Chin Med Herald,2014,11(6):162-166.
[3]胡海燕.β-淀粉样蛋白在阿尔茨海默病中的作用及中药多靶点对抗研究进展[J].中华中医药学刊,2012,30(3):488-492.Hu HY.Against research progress of beta amyloid protein in the role of Alzheimer disease and traditional Chinese medicine therapy by multiple targets[J].Chin Arch Tradit Chin Med,2012,30(3):488-492.
[4]Roher AE,Maarouf CL,Kokjohn TA,et al.Neuropathological and biochemical assessments of an Alzheimer’s disease patient treated with the γ -secretase inhibitor semagacestat[J].Am J Neurodegener Dis,2014,3(3):115-133.
[5]Nahalkova J,Volkmann I,Aoki M,et al.CD147,a γ-secretase associated protein is upregulated in Alzheimer’s disease brain and its cellular trafficking is affected by presenilin-2[J].Neurochem Int,2010,56(1):67-76.doi:10.1016/j.neuint.2009.09.003.
[6]智孔亮,辛娜,曹志红,等.细胞外基质金属蛋白酶诱导因子与阿尔茨海默病β-淀粉样蛋白的相关性研究[J].临床和实验医学杂志,2016,15(4):342-345.Zhi KL,Xin N,Cao ZH,et al.The relationship between CD147 and β-amyloid protein of Alzheimer’s disease[J].J Clin Exp Med,2016,15(4):342-345.doi:10.3969/j.issn.1671-4695.2016.04.014.
[7]Liu X,Zuo H,Wang D,et al.Improvement of spatial memory disorder and hippocampal damage by exposure to electromagnetic fields in an Alzheimer’s disease rat model[J].PLoS One,2015,10(5):e0126963.doi:10.1371/journal.pone.0126963.
[8]张琳琳,宋宛珊,王凯,等.阿尔茨海默病发病机制及药物治疗研究进展[J].世界中医药,2017,12(5):1200-1203.Zhang LL,Song WS,Wang K,et al.Progress in mechanism of pathogenesis and medical treatment of Alzheimer’s disease[J].World Chin Med,2017,12(5):1200-1203.doi:10.3969/j.issn.1673-7202.2017.05.058.
[9]徐金静,方力群,赵春慧,等.β淀粉样蛋白对阿尔茨海默病转基因果蝇认知功能的影响[J].国际神经病学神经外科杂志,2013,30(2):101-104.Xu JJ,Fang LQ,Zhao CH,et al.Effect of β-amyloid proteins on cognitive functions in transgenic drosophila with Alzheimer’s disease[J].J Int Neurol Neurosurg,2013,30(2):101-104.
[10]Aruoma OI,Jen SS,Watts HR,et al.Acute and chronic effects of intravitreally injected beta-amyloid on the neurotransmitter system in the retina[J].Toxicology,2009,256(1/2):92-100.doi:10.1016/j.tox.2008.11.007.
[11]谭展望,胡海燕,陈翔,等.清心开窍方皂苷对AD大鼠大脑皮层及海马区 Bax、Bcl-2、Aβ 及 βAPP 表达的影响[J].中国中西医结合杂志,2012,32(9):1258-1263.Tan ZW,Hu HY,Chen X,et al.Effect of Qingxin Kaiqiao Recipe Saponin on the expressions of Bax,Bcl-2,Aβ,and βAPP in the cortex and hippocampus of Alzheimer’s disease rats[J].CJITWM,2012,32(9):1258-1263.
[12]Arora K,Alfulaij N,Higa JK,et al.Impact of sustained exposure to β-amyloid on calcium homeostasis and neuronal integrity in model nerve cell system expressing α4β2 nicotinic acetylcholine receptors[J].J Biol Chem,2013,288(16):11175-11190.doi:10.1074/jbc.M113.453746.
[13]邓青山,马全红,徐如祥.人β-分泌酶与阿尔茨海默病[J].中华神经创伤外科电子杂志,2015,1(4):45-48.Deng QS,Ma QH,Xu RX.Human beta-secretase and Alzheimer’s disease[J].Chin J Neurotrauma Surg(Electronic Edition),2015,1(4):45-48.doi:10.3877/cma.j.issn.2095-9141.2015.04.011.
[14]Zhou S,Zhou H,Walian PJ,et al.CD147 is a regulatory subunit of the γ-secretase complex in Alzheimer’s disease amyloid β-peptide production[J].Proc Natl Acad Sci,2005,102(21):7499-7504.doi:10.1073/pnas.0502768102.
[15]张锦巍,井丽娟,孙亚平,等.CD147超表达对γ-分泌酶影响的临床研究[J].重庆医学,2012,41(36):3801-3806.Zhang JW,Jing LJ,Sun YP,et al.Effect of over expressed CD147 on γ -secretase[J].Chongqing Med,2012,42(36):3801-3806.doi:10.3969/j.issn.1671-8348.2012.36.001.
[16]智孔亮,辛娜,曹志红,等.细胞外基质金属蛋白酶诱导因子与阿尔茨海默病γ-分泌酶的相关性研究[J].国际神经病学神经外科学杂志,2015,42(3):244-247.Zhi KL,Xin N,Cao ZH,et al.Relationship between extracellular matrix metalloproteinase inducer and γ-secretase in Alzheimer’s disease[J].J Int Neurol Neurosurg,2015,42(3):244-247.doi:10.16636/j.cnki.jinn.2015.03.024.

