Treg在亚急性甲状腺炎发病免疫机制中的作用
王小玲,吕合作,甘怀勇,项 平,张小凤,徐二琴,裴晓艳,金国玺*
(蚌埠医学院第一附属医院 1.内分泌科;2.检验科;3.病理科;4.中心实验室;5.蚌埠医学院诊断学教研室, 安徽 蚌埠 233004)
亚急性甲状腺炎(subacute thyroiditis, SAT)是一种病因及发病机制未明的疾病,特征性的表现为甲状腺部位的疼痛和压痛,一般认为其与病毒感染及免疫因素有关,可能为病毒感染后出现了免疫机制异常。SAT的甲状腺损伤似乎是细胞毒性T细胞识别病毒与宿主细胞膜抗原复合物的结果,细胞免疫反应可能在SAT的发病机制中发挥重要作用[1]。调节性T细胞(regulatory T-lymphocytes,Treg)在多种自身免疫性疾病的发生中起着重要的作用,它能够释放白细胞介素- 10(interleukin- 10,IL- 10)和转化生长因子β(transforming growth factor beta,TGF-β)来抑制T细胞及抗原呈递细胞的功能,降低炎性反应及抗体的产生,发挥免疫抑制效应。叉头蛋白3(Foxp3)作为Treg的特异性标志分子,在其调节免疫自稳中起着关键的作用。前列腺素E2(prostaglandin E2,PGE2)是一种炎性致痛因子,能抑制成纤维细胞的增殖分化及胶原的合成,对肿瘤坏死因子α和TGF-β致炎致纤维化产生负性影响[2]。本研究拟通过检测外周血中Treg的比例、炎性反应因子的水平以及SAT组织中Treg的分布情况,以探讨Treg在SAT发病的免疫机制中可能的作用。
1 材料与方法
1.1 材料
1.1.1 实验样本:用于Treg及细胞因子检测的SAT外周血为2016年1月至2016年12月在蚌埠医学院第一附属医院内分泌科门诊及住院部收集,均为初发患者,且半年内未使用影响免疫的药物。SAT 46例,男13例,女33例,年龄范围26~67岁,平均年龄(46.9±8.6)岁。对照组15名,为同期于体检中心收集的外周血标本,男4名,女11名,年龄范围27~62岁,平均年龄(43.4±11.8)岁。
用于Foxp3检测的SAT及对照者甲状腺标本分别来源于蚌埠医学院第一附属医院外科手术的SAT甲状腺组织和甲状腺腺瘤瘤旁正常甲状腺组织,均为石蜡包埋保存,并经病理确诊。其中,SAT 29例,男6例,女23例,年龄范围29~62岁,平均年龄(46.7±7.7)岁。对照组20名,男4名,女16名,年龄范围32~64岁,平均年龄(47.37±9.7)岁。
所有SAT病例均经临床表现、实验室检查、查体及影像学检查等确诊。符合2007年中国甲状腺疾病诊治指南中SAT的诊断标准[3]。标本采集已获得蚌埠医学院第一附属医院伦理委员会批准及受试者知情同意。
1.1.2 主要试剂:Treg检测试剂盒(Anti-CD25-FITC、Anti-CD4-PerCP、Anti-CD127-PE及IgG1-FITC,BD公司);小鼠抗人Foxp3单克隆抗体[236A/E7](Abcam公司);EnVision试剂盒(迈新试剂公司);ELISA试剂盒(IL- 10、TGF-β1及PGE2,Elabscience公司)。
1.2 方法
1.2.1 甲状腺功能、ESR及CRP的检测:用化学发光法检测甲状腺功能,用魏氏法检测血沉(erythrocyte sedimentation rate, ESR),用速率散色比浊法检测C反应蛋白(C reactive protein, CRP)。
1.2.2 外周血Treg比例的测定:清晨收集EDTA-K2抗凝血标本2 mL,6 h内进行流式细胞术测定。取2只试管,管1加入Anti-CD4-PerCP及IgG1-FITC各20 μL,管2加入Anti-CD4-PerCP和Anti-CD25-FITC各20 μL及Anti-CD127-APC 5 μL,2管分别加入全血100 μL混匀,置于35 ℃水浴箱避光孵育15 min;加入FACSLysing溶血液2 mL,水浴箱中避光孵育10 min;1 800 r/min离心5 min,弃上清;加入PBS 1 mL,1 800 r/min离心5 min,弃上清,加入PBS 1 mL,行流式细胞仪检测。以前向和侧向散射荧光设门,获取淋巴细胞,分析CD4+T细胞占淋巴细胞的比例。再获取CD4+T细胞,分析CD4+CD25+T细胞及CD4+CD25+CD127-Treg所占的比例。
1.2.3 外周血血清IL- 10、TGF-β1和PGE2的浓度测定:肝素钠抗凝管留取空腹血3 mL,1 000×g离心15 min得上清后置于-80 ℃冰箱冻存。分别用IL- 10、TGF-β1和PGE2的ELISA检测试剂盒对血清进行测定,严格按照说明书操作。
1.2.4 甲状腺组织中Foxp3表达的测定:多聚甲醛固定新鲜甲状腺组织,石蜡包埋;用HE染色及EnVision免疫组化染色法染色。切片机进行厚度4 μm切片,脱蜡,水化;抗原修复,高压锅沸腾2 min,自然冷却;过氧化物酶试剂阻断;1∶100配置小鼠抗人Foxp3单克隆抗体试剂,并滴加至玻片上;37 ℃恒温培养箱培养1 h;滴加酶标羊抗小鼠IgG聚合物;DAB显色2~3 min;苏木精复染液复染;脱水后封片剂封固。
判断标准[4]以光镜下淋巴细胞核出现棕黄色颗粒为Foxp3阳性细胞,以高倍镜不重复视野Foxp3阳性细胞数为判定标准,每个标本选择5个高倍视野,取平均值,平均值≤3为阴性,>3为阳性。
1.3 统计学分析

2 结果
2.1 甲状腺功能、ESR及CRP比较
SAT组TT3、TT4、FT3和FT4均高于对照组,TSH低于对照组,ESR和CRP高于对照组(P<0.05)(表1)。
2.2 SAT患者外周血Treg比例
SAT组CD4+CD25+CD127-Treg比例明显低于对照组(P<0.05)(表2,图1)。
2.3 血清中细胞因子IL- 10、TGF-β1和PGE2的浓度比较
SAT组血清中TGF-β1浓度明显高于对照组(P<0.05)(表3)。
2.4 甲状腺组织中Foxp3蛋白的表达
SAT组甲状腺组织中有Foxp3蛋白表达,细胞核染色表现为黄褐色颗粒,呈分散分布,少数灶性分布,与淋巴细胞浸润多少有关,且分布于T细胞分布区域。而甲状腺腺瘤组织及腺瘤旁正常甲状腺组织基本无Foxp3蛋白表达,仅少数病例表达阳性。SAT组Foxp3蛋白阳性率为72.41%,明显高于腺瘤组及对照组(P<0.0125)(表4, 图2)。
3 讨论
研究证实,SAT患者循环中存在直接针对TSHR的抗体,并证实存在针对甲状腺抗原的致敏T淋巴细胞[5]。一些针对免疫系统的新疗法会导致SAT,提示有免疫因素参与其中[6]。目前已知Treg在体内能够发挥免疫抑制作用,维持自身耐受及抑制抗肿瘤免疫反应。Treg的数量异常及功能缺陷在多种疾病的发病中起了重要的作用,如Graves病(Graves disease,GD)、丙型肝炎病毒(HCV)和桥本氏甲状腺炎(Hashimoto’s thyroiditis,HT)等。Graves病患者体内存在Treg数量减少或者功能的缺陷[7]。恢复期HCV慢性病患者的Treg数量与持续感染有关,其比例显著增加能够抑制HCV特异的CD8+T细胞[8]。人Treg可抑制T细胞对HIV和巨细胞病毒的抗原特异性免疫应答[9]。推测,慢性病毒感染将引起抑制抗病毒免疫的Treg产生。但是,Treg在SAT发生发展中的变化及意义如何?至今没有相关的研究报道。TGF-β1、IL- 10和PGE2均可诱导初始T细胞转化为Treg并表达Foxp3,在维持和增强Treg的免疫抑制作用中起着重要的作用[10- 12]。为探讨SAT发病中Treg转化率的变化以及影响Treg 转化的细胞因子的相应变化,进行了相关研究。

表1 SAT组与对照组甲状腺功能、ESR及CRP的比较Table 1 Comparison of thyroid function, ESR and CRP between SAT group and control group(±s)
*P<0.05 compared with control group.

表2 SAT组与对照组外周血Treg比例的比较Table 2 Comparison of proportion of Treg in peripheral blood between SAT group and control group(±s,%)
*P<0.05 compared with control group.

A.the proportion of CD4+CD25+T cells of SAT group; B.the proportion of CD4+CD25+T cells of control group; C.the proportion of CD4+CD25+CD127-Treg of SAT group; D.the proportion of CD4+CD25+CD127-Treg of the control group
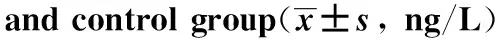
图1 SAT组与对照组外周血Treg比例的比较Fig 1 Comparison of proportion of Treg in peripheral blood between SAT group and control group
*P<0.05 compared with control group.

表4 SAT组、腺瘤组及对照组甲状腺组织中Foxp3蛋白的表达
#P<0.0125 compared with adenoma group;*P<0.0125 compared with control group.
实验结果显示,SAT组患者外周血中Treg明显降低。Treg降低后,免疫抑制作用减弱,易出现免疫紊乱。血浆中TGF-β1水平明显升高, 与外周血Treg减少相互矛盾,这在GD和HT中亦可见,可能与TGF-β1反馈性升高有关,以诱导CD4+CD25-T细胞转化为CD4+CD25+T细胞,减轻自身免疫反应[13]。

A.thyroid tissue of SAT; B.thyroid tissue of adenoma; C.thyroid tissue adjacent to adenoma图2 SAT组、腺瘤组及对照组甲状腺组织中Foxp3蛋白的表达
SAT组患者甲状腺组织中Foxp3蛋白表达明显增多,此与血液中Treg减少相悖,这在HT中亦曾被报道[14],可能为甲状腺产生免疫破坏后,血液中的Treg转移到甲状腺组织,从而增强病变部位的免疫抑制作用,以调节免疫机制紊乱。
推测SAT发病的机制可能为病毒感染诱发了免疫机制异常,Treg减少,对T细胞及抗原呈递细胞的抑制作用减弱,1型T辅助细胞与细胞毒性T细胞活性增高,破坏甲状腺滤泡,导致SAT的发生[1,15]。本研究证实,Treg减少可能是SAT发病的始动因素,当免疫炎性反应剧烈时,可伴有代偿性的TGF-β1升高,至于TGF-β1升高以后会不会及时地上调Treg的分化和成熟,产生免疫保护作用及其在SAT转归中的作用机制,是下一步的研究方向。
[1] Kojima M, Nakamura S, Oyama T,etal. Cellular composition of subacute thyroiditis. An immunohistochemical study of six cases[J]. Pathol Res Pract, 2002, 198: 833- 837.
[2] 龙翔, 熊盛道, 熊维宁, 等. 前列腺素E_2抑制转化生长因子-β1诱导的人胚肺成纤维细胞转分化及胶原合成[J]. 中国病理生理杂志, 2008, 24: 925- 930.
[3] 滕卫平, 曾正陪, 李光伟. 中国甲状腺疾病诊治指南[J]. 中华内科杂志, 2007, 46: 876.
[4] 赵纹芸, 沈坤炜, 包家林, 等. Foxp3在乳腺癌组织中的表达及其临床意 义[J]. 中国肿瘤生物治疗杂志, 2011, 18: 533- 538.
[5] 廖二元, 莫朝辉, 张红, 等. 内分泌与代谢性疾病上册[M]. 第3版. 北京:人民卫生出版社, 2012: 497.
[6] 曲卫, 李美晔, 王静, 等. 注射甲型H1N1流感疫苗引起亚急性甲状腺炎1例报告[J]. 标记免疫分析与临床, 2014,21: 489- 491.
[7] 何珂, 胡蕴, 毛晓明. Graves病患者外周血免疫调节细胞及其亚群比例异常[J]. 细胞与分子免疫学杂志, 2014, 30: 1190- 1193,1197.
[8] Sugimoto K, Ikeda F, Stadanlick J,etal. Suppression of HCV-specific T cells without differential hierarchy demonstratedexvivoin persistent HCV infection[J]. Hepatology, 2003, 38: 1437- 1448.
[9] Aandahl EM, Micha⊇lsson J, Moretto WJ,etal. Human CD4+CD25+regulatory T cells control T-cell responses to human immunodeficiency virus and cytomegalovirus antigens[J]. J Virol, 2004, 78: 2454- 2459.
[10] Murai M, Turovskaya O, Kim G,etal. Interleukin 10 acts on regulatory T cells to maintain expression of the transcription factor Foxp3 and suppressive function in mice with colitis[J]. Nat Immunol, 2009, 10: 1178- 1184.
[11] Liu Y, Zhang P, Li J,etalA critical function for TGF-beta signaling in the development of natural CD4+CD25+Foxp3+regulatory T cells[J]. Nat Immunol, 2008, 9: 632- 640.
[12] Karavitis J, Hix LM, Shi YH,etal. Regulation of COX2 expression in mouse mammary tumor cells controls bone metastasis and PGE2-induction of regulatory T cell migration[J]. PLoS One, 2012, 7: e46342. doi: 10. 1371/journal. pone. 0046342.
[13] 郑领涛, 于世鹏, 王娜, 等. 调节性T细胞和TGFβ_1在自身免疫性甲状腺疾病中的作用[J]. 山东医药, 2012, 52: 81- 82.
[14] 王荣, 张健, 秦秋, 等. Foxp3在自身免疫性甲状腺病患者外周血和病变组织中的表达[J]. 西安交通大学学报:医学版, 2012, 33: 56- 60.
[15] Kramer AB, Roozendaal C, Dullaart RPF. Familial occurrence of subacute thyroiditis associated with human leukocyte antigen-B35[J]. Thyroid, 2004, 14: 544- 547.

