外源脯氨酸对不同玉米自交系耐盐性的影响研究
王宇州
(兵团第四师六十四团,新疆 伊犁 835100)
0 引言
世界约20%的耕地和50%左右的灌溉耕作土地受到盐分的不良影响[1]。土壤盐碱化是限制农业生产的一个重要因素[2]。盐胁迫对植物造成的伤害包括光合作用受阻、活性氧过量产生、生长受抑制等,在盐胁迫下,植物的氮素同化能力降低,植物硝酸还原受到影响,造成植株氮代谢紊乱[3]。我国每0.67亿hm2耕地中就有10%为盐渍化土壤。干旱及不合理耕作等因素导致了耕地次生盐渍化的日益加重,土壤盐渍化已成为限制农作物产量进一步提高的重要环境因子之一。
玉米是重要的粮食、饲料和工业原料作物,也是世界上种植最广泛的作物之一。玉米生育期内对盐碱、干旱较为敏感[4]。为了提高作物产量,解决世界粮食问题,选育耐盐作物品种是最佳途径,进行作物耐盐性研究已成趋势。从20世纪30年代开始,人们就将开发利用盐碱地的研究转移到采取生物学措施,即大力从事植物抗盐性研究,探讨植物抗盐、耐盐机理,培育抗盐、耐盐植物及作物品种,直接利用盐碱地成为未来农业发展的重大课题。许多专家致力于玉米耐盐性研究,无论在盐胁迫伤害机理方面还是在耐盐机制上都取得了一定的进展[5]。
脯氨酸分子量低,水溶性高,在生理pH下无静电荷是它最主要的特点;脯氨酸作为一种重要的细胞渗调物质优先储存在植物液泡中,当细胞受到渗透胁迫时将脯氨酸运至细胞质,通过增大细胞质浓度,降低渗透势,使细胞在低渗条件下仍能吸收胞外水分,从而保持细胞原生质与外界环境的渗透平衡[6]。逆境胁迫下,植物细胞膜透性和MDA含量明显增加[7-8],自由基产量也明显增加[9-11],而植物体内pro的累积与植物的抗氧化作用密切相关[12-13]。通过作物盐害和耐盐机理的研究表明,利用化学调控手段是提高作物耐盐性的有效措施之一[14]。在水分渗透胁迫或盐胁迫下添加不同的外源脯氨酸能明显改善植物的生理特性,减轻逆境胁迫对植物的伤害[15]。在脯氨酸对作物耐盐性影响方面,颜志明等[16]研究表明,外源脯氨酸可以通过调节甜瓜幼苗体内硝酸还原酶活性和氮化合物含量来缓解盐胁迫对甜瓜幼苗植株的伤害。陈晓云等[17]的研究表明,外源pro可明显改善盐胁迫下荞麦幼苗的生理特性,对盐胁迫具有较好的缓解作用。关于外源脯氨酸对作物耐盐性的影响报道很多,然而目前外源脯氨酸对玉米耐盐性影响的研究还较少。本研究以81162、8723、P138等为材料研究外源脯氨酸在盐胁迫下对不同玉米自交系的影响,旨在为玉米耐盐生理研究及提高玉米耐盐性方面提供一定的依据。
1 材料与方法
1.1 供试材料
以本课题组前期筛选出的玉米盐敏感自交系P138和耐盐自交系81162、8723为试验材料,材料由甘肃农业大学玉米课题组提供。
1.2 试验方法
1.2.1 试验材料预处理
挑选饱满一致、无破损的种子,经0.1%NaCl消毒10 min后,用蒸馏水冲洗干净,于25℃下在蒸馏水中吸胀24 h,备用。
1.2.2 最佳外源脯氨酸浓度筛选
本阶段采用盐敏感自交系P138为材料进行pro浓度筛选。将经过上述方法预处理的盐敏感自交系P138种子分为2份,一份用于萌发期,一份用于苗期。萌发期用发芽盒在人工气候箱中培养,设3次重复每个重复设5组,即NaCl+50 μmol/L pro;NaCl+150 μmol/L pro;NaCl+250 μmol/L pro;NaCl+350 μmol/L pro;NaCl+450 μmol/L pro,每个发芽盒中种16粒种子。设置对照组,分别记为CK1(只加蒸馏水)、CK2(只加 200 mmol/L NaCl溶液),其余条件均与实验组相同。播种后在植物生长室培养,生长室的昼夜温度为25±2℃和20±2℃,每天光照12 h,光照强度为600 μmol/(s·m2),相对湿度 60%—80%,定时定量浇水。苗期用15 cm×13 cm的花盆进行培养,每个花盆中放400 g蛭石跟100 mL溶液混合均匀,处理同上,每个花盆中种9粒种子。
1.2.3 外源pro对不同玉米自交系耐盐性的影响
将准备好的种子同上述方法,在相同条件下种植,萌发期跟苗期都设3次重复,每个重复设3组处理,即CK1(只加蒸馏水)、CK2(只加200 mmol/L NaCl溶液)和最佳脯氨酸浓度(加NaCl跟250 μmol/L pro 的混合液)。
1.3 指标测定
1.3.1 萌发期指标测定
从第2 d起,每天统计发芽数(以芽长超过种子长度1/2或根长等于种子长度为发芽标准),并统计第3 d时的发芽势 (发芽势 =3 d发芽种子数/供试种子数 ×100%)和第7 d时的发芽率(发芽率 =7 d发芽种子数/供试种子数 ×100%)、胚芽长、胚根长、胚芽重、胚根重、胚芽干重和胚根干重等指标。
1.3.2 苗期指标测定
待幼苗长至三叶期时,测定株高、根长、地上部鲜重、地下部鲜重、地上部干重和地下部干重等。生理指标的测定参照张宪政主编的《植物生理研究技术》。测定相对含水量、相对电导率、丙二醛、脯氨酸、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)等指标,观察变化。
1.4 统计与分析
所有数据使用统计软件SPSS16.0和Excel 2007进行处理。实验结果用3次重复的平均值±标准偏差(SD)表示。采用Duncan进行差异显著性多重比较,对各处理间的差异显著性进行分析。
2 结果与分析
2.1 最佳外源pro浓度筛选
由图1至图4可知,盐胁迫下萌发期胚芽长、胚根长、胚芽鲜重、胚根鲜重、胚芽干重、胚根干重等都随添加外源pro浓度的增加呈先增后减的趋势,在250 μmol/L处,只加蒸馏水的对照组各项值都小于对照组,但大于其他浓度下的值,说明250 μmol/L是盐胁迫下萌发期适合P138生长的最佳pro浓度。
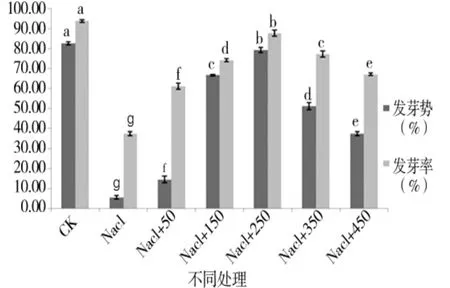
图1 外源pro处理下萌发期发芽势跟发芽率的变化Figure 1 Changes in germination and germination rate in germination stage of external source pro
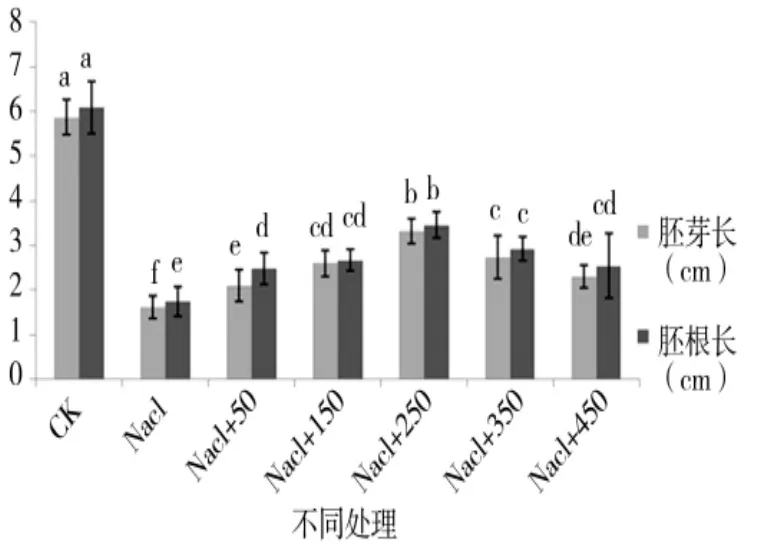
图2 外源pro处理下萌发期胚根长跟胚芽长的变化Figure 2 Changes of the embryo root length and germ length in the germination period of external source pro
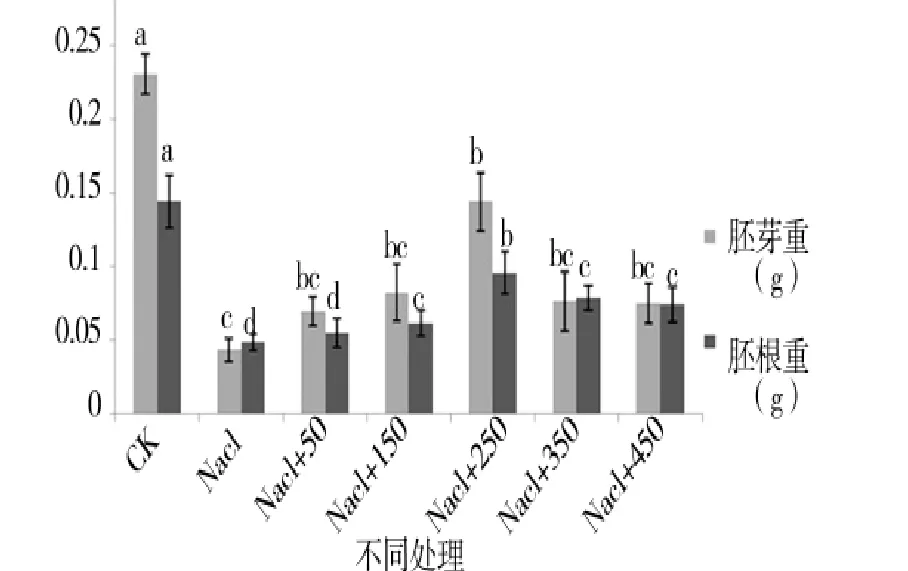
图3 外源pro处理下萌发期胚芽重跟胚根重的变化Figure 3 Changes of the embryo root weight and germ weight in the germination period of external source pro
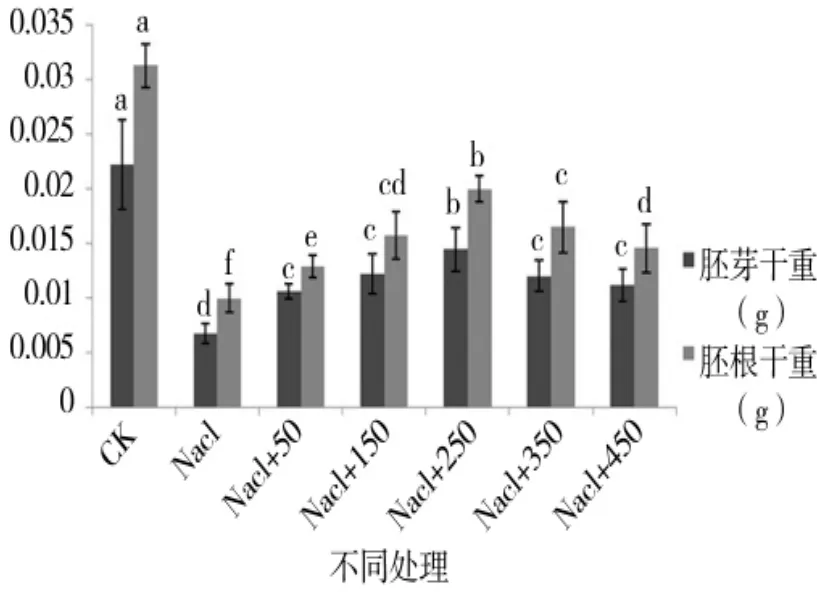
图4 外源pro处理下萌发期胚芽干重跟胚根干重的变化Figure 4 Changes of the embryo root dry weight and germ dry weight in the germination period of external source pro
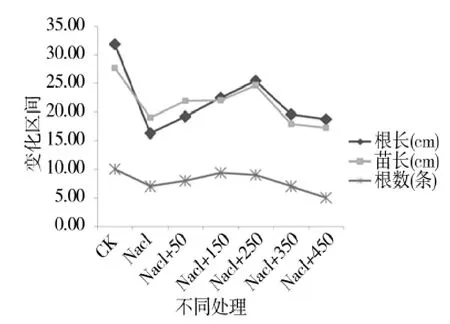
图5 不同处理下根长、苗长和根数的变化Figure 5 Change of root length,seedling and root num ber of different treatments
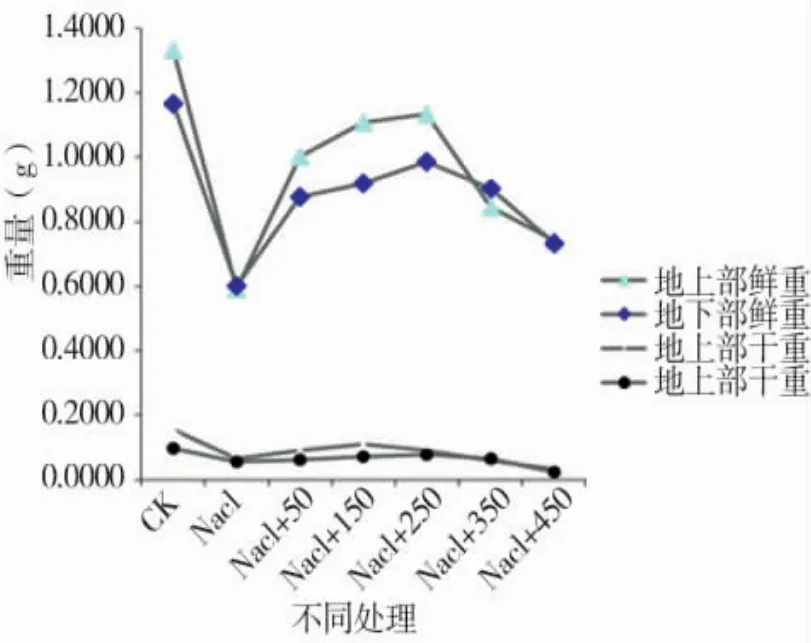
图6 不同处理下苗期形态指标的变化Figure 6 Changes in the morphological indexes of seedling stage different treatments
由图 5、图 6可知,苗期根长、苗长、根数、地上部鲜重、地下部鲜重、地上部干重、地下部干重等都随添加pro浓度的增大呈先增后减的趋势,在250 μmol/L处略小于CK,但与其他浓度相比有最大值。由图7可知,苗期叶片相对含水量在250 μmol/L处有最大值,并且与对照无显著性差异,由图8可知电导率在250 μmol/L处有最小值,且与对照之间无显著性差异。由图10可知在250 μmol/L处MDA有最小值且接近对照,以上指标都说明250 μmol/L pro最适合P138苗期生长。pro、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)等对植物逆境胁迫都有缓解作用,在逆境下会有不同程度升高,由图9、图11至图13可知,在添加250 μmol/L外源pro条件下,P138在200 mmol/L NaCl胁迫下这些酶含量跟其他浓度相比都有最大值,并且明显高于对照组,虽然其他浓度下对P138的生长都有不同程度的缓解作用,但在 250 μmol/L处缓解作用最好,说明250 μmol/L外源 pro浓度是适合 P138在 200 mmol/L NaCl条件下生长的最佳外源脯氨酸浓度。
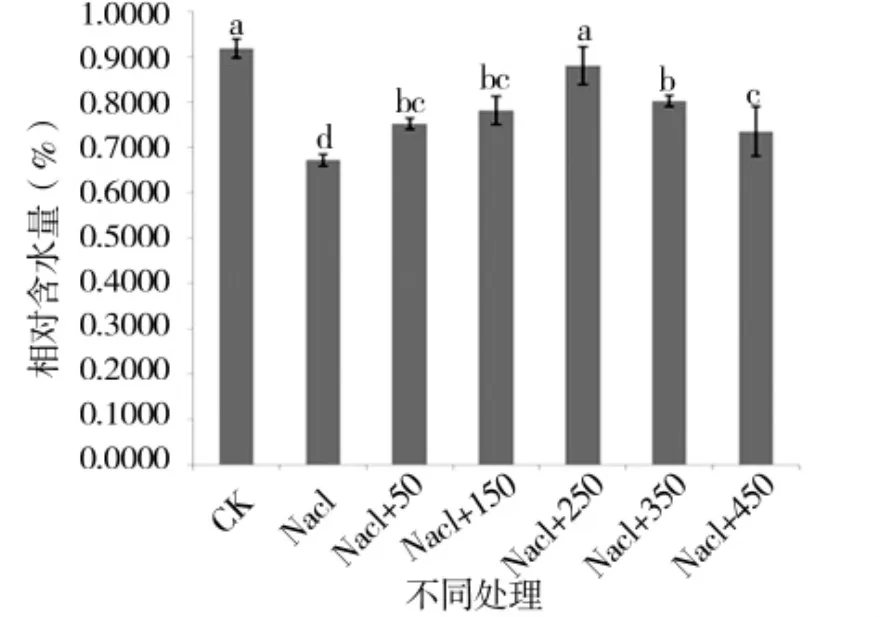
图7 外源pro处理下苗期相对含水量的变化Figure 7 Changes in relative watercontentofthe seedling period under external source pro
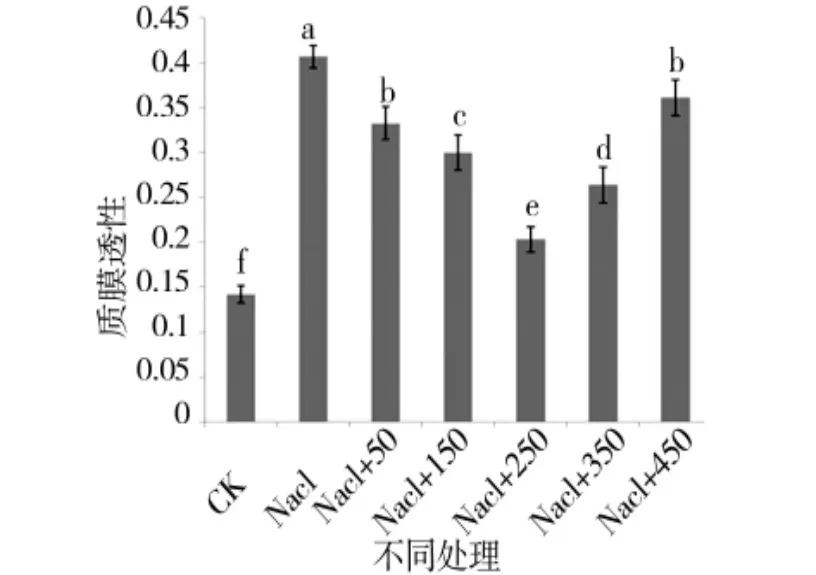
图8 外源pro处理下苗期质膜透性的变化Figure 8 Changes in the membrane permeability of the seedling stage with external source pro
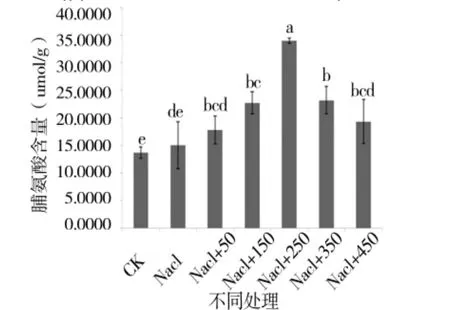
图9 外源pro处理下苗期pro含量变化Figure 9 Changes in pro of the seedling period under external source
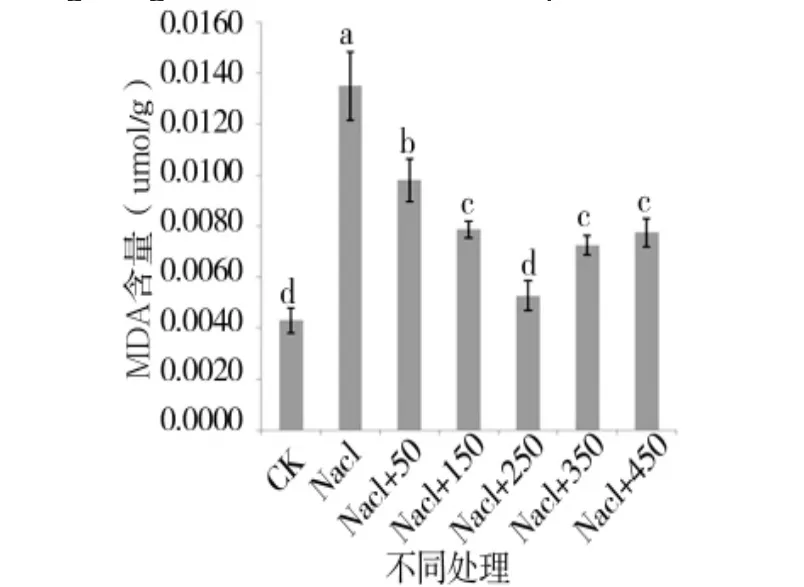
图10 外源pro处理下苗期MDA含量变化Figure 10 Changes in MDA of the seedling period under external source pro
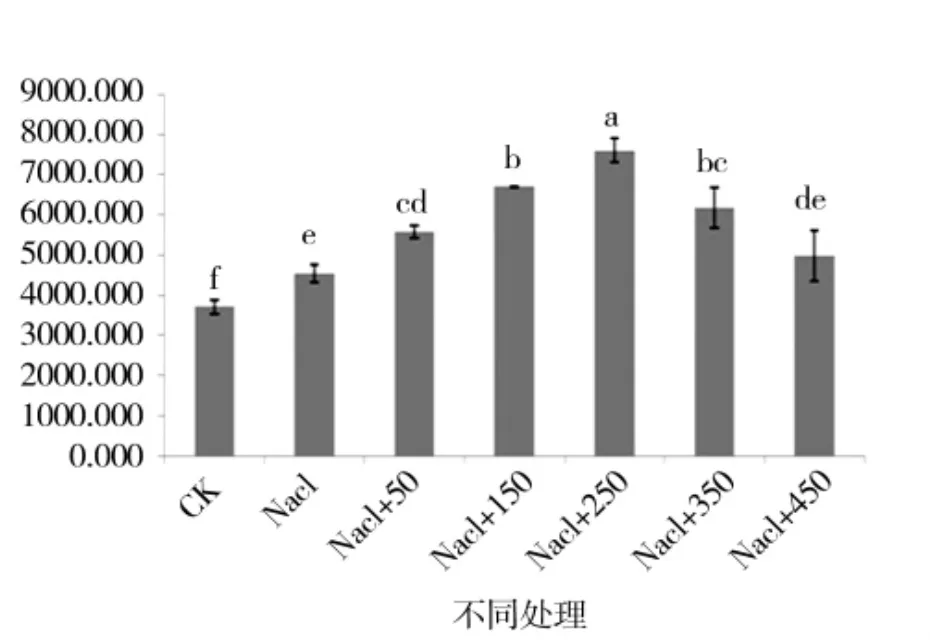
图11 外源pro处理下苗期POD活性变化Figure 11 Changes in POD of the seedling period under external
2.2 外源 pro对 P138、81162、8723在盐胁迫下影响的差异
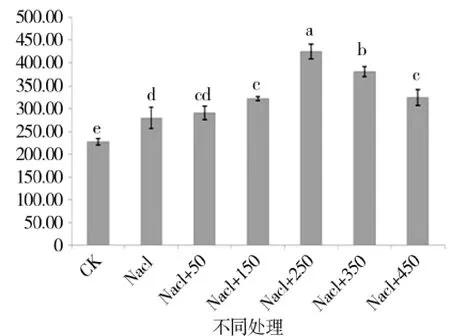
图12 外源pro处理下苗期SOD活性变化Figure 12 Changes in SOD of the seedling period under external source pro
由图14至图16可知,在最佳外源pro浓度处理时,200 mmol/L NaCl胁迫下,盐敏感自交系P138、耐盐自交系81162和8723萌发期各项形态指标都大于只加NaCl的对照组并且跟对照组之间存在显著差异,并且8723和81162的各项值都略小于P138,而3个品种的各项形态指标都较只加蒸馏水的对照组小,说明最佳外源pro对不同玉米自交系萌发期在盐胁迫下都有缓解作用,并且对盐敏感自交系的缓解作用略大于耐盐自交系。
由图17、图18可知,苗期实验组相对含水量和质膜透性差异不明显,但是各实验组的相对含水量都大于只加NaCl的对照组,而质膜透性小于对照组,由图19可知,P138的MDA含量略高于81162跟8723,3个品种的MDA含量都低于只加NaCl的对照组。由图20可知,P138的pro含量略低于81162和8723,3个品种的pro含量都高于只加NaCl的对照组,并且跟对照组之间存在显著差异。
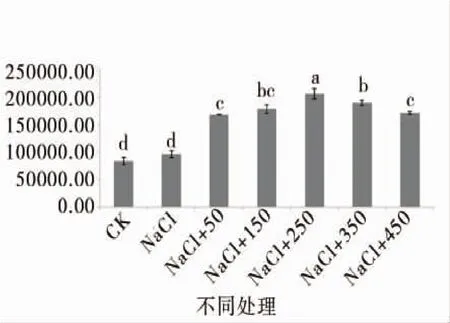
图13 外源pro处理下苗期CAT活性变化Figure 13 Changes in CAT of the seedling period under external
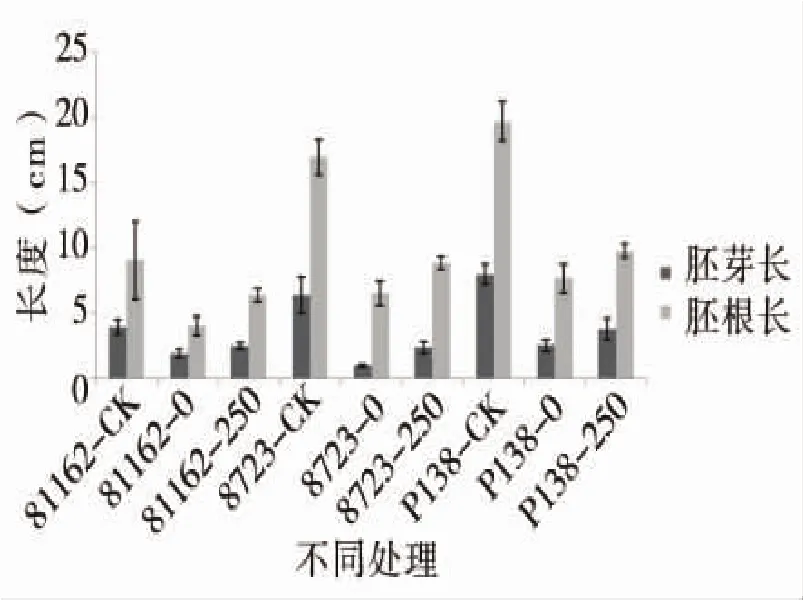
图14 最佳外源pro处理下萌发期胚芽长跟胚根长的变化Figure 14 Changes of germ length and radicle length in germination stage of the best exogenous pro
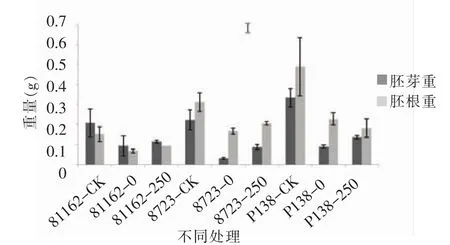
图15 最佳外源pro处理下萌发期胚芽重跟胚根重的变化Figure 15 Changes of germ weight and radicle weight in germination stage of the best exogenous pro
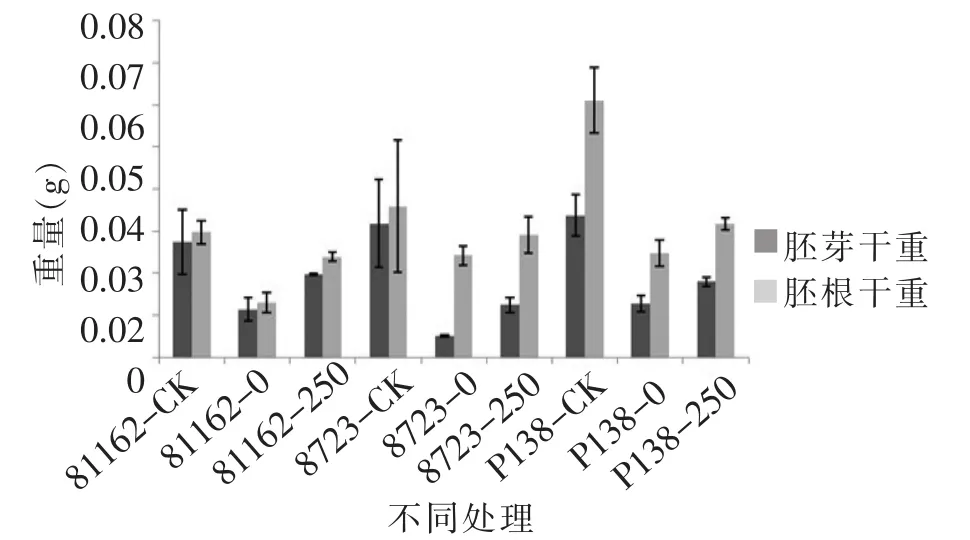
图16 最佳外源pro处理下萌发期胚芽干重跟胚根干重的变化Figure 16 Changes of germ dry weight and radicle dry weight in germination stage of the best exogenous pro
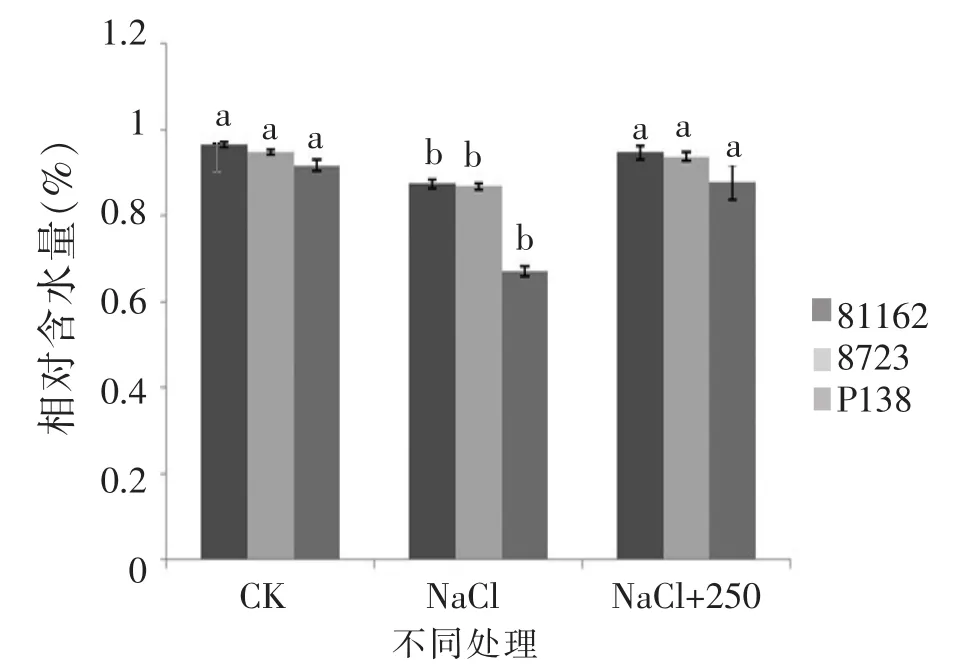
图17 最佳外源pro处理下苗期相对含水量的差异Figure 17 The difference between the relative water con tent in the seedling stage of the best exogenous pro
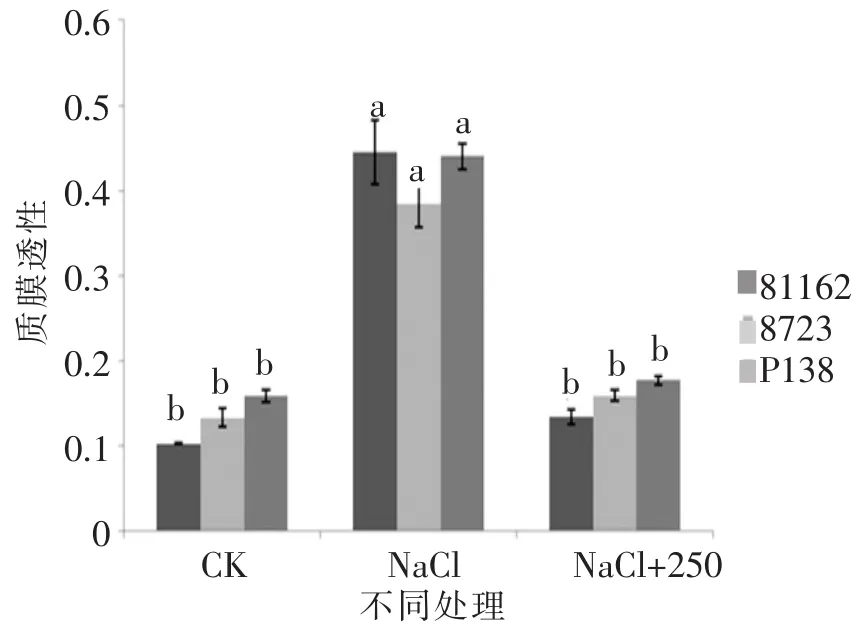
图18 最佳外源pro处理下苗期质膜透性的差异Figure 18 The difference between the plasmalemma per meability in the seedling stage of the best exogenous pro
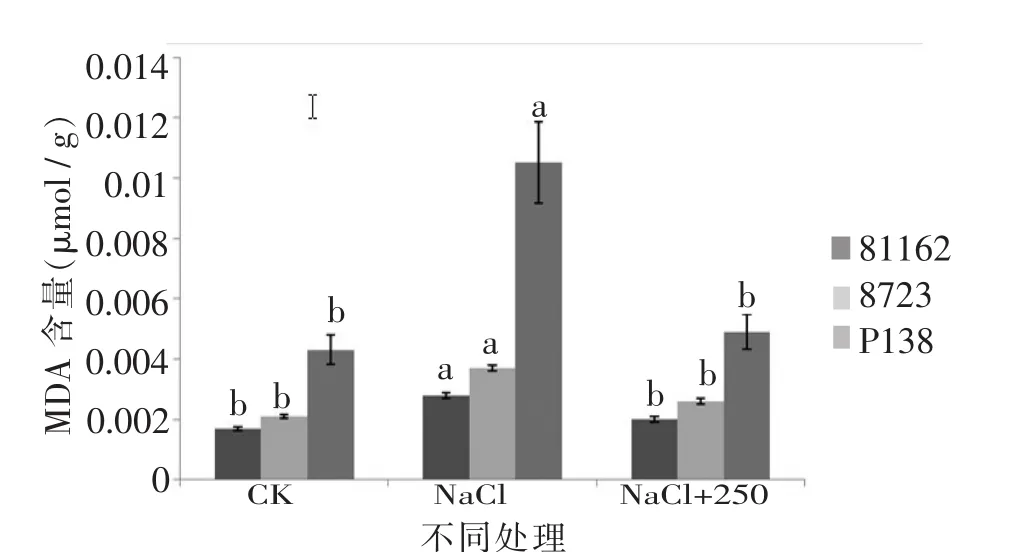
图19 最佳外源pro处理下苗期MDA含量的差异Figure 19 The difference between the MDA contents in the seedling stage of the best exogenous pro
由图 21和图 23可知,P138的 SOD和 POD活性均略低于8723,并且3个品种的两种酶活性都大于只加NaCl的对照组,并且存在显著差异。由图22可知,3个品种的CAT活性与只加NaCl的对照组相比实验组各项指标都大于对照组,并且差异显著。以上各项指标的变化说明最佳外源pro对苗期不同玉米自交系在盐胁迫下都有缓解作用,并且对盐敏感自交系P138的缓解作用略大于耐盐自交系81162和8723。
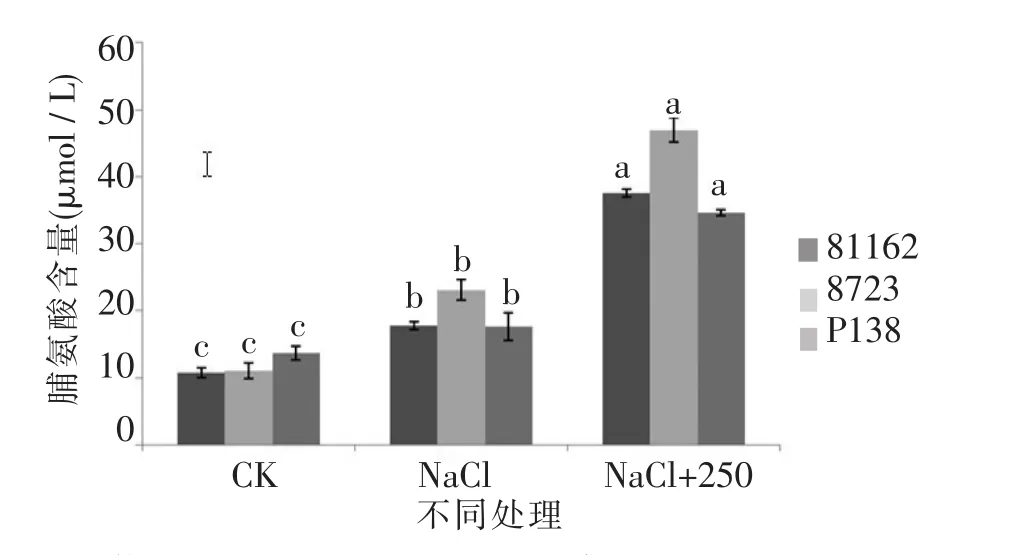
图20 最佳外源pro处理下苗期pro含量差异Figure 20 The difference between the pro contents in the seedling stage of the best exogenous pro
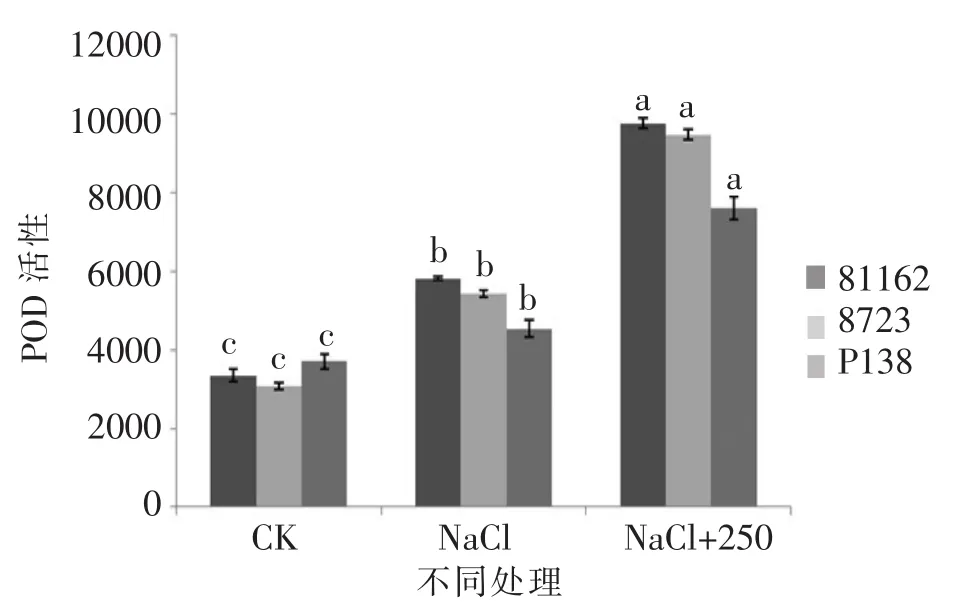
图21 最佳外源pro处理下苗期POD活性差异Figure 21 The difference between the POD activation in the seedling stage of the best exogenous pro
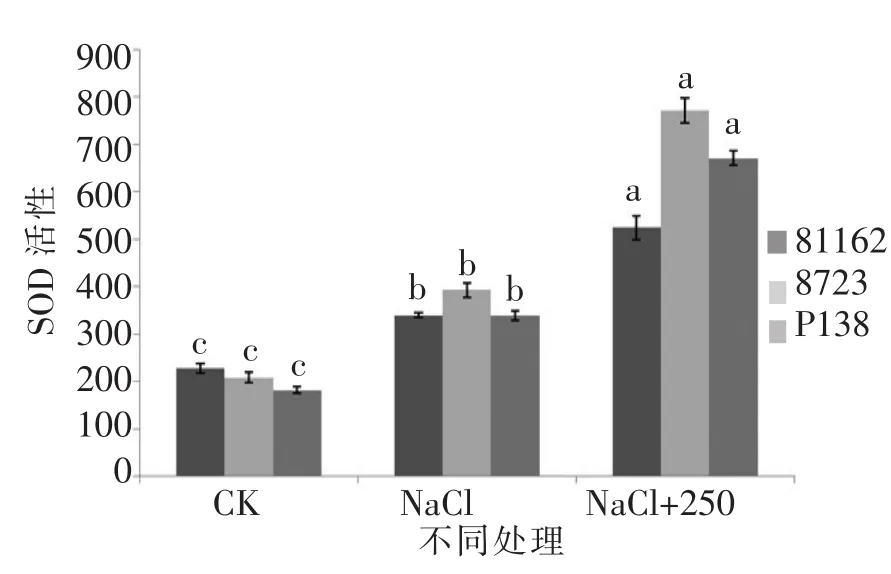
图22 最佳外源pro处理下苗期SOD活性差异Figure 22 The difference between the SOD activation in the seedling stage of the best exogenous pro
3结论与讨论
通过对不同玉米自交系萌发期各项形态指标的比较分析发现,外源pro可以不同程度的缓解盐胁迫下玉米自交系的伤害程度,并且在200 μmol/L外源脯氨酸处理时缓解作用最好。同时对不同耐盐自交系的缓解幅度略有不同,其中对盐敏感自交系P138的缓解幅度略大于耐盐自交系8723和 81162。
本研究中不同浓度pro处理可显著降低盐胁迫下不同玉米自交系苗期叶片的质膜透性和MDA含量,特别是250 μmol/L外源pro处理的效果最为明显,并且对耐盐自交系的缓解作用略大于盐敏感自交系。说明适当浓度的外源pro处理可明显降低玉米叶片质膜损伤和膜脂过氧化伤害作用,对不同耐盐自交系叶片细胞膜都具有较好的保护作用,并且苗期对耐盐自交系的保护作用略大于盐敏感自交系。该结论与郭启芳等[19-20]研究具有相似的结论,郭启芳等研究表明,在盐胁迫下添加外源甜菜碱处理可明显降低小麦幼苗的MDA含量,说明甜菜碱对盐胁迫诱导的膜脂过氧化起到一定缓解作用。
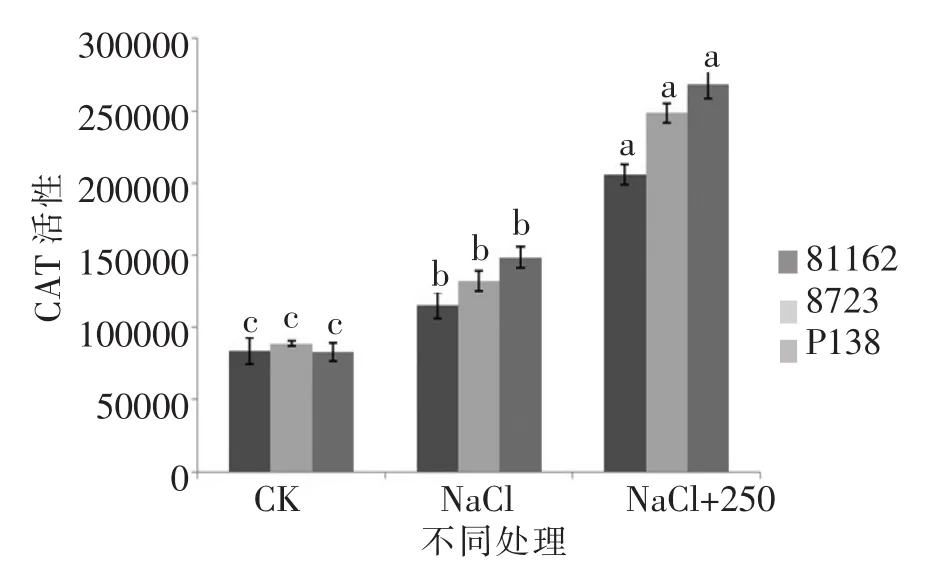
图23 最佳外源pro处理下苗期CAT活性差异Figure 23 The difference between the CAT activation in the seedling stage of the best exogenous pro
Alia等[21]研究发现,锌胁迫下芥菜和绿豆体内自由基的产量增加,同时脯氨酸大量累积,脯氨酸累积与自由基的非酶促清除之间有一定相关性;研究表明,氧化胁迫和水分胁迫均可引起水稻幼苗体内脯氨酸大量积累,且积累的脯氨酸具有明显的抗氧化用。本研究中不同浓度pro处理可增加盐胁迫下不同玉米自交系叶片SOD、POD和CAT活性,特别是250 μmol/L pro处理对增加玉米叶片SOD、POD和CAT活性的效果最为明显,而且耐盐自交系81162跟8723增加的幅度略大于盐敏感自交系P138,说明适当浓度的外源pro处理可明显降低盐胁迫下不同玉米自交系叶片的质膜透性和MDA含量,明显提高玉米叶片的SOD、POD、CAT活性,有效地改善盐胁迫下玉米幼苗的生理特性,使玉米幼苗更加适应盐胁迫环境,并且对耐盐自交系的改善作用略大于盐敏感自交系。
[1]Zhu J K.Plant salt to lerance.Trends Plant Sci,2001,2:66-71.
[2]Munns R.Comparative physiology of salt and water stress.Plant Cell Environ,2002,25:239-250.
[3]王志强,丁立,徐晋豫,等.蔗糖预处理对盐胁迫小麦幼苗氮同化的影响.河南农业大学学报,2008,42(3):268-276 Wang Z Q,Ding L,Xu J J,et al.Effects of pretreatment of sucrose pretreatmenton nitrogen assimilation ofwheat seedlings in salt stress.Journal of Henan Agricultural Univ er-sity,2008,42(3):268-276.(in Chinese)
[4]张永峰,殷波.玉米耐盐性研究进展.玉米科学,2008,16(6):83-85.Zhang Y F,Yin B.Research progress in salt resistance of maize.Journal of Maize Sciences,2008,16(6):83-85.
[5]段显得,周波,杨国会,等.玉米耐盐性研究.通化师范学院学报,2001(2):67-69.Duan X B,Zhou B,Yang G H,et al.Research on salt tolerance of maize.Journal of Tonghua Normal University,2001(2):67-69.(in Chinese)
[6]汤章城.逆境条件下植物脯氨酸的累积及其可能的意义.植物生理学通讯,1984(1):15-21.Tang Z C.The accumulation of proline and its possible significance under adverse conditions.Plant Physiology Communication,1984(1):15-21.(in Chinese)
[7]李锦树,王洪春,王文英,等.干早对玉米叶片细胞膜透性及膜脂的影响.植物生理学报,1983,9(3):223-229.Li J S,Wang H C,Wang W Y,et al.Effects of dry early on membranepermeabilityand membranelipid in maize leaves.Journal of Plant Physiology,1983,9 (3):223-229.(in Chinese)
[8]林植芳,李双顺,林桂珠,等.水稻叶片的衰老与超氧物歧化酶活性及脂质过氧化作用的关系.植物学报,1984,26(6):605-615.Lin Z F,Li S S,Lin G Z,et al.The relationship between the aging of rice leaf and the activity of superoxide dismutase and lipid peroxidation.Journal of Botany,1984,26(6):605-615.(in Chinese)
[9]李文卿,潘廷国,柯玉琴,等.土壤水分胁迫对甘薯苗期活性氧代谢的影响.福建农业学报,2000,15(4):45-50.LiW Q,Pan T G,Ke Y Q,et al.Effects of soil water stress on active oxygen metabolism in sweet potato seedling stage.Agricultural Journal of Fujian,2000,15 (4):45-50.(in Chinese)
[10]Kalir A,Poljakoff Mayber A.Changes in activity of malatedehydrogenase,catalase,peroxidase and superoxide dismutase inleaves of Halimione portulacoides (L.) aellen exposed to highsodium chloride concentrations.Annals of Botany,1981,47(1):75-85.
[11]Alia,Prasad K V S K,Saradhi P P.Effect of zinc on free radicalsand proline in Brassica and Cajanus.Phytochem istry,1995,39(1):45-47.
[12]蒋明义,郭绍川,张学明.氧化胁迫下稻苗体内积累的脯氨酸的抗氧化作用.植物生理学报,1997,23(4):347-352.Jiang M Y,Guo S C,Zhang X M.Antioxidant effects of proline accumulation in rice seedlings under oxidative stress.Journal of Plant Physiology,1997,23 (4):347-352.(in Chinese)
[13]蒋明义.水分胁迫下植物体内OH的产生与细胞的氧化损伤.植物学报,1999,41(3):229-234.Jang M Y.Under water stress in plant OH generation and cell oxidative damage.Acta Botanica Sinica,1999,9(3):229-234.(in Chinese)
[14]任艳芳,何俊瑜.外源SA对盐胁迫下莴苣种子萌发和幼苗生长的影响.北方园艺,2008(11):11-13.Ren Y F,He J Y.Effects of foreign SA on seed germination and seedling growth of lettuce seeds under salt stress.Northern Horticulture,2008(11):11-13.(in Chinese)
[15]董桃杏,蔡昆争,张景欣,等.茉莉酸甲酯(MeJA)对水稻幼苗的抗旱生理效应.生态环境,2007,16(4):1 261-1 265.Dong T X,Cai K Z,Zhang J X,et al.Effects of MeJA on drought resistance of rice seedlings.Ecological Environ-ment,2007,16(4):1 261-1 265.(in Chinese)
[16]颜志明,孙锦,郭世荣.外源脯氨酸对盐胁迫下甜瓜幼苗硝酸还原的影响.植物科学学报,2011,29(1):118-123.Yan Z M,Sun J,Guo S R.Effects of exogenous proline on the nitrate reduction of melon seedling under saltstress.Journal of Plant Science,2011,29 (1):118-123.(in Chinese)
[17]陈晓云,杨洪兵.外源脯氨酸对荞麦幼苗耐盐性的效应.中国农学通报,2012,28(36):92-95.Chen X Y,Yang H B.Effects of exogenous proline on salt resistance of buckwheat seedlings.Chinese Agronomy Bulletin,2012,28(36):92-95.(in Chinese)
[18]周建刚,丁少丽,袁金友,等.Nacl胁迫对苎麻叶片中SOD、POD及CAT活性的影响.武汉科技学院学报,2007,20(4):35-37.Zhou J G,Ding S L,Yuan J Y,et al.Nacl stresses the in fluence of SOD,POD and CAT activity in ramie leaves.Journal of Wuhan Institute of Technology,2007,20(4):35-37.(in Chinese)
[19]李杰,陈康,唐静,等.NaCl胁迫下玉米幼苗中一氧化氮与茉莉酸积累的关系.西北植物学报,2008,28(8):1629-1636.Li J,Chen K,Tang J,et al.The relationship between nitric oxide and jasmonic acid accumulation inmaize seedlings under NaCl stress.Journal of Northwest Plants,2008,28(8):1629-1636.(in Chinese)
[20]郭启芳,马千全,孙灿,等.外源甜菜碱提高小麦幼苗抗盐性的研究.西北植物学报,2004,24(9):1 680-1 686.Guo Q F,Ma Q Q,Sun C,et al.A study on the salinity of wheat seedling by yuxi yu-beet.Journal of Northwest Plants,2004,24(9):1 680-1 686.(in Chinese)
[21]Alia,Prasad K V S K,Saradhi P P.Effect of zinc on free radicals and proline in Brassica and Cajan.Phytochemistry,1995,39(1):45-47.

