脊尾白虾血蓝蛋白大亚基基因的克隆及表达分析
窦全伟 李吉涛, 刘 萍, 李 健, 刘九美孙东方 蔡 影 环朋朋
(1. 大连海洋大学水产与生命学院, 大连 116023; 2. 中国水产科学研究院黄海水产研究所, 农业部海洋渔业可持续发展重点实验室, 青岛 266071; 3. 青岛海洋科学与技术国家实验室, 海洋渔业科学与食物产出过程功能实验室, 青岛 266235)
脊尾白虾(Exopalaemon carinicauda)又名小白虾、五须虾、迎春虾等, 隶属甲壳纲(Crustacea)、十足目(Decapoda)、长臂虾科(Palaemonidae)、白虾属(Exopalaemon), 系热温带海区底栖虾类, 分布于中国大陆沿岸和朝鲜半岛西岸的浅海低盐水域,以黄渤海产量最高, 具有繁殖周期长、生长速度快、环境适应性广、食性杂、经济价值高等优点[1,2],成为沿海滩涂地区重要的特色水产养殖品种。
近20年来, 随着池塘养殖规模的迅速扩大, 脊尾白虾显示出明显的养殖前景, 然而细菌及病毒疾病的爆发给虾类养殖造成了严重的经济损失, 针对虾类非特异性免疫防御机制的研究正在广泛开展[3]。研究表明, 血蓝蛋白不仅具有输氧功能, 而且还具有酚氧化物酶活性[4]、抗病毒活性[5]、凝集活性[6]和抑菌活性[7]等多种免疫学功能, 被认为是一种具有多种非特异性免疫活性的多功能蛋白。目前, 随着对甲壳动物血蓝蛋白功能的深入研究, 其cDNA序列已相继被克隆[8—10]。研究表明凡纳滨对虾(Litopenaeus vannamei)具有大小两个血蓝蛋白亚基[11],且感染哈维氏弧菌后的血蓝蛋白mRNA的表达量呈上调趋势[12]。脊尾白虾血蓝蛋白基因小亚基的克隆工作已经完成[10], 而大亚基的研究未见报道。本研究通过RACE技术(Rapid Amplification of cDNA Ends)克隆了脊尾白虾血蓝蛋白大亚基基因的cDNA全长, 并分析了金黄色葡萄球菌、副溶血弧菌及白斑综合征病毒(WSSV)感染后该基因的表达变化, 为进一步深入了解血蓝蛋白基因在免疫防御中作用奠定基础。
1 材料与方法
1.1 材料
取体长(4.5±0.25) cm、(2.19±0.42) g的健康脊尾白虾, 饲养于200 L的PVC桶中, 暂养7d进行实验,实验期为3d。选取暂养的健康脊尾白虾1200尾(每桶100尾)分为4个组, 设金黄色葡萄球菌感染组、副溶血弧菌感染组、WSSV感染组和对照组, 每组3个平行, 分别进行细菌感染和病毒感染实验。
菌悬液的制备配制2216E (液体成分: 蛋白胨母膏, 磷酸高铁; 固体成分加琼脂粉)和胰蛋白大豆肉汤(TSB)液体及固体培养基, 灭菌备用。将副溶血弧菌(Vibrio parahaemolyticus)菌种(本实验室保存)接种于2216E液体培养基中, 28℃培养过夜。于2216E固体培养基上划线纯化1次; 选取单菌落接种于2216E液体培养基中, 28℃ 200 r/min摇床上培养8—10h, 使活菌数在108CFU/mL左右。将菌悬液离心, 弃上清液, 用生理盐水对菌体进行反复洗涤,重悬后, 使菌体的浓度达108CFU/mL。
将金黄色葡萄球菌(Stphylococcus aureus)(本实验室保存)接种于TSB液体培养基中, 37℃培养过夜。于TSB固体培养基上划线纯化1次; 选取单菌落接种于TSB液体培养基中, 37℃ 180 r/min摇床上培养12h, 使活菌数在108CFU/mL左右。将菌悬液离心, 弃上清液, 用生理盐水对菌体进行反复洗涤,重悬后, 使菌体的浓度达108CFU/mL。
WSSV 粗提液的制备取感染WSSV的脊尾白虾病虾(本实验室保存) 头尖组织5 g, 加入适量(800 μL) 4℃预冷的磷酸盐缓冲液(1×PBS), 20000 r/min冰浴匀浆, 将获得的匀浆液于4℃ 3000 r/min离心15min, 取上清液反复离心3次(4000、6000、8000 r/min各15min), 将所得的上清液用0.45 μm滤膜过滤除菌, 将除菌的粗提液稀释100倍(3.7×107copy/mL)进行分装并保存于 -80℃冰箱中备用。
实验时将菌悬液、WSSV粗提液用微量注射器从脊尾白虾的第2腹节处注入(20 μL/尾)。对照组注射pH为7.4的1×PBS缓冲液(20 μL/尾)。在注射后的6h、12h、24h、48h、72h取样, 每个时间点各取5尾虾, 取血液、肝胰腺、鳃、肌肉等组织, 用于总RNA提取。
1.2 脊尾白虾总RNA提取及cDNA合成
脊尾白虾组织总RNA提取利用TRIzol试剂(Invitrogen公司), 用核酸定量仪(Thermo, NanoDrop 2000)和1.0%琼脂糖凝胶电泳检测总RNA的质量及完整性。使用DNaseⅠ RNase-free (Fermentas)试剂盒去除提取的总RNA中残留的DNA。
cDNA合成体系(20 μL): 10 μL总RNA, 2 μL Oligo dT (50 μmol/L), 72℃水浴5min, 冰浴2min, 瞬时离心数秒使溶液聚集于管底; 之后再向管中加入1.0 μL dNTP Mixture (each 10 mmol/L)、5×M-MLV Buffer 4.0 μL、0.5 μL RNase Inhibitor (40 μL/mL,TaKaRa)和1.0 μL M-MLV反转录酶(TaKaRa), 用DEPC水补足体积; PCR仪上42℃孵育lh; 72℃孵育15min; 4℃孵育20min。合成的cDNA用于后期脊尾白虾血蓝蛋白基因的克隆及Real-time PCR检测。脊尾白虾3′和5′RACE模板的合成根据SMARTTM RACE Amplification Kit说明书进行。
1.3 脊尾白虾血蓝蛋白大亚基基因cDNA中间片段克隆
根据从GenBank获得的凡纳滨对虾血蓝蛋白基因(AJ250830.1)、斑节对虾(Penaeus monodon)血蓝蛋白基因(AF4317371)、日本沼虾(Macrobrachium mipponensis)血蓝蛋白基因(KF431830)序列设计简并引物HcL-F和HcL-R (上海生工生物工程有限公司合成)(表 1)。PCR反应体系(20 μL): TransTaq®HiFi Polymerase (5 U/μL) 0.2 μL, 10×TransTaqHiFi Buffer Ⅱ 2 μL, 2.5 mmol/L dNTPs 1.6 μL, HcLF 1 μL, HcLR 1 μL, 脊尾白虾cDNA模板2 μL, ddH2O 12.2 μL。反应程序: 94℃ 5min; 94℃ 30s, 58℃ 30s,72℃ 30s, 35个循环; 72℃ 10min; 4℃保存。1% 琼脂糖凝胶电泳检测后, 用DNA胶回收试剂盒(北京天根生化科技有限公司)纯化PCR扩增特异性产物,连接到pMD18-T (TaKaRa)载体上, 重组载体转化到大肠杆菌DH5α 感受态细胞(北京天根生化科技有限公司)中, 挑取阳性克隆子进行菌液PCR验证后测序。
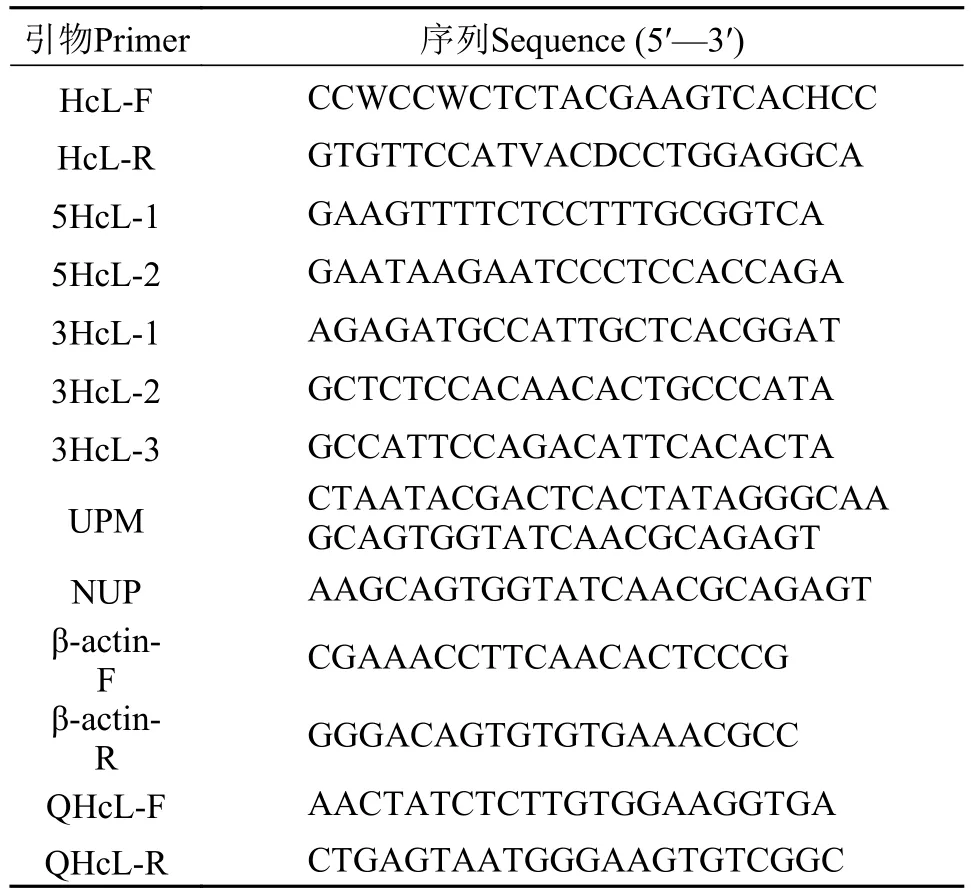
表 1 本研究所用引物序列Tab. 1 Primers used in this study
1.4 脊尾白虾血蓝蛋白大亚基cDNA 5′和3′末端的扩增
根据测序得到的中间序列设计5′ RACE引物(5HcL-1、5HcL-2)和3′ RACE引物(3HcL-1、3HcL-2)(表 1)扩增脊尾白虾大亚基血蓝蛋白基因cDNA全长序列。按照SMARTTMcDNA Amplification Kit(Clontech)说明书推荐的反应体系及反应条件进行5′ RACE和3′ RACE扩增。PCR扩增产物的纯化、克隆及测序同上所述。
1.5 序列分析
将测序结果去载体后, 采用ContigExpress进行5′和3′序列拼接, 用NCBI BLAST (http://blast.ncbi.nlm.gov/Blast.cgi)网页进行序列比对及结构域预测,用SignalP 4.0软件分析信号肽, 采用DNAMAN软件进行不同来源的血蓝蛋白的氨基酸序列多序列比对, 用MEGA 6.0软件[13]中的Neighbor-joining法[14]构建系统树。
1.6 EcHcL基因组织分布特征分析
根据脊尾白虾血蓝蛋白EcHcL基因设计正反向引物(QEcHcL-F/R)(表 1), 用于Real-time PCR检测。按照前述选择6尾健康的脊尾白虾, 取其鳃、卵巢、肝胰腺、心脏、肠、肌肉、胃、腹神经节、眼柄、血细胞用于各组织RNA的提取及cDNA的合成。利用Real-time PCR检测不同组织中EcHcL基因的分布情况。使用SYBR Premix ExTaqⅡ 试剂(TaKaRa), Applied Biosystems 7500 Real Time PCR仪上进行, 反应体系为10 μL: 5 μL SYBR Premix ExTaqⅡ、1 μL cDNA、0.4 μL正反向引物、0.2 μL ROX Reference dye Ⅱ 及3 μL ddH2O。反应程序为95℃ 10min; 95℃ 30s, 95℃ 5s, 60℃ 34s,40个循环; 95℃ 15s; 60℃ 1min; 95℃ 15s。以βactin基因作为内参基因, 样本和内参均设置3个平行, 采用2-ΔΔCt方法[15]计算EcHcL基因的相对表达量。
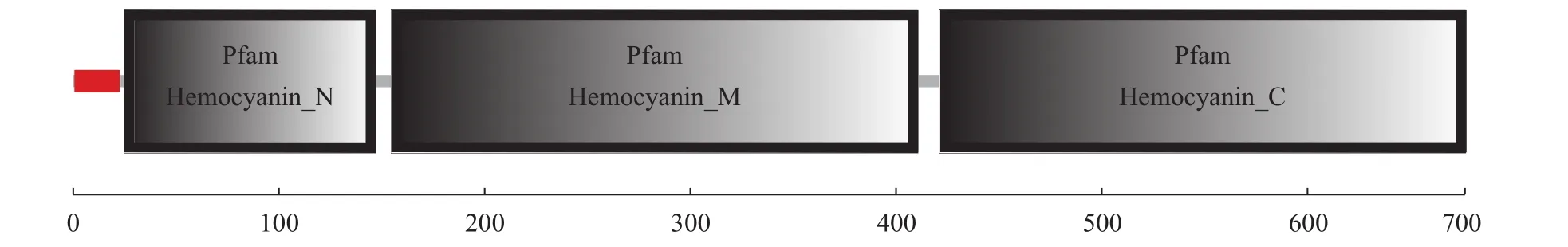
图1 脊尾白虾EcHcL血蓝蛋白结构域位置Fig. 1 Three domains of EcHcL hemocyanin
1.7 副溶血弧菌和金黄色葡萄球菌感染脊尾白虾后血蓝蛋白基因EcHcL的表达分析
分别提取副溶血弧菌和金黄色葡萄球菌感染后不同时间脊尾白虾的肝胰腺和血细胞组织的RNA, 按照前述方法逆转录合成cDNA进行Realtime PCR, 以β-actin基因作为内参基因, 样本和内参均设置3个平行, 检测细菌感染下的脊尾白虾血细胞和肝胰腺中EcHcL基因在不同时间点的表达情况。反应体系、反应程序及数据分析如1.6所述。
1.8 白斑综合征病毒感染后脊尾白虾EcHcL的表达分析
提取WSSV感染后不同时间脊尾白虾血细胞和肝胰腺组织的RNA, 按照前述方法反转录合成cDNA进行Real-time PCR。反应体系、反应程序及数据处理同如1.6所述。
2 结果
2.1 脊尾白虾血蓝蛋白大亚基因cDNA全长的克隆及序列分析
采用RACE方法和RT-PCR扩增获得脊尾白虾血蓝蛋白大亚基基因cDNA全长, 命名为EcHcL(GenBank登录号: MFID143190)。EcHcL序列分析显示全长2192 bp, 包括2034 bp的开放阅读框(ORF)、5′端非编码区(UTP) 21 bp和137 bp的3′非编码区, 其中包括1个终止子TAG和多聚腺苷酸PolyA尾(加尾信号AATAAA)。氨基酸序列分析显示,EcHcL编码677个氨基酸, 预测分子量为78.5 kD,理论等电点(PI)为5.41。Signal P 4.0 Server (http://www.cbs.dtu.dk/services/SignalP/)分析显示此氨基酸序列N端前21个氨基酸组成信号肽。SMART(Simple Modular Architecture Research Tool)软件分析表明, 脊尾白虾EcHcL血蓝蛋白含有3个结构域:Hemocyanin_N (25-147aa)、Hemocyanin_M (154-411aa)、Hemocyanin_C (420-668aa)(图1)。Hemoeyanin-M结构域中的两个铜离子结合位点含6个保守的组氨酸残基H218、H222、H249、H372、H376、H414。
2.2 EcHcL氨基酸序列比对同源性分析
使用NCBI BLAST (http://blast.ncbi.nlm.nih.gov/Blast.cgi) 对脊尾白虾EcHcL基因编码的氨基酸序列与其他物种的血蓝蛋白氨基酸序列进行同源性比较, 结果发现其与日本沼虾(Macrobrachium nipponense)同源性最高达到87%, 与凡纳滨对虾(Litopenaeus vannamei)、斑节对虾(Penaeus monodon)、日本囊对虾(Marsupenaeus japonicus)同源性分别为73%、72%、71%, 与疣酋妇蟹(Eriphia verrucosa)、中华绒螯蟹(Eriocheir sinensis)、斑点海虱(Eurydice pulchra)的同源性分别为68%、67%、63%。将多个物种的血蓝蛋白Hemocyanin_M结构域比对发现, 这些氨基酸序列都相对保守, 同源性达到90.97%, 并且均含有两个铜离子结合位点。
2.3 EcHcL氨基酸序列系统进化分析
利用MEGA 6.0软件对脊尾白虾EcHcL基因氨基酸序列进行系统进化分析, 并构建系统进化树(图2)。结果显示17个物种中, 脊尾白虾EcHcL与日本沼虾、大和米虾(Caridina multidentata)血蓝蛋白、日本囊对虾、斑节对虾、凡纳滨对虾、中国对虾(Fenneropenaeus chinensis)等动物的血蓝蛋白为一个亚群。与中华绒螯蟹、疣酋妇蟹、珍宝蟹(Metacarcinus magister)、蓝蟹(Callinectes sapidus)、拟穴青蟹(Scylla paramamosain)为另一个亚群。EcHcL在进化上与日本沼虾的亲缘关系最近, 与信号小龙虾(Pacifastacus leniusculus)、斑点海虱、蛀木水虱(Limnoria quadripunctata)、钩虾(Gammarus roeselii)、木纹网球虾(Atyopsis moluccensis)、蝉形齿指虾蛄(Odontodactylus scyllarus)等动物的血蓝蛋白亲缘关系较远。
2.4 EcHcL基因在不同组织中的表达分析
利用RT-PCR分析EcHcL基因在不同组织中的表达水平, 结果显示,EcHcL基因在脊尾白虾鳃、卵巢、肝胰腺、心脏、肠、肌肉、胃、腹神经节、眼柄、血细胞中均有表达, 其中, 肝胰腺中表达量最高, 其次为血细胞, 在腹神经节、心脏、肠、鳃、卵巢、肌肉、胃、眼柄中表达量较低(图3)。
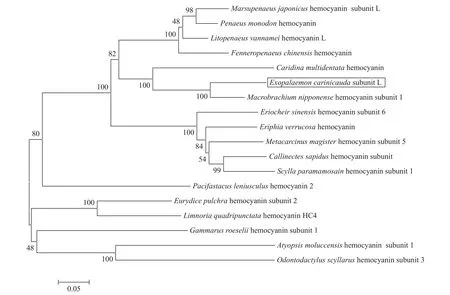
图2 MEGA 6.0软件构建的基于EcHcL氨基酸序列的NJ系统进化树Fig. 2 NJ phylogenetic tree based on EcHcL amino acid sequence by MEGA 6.0
2.5 感染后EcHcL基因在肝胰腺及血细胞中的表达分析
如图4所示, 脊尾白虾感染金黄色葡萄球菌、副溶血弧菌、WSSV后, 脊尾白虾肝胰腺中EcH-cL基因表现出一定的时间依赖性, 总体趋势表现为先升高后降低。EcHcL表达量在金黄色葡萄球菌感染后48h达到峰值, 与对照组有显著性差异(P<0.05), 到72h下降到与对照组无显著性差异(P>0.05)。EcHcL表达量在副溶血弧菌感染后12h达到峰值,与对照组差异极显著(P<0.01), 24h后表达量持续下降, 到72h下降到与对照组无显著性差异(P>0.05)。感染WSSV后,EcHcL在肝胰腺内表达量在12h达到最大值, 并与对照组差异极显著(P<0.01)。如图5所示, 感染金黄色葡萄球菌、副溶血弧菌、WSSV后,脊尾白虾血细胞中血蓝蛋白EcHcL基因表达量表现出先升高后下降的趋势, 均在24h达到峰值, 并且金黄色葡萄球菌感染组和WSSV感染组与对照组相比有显著性差异(P<0.05), 副溶血弧菌感染组与对照组相比差异极显著(P<0.01)。
3 讨论
3.1 EcHcL基因cDNA全长的克隆及序列分析
血蓝蛋白是位于甲壳动物血淋巴中的含铜呼吸蛋白, 它通过与氧气的可逆结合满足集体的氧需求, 结合氧状态与铜结合为蓝色, 脱氧状态与铜脱离为无色。本实验成功克隆了脊尾白虾血蓝蛋白大亚基基因, 预测编码蛋白分子量为78.5 kD, 与已分离的日本沼虾、凡纳滨对虾血蓝蛋白大亚基分子量类似[11,16]。研究表明, 典型的甲壳动物血蓝蛋白是由氨基酸数为630—660、分子量为70—80 kD的异源亚基构成的六聚体, 六聚体中每个亚基折叠为三个结构域, 其中第一、三结构域分别为亚基蛋白的N、C端, 第二结构域含血蓝蛋白的活性部位,活性部位结合有两个铜离子, 每个铜离子分别与蛋白质链上三个组氨酸结合[17]。在本实验中, SMART结果显示, 脊尾白虾血蓝蛋白大亚基含有3个结构域: Hemocyanin_N (25—147aa)、Hemocyanin_M(154—411aa)、Hemocyanin_C (420—668aa) 和Hemoeyanin-M结构域中的两个铜离子结合位点含6个保守的组氨酸残基H218、H222、H249、H372、H376和H414。氨基酸序列比对结果显示, 铜离子结合区相似性较高, 说明该血蓝蛋白铜结合区在进化上相对保守。系统进化分析结果显示EcHcL与日本沼虾血蓝蛋白亲缘关系最近, 疣酋妇蟹、中华绒螯蟹、斑点海虱等甲壳动物的血蓝蛋白亲缘关系次之。
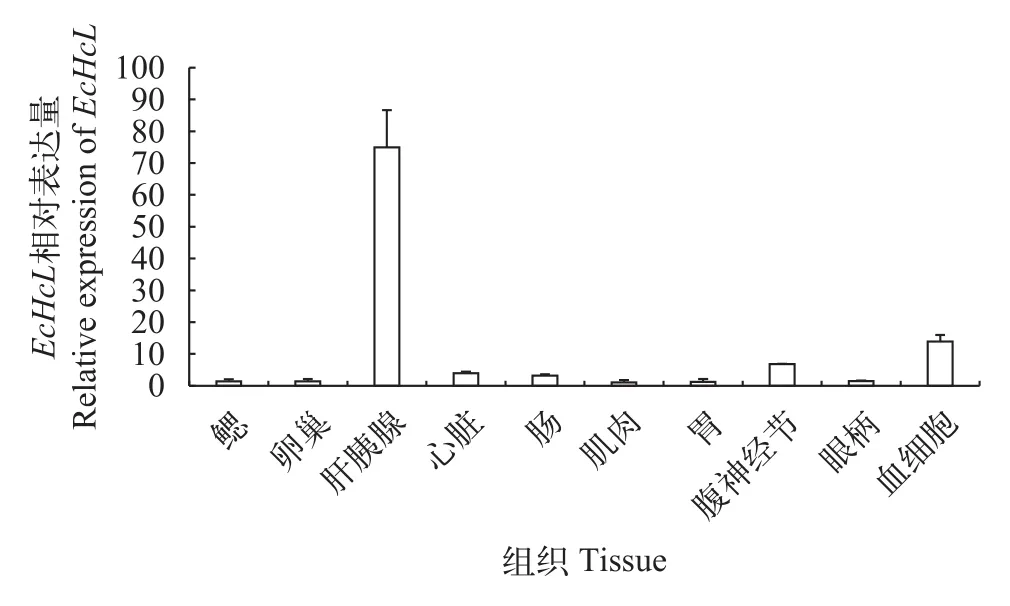
图3 EcHcL基因在脊尾白虾不同组织中的表达Fig. 3 EcHcL expression level in different tissues of E. carinicauda
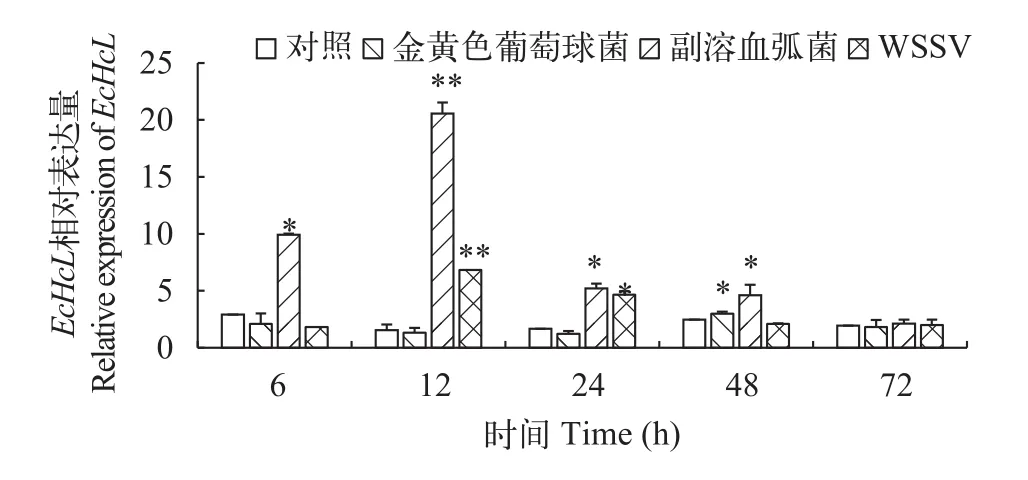
图4 EcHcL基因在脊尾白虾肝胰腺组织中的表达变化Fig. 4 Relative expression of EcHcL in hepatopancreas of E. carinicauda
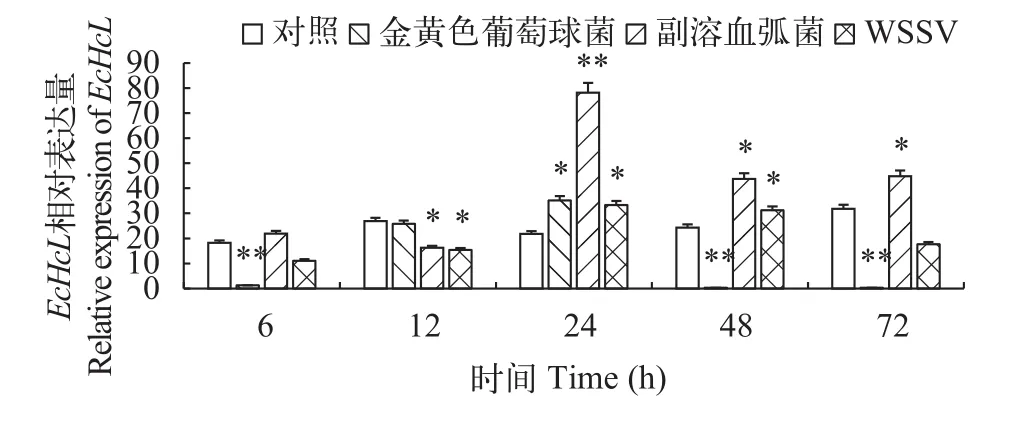
图5 EcHcL基因在脊尾白虾血细胞中的表达变化Fig. 5 Relative expression of EcHcL in haemocytes of E. carinicauda
3.2 EcHcL基因在不同组织中的表达分析
本实验对EcHcL在不同组织中的表达量进行了测定, 发现EcHcLmRNA的表达组织分布广泛且具有组织特异性, 在肝胰腺最高, 血细胞次之, 与凡纳滨对虾[18]、中国对虾[8]的研究结果一致。此研究支持了肝胰腺是甲壳动物血蓝蛋白的主要合成器官的观点[19]。
3.3 感染后EcHcL基因的表达分析
近年来的研究发现, 血蓝蛋白具有载氧功能外,还具有凝集活性、酚氧化酶活性、抗菌和抗病毒等作用。目前的研究结果认为血蓝蛋白是构成甲壳动物免疫防御体系的重要成员之一[20]。章跃陵等[21,22]研究发现血蓝蛋白蛋白斑点的肽质量谱峰值可以与流感病毒的血凝素相匹配, 提示血蓝蛋白可能具有凝集活性; 并发现血清中与溶藻酸弧菌、哈维氏弧菌、嗜水气单胞菌和金黄色葡萄球菌等4种病原菌直接结合的蛋白是血蓝蛋白, 提示血蓝蛋白具有一定的抗菌活性, 并首次证明了血蓝蛋白具有非特异性抗病毒作用[23]。Lee等[24]研究发现信号小龙虾血蓝蛋白在酸性环境下能水解产生抗菌肽, 对革兰氏阳性菌和阴性菌都有很强的抑制作用。综上所述, 血蓝蛋白及其降解片段在虾类的免疫系统中发挥着重要的作用。在本实验中, 脊尾白虾肝胰腺和血细胞血蓝蛋白基因EcHcL基因在金黄色葡萄球菌、副溶血弧菌刺激后, 其表达量表现出一定的时间依赖性, 总体趋势表现为先升高后降低。肝胰腺和血细胞EcHcL表达量在金黄色葡萄球菌感染后24h内发生轻微浮动, 在48h达到最大值,约是对照组的2倍, 随后下降到与对照组无显著差异(P>0.05), 与Lu等[25]研究发现注射金黄色葡萄球菌后, 凡纳滨对虾血蓝蛋白基因在肝胰腺中表达量增加显著结果相一致, 提示血蓝蛋白具有抗菌作用;血细胞EcHcL表达量在金黄色葡萄球菌感染后24h达到最大值, 约是对照组的2倍, 可能由于球菌的感染激活了血蓝蛋白的免疫活性, 促进血蓝蛋白基因的表达, 之后显著降低, 可能由于虾血细胞体液免疫将异物排除体外。脊尾白虾在受到副溶血弧菌感染后, 肝胰腺EcHcL表达量随着时间增加而增加,在注射12h达到最大值, 约是对照组的8倍, 随后逐渐下降, 72h恢复到与对照组相当, 与李彦飞[26]研究发现凡纳滨对虾血蓝蛋白p77亚基在注射病原菌后,12h达到表达量达到最大值之后下调趋势一致, 提示血蓝蛋白在虾类免疫防御体系中具有抗菌作用;血细胞EcHcL表达量在24h达到最大值, 约是对照组的3倍, 随后逐渐下降, 在72h与对照组无显著性差异(P>0.05), 与杨留冰[27]研究发现注射球菌及弧菌24h后凡纳滨对虾血浆血蓝蛋白亚基表达量达到最大值之后下调趋势一致, 提示血蓝蛋白具有抗菌作用。经金黄色葡萄球菌及副溶血弧菌感染脊尾白虾后, 在感染后期EcHcL表达量恢复到正常水平(图3), 推测病原菌的入侵激活了脊尾白虾的免疫防御体系, 血蓝蛋白及血细胞等免疫因子的共同作用先将病原菌清除[28]。
白斑综合征病毒是虾类主要的病毒性疾病之一, 给虾类养殖业造成巨大的经济损失[29,30], 因此越来越多的学者对虾类抗病毒展开研究。近十几年来研究表明, 对虾血蓝蛋白具有抗病毒活性。Zhang等[21]将凡纳滨对虾血蓝蛋白分离为分子质量为73 kD和75 kD的两种亚基, 并首次证明血蓝蛋白具有非特异性抗病毒作用。Lei等[31]研究发现血蓝蛋白能与WSSV和虹彩病毒(Singapore Grouper Irido Virus, SGIV)结合揭示血蓝蛋白具有抗病毒功能。在本实验中, 脊尾白虾肝胰腺及血细胞EcH-cL基因在WSSV感染后, 与对照组相比具有时空表达模式, 表达量先升高后降低, 分别在12h和24h达到最高值, 分别约是对照组的4倍和2倍, 与Xu等[32]研究发现凡纳滨对虾人工感染WSSV后血蓝蛋白基因在肝胰腺中的表达上调趋势一致, 表明血蓝蛋白在虾类的免疫防御中还具有抗病毒的作用。WSSV感染脊尾白虾前期在肝胰腺组织及血细胞中的EcHcL基因表达量持续增加, 可能因为病毒的复制刺激了血蓝蛋白的合成促进了免疫应答;感染后期, WSSV的扩增进入对数期, 抑制了脊尾白虾的免疫防御系统, 使EcHcL表达量持续下降。
本实验对脊尾白虾血蓝蛋白大亚基基因cDNA全长进行了克隆分析, 并研究了其在病原菌及病毒的感染下的表达规律, 发现感染后基因表达呈现特定的时空表达模式, 进一步证明了血蓝蛋白具有抗菌和抗病毒双重作用, 为深入研究血蓝蛋白在对虾免疫防御系统中的作用积累了资料。
[1]Li M Y. An approach to the reproduction and growth of shrimpExopalaemon carinicaudacultured in earthen ponds with reference to its maximum sustaining yield on catch rotation [J].Journal of Fisheries of China, 1994,18(2): 85—92 [李明云. 池养脊尾白虾的繁殖, 生长及其最大持续轮捕量的初步探. 水产学报, 1994, 18(2):85—92]
[2]Liang J P, Li J, Liu P,et al. Research progress of biological characteristics and artificial breeding of ridgetail white prawn,Exopalaemon carinicauda[J].Chinese Agricultural Science Bulletin, 2012, 28(17): 109—116 [梁俊平, 李健, 刘萍, 等. 脊尾白虾生物学特性与人工繁育的研究进展. 中国农学通报, 2012, 28(17): 109—116]
[3]Roch P. Defense mechanisms and disease prevention in farmed marine invertebrates [J].Aquaculture, 1999,172(1-2): 125—145
[4]Yan F, Zhang Y L, Luo H Q,et al. The phenoloxidase activity of hemocyanin from white leg shrimpLitopenaeus vannamei[J].Fish Science, 2008, 27(1): 5—8
[5]Zhang X, Huang C, Qin Q. Antiviral properties of hemocyanin isolated from shrimpPenaeus monodon[J].Antiviral Research, 2004, 61(2): 93—99
[6]Zhang Y L, Chen J, Lin B K,et al. An attempt to study the agglutinative activity of hemocyanin in shrimpPenaeus vannameiwith several kinds of erythrocyte [J].Journal of Shantou University(Natural Science), 2005,20(3): 48—53 [章跃陵, 陈俊, 林伯坤, 等. 南美白对虾血蓝蛋白血细胞凝集活性初探. 汕头大学学报(自然科学版), 2005, 20(3): 48—53]
[7]Zhang X Y, Lin X M, Zhang Y L,et al. Comparative analysis of hemolytic activity of hemocyanin isomers binding to different bacteria in shrimpLitopenaeus vanname[J].Acta Hydrobiologica Sinica, 2013, 37(6):1079—1084 [张小瑜, 林晓敏, 章跃陵, 等. 与不同病原菌相结合的凡纳滨对虾血蓝蛋白溶血活性对比分析.水生生物学报, 2013, 37(6): 1079—1084]
[8]Sun J, Wang B J, Sun S J,et al. cDNA cloning and sequence analysis of hemocyanin inFenneropenaeus chinensis[J].Marine Fisheries Research, 2010, 31(1):80—88 [孙杰, 王宝杰, 孙姝娟, 等. 中国明对虾血蓝蛋白基因cDNA的克隆与序列分析. 渔业科学进展, 2010,31(1): 80—88]
[9]Wang W F, Xia X C, Wang X S,et al. Molecular cloning and expression analysis of hemocyanin gene fromMacrobrachium nipponense[J].Acta Anatomica Sinica, 2012,43(2): 214—219 [王文锋, 夏西超, 王雪参, 等. 日本沼虾血蓝蛋白基因cDNA全长克隆及表达分析. 解剖学报,2012, 43(2): 214—219]
[10]Yu G, Li J, Li J T,et al. cDNA cloning and expression analysis of hemocyanin inExopalaemon carinicauda[J].Marine Fisheries Research, 2012, 33(6): 74—80 [于戈,李健, 李吉涛, 等. 脊尾白虾血蓝蛋白基因cDNA的克隆与表达分析. 渔业科学进展, 2012, 33(6): 74—80]
[11]Zhang X L. Single nucleotide polymorphism (SNPs) of hemocyanin Ig-like region inLitopenaeus vannamei[D].Thesis for Master of Science, Shantou University,Shantou. 2010 [赵宪亮. 凡纳滨对虾血蓝蛋白Ig-like区单核苷酸多态性(SNPs)的研究. 硕士学位论文, 汕头大学, 汕头. 2010]
[12]Pan L Q, Jin C X. A review on hemocyanins of crustacean [J].Journal of Fisheries of China, 2008, 32(3):484—490 [潘鲁青, 金彩霞. 甲壳动物血蓝蛋白研究进展. 水产学报, 2008, 32(3): 484—490]
[13]Tamura K, Peterson D, Peterson N,et al. MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods [J].Molecular Biology & Evolution, 2011,28(10): 2731—2739
[14]Saitou N, Nei M. The neighbor-joining method a new method for reconstructing phylogenetic trees [J].Molecular Biology and Evolution, 1987, 4(4): 406—425
[15]Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C (T)) method [J].Methods, 2001, 25(4):402—408
[16]Li C P, Huang H, Wang F,et al. Agglutinative and antibacterial activity of the peptides hydrolyzed fromLitopenaeus vannameihemocyanin with trypsin [J].Acta Hydrobiologica Sinica, 2017, 41(5): 1042—1047 [李长平, 黄河, 王帆, 等. 凡纳滨对虾血蓝蛋白酶解多肽的凝集与抑菌活性. 水生生物学报, 2017, 41(5): 1042—1047]
[17]Burmester T. Origin and evolution of arthropod hemocyanins and related proteins [J].Journal of Comparative Physiology B, 2002, 172(2): 95—107
[18]Daniel S, Soasig L, Alain V W. Molecular cloning of hemecyanin cDNA fromPenaeus vannamei(Crustaceu,Decapoda): structure, evolution and physiological aspects[J].FEBS Letters, 1997, 407(2): 153—158
[19]Gellissen G, Hennecke H, Spindler K D. The site of synthesis of hemocyanin in the crayfishAstacus leptodactylus[J].Experientia, 1991, 47(2): 194—195
[20]Fenmndo L, Gareia C, Keni C,et al. Phenoloxidmm activity of hemecyanin in whiteleg shrimpPenaeus vannamei: conversion, characterization of catalytic properties, and role in postmortem melanosis [J].Agricultural Food Chemistry, 2008, 56(15): 6454—6459
[21]Zhang Y L, Lin B, Chen J,et al. Bacterial agglutinative activity of hemocyanin in shrimpLitopenaeus vannamei[J].Journal of Fishery Sciences of China, 2006, 13(6):1006—1011
[22]Zhang Y L, Zhuo Y M, Zhu Y F,et al. Identification of two type of main differential proteins in white leg shrimpLitopenaeus vannameiinfected by pathogenic bacteriaVibrio alginolyticus[J].Fisheries Science, 2005, 24(6):19—23 [章跃陵, 卓奕明, 朱永飞, 等. 凡纳滨对虾人工感染细菌后肝胰脏中主要变化蛋白的研究. 水产科学,2005, 24(6): 19—23]
[23]Zhang Y L, Wang S Y, Xu A L,et al. Affinity proteomic approach for identification of an IgA-like protein inLitopenaeus vannameiand study on its agglutination characterization [J].Journal of Proteome Research, 2006,5(4): 815—821
[24]Lee S Y, Lee B L, Söderhäll K. Processing of an antibacterial peptide from hemocyanin of the freshwater crayfishPacifastacus leniusculus[J].Journal of Biological Chemistry, 2003, 278(10): 7927
[25]Lu X, Lu H, Guo L,et al. Cloning and characterization of a novel hemocyanin variant LvHMCV4 from shrimpLitopenaeus vannamei[J].Fish & Shellfish Immunology,2015, 46(2): 398—405
[26]Li Y F. Effects of injection of pathogenic bacteria and salinity on hemocyanin synthesis and phenoloxidase activity inLitopenaeus vannamei[D]. Thesis for Master of Science, Ocean University of China, Qingdao. 2009 [李彦飞. 注射病原菌, 盐度变化对凡纳滨对虾血蓝蛋白合成, 酚氧化酶活性的影响. 中国海洋大学, 青岛. 2009]
[27]Yang L B. Preliminary study on the immune function of hemocyanin inLitopenaeus vannamei[D]. Thesis for Master of Science, Ocean University of China, Qingdao.2013 [杨留冰. 凡纳滨对虾血蓝蛋白免疫作用的初步研究. 中国海洋大学, 青岛. 2013]
[28]Guo Z X, Feng J, Wang J Y. Clearance ofVibrio anguillarumby haemocytes in giant black tiger shrimpPenaeus monodonin vivo [J].Journal of Fishery Sciences of China, 2006, 13(1): 28—32 [郭志勋, 冯娟, 王江勇. 斑节对虾血淋巴细胞对鳗弧菌的清除作用. 中国水产科学,2006, 13(1): 28—32]
[29]Soto M A, Shervette V R, Lotz J M. Transmission of white spot syndrome virus (WSSV) toLitopenaeus vannameifrom infected cephalothorax, abdomen, or whole shrimp cadaver [J].Diseases of Aquatic Organisms, 2001,45(2): 81—87
[30]Li H M, Jiang X, Liu Z H,et al. Real-time fluorescence loop mediated isothernal amplification for the rapid detection of white spot syndrome virus [J].Acta Hydrobiologica Sinica, 2015, 39(1): 142—148 [李红梅, 江晓, 刘助红, 等. 白斑综合症病毒实时荧光LAMP检测方法的建立及应用. 水生生物学报, 2015, 39(1): 142—148]
[31]Lei K, Li F, Zhang M,et al. Difference between hemocyanin subunits from shrimpPenaeus japonicusin anti-WSS defense [J].Developmental & Comparative Immunology, 2008, 32(7): 808—813
[32]Xu J X, Ruan L W, Li Z,et al. Characterization of four hemocyanin isoforms inLitopenaeus vannamei[J].Acta Oceanologica Sinica, 2015, 34(2): 36—44

