嗜水气单胞菌cpxRA缺失株构建及生物学特性研究
张兰梨 张倩倩 陈 辉 王谢昊 吴振兵 冯宇晴 李爱华
(1. 中国科学院水生生物研究所, 淡水生态与生物技术国家重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049;3. 淡水水产健康养殖湖北省协同创新中心, 武汉 430070; 4. 江苏省渔业技术推广中心, 南京 210036)
嗜水气单胞菌(Aeromonas hydrophila)属于弧菌科气单胞菌属, 是一种革兰氏阴性短杆菌, 广泛分布于自然界各种水体及淤泥、土壤中, 对水产动物、畜禽和人均具有致病性[1—4], 尤其是对水产动物危害严重, 可导致水产动物患败血症、肠炎、烂尾病、腹水病等[5], 造成水产养殖业严重的经济损失。
细菌生存和繁殖的前提是适应环境[6], 这就需要细菌多种分子调控系统来有效整合外界信息并控制细菌行为应对方式。细菌分子调控系统包括单组分、双组分及三组分调控系统, 其中双组分调控系统处于中心地位。CpxRA系统是革兰氏阴性菌中普遍存在的一种双组分系统, 由细胞质内膜上的组氨酸蛋白激酶CpxA和细胞质内的反应调节蛋白CpxR组成。当CpxA蛋白感知到外界信号分子变化时, 通过自磷酸化使一个保守的组氨酸残基带上磷酸基团, 然后将磷酸基团转移到细胞质内反应调节蛋白CpxR的天冬氨酸残基上, 磷酸化的CpxR被激活, 会与靶基因启动子区的特异序列结合, 激活转录[7]。已有学者对大肠杆菌、霍乱弧菌、迟缓爱德华氏菌等的CpxRA双组分系统进行深入研究, 但有关嗜水气单胞菌中Cpx系统的作用则鲜有报道。因此本文通过构建嗜水气单胞菌株DBHS101的cpxRA双基因缺失突变株Δcpx来研究Cpx系统在嗜水气单胞菌的功能, 为后续深入认识该系统提供参考。
1 材料与方法
1.1 菌株及质粒
嗜水气单胞菌DBHS101由本实验室于2009年6月在患病鳙鱼肾脏分离得到[8], 具有氨苄青霉素抗性; 大肠杆菌S17-1λpir和pACYC184质粒由中国科学院水生生物研究所谢海侠博士馈赠; pMD18-T质粒购自大连TaKaRa公司; pRE112质粒由华中农业大学林蠡博士馈赠。
1.2 主要试剂和仪器
细菌基因组提取试剂盒、DNA Marker、2×TaqMasterMix购自北京康为世纪生物科技有限公司;质粒提取试剂盒购于OMEGA公司; 限制性内切酶、T4 DNA连接酶、PrimeSTAR Max DNA Polymerase、SYBR GreenⅠ购自大连TaKaRa公司; 蔗糖、氯霉素、氨苄青霉素购自Sigma公司。PCR仪购于Thermo公司; 核酸电泳仪购于Bio-Rad公司; 引物合成于北京擎科新业生物技术有限公司(表 1)。
1.3 基因缺失株及互补株的构建和鉴定
基因缺失株的构建和鉴定根据Ho等[9]的方法利用融合PCR获得基因缺失片段, 通过同源重组筛选出缺失突变株。以嗜水气单胞菌DBHS101的基因组为模板, 根据已公布的Aeromonas hydrophilaML09-119 (CP005966)、JBN2301 (CP013178)、NJ-35 (CP006870)全基因组序列, 同源克隆扩增得到DBHS101的cpxRA基因簇全序列, 用Primer Premier 5.0对序列设计引物。用引物cpx-5O/5I和cpx-3I/3O分别扩增cpx基因的上下游片段F1、F2,然后用F1、F2片段为模板, 用cpx-5O/3O进行融合PCR得到大片段F1F2, 将F1F2片段连接到pMD18-T载体上送测序, 验证片段序列正确后, 在限制性内切酶XbaⅠ和KpnⅠ及T4 DNA连接酶的作用下将片段与自杀性质粒pRE112连接起来构建重组质粒pRE-Δcpx; 把重组质粒转入大肠杆菌S17-1λpir感受态中, 然后利用接合转移法将重组质粒pRE-Δcpx转入受体菌DBHS101中进行同源重组, 通过含氨苄青霉素(Amp 100 μg/mL)、氯霉素(Cm 25 μg/mL)或蔗糖(SacB 0.1 g/mL) 的TSA平板筛选出SacBRCms表型菌株, 即为阳性菌株, 用cpx-5O/3O及两对检测引物cpx-outcheck F/R、cpx-incheck F/R对阳性菌株进行PCR验证, 条带大小符合期望值的即为cpxR-A基因缺失突变株Δcpx。双交换及筛选过程如图1。
互补株CΔcpx的构建以DBHS101的基因组为模板, 用互补引物com-F/com-R扩增cpx互补片段, 连T载测序正确后经限制性内切酶Hind Ⅲ 和SphⅠ 双酶切后连接pACYC184载体构成互补质粒pACYC-cpx, 互补质粒电转入缺失突变株Δcpx中,即可构建互补株, 经氯霉素抗性平板筛选和PCR验证挑出阳性克隆, 送测序。
1.4 扫描电镜观察
划线后分别挑取野生株、突变株和互补株的单菌落在TSB中过夜培养, 按照1%比例转接至底部放有盖玻片的新鲜的TSB培养基中, 28℃静置培养24h, 取出盖玻片用无菌PBS冲洗3次; 接着用2.5%戊二醛4℃固定4h, 之后依次用10%、30%、50%、70%、90%和无水乙醇脱水, 叔丁醇进行置换, 最后真空冷冻干燥, 喷金进行扫描电镜观察。
1.5 生长曲线、运动能力及生物膜形成能力测定
挑取野生株、突变株的单菌落在5 mL TSB中过夜培养, 调节吸光度值A600=1.0, 按照1%比例分别转接至新鲜的TSB培养基中28℃ 180 r/min进行振荡培养, 每1h取样测定OD600, 连续观察12h并绘制生长曲线; 当菌株长至A600=1.0时, 取2 μL接种至含0.35%琼脂的半固体TSB平板, 28℃ 静置培养24h后观察并测量泳动圈大小; 采用96孔法[10]进行生物膜的测定, 在菌株按照1%比例转接至新鲜TSB后, 立即将含菌的培养基以200 μL/孔的量转移到三个96孔细胞培养板中, 分别在24h、48h、96h各取出一板, 弃掉培养基, 用PBS洗涤3次自然风干后, 以Bouin’s固定液固定1h之后加入1%结晶紫染液, 染色30min。最后用蒸馏水洗涤3次, 待干燥后加入95%乙醇溶解, 静置10min; 以无菌培养基做空白对照, 用酶标仪检测570 nm波长(结晶紫最大吸收波长)各孔的光吸收值从而比较生物膜含量差异。

表 1 本研究中使用的引物Tab. 1 Primers used in this study

图1 cpxR-A基因缺失株的构建过程Fig. 1 Construction of cpxR-A mutant strain
1.6 刺激耐受实验
急性刺激挑野生株和突变株的单菌落活化后按照1%比例扩大培养至A600=0.5, 4℃ 8000×g离心5min, 加入TSB重悬; 之后取100 μL菌液加入到900 μL TSB (对照组)或含刺激因子的TSB (实验组)中, 28℃, 180 r/min培养30min; 对照组和实验组分别用TSB进行连续十倍倍比稀释, 每个浓度稀释液各取10 μL在含Amp的TSA平板上点样[11], 28℃培养12—14h后计数, 比较野生株和突变株的存活率差异(存活率%=实验组CFU/对照组CFU×100%)。
刺激因子及终浓度0.02 mol/L HCl、0.02 mol/L NaOH、0.5 mol/L KCl、0.5 mg/mL SDS、5 mg/mL EDTA,2 μm孔径滤膜过滤除菌。
慢性刺激挑单菌落活化后, 培养至A600=1.0时, 按照1%比例转接至30 mL含刺激因子的TSB培养基(对照组不含刺激因子)中28℃ 180 r/min培养12h, 每小时测定A600值。刺激因子及终浓度5 mg/mL EDTA溶液, 20 μg/mL多黏菌素B溶液。
1.7 致病性相关实验
斑马鱼浸泡感染实验挑取野生株和突变株的单菌落活化后扩大培养至对数期, 用PBS洗涤3次后调节菌液浓度为108CFU/mL, 分别用1 L的野生株、突变株菌悬液或PBS各浸泡15条健康斑马鱼24h, 之后每天正常换水, 但不喂食观察1周内鱼的生长状态及存活情况。
斑马鱼腹腔注射攻毒实验挑取野生株和突变株的单菌落活化后扩大培养至对数期(培养约2.5h), 用PBS调节菌液浓度(野生株浓度分别是1.29×105、6.45×104、3.23×104和1.62×104CFU/mL;突变株浓度为1.32×105、6.59×104、3.30×104和1.65×104CFU/mL)[12], 然后各取50 μL分别腹腔注射斑马鱼(平均长度为3 cm, 随机分为9组, 每组15条)对照组注射等量PBS, 统计2周内斑马鱼存活情况, 根据软件SPSS 16.0 通过几率单位加权回归法(Bliss)计算斑马鱼半数致死量LD50。
1.8 实时荧光定量PCR
为了进一步验证Cpx系统相关基因表达量的变化, 筛选了与Cpx系统可能相关的基因序列设计引物[11,13,14](表 2)进行荧光定量分析。培养野生株和突变株至对数期, 然后提细菌RNA, 测定其浓度及电泳检测质量后进行反转录, 以野生株作为对照组,选取稳定表达的16S rRNA基因作内参, 进行荧光定量PCR。反转录和荧光定量PCR过程严格按照试剂盒说明书进行操作。
根据前期实验, 选取5 mg/mL EDTA作为诱导剂, 当菌株培养至对数前期(A600为0.2—0.3)时, 加入EDTA溶液或等量无菌双蒸水(对照组), 继续培养30min, 提取细菌RNA, 迅速反转录得到cDNA后,选取外膜相关的5个基因进行荧光定量PCR, 比较野生株、突变株中这些基因经EDTA处理后的表达量变化。
实时荧光定量PCR反应体系为20 μL: SYBR GreenⅠMix 10 μL, 上、下游引物(10 μmol/L)各0.8 μL, 模板cDNA 1 μL, DEPC H2O 7.4 μL。
PCR反应条件为: 95℃ 预变性2min; 95℃ 变性10s, 58℃ 退火30s, 72℃ 延伸30s, 40个循环。
野生株和突变株各3个生物学重复, 每1个样品重复3次, 基因转录水平的变化根据2-ΔΔCt方法[15]计算。

表 2 荧光定量PCR引物Tab. 2 Primers used in qRT-PCR
1.9 数据分析
实验结果图通过GraphPad Prism 5.01绘制, 采用双尾t检验方法, 但斑马鱼浸泡实验的结果采用的是log-rank (Mantel-Cox) 检验, 显著性水平定义为P<0.05, 在图中用“*”标出,P<0.01, 用“**”标出。
2 结果
2.1 基因缺失株、互补株的鉴定
以嗜水气单胞菌野生株DBHS101为模板, 通过PCR分别获得cpxRA基因的上下游同源臂F1、F2(理论值F1=646 bp F2=505 bp), 然后进行融合PCR得到缺失cpxRA基因部分片段的上下游片段F1F2 (理论值F1F2=1116 bp), 结果如图2A所示。对构建的重组质粒进行XbaⅠ/KpnⅠ双酶切验证(图2B)并送测序, 测序结果正确。通过接合转移和同源重组, 在氨苄、蔗糖和氯霉素的压力条件下逐步筛选得到了嗜水气单胞菌cpxRA基因缺失株Δcpx,以cpx-incheck F/R、cpx-5O/3O、cpx-outcheck F/R三对引物同时对野生株和突变株进行PCR验证,结果如图2C所示, 和理论值相符(理论值: 野生株做模板时3对引物扩增产物大小应该为2649、2921和3325 bp, 阳性突变株做模板3对引物扩增产物大小应该为826、1116和1501 bp), 说明构建的缺失株Δcpx正确。
以嗜水气单胞菌野生株DBHS101为模板, 以com-F/com-R为引物扩增得到cpxRA互补片段, 将片段与质粒pACYC184酶切连接后电转入突变株Δcpx中, 筛选在含Cm的TSA平板上生长的单菌落,以com-F/com-R为引物, 野生株和突变株为对照进行PCR来验证, 结果如图3所示, 符合预期值(理论值: 野生株为模板时PCR产物应该为2238 bp, 突变株为模板时PCR产物应该为415 bp), 将互补株PCR产物送测序, 序列正确, 说明互补株CΔcpx构建成功。
2.2 扫描电镜观察
载有菌液的玻片在固定、冷冻、干燥后用扫描电镜进行观察, 结果如图4(进行了3次重复, 未显示所有重复图), 结果显示在20000倍放大下, 野生株、突变株和互补株的形态没有明显差异。

图2 基因缺失株的构建和鉴定Fig. 2 Construction and identification of cpxRA mutant strain

图3 互补株的鉴定Fig. 3 Identification of cpxRA complementary strain
图4 菌株扫描电镜图Fig. 4 SEM images of strains
2.3 生长曲线、运动能力及生物膜形成能力测定结果
野生株和缺失株生长曲线如图5A, 两者的生长曲线无明显差异, 说明cpxRA基因同时缺失不影响嗜水气单胞菌DBHS101正常条件下的生长; 运动能力结果如图5B, 对数据进行统计分析, 野生株、缺失株和互补株间泳动能力无明显差异。
在生物膜形成能力测定中, 通过测定生物膜吸附的结晶紫含量来分析菌株在静置培养24h、48h和96h后形成的生物膜浓度, 结果如图6所示, 突变株生物膜形成能力较野生株稍低, 且在96h两者差距更大, 但没有达到显著性水平; 而互补株则在24h时与野生株相似, 但在48h、96h菌膜形成较野生株少,这可能是因为后期菌株营养缺乏时互补株表达抗性基因会耗用能量。从总的结果分析,cpxRA基因簇对生物膜形成有一定作用但不是其关键因子。

图5 菌株的生长曲线及泳动直径Fig. 5 The growth curve of strains and motility assays

图6 生物膜形成能力Fig. 6 The assay of biofilm formation
2.4 刺激耐受实验
急性刺激实验分别选取酸性、碱性、高渗透压及去污剂和螯合剂刺激作为实验对象, 比较这些刺激对野生株和缺失株存活率的影响, 从而了解Cpx系统和这些刺激应对机制间的关系。结果如图7, 去污剂SDS存在环境下突变株较野生株存活率显著增加, 而高渗透压环境下突变株相比于野生株存活率则是显著下降的, 在其他环境中两者差异不显著, 这说明在嗜水气单胞菌中Cpx双组分系统参与细菌对高渗透压和SDS刺激的应答。
慢性刺激实验为了了解菌株对刺激的一个动态反应过程, 采用了测定吸光度值绘制生长曲线的方法来观察突变株和野生株对影响外膜结构的刺激的表现。结果如图8所示, 可以看出野生株和突变株在这2种刺激条件下生长情况有着显著差异, 在观察的12h内, 突变株在含有EDTA的环境中依然能缓慢生长, 而野生株则一直处于生长停滞状态; 在多黏菌素B刺激下, 突变株反而停滞生长, 而野生株则是持续生长。
2.5 毒力试验结果
斑马鱼浸泡攻毒试验以108CFU/mL浓度的野生株和缺失株菌液1 L同时各浸泡15条健康斑马鱼24h, 之后每天换水, 观察1周内斑马鱼的存活情况, 以PBS做空白对照。1周后根据实验结果绘制斑马鱼累积存活曲线(图9)并用log-rank (Mantel-Cox)检验进行差异分析, 结果显示通过菌液浸泡感染, 野生株对斑马鱼毒力较缺失株较大, 但差异不显著(P=0.283>0.05)。

图7 不同急性刺激下菌株存活率Fig. 7 The survival of strains in different acute stimulus
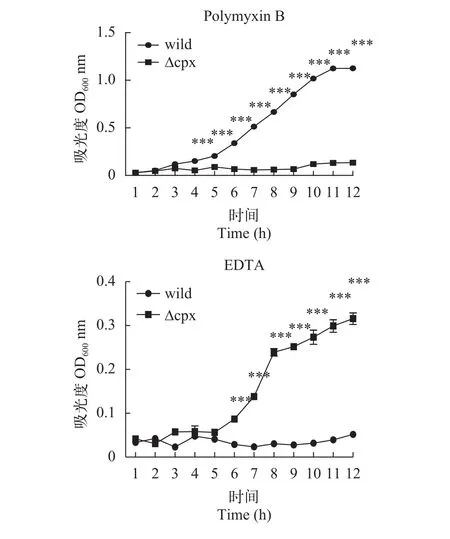
图8 在不同刺激下菌株的生长曲线Fig. 8 The growth curve of strains in different stimulus
斑马鱼腹腔注射攻毒试验分别用4个浓度菌液各50 μL腹腔注射斑马鱼(n=15), 同时以PBS作对照。斑马鱼死亡情况如表 3, 经计算LD50(wild)=6.19×102cfu/尾,LD50(Δcpx)= 7.00×102cfu/尾, 说明野生株和缺失株腹腔注射对斑马鱼的毒力均很强,并且缺失株毒力较野生株稍弱。
2.6 实时荧光定量PCR
提取细菌对数期的RNA进行反转录, 然后选取嗜水气单胞菌毒力蛋白基因、其他双组分系统基因及菌毛基因等共15个基因设计引物进行荧光定量PCR检测, 结果如图10。通过荧光定量PCR, 再次验证了突变株的cpxR和cpxA基因缺失, 并且可以看到突变株的毒力基因hly、aer、alt相比野生株显著上调, 但幅度不大; 另外可以发现CpxRA双组分系统的缺失会导致OmpR-EnvZ双组分系统上调, 说明CpxRA双组分系统可能和OmpR-EnvZ在功能上存在协调关系; 但CpxRA缺失对QseBC无显著影响,QseBC双组分系统与生物膜形成相关, 这和前面的实验结果一致, 说明cpxRA基因簇缺失对细菌生物膜形成影响不大; 当加入诱导剂EDTA后, 菌株的部分基因表达如图11所示, 经EDTA处理0.5h后, 野生株和突变株dsbA/exbD1/histidine kinase gene (AHML_03870)/hly基因均上调表达, 其中有显著差异的是exbD1和histidine kinase gene。
3 讨论

图9 斑马鱼浸泡攻毒累积存活曲线Fig. 9 The survival curve of zebrafish attacked by Aeromonas hydrophila strains soak

表 3 斑马鱼腹腔注射累积死亡情况Tab. 3 The cumulative death of zebrafish injected A. hydrophila strains by intraperitoneal
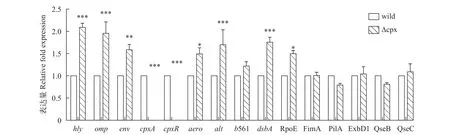
图10 相关基因表达量变化Fig. 10 Related genes expression level
自从1980年McEwen等[16]研究大肠杆菌基因缺失株特征时发现CpxRA系统, 这个双组分系统逐渐受到研究者的关注, 它的生物功能在越来越多的细菌中被揭示。Cosma等[17]研究发现Cpx系统的激活能缓和膜蛋白的错误折叠; De Wulf等[18,19]认为cpx系统能使细菌获得对不良应激的抵抗力; Gal-Mor等[20]研究表明Cpx系统可以调节嗜肺军团菌(Legionella pneumophila)毒力基因icm和dot的表达;Jubelin等[21]研究发现, Cpx系统可以调控大肠杆菌菌毛的合成, 间接影响病原菌的粘附和侵袭。本实验通过融合PCR构建嗜水气单胞菌CpxRA双基因缺失片段, 利用自杀质粒pRE112和同源重组获得cpx缺失突变株Δcpx来研究Cpx系统在嗜水气单胞菌中的作用。
结果显示突变株的外部形态以及在正常环境下摄取养分生长、运动、形成生物膜和野生株相比没有显著差异, 这说明cpxRA基因缺失对这些过程的影响程度较小; 斑马鱼腹腔注射实验结果显示野生株和缺失株相对于斑马鱼而言均为强毒株, 两者毒力没有明显差异, 而在浸泡感染过程中, 缺失株毒力较野生株稍弱, 但差异还没有达到显著水平。因此我们推测cpxRA基因簇不是主要毒力基因。在这些结果中, 突变株和野生株表现一致, 根据qRT-PCR比较, 可能有2种原因, 一种是cpxRA基因簇确实不参与嗜水气单胞菌的这些过程, 对毒力基因影响也不大; 另一种可能是CpxRA被敲除后,有其他系统取代了该系统在这些过程中的作用, 因而细菌表现与野生株无差异, 可以看到突变株的ompR、envZ双组分系统基因以及经EDTA诱导后类似于CpxA的组氨酸激酶(AHML_03870)是上调的, 这说明这些基因是受Cpx系统影响的[22]。

图11 加入EDTA诱导剂后菌株荧光定量结果Fig. 11 The result of qRT-PCR after EDTA induction
在急性刺激实验中, 突变株在0.5 mg/mL SDS刺激下存活率显著高于野生株, 而在0.5 mol/L KCl的高渗透压环境下则是显著低于野生株的; 同样的, 当给予慢性刺激时, 突变株在5 mg/mL的EDTA刺激下存活率显著高于野生株, 在20 μg/mL多黏菌素B刺激下甚至停滞生长。这些结果说明Cpx双组分系统参与嗜水气单胞菌对外界刺激的应答, 且对不同刺激的表现不同。突变株在SDS刺激反应中存活率较野生株高, 这可能是因为Cpx系统增加细菌对SDS的敏感性, 所以当失去这个系统后, 细菌敏感性反而减弱, 但这也许会对突变株其他方面带来不利; 突变株在高渗透条件下存活率显著降低表明Cpx系统参与嗜水气单胞菌抗高渗透压的调控过程。对于EDTA刺激, 综合急性和慢性刺激结果: 短时间的刺激没有明显降低菌株的存活率, 当刺激时间延长至12h, 野生株生长停滞, 突变株表现出缓慢生长, 由此说明5 mg/mL浓度的EDTA对菌株并不会带来明显致死效应, 但这种刺激环境的持续会干扰菌株的正常活动过程, 突变株由于缺少Cpx系统,对这种刺激反应迟钝, 因而生长较快, 但EDTA对细菌的累积损伤可能会造成突变株其他方面如离子吸收的改变。在荧光定量实验中, 经EDTA诱导后野生株exbD1基因的上调表达倍数高达62.7, 是突变株上调的3倍多,exbD1基因编码的蛋白是ExbBExbD-TonB转运系统的一部分, 该转运系统是能量依赖的运输外界阳离子进入机体进行生命活动的一个通道[23,24]。野生株在受刺激后大量表达exbD1基因, 有助于机体同EDTA争夺阳离子, 为细菌的大量繁殖做准备。多黏菌素B刺激结果说明野生株DBHS101对20 μg/mL多黏菌素B有一定耐药性, 突变株在这种条件下生长停滞可能是因为缺失Cpx双组分系统, 机体不能迅速启动耐药机制所以生长受阻, 由此我们推测Cpx系统参与多黏菌素B耐药过程, 当然这还需要后续进一步验证。本研究通过实验说明敲除cpxRA基因簇并不影响嗜水气单胞菌DBHS101毒力, 这与沙门氏菌[25]、大肠杆菌[26]等是不同的; 因此我们需要从嗜水气单胞菌的不同双组分系统间的关系及毒力基因表达谱方面继续探究来分析原因; 此外比较缺失突变株在其他环境压力、代谢等方面与野生株的差异来系统了解Cpx在嗜水气单胞菌中发挥的功能也是后续值得讨论的问题。
[1]Thune R L, Stanley L A, Cooper R K. Pathogenesis of gram-negative bacterial infections in warm water fish [J].Annual Reviews of Fish Diseases, 1993, 3: 145—185
[2]Popoff M. Aeromonas. Krieg N R, editor. Bergy’s Manual of Systematic Bacteriology, vol. 1. Baltimore [M]. Williams &Wilkins, 1984, 545—548
[3]Altwegg M, Geiss H K. Aeromonas as a human pathogen[J].Critical Reviews in Microbiology, 1989, 16: 253—286
[4]Austin B, Austin D A. Bacterial fish pathogens. Disease of Farmed and Wild Fish [M]. 5th ed Chichester: Springer Praxis, 2012, 119—146
[5]Cipriano R C.Aeromonas hydrophilaand Motile Aeromonad Septicemias of Fish [M]. Fish Disease Leaflet, 2001, 68
[6]Conrad M. Cross-scale information processing in evolution, development and intelligence [J].Biosystems, 1996,38(2—3): 97—109
[7]Raivio T L, Silhavy T J. Transduction of envelope stress in Escherichia coli by the Cpx two-component system [J].Journal of Bacteriology, 1997, 179(24): 7724—7733
[8]Zhang X J, Yang W M, Li T T,et al. The genetic diversity and virulence characteristics ofAeromonas hydrophilaisolated from fishponds with disease outbreaks in Hubei province [J].Acta Hydrobiologica Sinica, 2013,37(3): 458—466 [张旭杰, 杨五名, 李彤彤, 等. 湖北地区暴发病池塘中嗜水气单胞菌的遗传多样性和毒力特征研究. 水生生物学报, 2013, 37(3): 458—466]
[9]Ho S N, Hunt H D, Horton R M,et al. Site-directed mutagenesis by overlap extension using the polymerase chainreaction [J].Gene, 1989, 77(1): 51—59
[10]Hu Y H, Liu C S, Hou J H,et al. Identification, characterization, and molecular application of a virulence-associated autotransporter from a pathogenic Pseudomonas fluorescens strain [J].Applied and Environmental Microbiology, 2009, 75(13): 4333—4340
[11]Kristin S, Emina C, Elke H,et al. Molecular and proteome analyses highlight the importance of the Cpx envelope stress system for acid stress and cell wall stability inEscherichia coli[J].Microbiology Open, 2016, 5(4): 582—596
[12]Li A H. The study of the drug resistance, resistance plasmid of fish pathogenic bacteria, and the antibacterial action of several drug in China [D]. Ph D thesis, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan.1998 [李爱华. 我国鱼类病原菌耐药性、耐药质粒及几种药物抗菌作用的研究. 中国科学院水生生物研究所博士学位论文. 武汉. 1998]
[13]Acosta N, Pukatzki S, Raivio T L. TheVibrio choleraeCpx envelope stress response senses and mediates adaptation to low iron [J].Journal of Bacteriology, 2015, 197:262—276
[14]Raivio T L, Leblanc S K, Price N L,et al. The Escherichia coli Cpx envelope stress response regulates genes of diverse function that impact antibiotic resistance and membrane integrity [J].Journal of Bacteriology, 2013,195: 2755—2767
[15]Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-ΔΔCt)method [J].Methods, 2001, 25(4): 402—408
[16]McEwen J, Silverman P. Chromosomal mutations of Escherichia coli that alter expression of conjugative plasmid functions [J].Proceedings of the National Academy of Sciences of the United States of America, 1980, 77:513—517
[17]Cosma C L, Danese P N, Carlson J H,et al. Mutational activation of the Cpx signal transduction pathway ofEscherichia colisuppresses the toxicity conferred by certain envelope-associated stresses [J].Molecular Microbiology, 1995, 18: 491—505
[18]De W P, Lin E C. Cpx Two-Component Signal Transduction in Escherichia coli: Excessive CpxR-P levels underlie CpxA* phenotypes [J].Journal of Bacteriology, 2000,182(5): 1423—1426
[19]De W P, Kwon O, Lin E C. The CpxRA signal transduction system ofEscherichia coli: Growth-related autoactivation and control of unanticipated target operons [J].Journal of Bacteriology, 1999, 181(21): 6772—6778
[20]Gal-Mor O, Segal G. Identification of cpxR as a positive regulator of icm and dot virulence genes ofLegionella pneumophila[J].Journal of Bacteriology, 2003, 185(16):4908—4919
[21]Jubelin G, Vianney A, Beloin C,et al. Cpx R/Omp R interplay regulates curli gene expression in response to osmolarity inEscherichia coli[J].Journal of Bacteriology,2005, 187(6): 2038—2049
[22]Gerken H, Misra R. MzrA-EnvZ interactions in the periplasm influence the EnvZ/OmpR two-component regulon[J].Journal of Bacteriology, 2010, 192(23): 6271—6278
[23]Blanvillain S, Meyer D, Boulanger A,et al. Plant carbohydrate scavenging through tonB-dependent receptors: a feature shared by phytopathogenic and aquatic bacteria[J].PLoS One, 2007, 2: e224
[24]Schauer K, Gouget B, Carrière M,et al. Novel nickel transport mechanism across the bacterial outer membrane energized by the TonB/ExbB/ExbD machinery [J].Molecular Microbiology, 2007, 63: 1054—1068
[25]Humphreys S, Rowley G, Stevenson A,et al. Role of the two-component regulator Cpx AR in the virulence of Salmonella entetica serotype typhimurium [J].Infection andImmunity, 2004, 72(8): 4654—4661
[26]Debnath I, Norton J P, Barber A E,et al. The Cpx stress response system potentiates the fitness and virulence of uropathogenicEscherichia coli[J].Infection and Immunity, 2013, 81(5): 1450—1459

