不同糜子品种抗旱性研究
, ,
(1.内蒙古自治区农牧业科学院, 呼和浩特 010031; 2.呼和浩特市环境保护局, 呼和浩特 010020)
不良非生物因素环境因子如干旱、盐胁迫、冷害、氧胁迫、高温、低光照等会影响植物生长发育。其中干旱在农业生产中是造成农作物减产的最重要非生物因素。干旱胁迫造成的损失是其它逆境胁迫的总和,成为了阻碍农牧业可持续发展的严重问题[1]。糜子(PanicummiliaceumL.)又称黍、稷,栽培历史悠久,曾是人类最早的栽培谷物之一。其抗逆性强,耐旱、耐贫瘠、水分利用效率高,是干旱与半干旱地区的主要粮食作物。糜子是蒸腾最低、抗旱性最强的作物,具有较高的气孔蒸腾阻力和高叶片水势,形成每克干物质所需消耗水(255.12 g)。较耐旱节水作物谷子低约3 g、低于高粱约20 g、低于玉米约80 g,约为小麦(513 g)、大麦(534 g)等大作物的一半[2]。糜子是C 4植物,光合速率较高,干物质积累很快。C 3植物在低水分条件下完全停止生产干物质时,糜子仍能进行干物质生产。因此研究和探索糜子抗旱生态生理机制,对糜子优质高产栽培具有重要的参考价值[3]。
1 材料与方法
1.1 材 料
试验材料为内糜5号、内糜9号、伊糜5号、伊选黄糜、PY 2、PJ 1、PJ 2、205、242、247、248、259。种子来源于内蒙古自治区农牧业科学院。
1.2 方 法
种子处理:选取饱满均匀的种子,蒸馏水浸泡24 h。取萌动一致的种子,放入铺有2层滤纸的培养皿,每培养皿50粒种子,加入50 mL配制好的PEG-6000溶液。设对照(蒸馏水)及PEG浓度15%、25% 3个处理,每处理3次重复。
幼苗处理:清水培养24 h露白后,取萌动一致的种子放入装有沙壤土的花盆中,温室培养。待幼苗长到40 d(3叶1心)时,进行水分处理。分别继续浇水和质量浓度为25%的PEG-6000溶液5 d,干旱处理至叶片严重卷曲时,测定各生理指标[4]。
1.3 测定指标及方法
1.3.1 发芽率、发芽势测定
在种子发芽第3天测定发芽势,第7天测定发芽率及种子根长、芽长。
1.3.2 存活率测定
进行干旱胁迫5 d后,统计糜子品种幼苗成活株数。
1.3.3 细胞膜透性测定
采用电导率法测定。取0.5 g糜子幼苗叶片,蒸馏水冲洗,用滤纸吸干表面水分,电导率仪测定初始电导率,再将其置于沸水浴中煮沸15 min,冷却后测定其电导率。细胞膜透性以电导率表示。电导率(%)=处理电导率/煮沸后电导率×100%。
1.3.4 超氧化物歧化酶(SOD)活性测定
取糜子幼苗叶片0.2 g,加磷酸缓冲液研磨得10 mL匀浆,13 000 r/min下离心20 min,取上清液,按顺序加入蛋氨酸缓冲液、乙二胺四乙酸溶液、核黄素溶液、蓝四氮唑溶液,阳光下显色15 min,蒸馏水为参比液,波长560 nm处测定光密度值[5]。
1.3.5 丙二醛含量测定
取材料叶片0.2 g,加磷酸缓冲液研磨得10 mL匀浆,13 000 r/min下离心20 min,取上清液,加入硫代巴妥酸溶液,沸水浴加热15 min,冷却后4 000 r/min下离心5 min,以硫代巴妥酸溶液为参比液,分别在波长532 nm和600 nm处测定光密度值[5]。
1.3.6 游离脯氨酸含量测定
采用茚三酮法测定。取同位同色叶片0.1 g,分别置于20 mL试管中,加入5 mL 3%磺基水杨酸溶液,沸水中浸提10 min,取出试管,冷却至室温后,吸取上清液2 mL加入2 mL冰乙酸和3 mL显色液,于沸水中加热40 min,冷却后加甲苯5 mL萃取后在520 nm下比色,并通过脯氨酸标准曲线计算得到脯氨酸的值。从标准曲线中得到脯氨酸的浓度,按以下公式计算脯氨酸含量的百分数:
脯氨酸[μg/g]=(C×V/a)/W。
式中:C为提取液中脯氨酸的浓度(μg),由标准曲线中求得;V为提取液总体积(mL);a为测定时所吸取的体积(mL);W为样品重(g)[5]。
2 研究结果
2.1 水分胁迫对不同糜子品种种子发芽特性的影响
干旱胁迫程度随PEG-6000浓度的增加而增加,不同糜子品种的发芽率、发芽势均呈下降趋势。其中,内糜9号发芽率、发芽势下降幅度最小。在25%浓度下,仍可保持95%以上的发芽率。伊选黄糜发芽率、发芽势下降幅度最大,在25%浓度下,发芽率仅为7%,干旱胁迫对种子造成很大伤害。PJ 2发芽率、发芽势在对照及处理情况下均不高,但其较对照下降幅度较低。重度干旱胁迫延迟了各品种种子发芽进程。
随着干旱胁迫程度的增加,各品种根长、芽长比均有显著上升。干旱胁迫刺激了根部的生长,利于水分的吸收,是糜子品种适应干旱胁迫的一种响应方式。
综合以上指标,在不同水分胁迫下种子发芽率较高的糜子品种有:内糜9号、内糜5号、242、247、259。PJ 1,伊选黄糜发芽率最低。
2.2 水分胁迫对糜子幼苗存活率的影响
存活率是反映作物抗逆性的重要指标。在干旱胁迫下,各糜子品种的存活率均呈下降趋势,不同品种间差异显著(表2)。其中存活率高于80%的品种有:PJ 1、内糜5号、242、PJ 2;存活率低于50%的品种有:内糜9号、伊选黄糜、205。
表1 不同糜子品种在干旱处理下的发芽特性

品种 发芽率(%) 发芽势(%) 根长/芽长比 ck15%25%ck15%25%ck15%25%内糜5号100.0100.072.6100.098.086.6143.0179.0325.0内糜9号100.099.096.798.097.096.767.283.9128.0伊选黄糜96.095.07.095.070.03.066.7105.0158.8伊糜5号99.094.034.095.094.034.080.0164.0249.0PJ199.098.043.397.386.739.362.966.066.7PJ220.719.315.320.017.316.057.875.6116.7PY297.397.063.396.796.754.766.5186.1158.820599.099.092.399.097.086.673.0129.3269.0242100.098.085.798.091.390.757.193.1195.024799.094.091.398.091.390.384.6105.6135.7248100.096.587.397.094.784.061.485.7252.925999.096.091.397.094.082.488.3185.0241.4
表2 干旱胁迫下糜子品种存活率及生理指标的相对变化

品种存活率相对电导率(%)相对SOD活性(%)相对Pro含量(%)相对MDA含量(%)排序内糜5号89.7b163.2231.5200.9152.12内糜9号47.3j313.5110.7107.7323.710伊选黄糜41.7k351.7107.8107.3338.211伊糜5号75.8f232.9150.6132.4223.76PJ192.3a150.3245.7207.5124.51PJ280.5d203.4195.9165.7182.14PY251.9i291.6125.8110.6293.1920530.5l382.897.5101.7358.91224288.4c180.7213.9182.3179.2324760.7h267.6139.3119.2267.9824869.1g253.5143.6127.1259.8725977.3e215.3172.7148.7201.55
注:SOD为超氧化物歧化酶;Pro为游离脯氨酸;MDA为丙二醛(p<0.01)。
2.3 水分胁迫对糜子幼苗电导率的影响
水分胁迫伤害了植物叶片细胞,使得细胞膜相对透性增加,相对电导率是反映细胞膜受损的重要指标,在干旱胁迫下,糜子品种电导率均呈上升的趋势(图1)。其中205电导率最大,伊选黄糜次之;PJ 1电导率最小,其次为内糜5号。各材料间差异显著(p<0.01),与存活率呈显著负相关。在干旱胁迫下,PJ 1细胞膜受损程度较重,抵御干旱胁迫能力较强;205最重。
2.4 水分胁迫对糜子幼苗SOD活性的影响
在水分胁迫下,各材料间SOD活性变化差异显著(p<0.01)。其中,PJ 1的SOD活性最高,205的SOD活性最低。从表2可知,水分胁迫下糜子幼苗SOD活性与存活率呈正相关关系。

图1 不同糜子品种在水分胁迫下电导率的变化
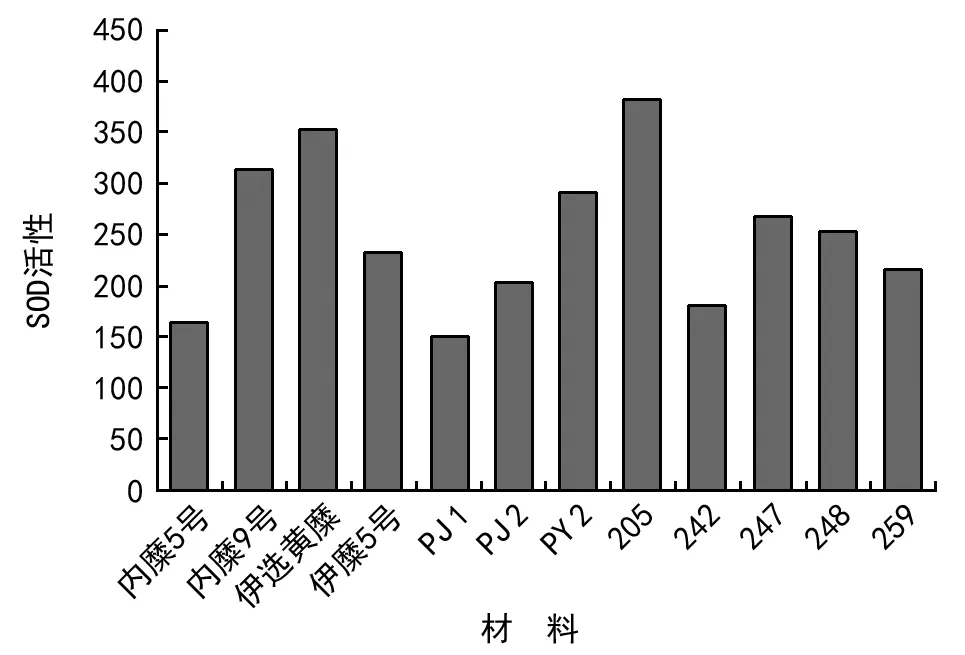
图2 不同糜子品种在水分胁迫下SOD活性的变化
2.5 水分胁迫对糜子幼苗MDA含量的影响
水分胁迫下各材料丙二醛含量变化均呈显著差异(p<0.01)。PJ 1的MDA含量最低,内糜5号次之;205的MDA含量最高。各材料的丙二醛含量表明在水分胁迫下205受到的伤害最大,PJ 1最小。

图3 不同糜子品种在水分胁迫下丙二醛含量的变化
2.6 水分胁迫对糜子幼苗Pro含量的影响
水分胁迫下各材料Pro含量呈现差异显著(p<0.01)。PJ 1的Pro含量最高,内糜5号次之,205的Pro含量最低。

图4 不同糜子品种在水分胁迫下游离脯氨酸含量的变化
3 讨 论
PEG模拟干旱胁迫减缓了糜子种子萌发进程,并降低了发芽率。较抗旱品种在干旱胁迫下表现出较高的根长、芽长比。干旱胁迫在一定程度上促进了根的生长以利于吸收水分,其具体生理机制有待进一步的研究。
干旱胁迫下,植物细胞电导率可反映植株受伤害程度。逆境胁迫使植物细胞膜受到伤害,细胞膜透性增大使得细胞电解质外渗量增加,其增幅的大小在一定程度上能够反映植物抵御逆境胁迫能力的强弱[6]。PEG模拟干旱胁迫下,PJ 1、内糜5号电导率较低;205电导率最高。干旱胁迫对PJ 1、内糜5号细胞膜伤害程度较小。
植物体内部分水解酶或与水解相关的酶包括一些氧化酶的活性,在逆境胁迫下,其活性会在一定程度上升,帮助植物抵御逆境胁迫。SOD对防止自由基活性氧的毒害至关重要,是植物体内清除活性氧的第一道防线[7]。抗旱性强的品种保护酶活性在逆境条件下可维持较高水平,有利于降低细胞膜受到伤害的程度[7]。植物细胞清除自由基能力随SOD活性维持上升的时间增加而加强。PEG模拟干旱胁迫下,供试材料PJ 1、内糜5号SOD维持高活性时间较长,其清除自由基能力较强,抗性较强;205的SOD活性最低。
植物器官在遭到逆境胁迫或衰老时,细胞发生膜脂过氧化作用,丙二醛含量增加。作为膜脂过氧化最终产物,丙二醛的积累在一定程度上伤害植物细胞,与电导率表现一致。丙二醛含量可以作为反映植物遭到逆境胁迫程度的重要指标之一[8]。植物细胞受伤害程度越大,丙二醛含量增幅越大[9]。PEG模拟干旱胁迫下,供试材料PJ 1、内糜5号丙二醛含量最低,其膜系统受伤害程度最轻;205的丙二醛含量最高。
游离脯氨酸在植物体中起到渗透调节作用,在一定程度逆境胁迫下其活性被激发,含量增加。游离脯氨酸亲水性可防止逆境胁迫时植物组织细胞的脱水,反应或与酶调控有密切的关系[10]。植物在逆境胁迫下通过游离脯氨酸含量的增加协助抵御逆境,消除蛋白质分解初期产生的氨,并防止其它有毒物质的积累[11]。本试验结果显示,干旱胁迫下,PJ 1、内糜5号游离脯氨酸含量最高,205最少。
4 结 论
干旱胁迫下,各糜子品种发芽率、发芽势均呈下降趋势,根长、芽长比上升。各品种间作为清除自由基重要物质的SOD活性,调节渗透物质Pro含量变化显著不同。抗旱性强的品种SOD活性及Pro含量显著高于抗旱性弱的品种,且与存活率呈显著正相关。MDA作为伤害积累物质,在干旱胁迫下其含量显著增加。抗旱性弱的品种MDA含量高于抗旱性强的品种,与存活率呈显著负相关。综合分析存活率及生理指标相对值的变化,初步得出供试品种的抗旱能力强弱依次为PJ 1>内糜5号>242>PJ 2>259>伊糜5号>248>247>PY 2>内糜9号>伊选黄糜>205。
[1]刘锦川.加拿大披碱草与老芒麦亲缘关系及抗性生理研究[D].呼和浩特:内蒙古农业大学,2011.
[2]胡银岗,林凡云,王士强,等.糜子抗旱节水相关基因PmMYB的克隆及表达分析[J].遗传,2008,10(3):373-379.
[3]高俊山,魏仰浩.我国糜子的抗旱适应性及其在干旱地区农业生产中的地位[J].粟类作物,1990(4):30-33.
[4]华东师范大学生物系.植物生理学实验指导[M].北京:高等教育出版社,1980.
[5]张盼盼.糜子抗旱性鉴定与抗旱指标筛选[D].陕西杨凌:西北农林科技大学,2010.
[6]刘锦川,云锦凤,张磊.氯化钠胁迫下3种披碱草属牧草生理特性的研究[J].草地学报,2010(5):694-697.
[7]刘锦川,云锦凤.披碱草属3种牧草幼苗对水分胁迫的影响[J].种子,2010,29(9):17-20.
[8]倪郁,郭彦军,吕俊,等.水分胁迫下豆科牧草的生理生化变化[J].土壤通报,2004(6):275-278.
[9]易津,王学敏,谷安琳,等.驼绒藜属牧草种苗耐盐性评价及生理基础研究[J].草地学报,2003,11(2):110-116.
[10]卢少云,陈斯平,陈斯曼.三种暖季型草坪草在干旱条件下脯氨酸含量和抗氧化酶活的变化[J].园艺学报,2003,30(3):303-306.
[11]裴真明,贺道耀,汤章城.质膜氧化还原系统中的抑制物及其特性[J].植物学报,1995(10):116-121.
[12]路贵和,安海润.作物抗旱性鉴定方法与指标研究进展[J].山西农业科学,1999,27(4):39-43.

