A/O工艺中污泥浓度对微生物群落结构的影响
罗 晓,郑向阳,赵丛丛,张立国,钟为章 (1.河北科技大学环境科学与工程学院,河北 石家庄 050018;.河北科技大学建筑工程学院,河北 石家庄 050018;.山西大学环境与资源学院,山西 太原 00006)
传统脱氮工艺是通过氨化、硝化和亚硝化、反硝化细菌的同化作用,经由有机氮化合物→NH4+-N→NO2-→NO3-→N2和有机氮化合物→NH4+-N→ NO2-→N2过程完成脱氮[1].目前脱氮工艺关注点由脱氮机理[2]、运行参数的控制[3]以及多种脱氮工艺耦合设计[4]逐渐转向了脱氮功能微生物的研究[5].但由于微生物培养条件复杂,仅有 1%~1.5%的微生物为可培养生物,所以采用传统生物学技术难以说明低丰度微生物及群落结构间的相互关系,无法用于分析污水处理工艺操作参数与脱氮微生物菌群特征之间的相互关系[6].
基于16s rDNA的高通量测序技术为揭示脱氮功能菌群及群落多样性提供了有力的手段[7].相关学者对不同处理工艺、温度、溶解氧浓度下的脱氮效果与微生物群落结构均有所研究[8-10].李鹏等[11]、窦娜莎等[12]、李志静等[13]研究发现,变形菌门、厚壁菌门和拟杆菌门为多种水处理工艺的主要菌门,同时,提高进水温度,控制氧气、NH4+-N浓度等,对微生物群落结构的相对丰度比例产生重要影响,从而影响水质处理效果.除去水处理工艺、温度、溶解氧、及NH4+-N浓度外,污泥浓度(MLSS)也是影响水处理效果的重要因素之一,有学者认为,提高MLSS可提高反硝化速率和脱氮效率[14],但 COD受其影响较小[15].辛海霞等[16]利用布生物反应器(FBR)处理高氨氮废水时发现,当污泥浓度小于6500mg/L时, NH4+-N去除率由 91.53%升至 95.85%,污泥浓度继续增加,NH4+-N去除率迅速下降,但是污泥浓度的高低致使微生物结构及功能代谢产生哪些差异,影响脱氮效果,相关报道相对较少.
因此,本文以平行运行的两组A/O工艺为出发点,结合其进出水水质,研究污泥浓度对脱氮性能的影响;利用 Illumina MiSeq测序技术,解析两组A/O池体中微生物群落构成及多样性,并确定优势脱氮菌群与水质、污泥浓度的相关性;同时通过生物信息学手段,考察两组池体中功能基因、代谢通路的差异,为优化A/O工艺提供技术支持与理论依据.
1 材料与方法
1.1 样品采集
污泥样品取自河北省某化工企业污水处理站,设计水量 15000m3/d,该站进水主要有 3个来源:淀粉厂区废水、维生素B12厂区废水和企业内部生活污水,其中生活污水量仅占总水量的 8%.该站主体工艺为多组改良型A/O工艺,进水COD和NH4+-N平均浓度分别为500mg/L和450mg/L,水质监测时间为3月4日至4月25日.水质处理效果稳定后,于第15d分别从两组A/O工艺池中取活性污泥样品,1号池两个:A1、O1,2号池 2个:A2、O2,且 1、2号池 MLSS 分别为 4066,2985mg/L.取样置于冰桶中运回实验室,离心(5min,11000r/min)后称取5g,冷冻于-80℃冰箱中,准备DNA提取.
1.2 污泥DNA提取及PCR扩增
DNA 提取采用 PowerSoil®DNA Isolation Kit试剂盒(Mobio),按照试剂盒流程提取 DNA,并进行DNA浓度、纯度及完整性检测.DNA浓度及纯度检测利用Genesys 10s紫外可见分光光度计(Thermo),依据其在260nm和280nm之间吸光率比率值(1.80~2.0之间)及在260nm和230nm吸光率比率值(高于1.70)进行判断.DNA完整性利用2%TAE稀释溶液、1%琼脂糖凝胶电泳检测,在SYSTEM GelDoc XR+凝胶成像系统(Bio-Rad)观察条带完整性,电泳时间45min,电压90V.
对提取到的DNA的16S rDNA V4区进行扩增.以所提取的各样品 DNA为模版,反应体系为30μL,选 用 通 用 上 游 引 物 为 EUb341f:5’-cctacgggaggcagcag-3’下游引物为 Eub907r:5’-ccgtcaattcctttgagt tt-3’.其中向PCR扩增管中添加DNA 模板 0.5μL,正反向引物各 0.6μL,灭菌水22.4μL,dNTP2.4μL,3μL 缓冲液,ExTaq 酶 0.5μL.扩增结束后,运用1%琼脂糖凝胶电泳对PCR产物进行检测,使用Axyprep DNA凝胶回收试剂盒(AXYGEN)切胶回收DNA.PCR扩增后的条带亮度明显,位置清晰,可直接用于后续测序分析.委托北京理化分析测试中心进行Illumina MiSeq高通量测序.
1.3 常规水质指标测定
遵循国家标准方法测定 NH4+-N、NO3--N和 NO2--N等常规水质指标[17],利用重量法测定MLSS.
1.4 Miseq测序及生物学分析
本研究采用Illumina MiSeq PE2 × 125方法进行测序.测序数据下机后(Raw reads),根据Barcode拆分不同样本数据,并去除Barcode序列及引物序列.采用FLASH拼接Miseq原始数据,拼接成功率控制在 90%以上[18].利用 MOTHUR去除含 N的序列及低质量序列[19],利用Usearch7.1软件对获得的高质量序列操作分类单元(OTU),OTU中序列之间的相似性设定为97%[20],并将获得的OTU与SILVA(Realease123,www.arb-silva.de)非冗余度0.9的16S序列数据库比对,获得各OTU代表序列的分类信息.
使用 MOTHUR软件计算各个样本 Alpha多样性指标,以反映本次测序深度、物种均匀性等;使用R软件对样本绘制heatmap并分析;使用PICRUST软件[21]完成本次测序功能分析,通过自编脚本程序将所获得序列对比Greengenes数据库(gg_13_5版本),参考序列最近邻居,寻找亲缘关系最近祖先并预测样品中除16S的其它基因片段,获得本次 A/O工艺各工段功能基因计数,从而实现对池体中微生物群落的代谢功能分析.
2 结果与讨论
2.1 MLSS对脱氮性能的影响
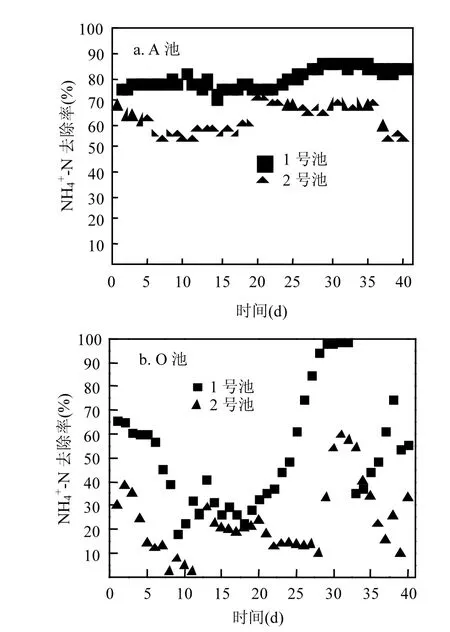
图1 NH4+-N去除率Fig.1 The scatter plot of ammonia nitrogen removal effect
由图 1、表 1可见,当 MLSS为 2985mg/L时,NH4+-N去除率较低,A池NH4+-N平均去除率仅为57.97%,O池NH4+-N平均去除率为23.27%,最终出水浓度为 147.47mg/L,当 MLSS升高至4066mg/L,A池NH4+-N平均去除率为 80.78%,平均出水浓度78.44mg/L,O池NH4+-N平均去除率为 51.81%,最终出水浓度为 40.19mg/L.其中NO3--N和NO2--N浓度在1号池A池、O池中均高于2号池,反映出1号池中硝化菌及亚硝化菌数量较多,硝化作用及亚硝化作用强烈,NH4+-N 浓度较低,反硝化作用强烈.在相同运行条件下,MLSS的高低对A/O工艺脱氮性能有着显著影响.因此,在处理高浓度 NH4+-N 废水时,MLSS可适当调高即污泥停留时间(SRT)适当延长,但MLSS过高则会引起微生物内源呼吸,产生 SMP积累,抑制硝化菌生长代谢,从而影响NH4+-N 去除效果[22]. Kawasaki等[23]研究发现,MLSS较低时,有机物不能被完全降解,当 MLSS维持在3000~5000mg/L时,处理效果稳定.

表1 NH4+-N、NO3--N和NO2--N平均浓度(mg/L)Table 1 The average concentration of NH4+-N,NO3--N and NO2--N(mg/L)
2.2 微生物多样性分析
经PCR和高通量测序后,4个污泥样品(A1、O1、A2、O2)获得有效序列数在70275~273582之间.为了解析活性污泥中微生物群落结构丰富度,在 97%的相似度水平对有效序列归类OTU 并统计各样本的 α-多样性指数见表 2.各样本 OTU 数量在 3929~8027之间,分别为:6022(A1)、3929(O1)、6151(A2)和 8027(O2)OTUs.各样品覆盖率均在 97%以上,说明本次测序可以覆盖群落的多样性,污泥中大多数微生物均已被检测出来.
Chao1指数、ACE指数和Shannon指数表示微生物群落结构的变化,Chao1指数和ACE指数越高,表明群落丰富度越高,Shannon指数越高,群落物种的多样性越高[24].表 2显示,2号池的Chao1指数、ACE指数和Shannon指数均较高,即2号池的物种丰度和多样性均高于1号池.其原因可能为1号池中污泥量较高,微生物的死亡-再生现象加剧,提供了更多反硝化碳源[25],使得脱氮效率提高,NH4+-N浓度降低,具有脱氮性能的微生物群落结构增殖迅速,使得样本多样性和丰度降低.
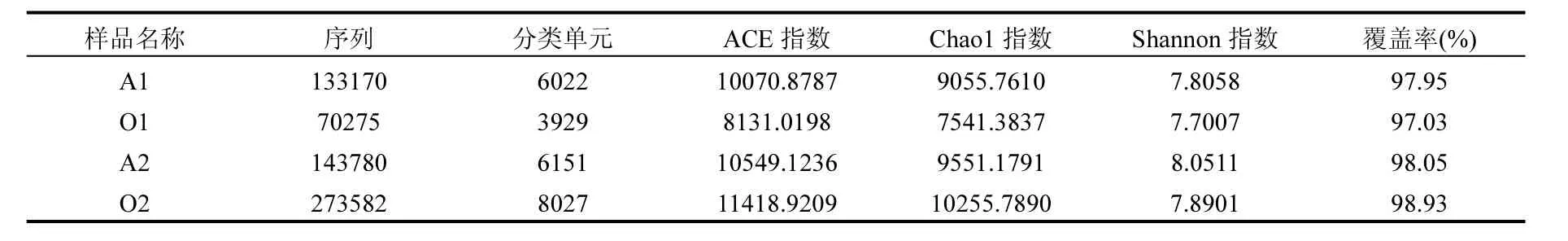
表2 4个样品中细菌群落指数Table 2 Species abundance and diversity of 4samples
2.3 微生物菌群分布特点
基于SILVA数据库的分类信息,对1、2号池样品测序数据进行了门、纲和属水平上的分类及分析.如图2所示,在门水平,4个样品共检测出55个菌门.A1和O1样品中变形菌门Proteobacteria为优势菌,丰度分别为 41.28%和 40.02%,其次是Bacteroidetes(24.69%和 25.82%)、Chloroflexi(7.74%和 7.95)、Firmicutes(7.73%和 7.3%)和Chlorobi(2.93%和 2.74%).A2和 O2样品中Bacteroidetes为优势菌,丰度分别为 33.78%和32.77%,其次是Proteobacteria(29.48%和31.08%).此 外 Chloroflexi、Firmicutes、Chlorobi、Actinobacteria、Candidate division TM7、Verrucomicrobia、Acidobacteria和 Candidate division OD1(相对丰度>1%)也是 A2、O2 样品中的主要门类.结果表明,1号和2号池体中微生物群落结构和丰度上差异较小.但在污水处理发挥脱氮除磷、降解多种污染物作用的的变形菌门(Proteobacteria)[26]含量不尽相同,差异明显,在NH4+-N处理效果较好的 A1、O1中,含量较高,分别为41.28%和40.02%,而脱氮性能较差的A2、O2中含量较低,分别为29.48%和31.08%.两池体中最优势菌门分别为 Proteobacteria(1号池)和Bacteroidetes(2号池).2号池体中在门一水平类群较为多样,且受到污泥回流影响,各池体中缺氧段和好氧段的微生物群落结构和丰度差异不大,这与以往很多研究结论一致.宋云龙等[27]研究发现,在A/O工艺中式装置中,缺氧段和好氧段优势微生物种类相同且Proteobacteria、Actinobacteria Bacteroidetes、Planctomycetes 、Acidobacteria等优势菌群相对丰度比例差异仅为1%~3%.
由表 3可知,所选 4个样品中 β-变形菌纲(β-Proteobacteria)是变形菌门中丰度最大的菌群,其在1号池体和2号池体中比例分别约占20%和12%.而β-Proteobacteria也是在脱氮除磷中发挥重要作用的菌群,其菌纲中的某些细菌与污泥反硝化有关[28].1号池 α-Proteobacteria和 γ-Proteobacteria的相对丰度均高于 2号池.δ-Proteobacteria和ε-Proteobacteria相对丰度两池体相近,且ε-Proteobacteria总体丰度最低.

表3 变形菌门(Proteobacteria)各纲分布Table 3 The distribution of classes of Proteobacteria
本次研究与先前研究结果相似.Hu等[29]通过454焦磷酸盐测序技术研究12座污水处理厂后发现,变形菌门尤其是β-Proteobacteria在各污水场中在门和纲级别相对丰度比例分别最高,而Ye 等[30]通过实验室装置研究得出,α-Proteobacteria、γ-Proteobacteria、ε-Proteobacteria等在硝酸盐还原过程中发挥了重要作用.
属分类水平上,1号池体和 2号池体微生物群落结构如图 3所示.其中,1号主要菌属为Thauera、Stenotrophomonas和Sphingomonas,其丰度分别为 13.99%、3.87%、3.55%(A1)和12.15%、3.67%、2.76(O1).其中,隶属于 β-变形菌(β-Proteobacteria)的陶厄氏菌属(Thauera)为最主要的反硝化脱氮微生物,在反硝化以及芳香族化合物的降解过程起了十分重要的作用[31-32].此外,A1、O1样品中的主要类群还包括Blautia、Lactobacillus、Sandaracinus和Bacillus等(相对丰度>1%).与 1号池相比,2号池中主要属类为Thauera、Stenotrophomonas、Sphingomonas、Blautia和Lactobacillus(相对丰度>1%)等菌属,在两池体差异较为明显的菌属为陶厄氏菌属Thauera,分别为 13.07%(1号池)和 5.78%(2号池),Sandaracinus,分别为 1.33%(1号池)和0.37%(2号池),同时,同一池体缺氧段好氧段菌属丰度比例差异不大.
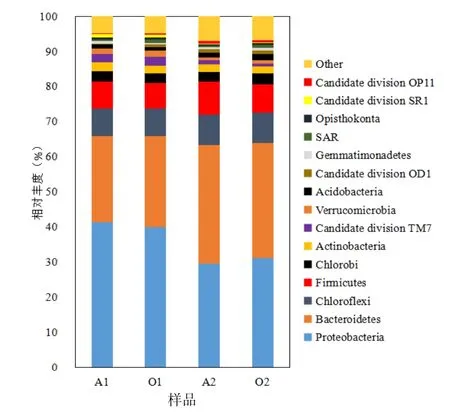
图2 门水平下微生物群落相对丰度Fig.2 Relative abundance of phylum in all samples
所取各样品中氨氧化菌(AOB)与亚硝酸盐氧化菌(NOB)种类一致,AOB包含亚硝化螺菌属(Nitrosospira)、亚硝化单胞菌属(Nitrosomonas)和亚硝化球菌属(Nitrosococcus),其中相对丰度比例较高者为亚硝化单胞菌属(Nitrosomonas),该菌广泛存在于水、土壤中,是能氧化氨为亚硝酸的化能自养细菌[33].NOB 包含Candidatus Nitrotoga和硝化螺菌属(Nitrospira).1号池AOB和NOB相对丰度分别为0.583%和0.476%,2号池 AOB和 NOB相对丰度分别为 0.355%和0.376%.1号池中AOB、NOB相对丰度比例均高于2号池,NH4+-N代谢效果优于2号池.AOB、NOB含量在各池体中相对丰度均低于 1%,但不影响其高效脱氮.Ye等[30]和Ma等[34]的研究均表明,活性污泥中AOB和NOB相对丰度比例处于0.01%~1%的条件下,在焦化废水处理厂和实验室装置中均能达到高效脱氮.

图3 属水平下微生物群落相对丰度Fig.3 Relative abundance of genus in all samples
2.4 微生物群落结构分析
在属的水平对样品及其所含菌属进行聚类分析,并根据各样品中不同OUT所含丰度绘制热图(heatmap),以反映在菌属水平上聚类差异及群落结构差异性,如图4所示.
从总体来看,与A2、O2相比,A1、O1之间群落结构和丰度差异均比较大.这说明当 A/O工艺MLSS较高时,微生物活性增加,使得缺氧段与好氧段各池体特定功能菌群代谢旺盛.结合非加权UniFrac距离可知(表4),对比缺氧段A1和A2、好氧段O1和O2可发现,群落结构在好氧段具有明显差异,MLSS对于好氧段作用强于缺氧段.
由图 4可知,各样品微生物热图可划分为 4个Cluster.菌属的丰度受到了MLSS的影响,其中1、2号池中菌群变化较为明显的从属于Cluster 1和 Cluster 4.Cluster 1主要包括Peritrichia、OPB35soil group uncultured和Sphingobacteriales等,Cluster 4主要包括 Thauera 2、Hyphomonadaceae uncultured、Saprospiraceaeuncultured 1和Cytophagaceaeuncultured.Cluster 1和Cluster 4中大部分菌群属于硝化菌、反硝化菌,并且Thauera和Saprospiraceaeuncultured 1等为优势菌群,其在脱氮过程中发挥了重要作用[35].

图4 属水平的前50个物种相对丰度热图Fig.4 Heatmap tree based on the relative abundance of top 50genus in all samples

表4 4个样品非加权UniFrac距离Table 4 Unweighted unifrac distance between 4samples
2.5 不同池体活性污泥的功能分析
基于宏基因组测序的物种信息,通过PICRUST软件与KEGG基因数据库(京都基因与基因组百科全书)和通路数据库进行对比分析,预测各样品功能基因组成[36].在第一层级的功能基因分类中,两组 A/O工艺中功能基因排序相同,主要分为细胞过程(Cellular Processes)、环境信息处理(Environmental Information Processing)、遗传信息处理(Genetic Information Processing)、人类疾病(Human Diseases)、代谢机制(Metabolism)、无(None)、生物系统(Organismal Systems)和未分类(Unclassified)等 8类.丰度最高的功能基因是代谢机制相关基因(1号池50.08%, 2号池 50.05%),其次是与遗传信息处理(1号池16.59%,2号池 16.91%)、环境信息处理(1号池13.41%,2号池13.38%)、细胞过程(1号池3.84%,2号池3.78%)、人类疾病相关基因(1号池1.06%,2号池 1.01%)、有机系统(1号池 0.83%,2号池0.81%)、未明确分类及无功能基因序列(1号池14.17%,2号池14.04%),除去遗传信息处理相关基因在1号池中含量略低,其余均在1号池中含量高.
在KEGG子类中,各类代谢相关基因如图5所示,膜转运相关基因是两种污泥功能基因中最大的类群(1号池11.10%,2号池11.18%).其次是氨基酸代谢相关基因(1号池 10.49%,2号池10.48%)和碳水化合物代谢相关基因(1号池10.27%,2号池 10.32%).随后是复制和修复(1号池7.40%,2号池7.38%)、能量代谢(1号池5.91%,2号池5.94%)、未识别基因(1号池5.09%,2号池5.10%)、翻译(1号池4.73%,2号池4.73%)、辅助因子和维生素代谢相关基因(1号池4.25%,2号池4.25%)等.这8类KEGG子类群在两组池体中的排序是相同的.其中,2号池中关于细胞通讯(Cell Communication)和感觉系统(Sensory System)功能基因含量明显高于1号池.
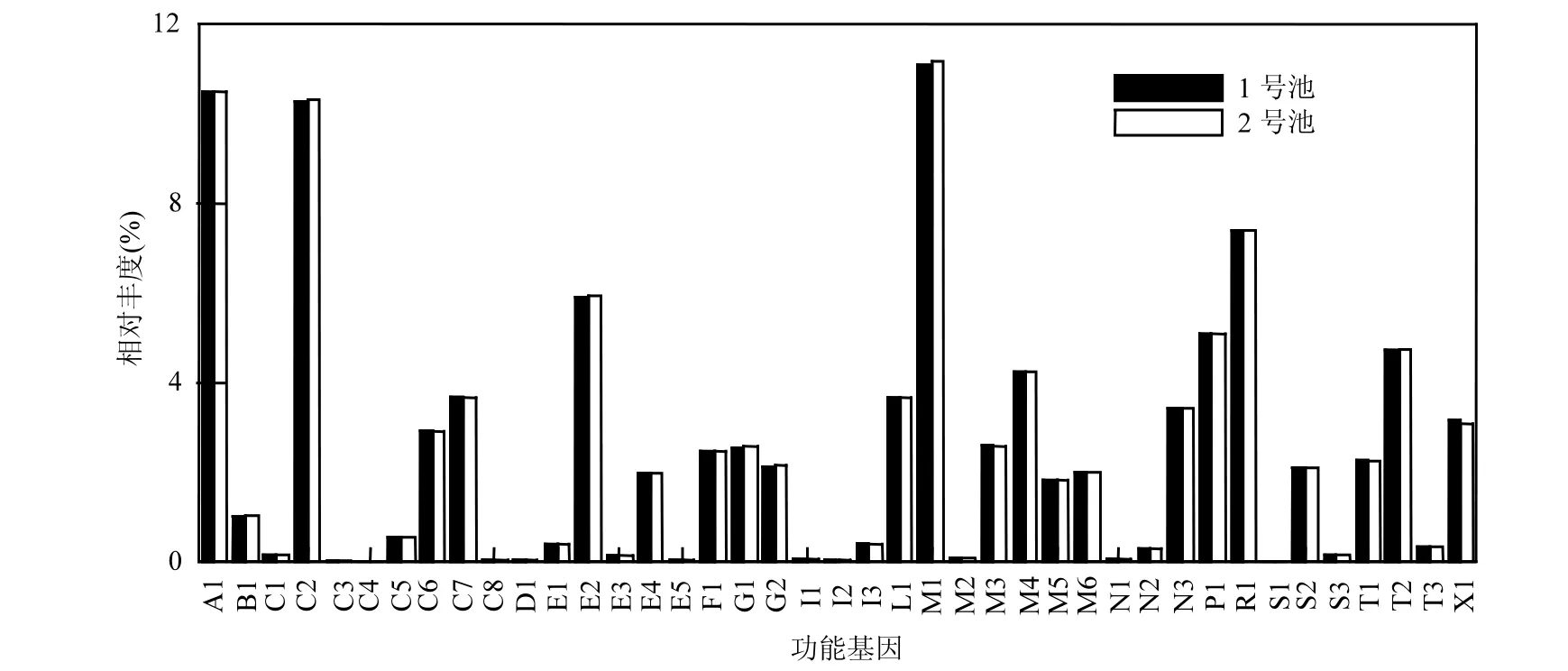
图5 两组池体功能基因分类的相对比例(Level 2)Fig.5 Relative proportions of functional classification in different tanks (Level 2)
脱氮效果是考量A/O工艺是否正常运行的重要指标之一,氮代谢基因广泛分布于 A/O工艺的污泥系统中.根据本次测序结果,结合KEGG 数据库,得到参与氮循环的基因序列(硝化、反硝化、氨化及固氮过程),筛选出并进行数学统计归类,得到氮代谢途径及各类基因数量,如图 6所示.结果显示,反硝化相关的功能基因序列在 1、2号池体中相对含量较高.其次是氨化、硝化和固氮相关功能基因.反硝化与氨化功能基因序列占优势地位,与田美等[37]及Yu等[38]的研究保持一致.除了EC1.7.99.6编码氧化亚氮还原酶、EC1.18.6.1编码固氮酶和EC1.7.3.4编码硝化酶的基因在 2号池(0.017%,0.023%,0.0045%)中相对含量高于 1号池(0.015,0.017%,0.0062%),其余编码硝化酶、反硝化酶和氨化酶的基因均在1号池中相对含量高,其中编码硝酸还原酶EC1.7.99.4基因含量最高.结合池体实际运行效果得知,编码反硝化酶和编码氨化酶的功能基因为影响该工艺处理效果的主要因素.

图6 两组池体参与氮循环关键酶的相对丰度Fig.6 Abundance of nitrogen cycle related key enzymes in the two tanks
3 结论
3.1 1号池和2号池进水水质相同,当MLSS分别为4066mg/L和2985mg/L时,其NH4+-N平均去除率分别为90.2%和67.2%.
3.2 两池体中微生物多样性差异不大,其优势菌门均为变形菌门、拟杆菌门、绿弯菌门和厚壁菌门,平均总相对丰度比例占到 81.09%以上;其中的A、O池微生物群落也不存在显著性差异.
3.3 在功能基因层面,两池体KEGG所有8个类别排序相同,氮代谢相关基因中,硝化酶、反硝化酶和氨化酶的相关功能基因在 1号池中含量均较高.
3.4 MLSS对A/O工艺脱氮效果有着重要影响,但过高也容易造成基质不足,影响微生物活性,为实现最佳脱氮效果,MLSS宜控制在4000mg/L左右.
[1]龚灵潇.缺氧/好氧生物膜工艺处理低碳氮比生活污水的脱氮特性 [D]. 北京:北京工业大学, 2013.
[2]成官文,吴志超,黄翔峰,等.沸石强化 A/O生物脱氮工艺氨氮去除机理研究 [J]. 环境工程学报, 2010,4(3):540-546.
[3]张鹏娟.A/O生物脱氮工艺影响因素及强化运行效果的试验研究 [D]. 郑州:郑州大学, 2013.
[4]徐峥勇.基于亚硝化、厌氧氨氧化与反硝化的脱氮耦合工艺及其控制策略研究 [D]. 长沙:湖南大学, 2011.
[5]赵继红,楼 燕,余志晟,等.城市污水厂(A/O工艺)微生物群落结构及其动态变化 [J].生态环境, 2008,17(3):898-902.
[6]Wintzingerode F V, Göbel U B, Stackebrandt E. Determination of microbial diversity in environmental samples: Pitfalls of PCR-based rRNA analysis [J]. FEMS Microbiology Reviews,1997,21(3):213-229.
[7]王绍祥,杨洲祥,孙 真,等.高通量测序技术在水环境微生物群落多样性中的应用 [J]. 化学通报, 2014,(3):196-203.
[8]孙豆豆.强化 A/O工艺低温脱氮效能与菌群特性研究 [D]. 哈尔滨:哈尔滨工业大学, 2015.
[9]赵文莉.复合碳源填料深度反硝化脱氮特性研究 [D]. 北京:北京工业大学, 2015.
[10]户海燕,瞿思宜,张正哲,等.分子生物技术在厌氧氨氧化工艺研究中的应用 [J]. 环境科学与技术, 2016,(1):20-26+43.
[11]李 鹏,毕学军,王 军,等.常规和倒置A2/O工艺活性污泥微生物群落结构的比较 [J]. 中国环境科学, 2017,37(3):1137-1145.
[12]窦娜莎,王 琳.不同温度下曝气生物滤池运行效能与微生物群落结构 [J]. 环境工程学报, 2016,10(6):2800-2806.
[13]李志静,孙宝盛,张笑雪,等.不同供氧策略和氨氮浓度下SBR中微生物群落的演变 [J]. 环境工程学报, 2017,11(1):359-365.
[14]Plósz B G, Jobbágy A, Jr G C. Factors influencing deterioration of denitrification by oxygen entering an anoxic reactor through the surface [J]. Water Research, 2003,37(4):853-863.
[15]邓仁健,张金松,曲志军.污泥浓度对双重后置反硝化工艺脱氮除磷的影响 [J]. 环境科学研究, 2014,27(7):797-803.
[16]辛海霞,季诚昌,张 凡,等.MLSS对FBR处理高氨氮印染废水的影响 [J]. 东华大学学报(自然科学版), 2015,41(5):692-695.
[17]国家环境保护总局.水和废水监测分析方法 [M]. 4版.北京:中国环境科学出版社, 2002:258-281.
[18]Tanja M, Steven L. FLASH: fast length adjustment of short reads to improve genome assemblies [J]. Bioinformatics, 2011,27(21):2957-2936.
[19]Patrick D S, Sarah L W, Thomas R, et al. Introducing mothur:Open-Source, Platform-Independent, Community-Supported Software for Describing and Comparing Microbial Communities[J]. Applied & Environmental Microbiology, 2009,75(23):7537-7541.
[20]Robert C Edgar. UPARSE: highly accurate OTU sequences from microbial amplicon reads [J]. Nature Methods, 2013,10(10):996-998.
[21]Langille M G, Zaneveld J, Caporaso J G, et al. Predictive functional profiling of microbial communities using 16S r RNA marker gene sequences [J]. Nature Biotechnology, 2013,31(9):814-821.
[22]封 莉,张立秋,吕炳南.污泥浓度对膜生物反应器运行特性的影响研究 [J]. 哈尔滨工业大学学报, 2003,35(3):307-310.
[23]Kawasaki K, Maruoka S, Katagami R, et al. Effect of initial MLSS, on operation of submerged membrane activated sludge process [J]. Desalination, 2011,281(20):334-339.
[24]张恩华,戴幼芬,肖 勇,等.还原 Cr(Ⅵ)的混菌胞外聚合物和细菌群落结构分析 [J]. 中国环境科学, 2017,37(1):352-357.
[25]Chung C M, Cho K W, Kim Y J, et al. Enhanced biological nitrogen removal in MLE combined with post-denitrification process and EF clarifier [J]. Bioprocess & Biosystems Engineering, 2012,35(4):503-511.
[26]Yang X, Zhou N, Chen M, et al. Analysis of microbial community structure in MBR with different ammonia concentrations using fluorescence in situ hybridization [J]. Journal of Southeast University: Nature Science Edition, 2013,43(2):380-385.
[27]宋云龙,张金松,朱 佳,等.基于高通量测序的微生物强化污泥减量工艺中微生物群落解析 [J]. 中国环境科学, 2016,36(7):2099-2107.
[28]黄 菲,梅晓洁,王志伟,等.冬季低温下 MBR与 CAS工艺运行及微生物群落特征 [J]. 环境科学, 2014,35(3):1002-1008.
[29]Hu M, Wang X H, Wen X H, et al. Microbial community structures in different wastewater treatment plants as revealed by 454-pyrosequencing analysis [J]. Bioresource Technology,2012,117(10):72-79.
[30]Ye L., Shao M.F., Zhang T, et al. Analysis of the bacterial community in a laboratory-scale nitri fi cation reactor and a wastewater treatment plant by 454-pyrosequencing [J]. Water Research, 2011,45(15):4390—4398.
[31]李卫华,孙英杰,刘子梁,等.序批式生物反应器填埋场脱氮微生物多样性分析 [J]. 环境科学, 2016,37(1):342-349.
[32]杨 华,黄 钧,赵永贵,等.陶厄氏菌Thauera sp. strain TN9的鉴定及特性 [J]. 应用与环境生物学报, 2013,19(2):318-323.
[33]陈亚平,叶 宏,王 娟,等.亚硝化单胞菌的分离鉴定及其降解特性的研究 [J]. 环境科学与技术, 2007,30(9):24-25.
[34]Ma Q, Qu Y Y, Shen W L, et al. Bacterial community compositions of coking wastewater treatment plants in steel industry revealed by Illumina high-throughput sequencing [J].Bioresource Technology, 2015,179:436-443.
[35]李 哿.活性污泥—生物膜复合系统脱氮除磷试验研究 [D].济南:山东建筑大学, 2011.
[36]Ning L, Jin H, Han Y, et al. Pathways in bacterial and archaeal communities dictated by ammonium stress in a high solid anaerobic digester with dewatered sludge [J]. Bioresource Technology, 2017,241:95-102.
[37]田 美,刘汉湖,申 欣,等.百乐克(BIOLAK)活性污泥宏基因组的生物多样性及功能分析 [J]. 环境科学, 2015,36(5):1739-1748.
[38]Yu K, Zhang T. Metagenomic and metatranscriptomic analysis of microbial community structure and gene expression of activated sludge [J]. Plos One, 2012,7(5):e38183.

