经皮射频消融治疗邻近膈顶较大肝癌
吴 薇,李荣杰,杨 薇,严 昆,张仲一,王 凇,陈敏华
(北京大学肿瘤医院暨北京市肿瘤防治研究所超声科 恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142)
原发性肝癌的常见治疗方法主要包括手术切除、肝移植及消融治疗[1]。尽管外科手术是首选治疗方法,但能够获得手术机会的患者仅约20%~30%。因超声引导下经皮射频消融(radiofrequency ablation, RFA)治疗具有微创、安全、有效的优点,使一些不耐受手术切除的患者获得根治机会[2-5]。但肿瘤大小、数目和部位一方面可提示肿瘤的进展程度,另一方面决定了进行射频治疗的难度,从而影响预后[6]。邻近膈顶且体积较大的肿瘤目前仍是RFA治疗的难题,原因在于肿瘤大范围贴近膈肌消融时,RFA治疗易造成膈肌损伤;如肿瘤存在来自膈肌的血供,则可能因血管损伤而引起出血;且RFA治疗邻近膈顶的较大肝癌易发生残留,再次消融治疗肿瘤细胞灭活较困难[7-8]。因此,RFA治疗应尽量一次性精准灭活。本研究探讨超声引导下经皮RFA在邻近膈顶较大肝癌治疗中的应用价值。
1 资料与方法
1.1 一般资料 回顾性分析2000年1月—2015年8月间于我院接受超声引导下经皮RFA治疗的176例邻近膈顶较大病灶原发性肝癌患者(近膈组)的资料,其中男144例,女32例,年龄30~79岁,平均(58.7±11.0)岁;病灶最大径3~6 cm;病灶边缘距膈顶<1 cm。并选取同期接受治疗的157例非邻近膈顶的较大病灶原发性肝癌患者为对照组,其中男130例,女27例;病灶最大径3~6 cm;病灶边缘距肝被膜、肝内大血管、胆囊、肾脏或肠管等重要结构≥1 cm。患者均经临床综合诊断确诊为原发性肝癌[9]。2组患者的临床资料见表1。
1.2 仪器与方法 采用Aloka SSD-5500、Aloka SSD-4000、Aloka α-10、GE Logiq E9或GE Logiq 9彩色多普勒超声诊断仪,小凸阵探头,频率2.5~5.0 MHz,配备穿刺引导架。RFA治疗采用RITA 1500型(14G伞状电极针)Tyco CC-1-220型(17G单电极针)、Olympus Celon Lab Power型(16G单电极针)消融仪。
对2组患者均行超声引导下经皮RFA治疗,治疗前完善临床相关检查。射频治疗操作由2名医师共同完成。首先行CEUS观察肿瘤浸润范围,依据多切面立体扫查情况制定个体化消融治疗方案。为避免膈肌损伤或肺内气体影响肿瘤显示,对近膈组经皮在膈上和/或膈下注射生理盐水以分离肝脏与膈肌(膈下注水);对照组中因肺内气体导致肿瘤显示不清的患者亦采用此方式。对近膈组先消融近膈区域,再消融其他区域。近膈组及对照组消融范围均须达到完全覆盖并超出癌周至少0.5 cm。对边界不清晰、形态不规则的肿瘤需扩大范围,至少超出瘤周0.5~1.0 cm。
1.3 疗效评价 依据治疗后影像学检查(CEUS、增强CT/MRI)判断疗效。计算肿瘤早期灭活率、局部复发率及肿瘤新生率。消融区域超越肿瘤、边界清晰、无增强认为肿瘤灭活;治疗后1个月影像学检查证实消融范围无活性,但4~6个月后在消融灶周围又出现异常强化认为局部复发;消融范围以外的其他区域出现新的病灶认为存在异位复发或新生。观察治疗后患者并发症情况。
1.4 统计学分析 采用SPSS 21.0统计分析软件,计量资料以±s表示,2组间比较采用独立样本t检验;计数资料以百分率表示,2组间比较采用χ2检验。采用Kaplan-Meier生存分析,以Log-Rank时序检验进行生存率比较。P<0.05为差异有统计学意义。
2 结果
2组患者年龄(t=0.397,P=0.692)、性别(χ2=0.055,P=0.814)差异均无统计学意义。近膈组176例共184个病灶,平均最大径(4.11±0.92)cm;对照组157例共174个病灶,平均最大径(3.89±0.85)cm。2组病灶最大径差异均无统计学意义(t=0.259,P=0.796)。
2.1 治疗情况 RFA治疗所用消融仪及电极针2组间差异无统计学意义(χ2=0.054,P=0.815),近膈组RFA治疗中膈下注水(图1)的比例高于对照组(χ2=5.737,P=0.016),见表2。
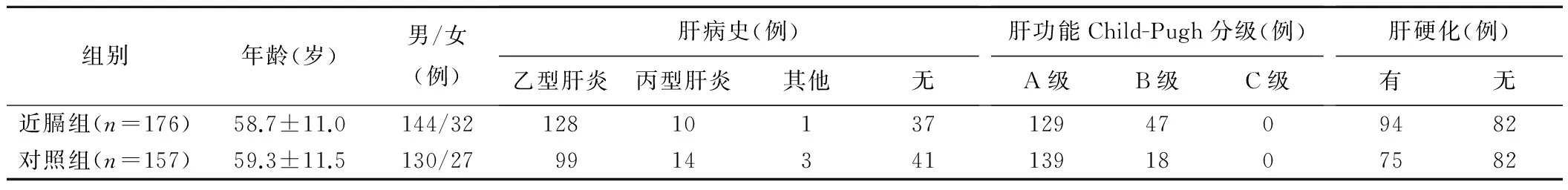
表1 近膈组和对照组患者临床资料

表2 近膈组和对照组患者超声引导下经皮RFA治疗情况[个(%)]
注:膈下注水:经皮在膈上和/或膈下注射生理盐水以分离肝脏与膈肌

图1 患者男,71岁,原发性肝癌 A、B.RFA治疗前CEUS动脉期肝右叶近膈肌病灶呈团状强化,范围约4.8 cm×3.8 cm; C.超声引导下经皮RFA治疗前于肝前及膈下注射生理盐水200 ml; D、E.超声引导下经皮RFA治疗中,于肿瘤内放置第1、第2及第3根电极针; F.RFA治疗后1个月复查增强CT动脉期肝右叶近膈肌病灶无强化
2.2 疗效 近膈组与对照组肿瘤早期灭活率分别为92.93%(171/184)、97.12%(169/174),局部复发率分别为20.65%(38/184)、12.07%(21/174),肿瘤新生率分别为39.77%(70/176)、36.94%(58/157)。近膈组局部复发率高于对照组(χ2=4.786,P=0.028)。2组间早期灭活率及肿瘤新生率差异均无统计学意义(χ2=3.290、0.280,P=0.069、0.596)。
2.3 生存率 近膈组与对照组患者RFA治疗后1、2、3、4、5年生存率差异无统计学意义(Log-RankP=0.203),见表3、图2。
2.4 并发症 近膈组中8例发生严重并发症,包括大量胸腔积液2例、血性胸腔积液2例、乳糜胸1例、肝功能损伤1例、肝脓肿1例、胆管扩张1例;对照组6例发生严重并发症,包括大量胸腔积液3例、肝脓肿2例、胆系感染1例。2组间并发症发生率差异无统计学意义(χ2=0.107,P=0.742)。
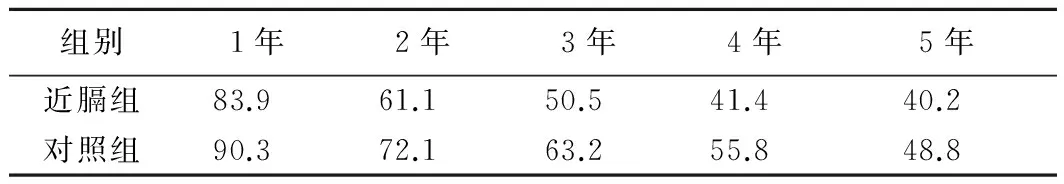
表3 2组患者超声引导下经皮RFA治疗后生存率(%)
3 讨论
2004年Koda等[10]报道经人造胸腔积液后进行膈下肝肿瘤RFA,结果显示肿瘤完全坏死率为88%,局部复发率为4.5%,无严重并发症发生。邻近膈肌的肿瘤易受肺气体影响而显示不良或显示不全,近膈顶部较大肿瘤更是射频治疗的难题。由于肿瘤大范围贴近膈肌在消融时易造成膈肌损伤,从而引起出血或肿瘤残留,为再次消融治疗带来困难。因此,RFA治疗近膈顶部较大肿瘤必须争取一次性精准灭活。
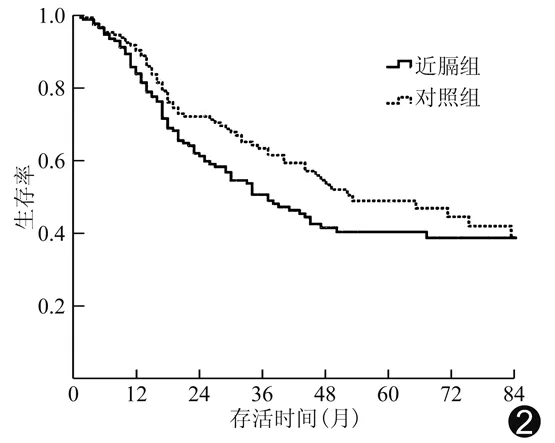
图2 近膈组及对照组生存率比较差异无统计学意义(P=0.203)
采取个体化治疗方案及策略实施RFA治疗近膈顶部较大肿瘤更有利于达到精准灭活的目的。膈下或膈上注水,不仅能保护膈肌,还可使超声对膈顶部肝肿瘤的显示得以改善;同时还应重视超声扫查手法技巧[11]。在膈肌与肝肿瘤之间注射生理盐水100~500 ml,制造人工腹腔积液分离肿瘤与膈肌;在通过人工腹腔积液保护膈肌的同时,由于右肺上移,可减少肺内气体对CEUS图像的影响,清晰显示肝膈顶部肿瘤,使RFA治疗更安全、彻底。消融顺序也是RFA治疗邻近膈顶较大肝癌的关键,笔者认为应先消融邻近膈肌的肿瘤区域后再消融其他区域,且进针方向自足侧朝向膈肌,如采用伞状电极针则在邻近膈肌区域进行“拽拉式扩针”[12]。由于肿瘤较硬导致扩针受限造成邻近膈肌的肿瘤区域消融范围不足或肿瘤形态不规则时,可采用“追加消融法”或“拉压式消融法”进行弥补。RFA治疗中重视实时监控射频针位置及消融范围,可有效预防并发症的发生。
本研究结果显示,RFA治疗后近膈组与对照组的肿瘤早期灭活率、肿瘤新生率及生存率差异均无统计学意义(P均>0.05);2组间并发症发率差异亦无统计学意义(P=0.742)。
综上所述,超声引导下经皮RFA治疗邻近膈顶的较大肝癌时,应采取膈下注水等个体化治疗方案及策略,以获得较好的治疗效果。
[1] Omata M, Cheng AL, Kokudo N, et al. Asia-pacific clinical practice guidelines on the management of hepatocellular carcinoma: A 2017 update. Hepatol Int, 2017,11(4):317-370.
[2] Kim SH, Choi SB, Lee JG, et al. Prognostic factors and 10-year survival in patients with hepatocellular carcinoma after curative hepatectomy. J Gastrointest Surg, 2011,15(4):598-607.
[3] Li L, Zhang J, Liu X, et al. Clinical outcomes of radiofrequency ablation and surgical resection for small hepatocellular carcinoma: A meta-analysis. J Gastroenterol Hepatol, 2012,27(1):51-58.
[4] Yang W, Yan K, Goldberg SN, et al. Ten-year survival of hepatocellular carcinoma patients undergoing radiofrequency ablation as a first-line treatment. World J Gastroenterol, 2016,22(10):2993-3005.
[5] 彭莉晴,周静,张煜,等.超声引导下经皮射频消融治疗肝癌.中国介入影像与治疗学,2013,10(8):469-472.
[6] 程馨玉,丁建民,经翔.影响原发性肝癌射频消融治疗预后的因素.中国介入影像与治疗学,2015,12(1):18-21.
[7] Yang W, Yan K, Wu GX, et al. Radiofrequency ablation of hepatocellular carcinoma in difficult locations: Strategies and long-term outcomes. World J Gastroenterol, 2015,21(5):1554-1566.
[8] Inoue T, Minami Y, Chung H, et al. Radiofrequency ablation for hepatocellular carcinoma: Assistant techniques for difficult cases. Oncology, 2010,78(Suppl 1):94-101.
[9] Bruix J, Sherman M, American Association for the Study of Liver Diseases. Management of hepatocellular carcinoma: An update. Hepatology, 2011,53(3):1020-1022.
[10] Koda M, Ueki M, Maeda Y, et al. Percutaneous sonographically guided radiofrequency ablation with artificial pleural effusion for hepatocellular carcinoma located under the diaphragm. AJR Am J Roentgenol, 2004,183(3):583-588.
[11] Chen MH, Yang W, Yan K, et al. Radiofrequency ablation of problematically located hepatocellular carcinoma: Tailored approach. Abdom Imaging, 2008,33(4):428-443.
[12] 陈敏华,Goldberg SN.肝癌射频消融——基础与临床.北京:人民卫生出版社,2009:275-280.