晒黄烟调制期烟叶真菌多样性研究
米其利,钱颖颖,朱洲海,管 莹,高 茜,陈建华,谢丽华,李雪梅,霍世东,方 耀,夭建华*,文孟良
(1.云南中烟工业有限责任公司技术中心,昆明 650106;2.云南大学,云南省微生物研究所,昆明 650091;3.云南农业大学烟草学院,昆明 650201)
成熟的烟叶采收后,大量的微生物,包括细菌、真菌、酵母和放线菌等,仍然存在于烟叶的表面或组织内。在烟叶的调制过程中,这些微生物通过分解烟叶中的糖类和蛋白质等物质来获取自身生长所需的营养和能量,并将这些大分子物质分解为酚类、醇类、酯类等小分子物质,微生物的代谢活动对烟叶化学成分的组成和烟叶品质的形成都会产生重要的影响[1]。烟叶细菌的多样性及其对烟叶品质形成的影响研究报道较多[2-7]。真菌是烟叶微生物的另一大类群,数量仅次于细菌[6]。与细菌相比,目前对烟草真菌种群和结构的研究比较少,主要是采用纯培养方法对一些烤烟烟草内生真菌进行了分离鉴定[8-11]。烟草真菌具有有利和有害两个方面的作用,如防治烟草病虫害[8]、降低烟碱含量[12-14]、改善烟叶品质[15-17]、引起烟草病害[18]和烟叶腐烂变质等[19-21]。
晒黄烟是我国特有的一种烟叶类型,几百年的栽培和种植使之形成了独特的烟叶品质,是我国发展具有独特香气风格和口味特征的中式卷烟的优质原料。本文采用纯培养分离和ITS序列系统发育分析方法,研究晒黄烟烟叶晾晒调制期真菌群落结构的组成和动态变化,为人工调控并改进晒黄烟烟叶调制方式,提升烟叶品质提供理论指导。
1 材料与方法
1.1 试验材料
供试样品取自晒黄烟云晒1号调制过程中的烟叶,该品种种植于云南盈江弄璋晒黄烟基地。
1.2 方法
1.2.1 烟叶调制和取样 云晒1号烟叶的调制和取样方法参照倪红梅等[7]的方法,2013年3月至4月期间,依次收集下、中和上3个部位的新鲜烟叶(调制第1天)、调制中期烟叶(调制第7天)和调制结束烟叶(调制第13天)。
1.2.2 真菌的分离和纯化 烟叶菌悬液的制备参照雷丽萍等[22]方法,略有改进。分别称取5 g烟叶,剪碎后放入含95 mL无菌磷酸缓冲液(pH 7.0~7.2)的无菌料理杯内,搅碎处理1 min。倒入无菌三角瓶内,置于摇床室温140 r/m振荡30 min,再置于超声波清洗机中超声5 min。收集滤液,梯度稀释后采用马铃薯葡萄糖琼脂培养基(PDA)和沙氏葡萄糖琼脂培养基(SDA)于28℃培养分离真菌。通过菌落的培养特征,包括菌落形状、菌落颜色、菌落表面状态、隆起状态、边缘情况和孢子颜色等,以及菌丝、孢子和产孢结构的形态特征进行初步归类,将菌株归类到各自的形态型,进行后续的分析。
1.2.3 菌株DNA提取及ITS序列分析 从每个形态型真菌中选1株作为代表,采用CTAB(十六烷基三甲基溴化铵)法提取菌株的总DNA。选取真菌ITS基因扩增和测序,引物序列:ITS1:5'-TCCGTAGGTGAACCTGCGG-3', ITS4 :5'-TC CTCCGCTTATTGATATGC-3'[23]。将获得的ITS序列进行校正后,使用NCBI GenBank(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行同源性搜索。利用ClustalX软件对获得的ITS序列与近缘种的ITS序列进行多重序列比对,然后通过MEGA 6.0软件,以Kimura2-parameter模型计算进化距离,基于Neighbor-Joining法构建系统发育树[24]。
1.2.4 物种多样性分析 调制期晒黄烟烟叶中纯培养真菌的多样性评估,采用Shannon多样性指数(H’),Simpson多样性指数(D)和Shannon均匀度指数(EH),计算公式如下:
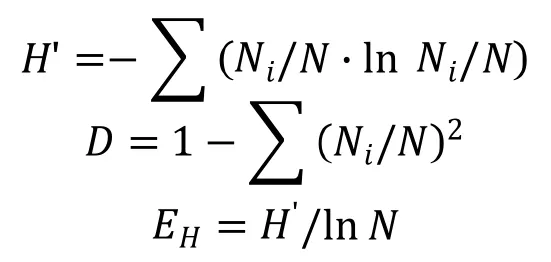
其中,Ni为样品中第i个分类单元的菌株数目,N为所有菌株数总和。
2 结果
2.1 真菌菌株分离结果
采用PDA培养基和SDA培养基双平板法,从云晒1号调制期烟叶中分离真菌,两种培养基上的菌落数都比较多,菌落多样性比较丰富,两种培养基对烟叶真菌的分离效果没有明显差异。根据菌落形态特征挑取单菌落,共分离获得126株真菌,其中,57株分离自PDA培养基,69株分离自SDA培养基。自下部烟叶分离得到50株,中部烟叶得到35株,上部烟叶得到41株;调制中期分离到32株,少于调制前期的51株和调制结束的43株(表1)。

表1 各调制期烟叶样本真菌菌株分离数量Table 1 The fungal isolate amount of curing leaves
2.2 真菌多样性分析
根据菌株在PDA和SDA培养基上的培养特征将获得的126株真菌初步归类,选择代表性菌株进行ITS基因序列测序。将测定的73株真菌序列分别在GenBank数据库中Blast同源性搜索,获得近缘种的序列,同源性搜索结果显示有38株不同的代表性菌株(表2)。从表2看出,Shannon多样性指数(H')、Simpson多样性指数(D)和Shannon均匀度指数(EH)分别为3.42、0.96和0.71,表明云晒1号调制期烟叶样本中纯培养真菌的类群多样性比较丰富。
38株代表性真菌菌株中,有35株分别与相关已知真菌菌株的ITS基因序列相似性为100%,另有3株相似性为99%。有11株菌株(YT200045、YT200034、YT200023、YT200123、YT200049、YT200021、YT200092、YT200053、YT200084、YT200003、YT200121)和属级分类水平上未知物种的ITS基因序列相似性是100%,有3株菌株YT200010、YT200101和YT200124与属级分类水平上未知物种的ITS基因序列相似性为99%(表2),推测该14株菌可能是分类地位未确定的物种。
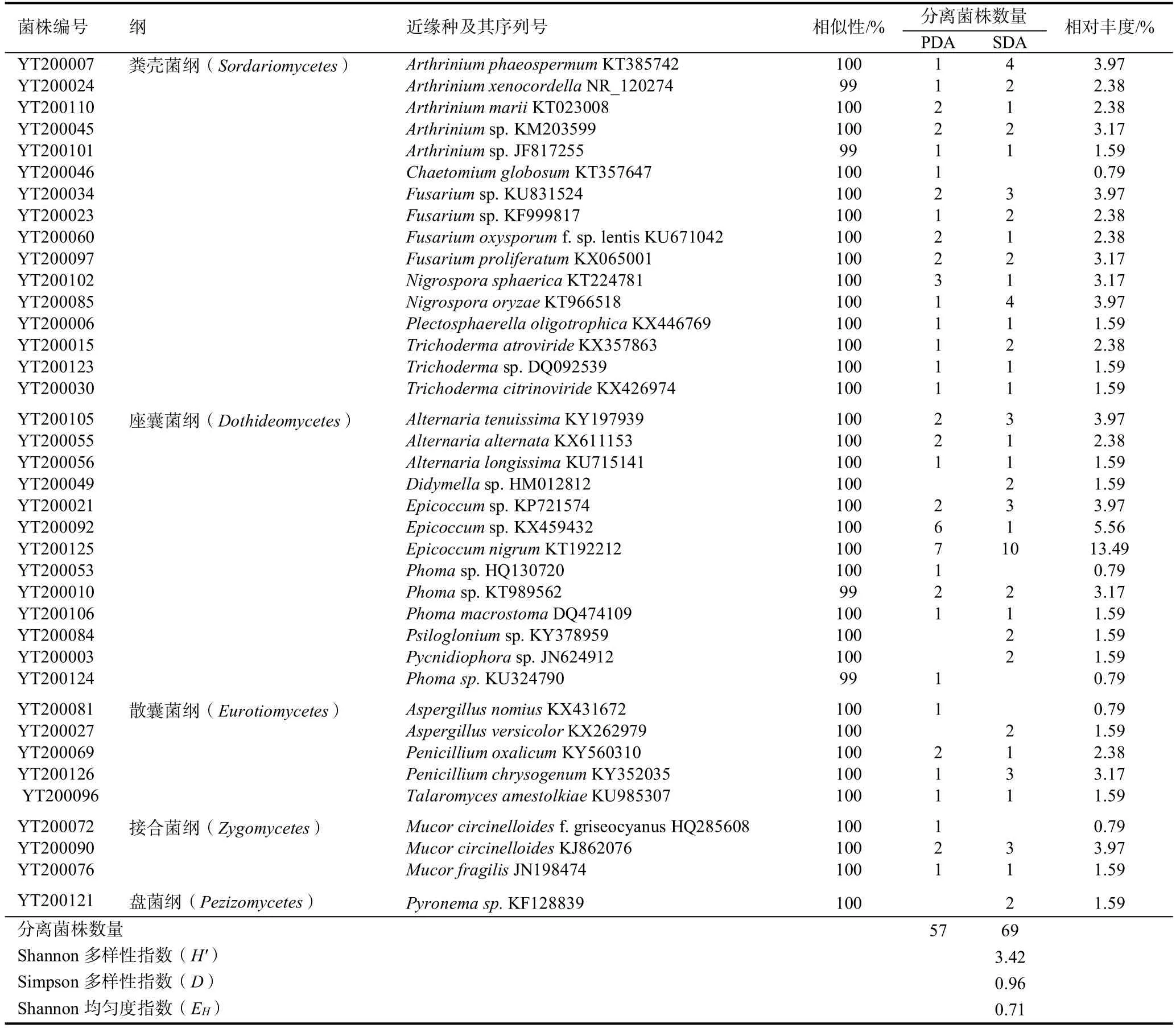
表2 晒黄烟调制期烟叶样本中纯培养真菌的分离和近缘种分析Table 2 The fungal isolation and analysis of yellow sun-cured tobacco curing leaves with closest species
由表3看出,在126株真菌中,绝大多数菌株(118株)属于子囊菌门(Ascomycota),占总数的93.65%。子囊菌门的菌株在纲、目、科和属等分类水平上的多样性较为丰富,包括4纲、9目、13科、16属。仅有8株菌株属于接合菌门(Zygomycota),占6.35%,仅1个属。在纲分类水平上,座囊菌纲(Dothideomycetes),有53株,占42.06%;粪壳菌纲(Sordariomycetes),有51株,占40.48%;散囊菌纲(Eurotiomycetes),有12株,占9.52%;盘菌纲(Pezizomycetes),有2株,占1.59%;接合菌纲(Zygomycetes),有8株,占6.35%。在目分类水平上,格孢腔菌目(Pleosporales)为优势目,有51株,占40.48%;其次是肉座菌目(Hypocreales)、炭角菌目(Xylariales)和散囊菌目(Eurotiales),分别有22、17和12株;属于假毛球壳目(Trichosphaeriales)、盘菌目(Pezizales)、粪壳菌目(Sordariales)、小丛壳目(Glomerellales)和纵裂菌目(Hysteriales)等目的菌株相对较少。在科分类水平上,亚隔孢壳科(Didymellaceae),有39株,占30.95%;梨孢假壳科(Apiosporaceae),有17株,占13.49%;丛赤壳科(Nectriaceae),有15株,占11.90%;曲霉科(Aspergillaceae)和格孢腔菌科(Pleosporaceae),各有10株,分别占7.94%;假毛壳球科(Trichosphaeriaceae),有9株,占7.14%;肉座菌科(Hypocreaceae),有7株,占5.56%;发菌科(Trichocomaceae)、火丝菌科(Pyronemataceae)、小不整球壳科(Plectosphaerellaceae)、纵裂菌科(Hysteriaceae)和荚孢腔菌科(Sporormiaceae)各有2株,分别占1.59%;毛壳菌科(Chaetomiaceae),有1株,占0.79%。
在属的分类水平上,126株真菌的分布如图1,附球菌属(Epicoccum)、节菱孢属(Arthrinium)和镰孢菌属(Fusarium)分离菌株数量相对较多,是晒黄烟烟叶真菌的优势类群,分别有29株、17株、15株,占分离菌株总数分别为23.02%、13.49%和11.90%;其次是链格孢属(Alternaria)和黑孢菌属(Nigrospora),分别有10株和9株;毛霉属(Mucor)和茎点霉属(Phoma),各有 8株;木霉属(Trichoderma)和青霉属(Penicillium),各有7株;曲霉属(Aspergillus),有 3株;踝节菌属(Talaromyces)、小不整球壳属(Plectosphaerella)、无垫船壳菌属(Psiloglonium)、亚隔孢壳属(Didymella)、分孢梗壳菌属(Pycnidiophora)和火丝菌属(Pyronema),各有2株;毛壳属(Chaetomium),有1株。

表3 晒黄烟烟叶中纯培养真菌的菌群结构Table 3 Composition of cultured fungi isolated from yellow sun-cured tobacco leaves

图1 126株真菌分离菌株在属级分类水平的分布Fig.1 The distribution of 126 fungal strains from yellow sun-cured curing tobacco leaves in genus
利用ClustalX 1.8软件进行菌株ITS序列的多重比对后,用Mega 6.0构建系统发育树,进行1000次Bootstrap统计学检验(图2)。系统发育分析结果显示,晒黄烟调制期烟叶纯培养真菌聚类为2个大分支:A分支和B分支。A分支为子囊菌门,包括Ⅰ亚分支、Ⅱ亚分支、Ⅲ亚分支和Ⅳ亚分支,依次为粪壳菌纲、散囊菌纲、盘菌纲和座囊菌纲。B分支为接合菌门,由Ⅴ亚分支接合菌纲组成。
3 讨论
本文选用PDA和SDA两种培养基对调制期云南晒黄烟烟叶的纯培养真菌进行了分离,共获得126株菌株。根据菌株的形态特征和ITS序列系统发育分析,126株真菌分布在2门、5纲、10目、14科和17属,这17个属分别为附球菌属、节菱孢属、镰孢菌属、链格孢属、黑孢菌属、毛霉属、木霉属、青霉属、茎点霉属、曲霉属、踝节菌属、小不整球壳属、无垫船壳菌属、亚隔孢壳属、分孢梗壳菌属、火丝菌属和毛壳属,有14株菌可能是未确定分类地位的物种。
晒黄烟在调制期烟叶的优势真菌类群为附球菌属、节菱孢属和镰孢菌属,分别占分离菌株总数的23.02%、13.49%和11.90%。附球菌属菌株在衰老或刚死亡的植株表面能迅速产生分生孢子和抗真菌化合物[25],因此可以作为一种生防菌应用于植物病害的生物防治中,例如可以降低核盘菌对莴苣的侵染[26],抑制小麦禾旋孢腔菌的生长[27],抑制桃树的桃褐腐病的发生[28],拮抗樟子松枯梢病病原菌的生长[29]等。而镰孢菌属菌株可引起多种烟草病害,如烟草枯萎病和镰刀菌根腐病[30]。对烤烟的内生真菌的研究表明,链格孢属和镰孢菌属是主要的真菌类群[8-11]。链格孢属是分布广泛的重要的半知菌类真菌,能够引起多种植物病害及腐霉病,造成全球性的巨大经济损失[31]。
在烟草中,链格孢属菌株也是引起烟草病害的一类重要的致病微生物[32]。本文从晒黄烟烟叶中共分离到10株链格孢属菌株,占分离菌株总数的7.94%。另一方面,在烟叶的加工和存储过程中,某些霉菌的生长和繁殖,会造成烟叶的大量霉变,而曲霉、青霉和毛霉属真菌是引起我国烟叶霉变的主要菌类[33]。从晒黄烟调制期烟叶中共分离到3株曲霉、7株青霉和8株毛霉属菌株,在调制后的烟叶醇化或存储中,如遇烟叶受潮以及适宜的环境温度和湿度,这些霉菌有可能引起烟叶的霉变。

图2 基于ITS序列构建纯培养真菌的系统发育树(邻接法)Fig.2 Phylogenetic tree of cultured fungi of yellow sun-cured tobacco curing leaves basing on ITS sequences(neighbor-joining method)
多种真菌制剂已经应用到烟草植株病害防治和烟叶的加工过程。例如任加庆等[34]用8种真菌菌剂处理田间烟草植株叶片发现,其中一种曲霉菌剂ESF-6在烟草病毒病发病高峰期的防效为83.8%。高文霞等[17]从烟叶中分离到一株木霉属菌株YZ2和曲霉属菌株SZ14,两株真菌的菌液处理烟丝后,烟叶香气前体物质含量增加,感官评吸得分显著提高。周瑾等[15]从烟叶上分离到一株假丝酵母属(Candida)菌株Yu-1,将真菌悬液应用到低次烤烟碎片上,经发酵后,能显著降低烤烟碎片的刺激性,改善吸味。烟叶真菌在整个晒黄烟的调制过程中都有分布,多样性指数分析显示,晒黄烟调制期的纯培养真菌的多样性比较丰富,在这些真菌类群中蕴含着丰富的微生物资源,从这些真菌中可以筛选出有益的真菌类群,用以防治烟草病虫害、提高烟草产量以及改善烟叶品质等。
4 结论
本研究采用PDA和SDA培养基从调制期晒黄烟烟叶中共分离获得126株真菌,下部和上部烟叶分离的菌株数多于中部烟叶,调制中期分离的菌株数少于调制前期和调制后期。这些菌株分布在2门、5纲、10目、14科、17属,其中14株菌可能是未确定分类地位的物种。多样性指数分析显示,晒黄烟烟叶调制期的纯培养真菌类群多样性比较丰富。所分离的真菌中,93.65%的菌株属于子囊菌门。优势属为附球菌属、节菱孢属和镰孢菌属,分别占23.02%、13.49%和11.90%。
[1]祝明亮.烟草调制期间微生物研究进展[J].微生物学通报,2008,35(8):1278-1281.
[2]陈泽斌,夏振远,雷丽萍,等.烟草内生细菌种群特征分析[J].中国烟草学报,2014,20(3):102-107.
[3]宫长荣,程龙,宋朝鹏,等.烤烟烘烤过程中微生物的动态变化[J].中国烟草科学,2010,31(1):44-46.
[4]HUANG J,YANG J,DUAN Y,etal.Bacterial diversities on unaged and aging flue-cured tobacco leaves estimated by 16S rRNA sequence analysis[J].Applied Microbiology and Biotechnology,2010,88(2):553-562.
[5]BRANDSCH R.Microbiologyandbiochemistryof nicotine degradation[J]. Applied Microbiology and Biotechnology,2006,69(5):493-498.
[6]MORIN A,PORTER A,JOLY J,et al.Evolution of tobacco-specific nitrosamines and microbial populations during flue-curing of tobacco under direct and indirect heating[J].Beiträge zur Tabakforschung/Contributions to Tobacco Research,2004,21(1):40-46.
[7]倪红梅,李雪梅,谢丽华,等.晒黄烟调制期叶面可培养细菌的多样性研究[J].中国烟草学报,2015,21(1):95-99.
[8]裴洲洋.烟草内生真菌种群多样性及烟草赤星病生防内生菌的筛选[D].郑州:河南农业大学,2009.
[9]李文君,钱正强,金蕊,等.云南大理烟区烟叶内生真菌多样性及分布特征[J].微生物学通报,2013,40(5):783-791.
[10]徐慧,杨根华,张敏,等.云南烟草叶片内生及叶际细菌,真菌多样性研究[J].云南农业大学学报(自然科学),2014,29(2):149-154.
[11]刘宏玉,金慧清,王佳莹,等.烟草内生真菌多样性和种群结构[J].菌物学报,2015,34(6):1058-1067.
[12]SINDELAR R D,ROSAZZA J P,BARFKNECHT C F.N-demethylation of nicotine and reduction of nicotine-1'-N-oxide by Microsporum gypseum[J].Applied and Environmental Microbiology,1979,38(5):836-839.
[13]UCHIDA S,MAEDA S,KISAKI T.Conversion of nicotine into nornicotine and N-methylmyosmine by fungi[J].Agricultural and Biological Chemistry,1983,47(9):1949-1953.
[14]MENG X J,LU L L,GU G F,et al.A novel pathway for nicotine degradation by Aspergillusoryzae 112822 isolated from tobacco leaves[J]. Research in Microbiology,2010,161(7):626-633.
[15]周瑾,李雪梅,许传坤,等.利用微生物发酵改良烤烟碎片品质的研究[J].烟草科技,2002(6):3-5.
[16]高文霞,程祖锌,王峰吉.烤烟有益真菌菌株的筛选与鉴定[J].中国烟草学报,2011,17(5):90-95.
[17]高文霞,王峰吉,程祖锌,等.真菌处理对烟叶感官质量的影响及最佳发酵条件的研究[J].热带作物学报,2013,33(11):2066-2069.
[18]蒲小明,沈会芳,陈永明,等.广东烟叶主要真菌病害无公害化学防治药剂筛选试验[J].广东农业科学,2016,43(11):97-102.
[19]WELTY R E,LUCAS G B,FLETCHER J T,et al.Fungi isolated from tobacco leaves and brown-spot lesions before and after flue-curing[J].Applied Microbiology,1968,16(9):1309-1313.
[20]WELTY R E,LUCAS G B.Fungi isolated from damaged flue-cured tobacco[J].Applied Microbiology,1968,16(6):851-854.
[21]何婉文.仓储烟叶霉变及其生物防治措施探讨[J].农业与技术,2016,36(6):255-257.
[22]雷丽萍,BUSH L,COYNE M S,等.烟叶生长和晾制期间细菌种群动态变化-烟草微生物细菌调控技术研究之一[J].中国烟草科学,2001,22(3):4-6.
[23]WHITE T J,BRUNS T,LEE S,et al.Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[J].PCR protocols:a guide to methods and applications,1990,18(1):315-322.
[24]TAMURA K,STECHER G,PETERSON D,et al.MEGA6: molecular evolutionary genetics analysis version 6.0[J].Molecular Biology and Evolution,2013,30(12):2725-2729.
[25]李扬,王亚南,胡同乐,等.黑附球菌在植物病害生物防治中的研究与应用进展[J].安徽农业科学,2010,38(6):2988-2990.
[26][MERCIER J,REELEDER R D.Interactions between Sclerotinia sclerotiorum and other fungi on the phylloplane of lettuce[J].Canadian Journal of Botany,1987,65(8):1633-1637.
[27]CAMPBELL W P.The influence of associated microorganisms on the pathogenicity of Helminthosporium sativum[J].Canadian Journalof Botany,1956,34(6):865-874.
[28]MADRIGAL C,PASCUAL S,MELGAREJO P.Biological control of peach twig blight(Monilinia laxa)with Epicoccum nigrum[J].Plant Pathology,1994,43(3):554-561.
[29]李宝年,徐树辉,杨传波,等.樟子松枯梢病拮抗真菌的筛选[J].东北林业大学学报,2004,32(5):97-99.
[30]陈志敏.福建省烟草根茎病害诊断及防治药剂筛选[D].福州:福建农林大学,2009.
[31]崔迪,王继华,陈捷,等.链格孢属真菌对农作物的危害[J].哈尔滨师范大学(自然科学学报),2005,21(4):87-91.
[32]张万良,翟争光,谢扬军,等.烟草赤星病研究进展[J].江西农业学报,2011,23(1):118-120.
[33]李魁,李廷生,王平诸,等.我国烟草真菌区系调查及霉变成因的研究[J].郑州工程学院学报,2003,24(3):20-24.
[34]任加庆,薛守聪,李锡宏,等.不同真菌菌剂对烟草病毒病的田间防治效果[J].中国烟草科学,2015,36(4):96-101.

