含洛铂方案经肝动脉化疗栓塞联合125I粒子植入术治疗不能手术的中晚期肝癌的疗效观察
李 靖,肖金成,郑 琳,康鑫鑫,朱文良,郭晨阳
1.郑州大学附属肿瘤医院(河南省肿瘤医院)微创介入科,河南 郑州 450003;
2.郑州大学第一附属医院麻醉科,河南 郑州 450052;
3.广西中医药大学附属瑞康医院肿瘤内科二病区,广西 南宁 530011
原发性肝癌是最常见的消化道恶性肿瘤,其恶性度高、病情进展快,约有50%~70%的患者确诊时已为中晚期,失去外科手术切除机会[1]。尤其是直径大于6 cm的中晚期肝癌患者,大部分生存期仅在6个月左右[2]。对于不宜手术切除的中晚期肝癌或大肝癌患者,经肝动脉化疗栓塞(transcatheter arterial chemoembolization,TACE)是首选的辅助治疗方法,具有既能通过动脉造影提高小病灶的检出率,又能栓塞治疗肿瘤的优势,但TACE治疗肝癌的化疗方案国内外无统一标准,并且它只能使约50%的肿瘤达到坏死,并非肿瘤的根治性方法[3]。近年来,125I粒子植入术作为一项新的放疗技术在肝癌治疗中取得了良好的疗效。有研究报道,TACE与125I粒子植入术联合应用后具有较好的互补作用,可为肝癌患者的治疗提供新的有效途径[4]。本研究采用前瞻性随机对照研究方法,观察含洛铂方案TACE联合125I粒子植入术对不能手术的中晚期肝癌患者的临床疗效及3年生存情况。
1 资料和方法
1.1 一般资料
所选研究对象为2010年1月—2013年1月在郑州大学附属肿瘤医院住院治疗的不能手术切除的中晚期肝癌患者,所有患者年龄大于等于18岁,均经病理或影像学检查以及临床诊断标准确诊为中晚期肝癌;根据2010年巴塞罗那临床肝癌(Barcelona Clinic Liver Cancer,BCLC)分期标准,为B或C期;肝功能分级为Child-Pugh A或B级,无明显凝血功能障碍,无心肺肾功能障碍,无严重活动性感染,预计生存期大于等于3个月,无TACE及125I放射性粒子植入禁忌证,同时排除肿瘤体积超过正常肝脏体积70%以上者,严重肝肾功能不全、出现明显黄疸、凝血功能障碍、近期消化道出血史、大量腹水者,以及混杂有其他介入治疗(射频消融、微波消融及化学消融等)者。将符合纳入条件的102例患者采用随机数字表法分为观察组和对照组,每组51例。其中对照组男性35例,女性16例,平均年龄(51.2±12.8)岁,肿瘤平均直径(6.3±1.7) cm;观察组男性37例,女性14例,平均年龄(49.7±13.1)岁,肿瘤平均直径(6.2±2.1) cm。两组患者在性别、年龄、肿瘤直径、肝功能分级及BCLC分期等方面差异无统计学意义(P>0.05),具有可比性。所有患者及其家属均知情同意,并签署知情同意书,此研究经郑州大学附属肿瘤医院伦理委员会审核通过。
1.2 治疗方法
对照组患者接受单独TACE治疗,采用Seldinger技术对股动脉进行穿刺,在数字减影血管造影(digital subtraction angiography,DSA)透视下将导管选择性置入肿瘤供血动脉内,再将化疗药物(注射用洛铂50 mg/m2,购自海南长安国际制药有限公司;氟尿苷0.5~1.0 g/m2,购自浙江海正药业股份有限公司;同时根据肿瘤体积及肿瘤术中栓塞情况酌情使用注射用盐酸吡柔比星20~40 mg/m2,购自浙江海正药业股份有限公司)与碘化油(5~25 mL,具体剂量根据肿瘤大小、血供丰富程度、患者体表面积和肝功能情况而定)在DSA透视下经导管缓慢注入供血动脉内进行栓塞,3~4周重复1次,进行3~4次。
观察组在对照组的基础上于TACE治疗结束3~4周后接受125I粒子植入术治疗。术前应用Bright Speed 16排螺旋CT机(购自美国GE公司)对肿瘤组织病灶进行平扫及增强扫描,CT图像输入HGGR-2000放射性粒子治疗计划布控系统(treat-ment planning system,TPS)计算植入粒子的数量和剂量。125I放射粒子平均能量27~35 keV,半衰期59.6 d,组织穿透能力1.7 cm,释放粒子间隔为1.0~1.5 cm。植入完毕进行CT扫描了解粒子分布情况,必要时可继续补植粒子。
1.3 观察指标及疗效评价
术前、术后6个月检测患者的血常规、肝功能及细胞免疫相关指标,记录两组患者血清甲胎蛋白(alpha-fetoprotein,AFP)、丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、总胆红素(total bilirubin,TBIL)含量及辅助T淋巴细胞CD4(helper T lymphocytes CD4,Th)、抑制T淋巴细胞CD8(suppression cytotoxicity of T lymphocytes CD8,Ts)水平,计算CD4/CD8。术后4周通过增强CT或MRI判断患者近期疗效,评价标准参照1981年世界卫生组织(World Health Organization,WHO)发布的实体瘤近期疗效评价标准[5]:
① 完全缓解(complete response,CR):所有目标病灶消失或功能活性消失(PET-CT检查结果为阴性且血清学AFP检测为正常);② 部分缓解(partial response,PR):目标病灶长径总和缩小大于等于30%,CT显示中央凝固性坏死或空洞形成,PET-CT显示标准摄入值(standard uptake value,SUV)下降;③ 稳定(stable disease,SD):基线病灶长径总和有所缩小但未达PR,中央未见有坏死;④ 进展(progressive disease,PD):肝内新发病灶或原位新发病灶增长之长径总和大于等于20%或出现肝外新发病灶,PETCT检查显示SUV增加。有效率(response rate,RR)=(CR+PR)/(CR+PR+SD+PD)。
所有患者定期随访3年,记录每例患者的生存期(从术后24 h开始算起至死亡或失访的日期)及术后6个月患者的远处转移情况,计算1、2和3年内两组患者的生存率情况,同时统计随访期间患者的并发症发生情况。药物不良反应程度评价参照WHO制定的《抗癌药急性及亚急性毒性反应分度标准》。
1.4 统计学处理
采用SPSS 13.0统计学软件进行数据分析,计量资料数据,治疗前后比较采用配对t检验,多组间比较采用单因素方差分析;计数资料用率表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者治疗前后实验室指标变化比较
治疗前,两组患者在性别、年龄、肿瘤直径、肝功能分级及肿瘤分期等方面差异均无统计学意义(P均>0.05,表1)。102例患者均顺利完成治疗,无严重术中并发症发生。两组患者治疗前血清AFP、ALT、AST及TBIL水平差异均无统计学意义(P均>0.05),接受相应治疗6个月后,血清AFP水平较治疗前均显著降低,且观察组降低幅度明显高于对照组(P<0.01);ALT、AST及TBIL水平与治疗前相比差异均无统计学意义(P均>0.05,表2)。检测患者CD4、CD8及CD4/CD8 T细胞亚群水平变化,评估不同治疗方式对患者细胞免疫功能的影响。结果显示,与治疗前相比较,两组患者CD4水平均略有升高,CD8水平略有下降,但差异均无统计学意义(P均>0.05,表3)。
表1 两组患者一般资料比较Tab. 1 Baseline characteristic the patients(n, ±s)

表1 两组患者一般资料比较Tab. 1 Baseline characteristic the patients(n, ±s)
Variables Control group (N=51) Observation group (N=51) t/χ2 value P value Age/year 51.2±12.8 49.7±13.1 -0.585 0.560 Gender (male/female) 35/16 37/14 0.189 0.664 Tumor diameter l/cm 6.3±1.7 6.2±2.1 -0.264 0.792 Child-Pugh (A/B) 31/20 33/18 0.168 0.682 BCLC (B/C) 27/24 29/22 0.158 0.691
表2 两组患者治疗前后AFP、ALT、AST和TBIL变化比较Tab. 2 Changes in AFP, ALT, AST and TBIL between the two groups before and after treatment( ±s, N=102)
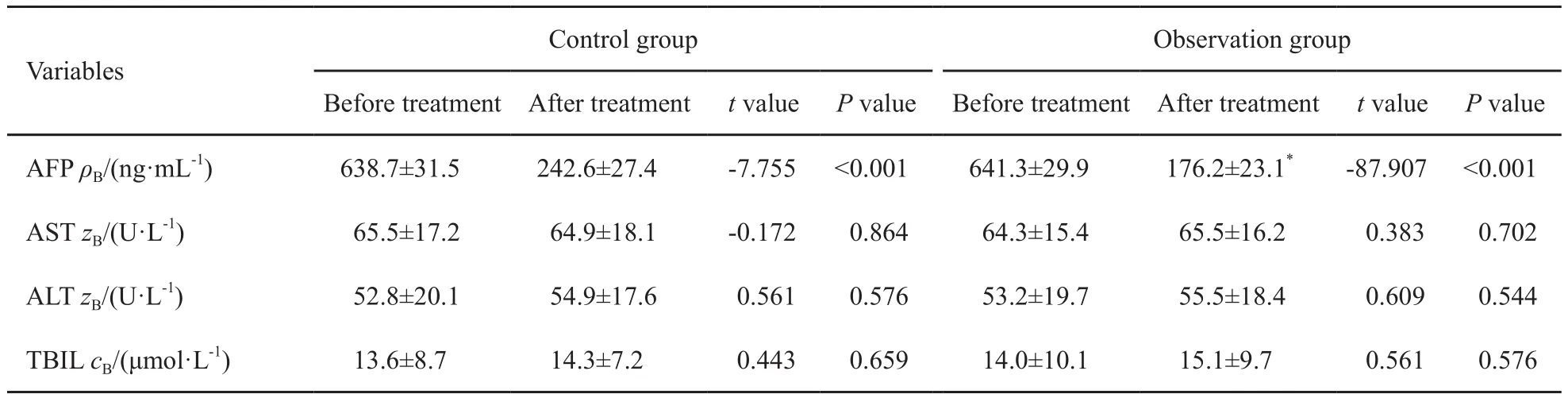
表2 两组患者治疗前后AFP、ALT、AST和TBIL变化比较Tab. 2 Changes in AFP, ALT, AST and TBIL between the two groups before and after treatment( ±s, N=102)
*: P<0.01, Compared with control group at the same time point
Control group Observation group Before treatmentAfter treatment t value P value Before treatment After treatment t value P value AFP ρB/(ng·mL-1) 638.7±31.5 242.6±27.4 -7.755 <0.001 641.3±29.9 176.2±23.1* -87.907 <0.001 AST zB/(U·L-1) 65.5±17.2 64.9±18.1 -0.172 0.864 64.3±15.4 65.5±16.2 0.383 0.702 ALT zB/(U·L-1) 52.8±20.1 54.9±17.6 0.561 0.576 53.2±19.7 55.5±18.4 0.609 0.544 TBIL cB/(μmol·L-1) 13.6±8.7 14.3±7.2 0.443 0.659 14.0±10.1 15.1±9.7 0.561 0.576 Variables
表3 两组患者治疗前后细胞免疫水平变化比较Tab. 3 Changes in cellular immunity between the two groups before and after treatment( ±s, N=102)
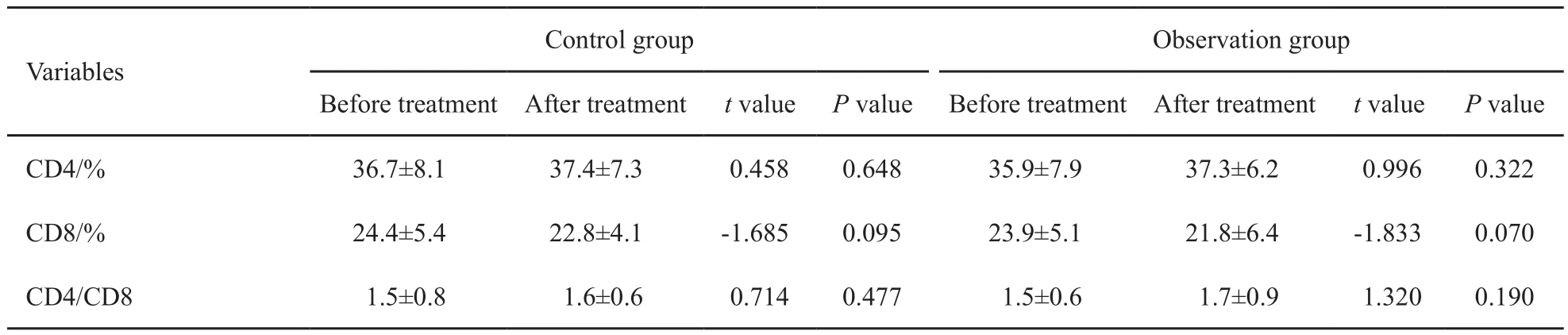
表3 两组患者治疗前后细胞免疫水平变化比较Tab. 3 Changes in cellular immunity between the two groups before and after treatment( ±s, N=102)
Variables Control group Observation group Before treatmentAfter treatment t value P value Before treatment After treatment t value P value CD4/% 36.7±8.1 37.4±7.3 0.458 0.648 35.9±7.9 37.3±6.2 0.996 0.322 CD8/% 24.4±5.4 22.8±4.1 -1.685 0.095 23.9±5.1 21.8±6.4 -1.833 0.070 CD4/CD8 1.5±0.8 1.6±0.6 0.714 0.477 1.5±0.6 1.7±0.9 1.320 0.190
2.2 两组患者近期疗效比较
手术30 d评价肿瘤治疗的近期疗效,结果显示,对照组的51例患者中,CR 6例,PR 29例,RR为68.6% ;观察组的51例患者中,CR 9例,PR 35例,RR为86.3%。提示含洛铂方案TACE联合125I粒子植入术治疗在近期疗效方面明显优于单纯TACE治疗(表4)。
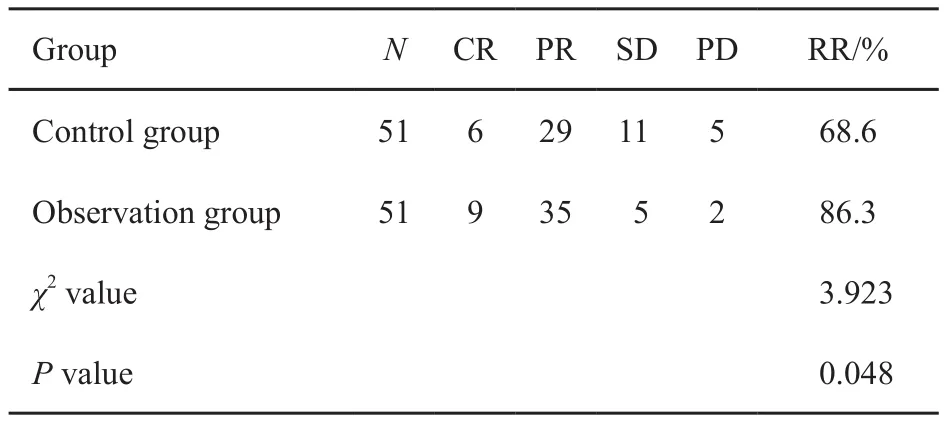
表 4 两组患者近期疗效比较Tab. 4 Comparison of the two groups with short-term efficacy(N=102)
2.3 两组患者6个月远处转移及随访期生存率比较
两组患者治疗6个月后,对照组有12例发生转移(23.5%),观察组有4例发生转移(7.8%),与对照组相比较,观察组发生转移例数明显减少,差异有统计学意义(P<0.05)。本研究共有99例患者完整随访,观察组于第12个月失访1例,第36个月失访1例,对照组于第12个月失访1例。至随访结束,死亡73例,除2例为上消化道大出血外,其余死因均为肿瘤恶化。存活患者中,对照组7例,观察组19例。对照组与观察组的1、2、3年生存率分别为41.2%、29.4%、13.7%和68.6%、43.1%、31.4%,差异均有统计学意义(P均<0.05,图1)。
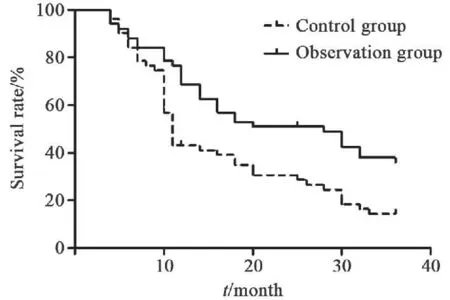
图 1 两组肝癌患者生存曲线Fig. 1 Survival curve of patients with hepatocellular carcinoma
2.4 两组患者随访期不良反应发生情况比较
102例患者中有92例(90.2%)在术后出现不同程度的发热、恶心、呕吐及腹痛等栓塞后综合征,经对症处理后1周内逐渐缓解。对照组胃肠道不良反应25例,肝功能损伤15例,观察组发生胃肠道不良反应23例,肝功能损伤13例,两组间比较差异无统计学意义(P>0.05);观察组骨髓抑制发生10例(19.6%),显著低于对照组的19例(37.3%),差异有统计学意义(P<0.05);观察组125I粒子植入后未发生临近器官坏死及全身严重不良反应。
3 讨 论
TACE因其微创、近期疗效显著,已成为现阶段中晚期肝癌患者非手术治疗的首选方法。但在临床实践中,由于肿瘤多支供血、侧支循环建立、双重供血及病灶内栓塞药物沉积不佳等原因,TACE单独治疗肿瘤的效果并不十分理想[6]。有文献报道,原发性肝癌经TACE治疗的1、3和5年生存率仅为50%、20%和6%[7]。另有研究显示,TACE治疗后会导致肿瘤血管内皮生长因子(vascular endothelial growth factor,VEGF)表达上调,刺激肿瘤细胞生长,进而引起栓塞效果的下降[8]。此外TACE所用的化疗药物、碘油及反复多次的TACE治疗均可对正常肝实质不可避免地造成损伤,进而加重肝功能损伤,影响生存率[9]。因此,寻求更合适的化疗药物以及与其他新技术如放疗、射频消融、氩氦刀冷冻消融和生物靶向治疗等联合应用治疗中晚期肝癌已成为目前研究的热点[10-12]。
洛铂是一种第三代铂类抗肿瘤药物,相较于常用化疗药物奥沙利铂和卡铂,其水溶性更佳,并易与碘油乳化形成油水微粒,便于术中经导管灌注使用并在病灶中有效沉积。有研究报道,洛铂用于原发性肝癌治疗疗效指数显著高于其他铂类药物,并无明显肾脏及神经毒性[13-14]。因此,本研究中TACE选择洛铂作为主要化疗药物。
近年来,包括粒子植入等各种微创手术开始积极应用于肝癌的临床治疗。放射性粒子植入术就是指在CT、B超直视下利用特殊穿刺针将放射性粒子植入肿瘤内或受肿瘤侵犯的组织中,通过药物持续释放的功效作用于肿瘤,抑制和杀灭肿瘤细胞,从而使局部肿瘤得到有效控制。放射性粒子近距离治疗能增加放射敏感性,从而不断地杀灭肿瘤干细胞,使患者无瘤生存率显著提高。与射频消融、氩氦刀冷冻消融等治疗方式相比,粒子植入对患者身体状况要求较低,特别适合于年老体弱、身体条件无法耐受手术、放化疗的患者,并且创伤小,可操作性强,不良反应较小。有研究表明,125I粒子植入术(内放疗)与TACE联合治疗,可使分子水平上诱导肿瘤细胞凋亡的效果加倍[15]。本研究应用含洛铂方案TACE联合125I粒子植入术对51例不能手术的中晚期肝癌患者进行治疗,结果显示,与单纯洛铂方案TACE治疗相比,联合治疗方案显著提高了肿瘤的近期疗效,减少了6个月肿瘤远处转移发生率,延长了患者的生存期,将3年生存率提高到了31.4%。作为原发性肝癌的重要标志物,血清AFP的变化对肝癌的诊断及治疗效果判定意义重大,常用来监测原发性肝癌复发、进展情况。本研究的两种治疗方案均能有效降低患者血清AFP水平,并且较单纯的TACE治疗,联合治疗方案能更大幅度的下调患者血清AFP水平,提示联合治疗方案在控制病情进展方面较单纯TACE治疗优势明显。分析原因可能为TACE可从整体上杀灭大量的肿瘤细胞,使肿瘤缩小,肿瘤细胞周期同步化疗有利于125I粒子杀灭周期敏感细胞,同时放射线改变了肿瘤细胞的周期分布,从而增加了对化疗药物的敏感性[16],此外TACE有助于肿瘤细胞的定位及125I粒子的植入,从而提高射线对肿瘤的控制程度,更加彻底的消灭肿瘤细胞。
肝功能损伤为TACE治疗的主要不良反应,骨髓抑制则为洛铂的主要药理毒性[17]。本研究中的两组患者肝功能指标(ALT、AST和TBIL)较治疗前均略有升高,但差异无统计学意义,分析原因可能为本研究所选药物洛铂可通过非肝脏途径代谢,从而减少了对正常肝脏组织的损伤[18]。观察组患者骨髓抑制发生率低于对照组患者,可能归因于125I粒子植入术的联合应用减少了洛铂的使用量,从而减少了不良反应的发生。此外,两种治疗方法对患者的细胞免疫水平均无显著抑制作用。由于中国人正常全肝耐受射线剂量仅为23 Gy,因此肝组织对放射治疗的剂量有着严格的限制[19]。本研究中TACE术联合125I粒子植入术后患者无全身严重并发症的出现,进一步证明了此种联合治疗具有较高的安全性。
综上所述,含洛铂方案经肝动脉化疗栓塞联合125I粒子植入术治疗不能手术的中晚期肝癌的疗效确切,与单纯含洛铂方案经肝动脉化疗栓塞治疗相比优势明显,能更为有效的控制肿瘤转移,提高生存率,值得在临床推广应用,但关于125I粒子植入有效内放疗剂量设定及联合治疗时洛铂的剂量使用标准尚需进一步研究。
[1] 曹 旸, 赵 丹, 朱 眉, 等. 氩氦刀冷冻消融治疗联合肝动脉化疗栓塞术对原发性肝癌生存的影响[J]. 航空航天医学杂志, 2012, 23(2): 141-147.
[2] 张 阳, 梁宪斌, 张丽红, 等. 氩氦刀联合肝动脉化疗栓塞术治疗原发性肝癌的临床研究[J]. 现代肿瘤医学,2010, 18(4): 757-759.
[3] 郑 琳, 郭晨阳, 黎海亮, 等. 肝动脉热灌注化疗栓塞联合射频消融治疗原发性肝癌的对照研究[J]. 临床放射学杂志, 2013, 32(7): 1032-1035.
[4] 欧盛秋, 韦长元, 马亦龙, 等.125I放射性粒子联合TACE治疗原发性肝癌的临床观察[J]. 中华肿瘤防治杂志,2014, 21(17): 1373-1375.
[5] 丁德权, 曹齐生, 何昌霞, 等. 中晚期原发性肝癌的TACE治疗和FOLFOX4方案化疗疗效分析[J]. 安徽医药,2013, 17(8): 1388-1391.
[6] 刘文导, 孟凡喆, 梅世伟, 等. 洛铂与碘油化疗栓塞联合射频消融术治疗原发性肝癌的近期疗效观察[J]. 实用临床医药杂志, 2015, 19(1): 107-109.
[7] 张 鹏, 李晓冰, 任虎虎, 等. 经皮肝动脉栓塞化疗联合洛铂热灌注化疗治疗不能手术切除的肝细胞癌的近期疗效观察[J]. 中国肿瘤临床, 2013, 40(5): 284-286.
[8] 丁 罡, 邵 怿, 刘合代, 等. 血清血管内皮生长因子在肝癌介入栓塞后的表达[J]. 实用癌症杂志, 2010, 25(5):464-466.
[9] 吕天石, 邹英华, 王 健, 等. 经肝动脉化疗栓塞术联合射频消融治疗原发性肝癌的现状[J]. 临床肝胆病杂志,2016, 32(1): 49-55.
[10] QIAN G J, WANG N, SHEN Q, et al. Efficacy of microwave versus radiofrequency ablation for treatment of small hepatocellular carcinoma: experimental and clinical studies[J]. Eur Radiol, 2012, 22(9): 1983-1990.
[11] DUNNE R M, SHYN P B, SUNG J C, et al. Percutaneous treatment of hepatocellular carcinoma in patients with cirrhosis: a comparison of the safety of cryoablation and radiofrequency ablation[J]. Eur J Radiol, 2014, 83(4): 632-638.
[12] 李 臻, 周进学, 任建庄, 等.131I美妥昔单克隆抗体灌注联合经肝动脉化疗栓塞术治疗中晚期肝癌介入术后复发的临床价值[J]. 中华肝脏病杂志, 2013, 21(10): 728-733.
[13] 刘伟波, 杨有甜, 李凤彩. 洛铂介入治疗原发性肝癌的临床研究[J]. 深圳中西医结合杂志, 2015, 25(5): 12-13.
[14] 顾 兵, 张 敏, 陈 双, 等. 两种三联动脉化疗栓塞方案治疗无法切除原发性肝癌临床对比研究[J]. 现代肿瘤医学, 2016, 24(16): 2565-2568.
[15] 李 庆, 曹苏娟, 龙文兴, 等.125I粒子植入术联合TACE治疗大肝癌的临床效果[J]. 中国医药导报,2016, 13(2):73-77.
[16] 王旭杰, 冯卫华, 于春鹏, 等. 介入联合含洛铂方案治疗原发性肝癌的效果观察[J]. 齐鲁医学杂志, 2015, 30(3):280-283.
[17] 彭 盛, 杨秋霞, 卢鸣剑, 等. 含洛铂化疗方案TACE治疗不可切除肝癌的应用[J]. 现代肿瘤医学, 2014, 22(7):1609-1612.
[18] 中国医师协会介入医师分会. 注射用洛铂在原发性肝癌TACE治疗中的专家共识(2016版)[J]. 中华介入放射学电子杂志, 2016, 4(1): 1-3.
[19] 谢小西, 吕银祥, 章宏欣, 等. 肝动脉化疗栓塞、射频消融联合~(125)Ⅰ粒子植入治疗原发性肝癌的临床应用[J].介入放射学杂志, 2011, 20(11): 863-866.

