应用基因芯片技术筛查针刺人迎穴对原发性高血压大鼠下丘脑基因表达谱的影响
郭妍 石学敏 赵瑞利 芦娟 马田
原发性高血压简称高血压,以舒张压和(或)收缩压升高为主要临床表现,病因复杂,多伴有心脏、血管、脑和肾脏等器官功能性或器质性改变的全身性疾病。血压升高主要是由于动脉阻力血管功能或结构的改变,导致外周血管阻力增加,左心室的后负荷加重,心室壁增厚甚至恶化,导致左心室结构和功能发生改变,主要会引起心室肥大、冠脉重建、心绞痛、心肌梗死和心力衰竭等一系列严重心血管疾病[1],因此治疗高血压及其对靶器官心脏的损害刻不容缓。随着社会经济的发展,工作压力增大及人们生活方式的改变,高血压的患病率呈持续增长趋势,有效平稳地控制血压已经成为全球重要的公共卫生问题之一[2]。在疾病发生的过程中,大多伴有多种基因的改变[3],但各种针对血压干预的方法是否逆转了基因的改变或影响基因向病态发展,这方面的研究少之又少。针刺目前已成为一种治疗高血压病较理想的重要手段,并且深受广大患者的欢迎。而对近年来针灸的临床进展的观察得知,针刺可以通过调节免疫系统从而影响交感神经兴奋性[4],调节血管内皮异常功能[5],调节外周血管的压力[6],调节肾素-血管紧张素-醛固酮系统,增加血浆中钠钾排泄[7],改善胰岛素抵抗状态[8]等途径来达到降压效果。
基因芯片技术是一种分析基因表达的新方法,具有高灵敏度、高通量等特性。它能在检测基因表达多样性的同时,为研究高血压多基因表达的影响提供了一个平台[9]。这是一种从基因水平探知高血压发病原理的高科技方法。本课题组以SHR作为研究对象,针刺人迎穴为主要干预手段,运用基因芯片技术,筛选出与血压相关的差异表达的基因,从基因层面探究高血压的发病原理,针刺降压及对下丘脑的保护作用。
1 材料与方法
1.1 实验动物与分组
SPF级9周龄自发性高血压大鼠(spontaneous hypertensive rats,SHR)雄性20只,体重180~200 g,按照随机数字表分为人迎组和模型组,每组10只。另取同体重SPF级9周龄Wistar Kyoto(WKY)大鼠10只作为空白对照组。动物均由北京维通利华实验动物中心提供,许可证号:SCXK(京)200223。
1.2 主要仪器和试剂
一次性毫针(0.16×7 mm)购自北京中研太和医疗器械有限公司;型号为BP-6的无创血压仪购自成都泰盟生物仪器有限公司;冻存管购自北京健力园科技有限公司;超净操作台生产于北京亚泰科隆仪器有限公司;手术器械、移液枪及型号为ACS-5的电子秤均由北京中医药大学针灸推拿学院提供。生理盐水、水合氯醛、无水乙醇购自天津市科密欧化学试剂中心;多聚甲醛购自常德市华生医疗器械有限公司;液氮购自中国计量科学研究院。
1.3 取穴
根据《实验针灸学》教材选取双侧人迎穴:颈部三角区,当胸骨舌骨肌与胸锁乳突肌上缘交点,约颈总动脉分叉处,即两侧下颌骨隅突连线下8 mm,前正中线旁开3.50 mm,左右各一。
1.4 干预方法
人迎组:将大鼠置于自制鼠套中束缚,以右手为刺手,针刺双侧人迎穴,直刺约4~5 mm,进针后行捻转泻法1分钟,留针19分钟。(每天中午12点进行一次,共操作28天,所有针刺操作均由1人完成)。
模型组及空白组:分别将大鼠放入自制鼠套中20分钟,不作任何针刺干预。
1.5 血压测量
测压前,检测无创血压仪是否运转正常,仪器是否灵敏。
将固定于鼠笼的大鼠放入36℃左右的预热箱约15分钟,开始测量其尾动脉收缩压,动作要轻柔,不能激惹大鼠,测压过程中保持安静,以免血压不稳定。在正式测量血压之前,可进行训练若干次,待大鼠熟练适应后开始实验。
实验前一天,各组大鼠用无创血压仪测量尾动脉收缩压,共测量3次,取平均值并记录。在针刺干预治疗进行中的第1、5、9、13、17、21、25和28天分别测量其尾部收缩压,每只大鼠3次,取平均值作记录。
1.6 实验取材
三组大鼠在麻醉状态下取材并处死,每组大鼠取2只全脑置于固定液中以备做形态学检测,其余大鼠则迅速取出下丘脑,用4℃ 0.9%生理盐水冲洗后用滤纸吸干于液氮中固定,保存于-80℃冰箱中待检。
1.7 基因芯片检测
分别将人迎组、模型组和空白组的24只大鼠全部下丘脑组织样本取出100 mg,研磨成均匀粉末状,应用mirVana miRNA isolation技术从中提取总RNA,并对其质量和纯度进行鉴定。严格依照Affymetrix protocol试剂盒说明对样本进行操作,于北京博朗生科技有限公司进行基因芯片的制备、RNA标记、芯片杂交和扫描分析[首先进行cRNA的制备→合成cDNA→用RNase H进行水解→对cDNA进行标记制成基因芯片→分别用Affymetrix Gene Chip 645系统对芯片进行杂交→使用Affymetrix Gene Chip 450系统进行洗染(将未杂交分子洗去),杂交成功的分子进行染色→用Affymetrix Gene Chip 7G microarray scanner进行扫描]。
1.8 基因芯片数据分析
将扫描的CEL格式图像输入到Affymetrix Expression console software,对基因芯片图像进行数据分析,应用Robust Multichip Average计算方法对基因数据进行归一化处理之后,用荧光共聚焦显微镜扫读结果进行比较分析,得到各组基因的荧光信号强度,由于正确碱基互补双链具有较高的热力学稳定性,因此,探针与样品分子在某位点配对有差异时,该位点的荧光强度就会有所不同。将空白组与模型组、模型组与人迎组的基因的荧光信号强度进行比较,并用Transcriptome Analysis console对比值进行分析,判断基因差异表达的标准及筛选出样本之间的差异表达基因:两个基因比值的fold change≥1.5为表达上调,fold change≤-1.50为表达下调,-1.50~1.50之间为不存在显著表达差异。
1.9 统计学处理

2 结果
2.1 各组大鼠血压的变化
28天干预治疗结束后,可以看到模型组的收缩压明显升高。与空白组比较,人迎组在第1、5、9、13、17、21、25和28天所测收缩压中明显持续升高,差异具有统计学意义(P<0.01)。与模型组对比,人迎组在干预过程中第1、5、9天收缩压有所降低,具有统计学意义(P<0.05),在第13、17、21、25和28天显著降低,具有统计学意义(P<0.05)。详见表1。
2.2 基因芯片筛查结果
与空白组相比:模型组共有372个差异表达基因,其中243个基因表达下调,129个基因表达上调(P<0.01且fold change≥1.50)。与模型组比较:人迎组共有355个差异表达基因,其中188个基因表达下调,167个基因表达上调(P<0.01且fold change≥1.50)。在模型组上调同时在人迎组下调的基因有75个(见图1-A),其中有意义的基因有EPHX2、CHI3L1、Acsm3、Tstd1、MGC108823、Naip5、RGD1310641、Wdr46、Pus71等。详见表2。在模型组中下调并在人迎组中上调的基因有67个(见图1-B),其中有意义的基因有5-HT1A、KLK1、CBS、Ifitl、Cd4、Pnpla1、Zcchc9、Ppp2r4、Tnnt1等。详见表3。

表1 治疗后各组大鼠收缩压的变化
注: 与空白组相比,aP<0.01;与模型组相比,bP<0.01,cP<0.05。

注:图A:模型组/空白组中上调的基因与人迎组/模型组中下调的基因;图B:模型组/空白组中下调的基因与人迎组/模型组中上调的基因
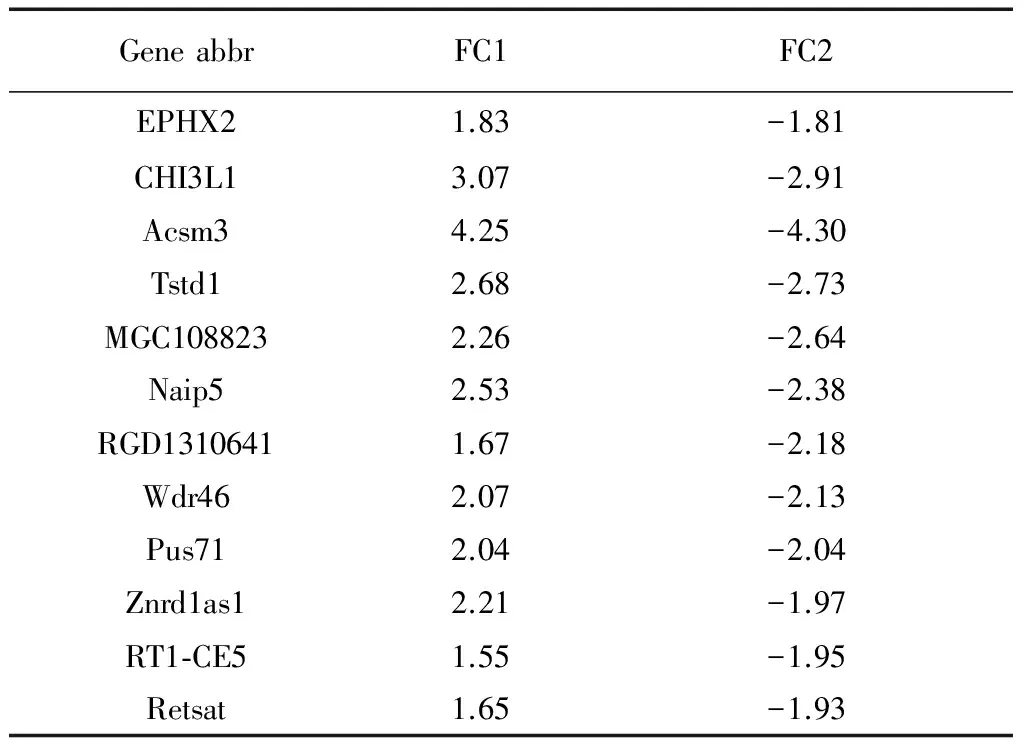
表2 在模型组中表达上调,同时在人迎组下调的基因
注: Gene abbr:基因缩写;FC1:基因在模型组的表达水平/基因在空白组的表达水平;FC2:基因在人迎组的表达水平/基因在模型组的表达水平。

表3 在模型组中表达下调,同时在人迎组上调的基因
注: Gene abbr:基因缩写;FC1:基因在模型组的表达水平/基因在空白组的表达水平;FC2:基因在人迎组的表达水平/基因在模型组的表达水平。
3 讨论
高血压的普遍性和随之带来的并发症的高风险使之成为重要的公共卫生问题[10]。在预防治疗方面,大量的动物实验和临床研究报道了针刺治疗高血压的有效性[11-14]。因此本实验以针刺人迎穴为研究平台,采用基因芯片技术分析了干预后大鼠靶器官中整个基因组的基因表达,发现其中存在着特殊而显著的改变。在所获得的372条差异表达基因中,上调基因129条,下调基因243条,其中课题组挑出了与模型组和人迎组密切相关的基因20条,按其作用和功能可将这些基因归类,现就其中较重要的两类分别进行讨论分析。
3.1 免疫方面的炎症介导
炎症已被公认在高血压和心血管疾病中发挥着重要的病理生理作用,它参与的许多过程均能使血压升高。在病理状况下,炎症介质能损伤血管内皮的屏障功能致使血管通透性增高,增加了表面粘附因子的表达,同时也促进了单核细胞的聚集粘附以及泡沫的形成,会导致大血管动脉粥样硬化[15]。而在脉管系统中,炎症可以促进平滑肌细胞的增殖,在血管重构中起着一定作用[16-18]。再者,脑部拥有许多复杂的神经网络,能通过神经递质调整交感-迷走神经的平衡,从而调节心血管系统以及中心和周围的血液流通[19],因而与高血压的治疗密切相关。神经递质介导方面,针灸效应可能是通过神经-内分泌-免疫网络实现的,针刺人体特定穴位会直接或间接刺激神经受体,通过中枢神经系统诱导内分泌和体内系统部分化学物质的改变,引起一系列细胞免疫和体液免疫[20-21]。也有研究表明,针刺可以激活细胞间和细胞内的信号转导过程,而细胞的局部电活动,可能与细胞骨架或部分受体受到激活作用有关[22]。
在所挑选的20个基因中与高血压密切相关的Klk1、5-HT1A、CBS、Ifit1、CD4、Pnpla1、Ppp2r4等基因在模型组下调的同时在人迎组上调,其中与炎症方面相关的基因有CD4、Ifit1、KLk1。有研究表明[23-26],CD4+、CD25+等因子的数量减少和(或)功能降低,与原发性高血压的发病存在一定联系,其发生的可能机制是针刺能刺激相应感受器,促进细胞因子及化学成分的产生,介导体液免疫应答,从而提高外周CD4的数量和功能,降低了炎症细胞在中枢神经系统和血管周围组织的渗透,同时减少了炎症因子的产生,对高血压起到一定的免疫治疗作用[23,27]。基因Ifit1在功能分类上属于调控蛋白,可以被IfN诱导产生,但其作用机制与CD4相类似,在一定程度上能促进自身免疫中Th2的亚单位IL-4和IL-10细胞因子的分泌,从而增强体液免疫应答,提高CD4含量[28],达到免疫治疗的效果。本实验研究结果显示,CD4和IfN在模型组表达下调的同时在人迎组表达上调,与这两条基因的其他研究成果相一致,都说明了针刺人迎穴可抑制高血压的发展。组织缓激肽释放酶(kallikren-1,KLK1)由丝氨酸蛋白酶分解产生,是肥大细胞和血小板在最初的炎症过程[29]。它能刺激产生和释放炎性介质,如粘附分子、细胞因子、前列腺素、一氧化氮和自由基等参与高血压、炎症、心血管疾病的内稳态等活动[30-31]。大量研究报道,KLK1可大范围降低血压[32]。结合的实验结果显示:与空白组相比,模型组大鼠的KLK1基因显著减少,同时这也符合对高血压患者的临床研究,即高血压时KLK1含量较低[33],而针刺人迎穴可以增加基因KLK1的表达。有临床研究也显示针刺可以显著降低下丘脑中细胞激素的水平[34]。以上研究结果均说明针灸具有抗高血压类作用,其作用机制可能涉及促炎性细胞因子的抑制作用[35]。因此课题组推断,人迎穴可以改善高血压状态,抑制基因的表达。
3.2 调节细胞周期的核转录因子
PP2A可以双向调节细胞周期,目前研究认为它具有肿瘤抑制因子的潜在能力[36]。此抑制功能与对DNA损伤时的反应和信号传导,细胞生长分化的蛋白去磷酸化作用有关。PP2A有关功能是靠其家族的小亚群来实现的。而PPP2r4作为PP2A一个重要的亚单位[37-38],在周期细胞增殖、分化、细胞调节和DNA复制时等有一定关系,其表达异常或基因突变等均可能影响了正常细胞的增殖。同为RNA转录因子相关的Pnpla1基因突变时由它介导的磷脂酶类的产生也会受到抑制,也就是会数量减少或功能降低,导致部分功能缺失、皮肤屏障受损,甚至可能致使大鼠过早死亡。在干预28天以后,基因Pnpla1在模型组大鼠表达下调,在人迎组表达上调,间接证实了针刺人迎穴对下丘脑中Pnpla1的表达有一定影响,从而对高血压病情的发展有重要作用[39-41]。因此课题组推测,针刺人迎穴影响了多条基因在下丘脑中的表达,是其对心血管重构和血压调节影响的原因所在。
3.3 影响神经递质的调控
下丘脑拥有许多复杂的神经网络,它通过神经递质调节中枢和周围的血液流通。电生理学研究表明,下丘脑是心血管核心的重要组成部分,它通过不同的神经递质调控交感-迷走神经的平衡来调节心血管系统[42]。
5-羟色胺受体是一种调节心血管反应并且拥有176da生物单胺分子量的受体[43]。5-HT1A能激活脑干和脊髓,通过下行通路抑制交感神经活性,降低血压,减缓心率[44]。脑干中5-HT1A受体的激活引起强有力的选择性抑制高血压和交感神经的反应,刺激并诱发背内侧的下丘脑核团[45]。H2S是在中枢神经系统内产生硫化氢的主要酶类,能调节交感神经系统。硫化氢是一种内皮依赖性血管舒张因子,它能改善周围血管的舒张功能[46]。
本实验数据显示,与空白组相比,模型组大鼠体内的基因5-HT1A和Cbs表达降低,人迎组干预后,5-HT1A和Cbs的表达明显增多。这表明,针刺人迎穴可以调节基因5-HT1A和Cbs在SHR下丘脑内的表达。在针灸领域,脑干中心血管相应区域的躯体感觉神经的诱发是通过一系列神经递质系统活动的,基本上使神经改变活动恢复到一个稳定的基线水平[47]。因此课题组推测,针刺人迎穴可以影响5-HT1A和Cbs等兴奋性和抑制性神经递质在中枢神经系统中释放,从而改变感觉信息传递的过程,最终降低血压,使血压和心血管功能正常化。
综上所述,针刺人迎穴能明显降低SHR的血压,影响下丘脑中355条基因的表达,其中部分基因和原发性高血压的病情发展密切相关。本实验的创新点在于采用针刺人迎穴干预,利用基因芯片技术从基因层面进行研究;它可以在同一时间检测大量基因的表达,正好适用于研究多基因影响的高血压疾病,同时可以从分子水平全面而深刻的探明针刺的作用机制,符合了中医治疗疾病的整体观念。根据本实验结果推测,针刺人迎穴对抗原发性高血压的可能机制是其影响了部分基因的表达,通过调节炎症、神经递质及其受体、交感神经兴奋性等影响血管重构以及其相关功能,从而对高血压达到一定治疗效果,并且为以后同方向的科研提供了思路和相关材料,对临床也有较为可行的指导意义。下一步工作有必要对基因芯片分析获得的差异表达基因做进一步验证。
[1] 陈广胜,李立新,许迪,等.高血压前期人群左室结构和功能的改变:盲法评估及对照组比较[J].中国临床康复,2005,9(15):80-81.
[2] Slama M, Susic D, Frohlich ED. Prevention of hypertension[J]. Current Opinion in Cardiology, 2002, 17(5):531-536.
[3] Franceschini N,Le TH.Invited Review-Genetics of Hypertension:discoveries from the bench to human populations [J].Am JPhysiol Renal Physiol,2014,306(1):1-11.
[4] 于正,吴巧凤,梁繁荣,等. 针刺通过调节免疫系统治疗原发性高血压的机制探讨[J].针刺研究,2014,39(4) : 333-336.
[5] 陈晶,刘宁,张毅杰,等. 血管内皮细胞功能障碍与原发性高血压[J].中国实用医药,2009, 4(23): 241-242.
[6] 靳聪妮,安玉兰,张天生,等.针刺降压组穴治疗轻中度高血压病临床疗效观察[J].中华中医药学刊,2010,24(4):291-293.
[7] Wang J,Xiong X, Liu W. To systematically assess the current clinical evidence of acupuncture for essential hypertension[J]. Int J Cardiol,2013,169(5):317-326.
[8] 周逸平,王月兰,方志斌,等.针刺对SHR血压及NE、DA、5-HT含量的影响和血压与血粘度的关系[J].针刺研究,2005,20(3):55-61.
[9] Korostynski M, Piechota M, Golda S, et al. High-Throughput Gene Expression Profiling of Opioid-Induced Alterations in Discrete Brain Areas[J]. Methods in Molecular Biology, 2015,(1230):65.
[10] Yin C, Seo B, Park H J, et al. Acupuncture, a promising adjunctive therapy for essential hypertension: a double-blind, randomized, controlled trial[J]. Neurological Research, 2007, 29 Suppl 1(S1):98.
[11] Park JM, Shin AS, Park SU, et al. The acute effect of acupuncture on endothelial dysfunction in patients with hypertension: a pilot, randomized, double-blind, placebo-controlled crossover trial[J]. Journal of Alternative & Complementary Medicine, 2010, 16(8):883-888.
[12] Sugioka K,Mao W, Woods J,et al. An unsuccessful attempt to treat hypertension with acupuncture[J]. Am J Chin Med (Gard City NY), 1977,5(1): 39-44.
[13] Kalish LA, Buczynski B, Connell P, et al. Stop Hypertension with the Acupuncture Research Program (SHARP): clinical trial design and screening results[J]. Controlled Clinical Trials, 2004, 25(1):76-103.
[14] 王春,秦少博,李萍,等.H型高血压患者炎症水平与内皮功能的关系研究[J].心血管病学进展,2015,36(1):89-92.
[15] Virdis A, Schiffrin E L. Vascular inflammation: a role in vascular disease in hypertension?[J]. Curr Opin Nephrol Hypertens, 2003, 12(2):181-187.
[16] Trott D W, Harrison D G. The immune system in hypertension[J]. Advances in Physiology Education, 2014, 38(1):20-24.
[17] Harrison D G, Guzik T J, Lob H E, et al. Inflammation, immunity, and hypertension[J]. Hypertension, 2011, 57(2):132-140.
[18] Chen H, Dai J, Zhang X, et al. Hypothalamus-Related Resting Brain Network Underlying Short-Term Acupuncture Treatment in Primary Hypertension[J]. Evidence-based complementary and alternative medicine : eCAM, 2013, (2):808971.
[19] 卢金花,王玲玲,姜劲峰,等.针灸对抑郁症患者神经-内分泌-免疫系统影响研究[J].吉林中医药,2010,10(10):893-895.
[20] 牛文民,牛晓梅,雷政权,等.针灸足三里穴对神经内分泌免疫网络系统的影响[J].陕西中医学院学报,2014,3(2):101-103.
[21] Bazzoni G, Dejana E. Endothelial cell-to-cell junctions: molecular organization and role in vascular homeostasis[J]. Physiological Reviews, 2004, 84(3):869.
[22] Guzik T J, Hoch N E, Brown K A, et al. Role of the T cell in the genesis of angiotensin II induced hypertension and vascular dysfunction[J]. Journal of Experimental Medicine, 2007, 204(10):2449.
[23] Todryk S M, Gough M J, Pockley A G. Facets of heat shock protein 70 show immunotherapeutic potential[J]. Immunology, 2003, 110(1):1-9.
[24] Kovalenko A D. T regulatory lymphocytes prevent angiotensin II-induced hypertension and vascular injury[J]. Hypertension, 2011, 57(3):469.
[25] Bomfim G F, Echem C, Martins C B, et al. Toll-like receptor 4 inhibition reduces vascular inflammation in spontaneously hypertensive rats[J]. Life Sciences, 2015, (122):1.
[26] 杨子聪, 施莹, 刘伶. CD4+T淋巴细胞亚群在原发性高血压中作用的研究进展[J]. 中国临床新医学, 2016, 9(11):1038-1041.
[27] 李卓成, 罗蓉, 李延武. SLE相关基因IFIT1免疫调节功能的初步研究[J]. 深圳中西医结合杂志, 2008, 18(5):265-269.
[28] Guevara-Lora I. Kinin-mediated inflammation in neurodegenerative disorders[J]. Neurochemistry International, 2012, 61(1):72-78.
[29] Naffahmazzacoratti M D G, Gouveia T L F, Simões P S R, et al. What have we learned about the kallikrein-kinin and renin-angiotensin systems in neurological disorders[J]. 世界生物化学杂志:英文版(电子版), 2014, 5(2):130-140.
[30] Pesquero J B, Bader M. Molecular biology of the kallikrein-kinin system: from structure to function[J]. Brazilian Journal of Medical & Biological Research, 1998, 31(9):1197-1203.
[31] Yu H Z, Xie L D, Zhu P L, et al. Human tissue kallikrein 1 gene delivery inhibits PDGF-BB-induced vascular smooth muscle cells proliferation and upregulates the expressions of p27 Kip1, and p2l Cip1[J]. Molecular & Cellular Biochemistry, 2012, 360(1-2):363-371.
[32] Ling L, Hou Q, Xing S, et al. Exogenous kallikrein enhances neurogenesis and angiogenesis in the subventricular zone and the peri-infarction region and improves neurological function after focal cortical infarction in hypertensive rats[J]. Brain Research, 2008, 1206(3):89-97.
[33] Lu J, Shaoa R H, Hub L, et al. Potential antiinflammatory effects of acupuncture in a chronic stress model of depression in rats[J]. Neuroscience Letters, 2016, (618):31.
[34] Wan F, Niu X, Song Y L, et al. The Role of Chinese Herbs and Acupuncture on the Inflammation Reaction After Cerebral Ischemia[J]. Current Pharmaceutical Design, 2016, 22(6):709.
[35] Virshup D M. Protein phosphatase 2A: a panoply of enzymes[J]. Current Opinion in Cell Biology, 2000, 12(2):180-185.
[36] Sontag E. Protein phosphatase 2A: the Trojan Horse of cellular signaling[J]. Cellular Signalling, 2001, 13(1):7-16.
[37] Goldberg Y. Protein phosphatase 2A: who shall regulate the regulator?[J]. Biochemical Pharmacology, 1999, 57(4):321-328.
[38] Csortos C,Zolnierowicz S, Bolo E, et al. High Complexity in the expression of the B subunit of protein phosphatase 2AO Evidence for the existence of at least seven novel isoforms[J].J Biol Chem,1996,271:2578-2588.
[39] Hirabayashi T, Anjo T, Kaneko A, et al. PNPLA1 has a crucial role in skin barrier function by directing acylceramide biosynthesis[J]. Nature Communications, 2017, 8:14609.
[40] Ohno Y, Kamiyama N, Nakamichi S, et al. PNPLA1 is a transacylase essential for the generation of the skin barrier lipid ω-O-acylceramide[J]. Nature Communications, 2017, (8):14610.
[41] Chen H, Dai J, Zhang X, et al. Hypothalamus-Related Resting Brain Network Underlying Short-Term Acupuncture Treatment in Primary Hypertension[J]. Evidence-based complementary and alternative medicine : eCAM, 2013, 2013(2):808971.
[42] Barnes N M, Sharp T. A review of central 5-HT receptors and their function[J]. Neuropharmacology, 1999, 38(8):1083-1152.
[43] Ramage A G, Villalón C M. 5-Hydroxytryptamine and cardiovascular regulation[J]. Trends in Pharmacological Sciences, 2008, 29(9):472-81.
[44] Horiuchi J, Wakabayashi S, Dampney R A. Activation of 5-hydroxytryptamine 1A receptors suppresses the cardiovascular response evoked from the dorsomedial hypothalamic nucleus.[J]. Hypertension, 2005, 46(1):173-179.
[45] Perna A F, Lanza D, Sepe I, et al. Hydrogen sulfide, a toxic gas with cardiovascular properties in uremia: how harmful is it?[J]. Blood Purification, 2011, 31(1-3):102-106.
[46] Longhurst J. Acupuncture’s cardiovascular actions: a mechanistic perspective[J]. Medical acupuncture, 2013, 25(2): 101-113.

