不同盐浓度下粪肠球菌代谢精氨酸的规律
吕佳良, 刘 芳, 孙芝兰, 王道营, 许晓曦, 徐为民
(1.东北农业大学食品学院,黑龙江哈尔滨 150030; 2.江苏省农业科学院农产品加工研究所,江苏南京 210014)
精氨酸的生物合成和代谢因其代谢途径的复杂性和多样性吸引了大量的研究者。精氨酸及其前体(如多胺和一些抗生素)可参与一些代谢产物的生物合成。精氨酸降解的多种途径在微生物中已有描述,某些情况下其中的几个途径在同种微生物中同时存在[1-2]。在这些降解途径中,精氨酸脱亚胺酶(ADI)途径是精氨酸降解最广泛的厌氧途径。精氨酸脱亚胺酶途径包含3个反应,参与的酶有精氨酸脱亚胺酶(ADI)、鸟氨酸氨甲酰基转移酶(OTC)和氨基甲酸酯激酶(CK)(图1),并且完成了精氨酸到鸟氨酸、氨气和CO2的转化,其中生成1 mol ATP消耗1 mol精氨酸,因此ADI途径是一些微生物主要的能量来源[2-3]。

有研究提出,精氨酸脱亚氨酶途径对细菌在酸性环境中的存活起着重要作用[4-5]。Vrancken等进行了在发酵乳杆菌IMDO130101中环境pH值下通过精氨酸脱亚氨酶途径决定瓜氨酸和鸟氨酸释放的试验[6]。然而到目前为止,还没有关于精氨酸在细菌盐胁迫条件下代谢规律的研究。本研究主要对粪肠球菌在不同盐浓度条件下代谢精氨酸的规律进行研究,可为解析该菌适应酸胁迫环境的机制提供一定的参考,同时可为研究该菌在酸性条件下的生长奠定基础。
1 材料与方法
1.1 试验材料
粪肠球菌R-612-Z1(江苏省农业科学院农产品加工研究所自盐水鸭中分离获得的产酪胺菌株);乙腈、正己烷,均为色谱纯;异硫氰酸苯酯(纯度≥98%,美国Sigma公司);三乙胺(纯度≥99.5%,瑞士Fluka公司);乙酸钠(AR级,国药集团化学试剂有限公司);M17培养基(山东青岛高科园海博生物技术有限公司);L-精氨酸标准物质(纯度>99%,上海融禾医药科技发展有限公司)。
1.2 试验方法
1.2.1 样品的制备 活化菌种:取-40 ℃保藏的粪肠球菌R-612-Z1 600 μL接种到50 mL的M17培养基中,在37 ℃恒温箱中培养12 h。
配制氯化钠浓度分别为0%、2%、4%、6%的M17培养基,并加入1%的精氨酸,将活化好的菌液按4%接种,每隔 2 h 取2 mL菌液,用紫外分光光度计测600 nm处菌液的吸光度。通过吸光度的变化规律,观察粪肠球菌在不同浓度氯化钠胁迫下的生长情况。
1.2.2 不同浓度氯化钠培养条件下发酵液中残留精氨酸浓度的测定
1.2.2.1 标准溶液的配制 精确称取L-精氨酸标准物质213.2 mg置于50 mL容量瓶中,用去离子水溶解并定容,摇匀即得L-精氨酸标准储备液,稀释成浓度分别为4.264、2.132、1.066、0.533、0.267、0.133 mg/mL的溶液,于4 ℃冰箱保存备用。
1.2.2.2 样品处理 在无菌操作台上,用移液枪取8 mL菌液置于10 mL离心管中,用离心机以6 000 r/min的转速离心10 min,取上清液,于-20 ℃冰箱保存备用。
1.2.2.3 样品的提取和衍生化 精密量取标准品溶液或菌液200 μL,加入0.1 mol/L的异硫氰酸苯酯-乙腈溶液 100 μL,1.0 mol/L的三乙胺-乙腈溶液100 μL,旋涡混匀后室温放置1 h,加入400 μL正己烷溶液,旋涡混匀1 min并静置10 min,取澄清的下层溶液200 μL用乙腈定容至1 mL,摇匀,经0.45 μm有机相滤膜过滤后上液相色谱仪进行分析。
1.2.2.4 色谱条件 Waters Alliance 2695液相色谱系统,色谱柱为Agilent ZORBAX Eclipse XDB-C18(4.6 mm×250 mm,5 μm),UV-2487紫外检测器,检测波长为254 nm,流速为 1 mL/min,进样量2 μL,柱温40 ℃,流动相A为 0.1 mol/L 醋酸钠-乙腈溶液(体积比93 ∶7),流动相B为水-乙腈溶液(体积比20 ∶80),梯度洗脱条件见表1[7]。
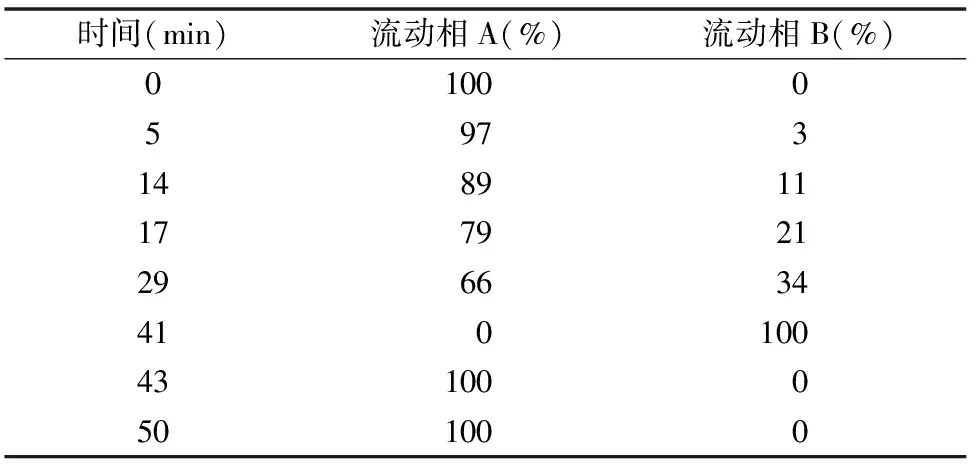
表1 梯度洗脱条件
1.2.3 不同浓度氯化钠培养条件下菌体内精氨酸脱亚胺酶的表达量差异 将活化好的菌液按4%接种到不同氯化钠浓度且添加1%精氨酸的M17培养基中,培养4 h后,从每个样品(每个处理3个重复)取出3 mL菌液,4 ℃条件下以 10 000 r/min 的转速离心3 min,收集沉淀物。使用天根生化科技(北京)有限公司的细胞/细菌总RNA提取试剂盒提取菌泥的RNA。通过2%的琼脂糖电泳和D260 nm/D280 nm的值对RNA的完整性、浓度和纯度进行鉴定。
使用宝生物工程(大连)有限公司生产的PrimeScript RT reagent kit去除提取液中的DNA,并将提取的RNA反转录成cDNA。参照宝生物工程(大连)有限公司的SYBR Premix ExTaqTM试剂盒的使用说明书配制实时荧光定量PCR反应液,反应体系按照说明书添加。荧光定量PCR引物见表2。使用美国应用生物系统公司的ABI 7500 Real-Time PCR System进行实时荧光定量PCR试验,不同样品反应体系设3次重复。分析各基因的CT值,利用Excel 2003软件计算出标化后的-ΔΔCT值,目的基因的相对表达量采用2-ΔΔCT法进行评估,计算公式为ΔΔCT=未知样品ΔCT-参照样品ΔCT,未知样品ΔCT=CT目的基因-CT管家基因,参照样品ΔCT=CT参照样品目的基因-CT参照样品管家基因。
2 结果与分析
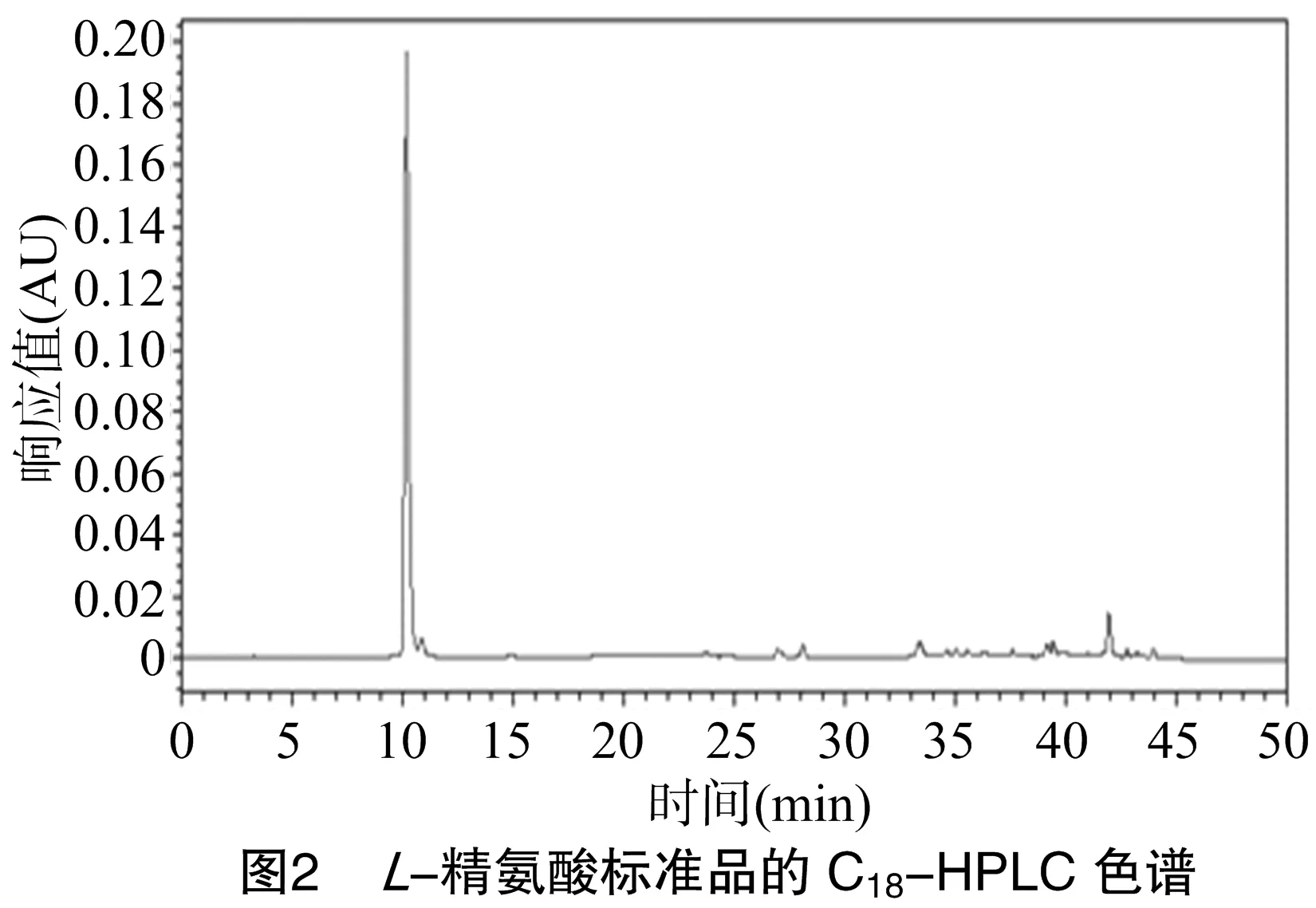
2.1 精氨酸测定方法的建立
L-精氨酸标准品的C18-HPLC色谱结果如图2所示。以L-精氨酸衍生物的峰面积为横坐标,L-精氨酸标准溶液浓度(mg/mL)为纵坐标得到的线性回归方程为y=6.1×105x-196 18,r2=0.998。结果表明,L-精氨酸质量浓度在0.133~4.264 mg/mL范围内时,其质量浓度与峰面积呈良好的线性关系。
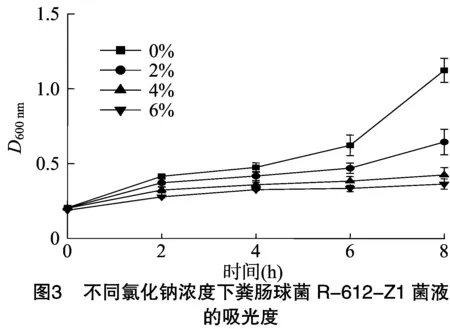
2.2 不同浓度氯化钠溶液处理下粪肠球菌的吸光度变化
由图3可知,0%、2%氯化钠溶液处理的粪肠球菌R-612-Z1菌液增长幅度较大,接种后6~8 h快速增长,而4%、6%氯化钠溶液处理的粪肠球菌R-612-Z1菌液增长幅度较平缓,6%氯化钠溶液处理的粪肠球菌R-612-Z1菌液的吸光度明显低于其他组。随着氯化钠浓度的升高,粪肠球菌R-612-Z1受到抑制的程度依次增加,4组不同浓度氯化钠溶液处理的粪肠球菌R-612-Z1菌液在培养8 h后,最终的吸光度随氯化钠溶液浓度的升高而减小,其中最大值是最小值的3.41倍。
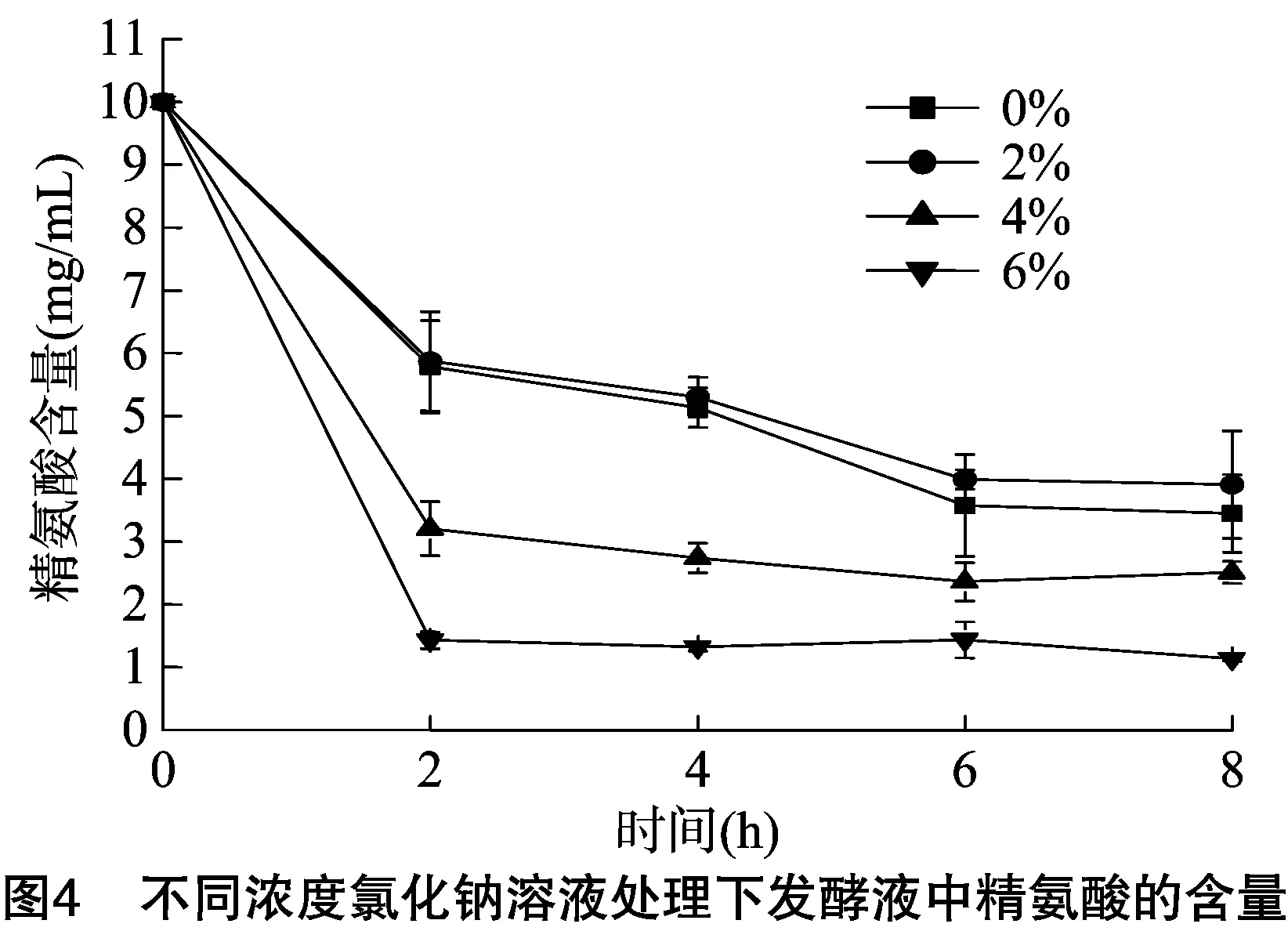
2.3 不同浓度氯化钠溶液处理下发酵液中残留精氨酸含量的变化
由图4可知,菌液中精氨酸的初始浓度为10 mg/mL,不同浓度氯化钠溶液处理后0~2 h精氨酸含量迅速消耗,0%、2%氯化钠溶液处理的粪肠球菌R-612-Z1菌液的精氨酸含量下降趋势基本一致,4%、6%氯化钠溶液处理的粪肠球菌R-612-Z1菌液的精氨酸含量下降速度更快,其中6%氯化钠溶液处理的粪肠球菌R-612-Z1菌液的精氨酸含量下降速度最快。培养2~6 h下降趋势明显变缓,0%、2%氯化钠溶液处理的粪肠球菌R-612-Z1菌液的精氨酸含量明显高于4%、6%氯化钠溶液处理的粪肠球菌R-612-Z1菌液,其中6%氯化钠溶液处理的粪肠球菌R-612-Z1菌液的精氨酸含量最低。培养6~8 h,精氨酸含量趋于稳定。
2.4 荧光定量PCR测定精氨酸脱亚胺酶基因表达量的变化
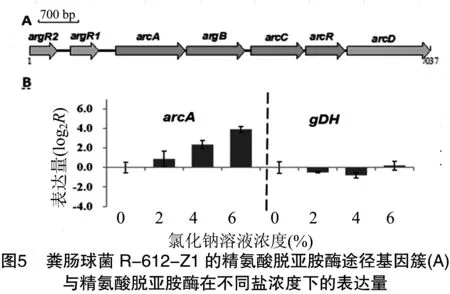
精氨酸脱亚胺酶途径包含3个反应,包括精氨酸脱亚胺酶(由arcA编码)、鸟氨酸氨甲酰基转移酶(由argB编码)和氨基甲酸酯激酶(由arcC编码)等3种酶,并且完成精氨酸到鸟氨酸、氨气和CO2的转化。以上各酶的基因处于1个操纵子上(图5-A)。因此笔者选择了精氨酸脱亚胺酶为目标物,通过分析其对应基因在不同氯化钠浓度条件下的表达量差异来研究精氨酸的代谢情况。结果(图5-B)表明,随着氯化钠浓度的升高,gDH管家基因的表达量几乎无变化,而arcA基因表达量依次升高,说明高浓度氯化钠胁迫下粪肠球菌 R-612-Z1中与精氨酸代谢相关的精氨酸脱亚胺酶基因的表达量升高,增强了精氨酸的代谢能力。
3 讨论
精氨酸脱亚胺酶途径催化精氨酸产生鸟氨酸、氨气和CO2,生成1 mol ATP消耗1 mol精氨酸。因此,该途径是一些微生物主要的能量和碳、氮来源[2-3]。Xu等研究发现,精氨酸脱亚胺酶途径是马链球菌兽疫亚种(Streptococcusequissp.zooepidemicus)适应环境pH值变化的主要途径之一[9]。Vrancken等研究发现,环境pH值决定发酵乳杆菌(Lactobacillusfermentum)IMDO 130101通过精氨酸脱亚胺酶途径产生瓜氨酸和鸟氨酸的含量[6]。以上研究都说明,精氨酸脱亚胺酶途径是细菌适应酸性环境的一个机制。本研究发现,虽然在高盐浓度下粪肠球菌R-612-Z1的生长变得缓慢,但是发酵液中残留的精氨酸的含量却急剧减少,说明菌体在高盐环境下代谢精氨酸的能力提高,因此推断精氨酸脱亚胺酶途径也是粪肠球菌R-612-Z1适应高盐环境的一个机制。目前有关精氨酸脱亚胺酶途径在细菌盐胁迫中作用的文献报道较少,有研究者在植物盐胁迫中发现,瓜氨酸是甜瓜耐盐碱和干旱胁迫时叶片中的一个重要生化指标[10]。Vrancken等研究发现,发酵乳杆菌IMDO 130101中精氨酸脱亚胺酶通路的活性与培养环境中的盐浓度有关[11],说明精氨酸脱亚胺酶途径在细菌适应盐胁迫环境的过程中也起着重要作用。
[1]Abdelal A T. Arginine catabolism by microorganisms[J]. Annual Review of Microbiology,1979,33(1):139-168.
[2]Cunin R,Glansdorff N,Piérard A,et al. Biosynthesis and metabolism of arginine in bacteria[J]. Microbiological Reviews,1986,50(3):314-352.
[3]Crow V L,Thomas T D. Arginine metabolism in lactic streptococci[J]. Journal of Bacteriology,1982,150(3):1024-1032.
[4]Marquis R E,Bender G R,Murray D R,et al. Arginine deiminase system and bacterial adaptation to acidic environments[J]. Applied and Environmental Microbiology,1987,53(1):198-200.
[5]Xiong L F,Teng J L,Watt R M,et al. Arginine deiminase pathway is far more important than urease for acid resistance and intracellular survival inLaribacterhongkongensis:a possible result of arc gene cassette duplication[J]. BMC Microbiology,2014,14(1):1-12.
[6]Vrancken G,Rimaux T,Weckx S,et al. Environmental pH determines citrulline and ornithine release through the arginine deiminase pathway inLactobacillusfermentumIMDO 130101[J]. International Journal of Food Microbiology,2009,135(3):216-222.
[7]周 慧,郝 宁,严 明,等. 柱前衍生化HPLC法测定发酵液中L-瓜氨酸和L-鸟氨酸含量[J]. 南京工业大学学报(自然科学版),2009,31(2):77-80.
[8]Lenz C A,Hew Ferstl C M,Vogel R F. Sub-lethal stress effects on virulence gene expression inEnterococcusfaecalis[J]. Food Microbiology,2010,27(3):317-326.
[9]Xu B,Yang X Y,Zhang P,et al. The arginine deiminase system facilitates environmental adaptability ofStreptococcusequissp.zooepidemicusthrough pH adjustment[J]. Research in Microbiology,2016,167(5):403-412.
[10]Kusvuran S,Dasgan H Y,Abak K. Citrulline is an important biochemical indicator in tolerance to saline and drought stresses in melon[J]. The Scientific World Journal,2013,2013(5):253414.
[11]Vrancken G,Rimaux T,Wouters D,et al. The arginine deiminase pathway ofLactobacillusfermentumIMDO 130101 responds to growth under stress conditions of both temperature and salt[J]. Food Microbiology,2009,26(7):720-727.

