花生种子在不同发育时期油体的显微结构分析
王允,刘婷,和小燕,张幸果,马兴立,殷冬梅
(河南农业大学农学院,河南 郑州 45002)
花生种子在不同发育时期油体的显微结构分析
王允,刘婷,和小燕,张幸果,马兴立,殷冬梅
(河南农业大学农学院,河南 郑州 45002)
为进一步探讨子叶细胞内油体与含油量的关系,采用尼罗红染色和激光共聚焦技术相结合的方法观察不同含油量品种(花U 606和花17)在种子发育及萌发后不同时期油体的动态变化,结果表明,2个品种中油体的变化趋势基本一致,只在油体数量及大小上差异明显。随着花生种子的发育,油体逐渐增多,直至充满整个细胞且体积变大。萌发后随着油脂的降解,油体数量逐渐减少,30 d时仅在细胞壁周围有油体分布。通过对花生子叶细胞内油体含量进行分析,发现随着种子的发育,油体数量逐渐增加,油体含量也逐渐增加;而在种子萌发后不同阶段,油体的数量逐渐减少,油体含量也逐渐减少。结合子仁不同发育及萌发后不同时期含油量的变化可知,油体含量越高,含油量越高;反之,油体含量越低,含油量也越低。
花生;激光共聚焦技术;含油量;油体
在植物种子内, 脂类物质一般是以三酰甘油酯(TAG)的形式贮存在油体内[1]。在种子发育过程中, 油体主要集中在子叶、胚乳或盾片等贮藏组织中[2-3],主要包括TAG、外部的磷脂单分子层和油体相关蛋白3个部分,油体的直径很小,通常为0.5~2.5 μm,但也有例外,如经济作物可可的油体直径可达7 μm[4]。近年来,许多对油体的研究报道主要集中在油体的数量、形态大小及油体蛋白质的结构和功能上。韦存虚等[5]对油菜种子中胚子叶细胞内的油体进行观察,结果发现,小油体数量较多,大油体数量较少,且随着油体体积的增加,油体的数量随之减少。TZEN等[6]研究发现,油体体积小时能提高酯酶的作用面积,并能增强TAG的流动性。TING等[7]发现,在高油玉米中含有较大的油体及较高的TAG/油体蛋白比。SILOTO等[8]采用RNAi技术在拟南芥中发现种子胚中油体异常大,种子的含油量和蛋白质含量也发生了改变。在油菜种子中发现,油体蛋白质含量的减少引起油体异常增大,含油量降低[9]。SILOTO等[8]认为,在拟南芥中油体蛋白质的积累决定油体的大小。这些研究结果都表明,油体蛋白质在调控油体大小方面起着重要作用,且在种子萌发时油体蛋白质能阻止油体的异常融合从而增强种子的抗寒能力[10]。近年来,人们对油体产生、油体数量与形态及油体与含油量的关系等方面进行了探讨研究,针对油体和含油量的关系,研究者有两种不同的观点:一种认为油体越大含油量越高,二者呈正相关;而另一观点则认为油体与含油量之间是存在一定关系,但并非是正负相关这么简单。HENEEN等[11]观察燕麦胚乳发育过程中油体形态,结果发现,小油体逐渐融合成大油体,其认为油体的大小与含油量呈正相关。董劲松等[12]通过对不同含油量的甘蓝型油菜油体数量的研究观察发现,在单个子叶细胞内,高低油组分间无论油体数量还是油体截面积之和都存在显著差异,油体的数量和总面积与含油量呈正相关。含油量较低时细胞内也可存在体积较大的油体[9]。SILOTO等[8]研究发现,种子内油体数量和大小的改变影响油脂的含量。目前大家普遍认同这一观点。尽管前人在不同的作物中对油体的产生、数量和形态等进行了大量研究,但关于花生子仁中不同发育阶段油体的数量、形态及分布等还不清楚,因此,本试验分别在花生子仁发育及萌发后选取4个特定阶段,利用激光共聚焦扫描电镜对花生不同发育及萌发后子叶细胞的油体进行观察,并统计其油体截面积,以期进一步探讨花生中含油量与油体的关系,为花生高油品种的选育提供理论依据。
1 材料方法
1.1 试验材料
花生品种(ArachishypogaeaL.)花U 606和花17由河南农业大学花生研究室提供,花U 606属于普通早熟高油花生,花17为普通含油量花生品种。
1.2 取材方法
1.2.1 花生子仁不同发育时期的取材方法 以高油品种花U 606和普通品种花17为研究对象,所需试验材料种植在河南农业大学科教园区,在荚果发育过程中依据果针入土时间和子仁大小将花生仁分成4个不同的发育时期(果针入土后20 ,40 ,60,80 d),每个发育时期取样重复3次,保存备用。
1.2.2 子仁萌发后不同时期的取样方法 仍以花U 606和花17为研究对象,从2个材料中选取饱满且大小一致的子仁各40粒,完全浸泡4 h后转到培养瓶中加入适量的水,置于25 ℃的培养箱中催芽,以后每天换水,在其萌发后1个月内取样4次(萌发后5,10,20,30 d),3次重复。
1.3 花生不同发育时期子仁和萌发后子叶的观测
取花后时间(DAF)20,40,60,80 d的子仁和萌发后时间(DAG)5,10,20,30 d的子叶观察其生长情况。用天平称量不同时期花生子仁的质量,计算子仁在不同时期中的鲜质量变化。称鲜质量后,放在105 ℃烘箱中烘2 h,然后在60 ℃烘箱中烘至质量恒定,取出后放到干燥器中冷却,称其干质量。
1.4 激光共聚焦扫描切片制作与观察
取5 mg尼罗红溶于5 mL丙醇中,得到质量浓度为1 g·L-1的尼罗红母液,然后分装,并于4 ℃避光保存,取尼罗红母液用超纯水稀释到5 mg·L-1。取不同发育及萌发后时期的花生子仁,徒手切片(尽量薄),放于稀释好的尼罗红染液中黑暗温育15 min,后用磷酸盐缓冲液冲洗3次,洗去多余染料,制片,用激光共聚焦显微镜在激发波长为543 nm时观察细胞内的油体。
1.5 图片处理与数据统计
利用image软件的测量功能测定花生不同发育及萌发后单个子叶细胞内油体截面积之和。每个时期选取5个细胞进行细胞内油体截面积统计,设定:油体含量=单个细胞内油体截面积之和/整个细胞的面积×100%,比较含油量与油体含量的差异。
2 结果与分析
2.1 花生子仁不同发育及萌发后时期的形态特征
花U 606和花17品种在子仁发育阶段及萌发后形态上趋势大体相同。对不同发育时期花生子仁鲜质量及干质量进行测定可发现(表1),花生子仁的干质量在花后20~40 d增加缓慢;在40~80 d其子仁干质量迅速增加。这一结果表明,花生子仁在花后40~80 d,其内部贮藏物质迅速增加,是花生子仁发育的关键时期。在萌发后阶段,其子仁的干质量一直减少。此现象表明,花生子仁内部的贮藏物质是为维持种子的萌发及植株的生长而逐渐消耗的。

表1 花生不同发育时期子仁的干鲜质量Table 1 The fresh weight of peanut pods and seeds at different developmental stages g ·荚-1
2.2 不同发育时期花生子叶细胞中油体的分布及比较
花生子仁中油脂贮存于油体中,油体能被尼罗红染色,在激光共聚焦显微镜下,油体都染成红色的圆球形。在不同发育时期不同含油量花生品种子仁中子叶细胞内油体的变化不尽相同。使用共聚焦显微镜观察花生子仁在不同时期油体的动态变化,结果表明(图1),花后20 d在子仁的子叶细胞中已经有清晰可见的油体,但数量很少,油体体积比较小,油体间的空隙大且沿细胞壁分布(图1 A),花U 606和花17子叶细胞中的油体分布、形态大小及数量差别不大。花后40 d相较于花后20 d子叶细胞而言,油体依然分布在细胞壁两侧,但数量增多,逐渐向细胞中间分布,油体体积也增大,且其外形变得更为圆润饱满。比较发现,花U 606中的油体数量比花17中多(图1 B、图1 F);在花后40~60 d油体继续向细胞中间分布,油体数目进一步增多,油体空隙也进一步缩小(图1 C、图1 G),花U 606中油体数目仍比花17中多,且有较大的油体出现。在花后60~80 d油体的数量不断增加,分布紧密且充满整个子叶细胞(图1 D、图1 H),相比之下,花U 606中油体的分布更为紧密,油体数量明显高于花17,花17中油体分布稍微分散且有少许空洞。总的来说,在花生子仁发育过程中花U 606和花17在油体分布及变化趋势上是一致的,只是随着发育进程细胞内油体的数量及大小上有所差异。
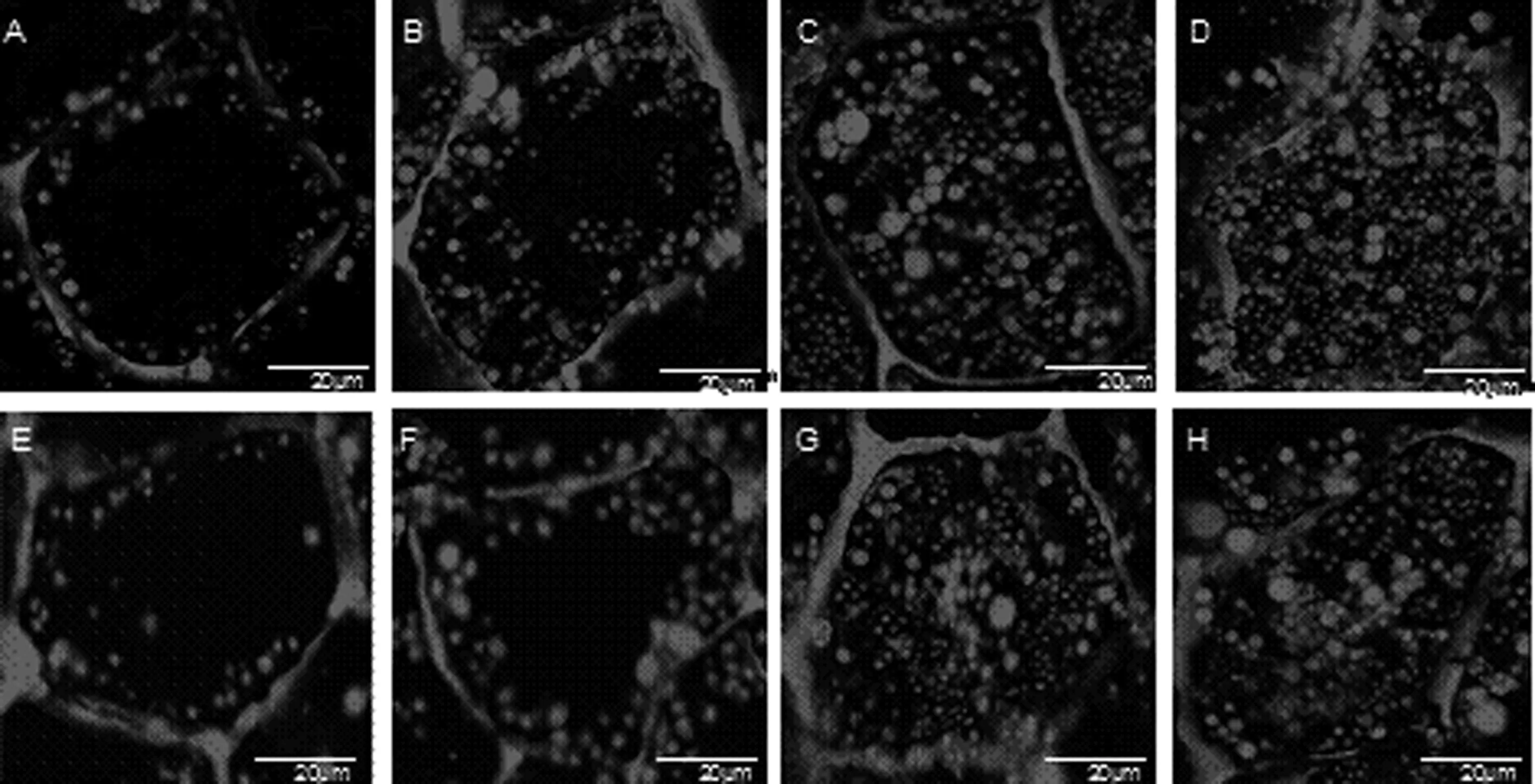
其中A,B,C,D分别代表U606花后20 DAG,40 DAG,60 DAG,80 DAG; E,F,G,H分别代表花17花后20 DAG,40 DAG,60 DAG,80 DAG。A,B,C,D stand for days after flowering(DAG) (20,40,60 and 80DAG) of Hua U 606,respectively; E,F,G,H stand for days after flowering(DAG) (20,40,60 and 80 DAG) of Hua 17,respectively.
2.3 不同萌发后时期花生子叶细胞中油体的分布
随着种子的萌发,子叶中贮存的油脂要转化为其他物质,为种子萌发和幼苗生长提供营养,通过分析花生种子在萌发后时期油体的动态变化,可以看出(图2),在萌发后5 d时油体虽然仍充满整个子叶细胞,但数量已明显减少。从油体减少的速度来看,花U 606油体减少量明显高于花17;萌发后10 d时子叶细胞内油体的数量进一步减少,油体间空隙变大甚至细胞中间出现空洞;萌发后20 d时油体数量持续减少且大多沿细胞壁分布;萌发后30 d时只有少数沿细胞边缘分布的油体。总的来说,萌发后5 d时油体已经开始降解,随着萌发进程的推进,花U 606和花17内油体的趋势一致,即油体的数量都越来越少。从油体充满细胞到逐渐分布在细胞壁的两侧,结合种子萌发后时期粗脂肪含量的变化趋势发现,油体数量的变化趋势与花生种子萌发后阶段粗脂肪含量的变化趋势一致。
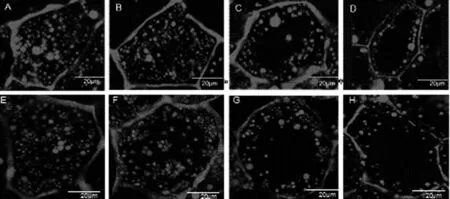
其中,A,B,C,D分别代表:花U 606萌发后5 DAG,10 DAG,20 DAG,30 DAG; E,F,G,H分别代表:花17萌发后5 DAG,10 DAG,20 DAG,30 DAG。A,B,C,D stand for days after germination(DAG) ( 5, 10, 20 and 30 DAG) of Hua U 606,respectively; E,F,G,H days after germination(DAG) ( 5, 10, 20 and 30 DAG) of Hua 17,respectively.
2.4 不同发育时期花生子叶细胞内油体含量的统计分析
为了解花生子仁在不同时期含油量与细胞内油体含量的关系,从所得到的激光共聚焦图片中选取子仁不同时期的切片图片,测量细胞表面积及细胞内油体的总截面积,计算出细胞内的油体含量(表2)。通过比较2个品种在不同时期的油体含量,结果发现,油体含量越高,细胞内含油量也越高,2个品种在种子发育时期含油量都随着油体含量的增加而增加,花U 606中油体含量明显高于花17,而在萌发后阶段含油量则随着油体含量的减少而减少。
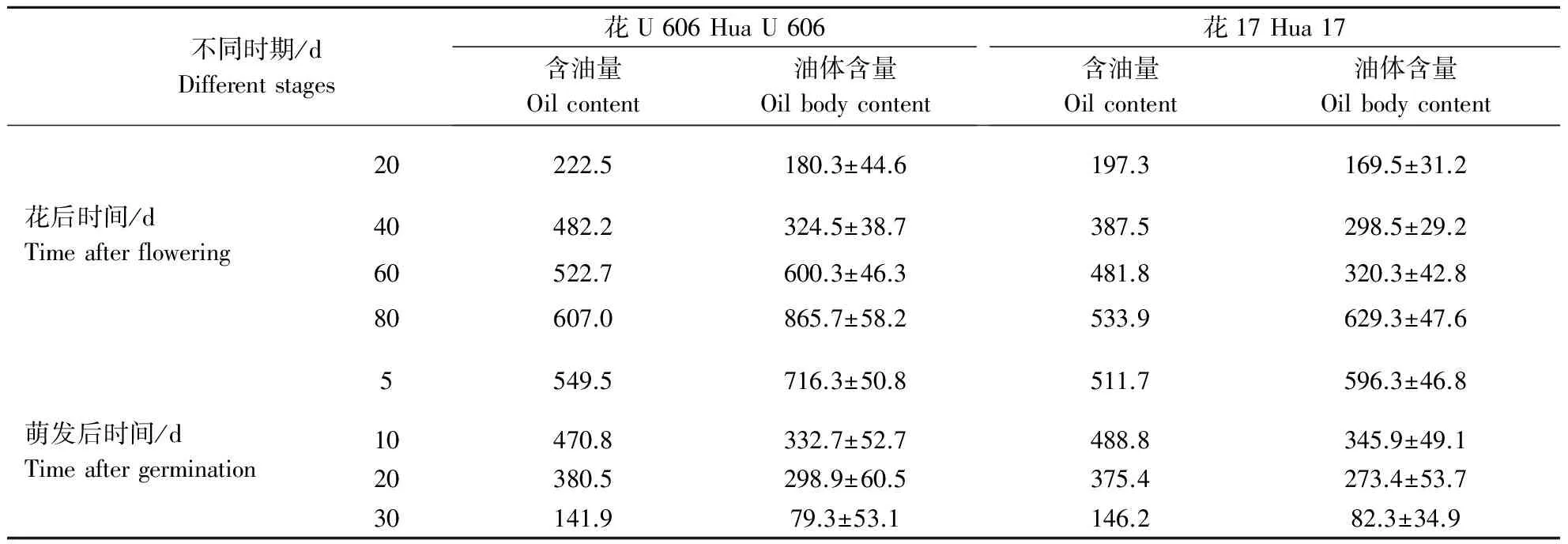
表2 不同生长时期花生子叶细胞内的含油量与油体含量Table 2 The oil content of different growth period of peanut seeds compared with the rate of the oil body g·kg-1
3 结论与讨论
在油料作物种子中的贮藏物质主要有脂类和蛋白质,脂类物质主要以TAG形式储存在油体中。花生是中国重要的油料作物,种子中含有丰富的油脂,油脂含量能高达60%左右,因此,通过对花生子仁不同发育与萌发后时期的油体数量,形态及分布的观察,有助于了解子仁内油脂的动态变化。
3.1 花生子叶细胞在不同时期油体动态的细胞学特征变化
花生种子在油脂累积过程中,不仅有油体数量的增加,还伴随着体积的增大,大油体通常被认为是由小油体融合而成的,而油体是否融合则是由油体表面的油体蛋白(oleosin)决定[13-14]。占志勇[15]对油桐种仁发育的3个时期进行研究,认为随着种仁发育,胚乳细胞内的油体数量与含油量呈负相关,而油体的大小与含油量则呈正相关。在本研究中,采用徒手切片与尼罗红染色相结合的方法,使用共聚焦显微镜观察花生子仁在不同时期的油体变化,结果发现,随着花生种子的发育,油体逐渐增多,直至充满整个细胞且油体体积也增大,而在萌发后油体数量逐渐减少,且到萌发后30 d时油体沿着细胞壁分布。通过不同含油量在不同时期内油体的比较发现,在花生子仁发育过程中花U 606和花17在油体整体变化趋势上是一致的,只是在油体的数量及大小上有所差异。在成熟花生子仁的子叶细胞中同花17相比,高油材料花U 606油体分布更紧密,油体空隙更小,这与董劲松等[12]观察得到的结果一致。
3.2 花生油体与油脂动态变化过程的相关性分析
研究不同时期花生子叶细胞内油体的动态变化,有助于了解花生种子中油脂的积累和降解过程。本研究前期对不同发育与萌发后时期的花生子仁内油脂含量进行分析,结果发现,随着种子的发育油脂的含量呈“S”型增长,即在脂质积累初期,种子中的油脂含量缓慢增长,而在脂质积累高峰期,种仁内的油脂含量快速上升,而在脂质积累后期,油脂含量趋于稳定,在种子萌发阶段种子中的油脂含量快速下降。
通过对花生子仁中子叶细胞内的油体的截面积及油体含量进行分析,结果发现,随着种子的发育,油体的截面积之和增加,油体含量增加。花U 606中油体含量明显高于花17,而在萌发后阶段,油体的截面积之和逐渐减少。分析花生子叶细胞中油脂和油体含量在不同时期的动态变化发现,在种子发育时期含油量随着油体含量的增加而增加,而在萌发后阶段含油量则随着油体含量的减少而减少。
3.3 花生油体动态相关蛋白表达变化与油脂积累过程的关联性分析
油体的表面包裹着一层油体蛋白,油体蛋白在油脂积累与降解过程中发挥重要作用,油体蛋白与油体的形成有关,且能维持油体的稳定。对种子发育和萌发后过程中的差异蛋白质组学的分析可知,油体蛋白oleosin 14.9的蛋白表达丰度在种子发育阶段呈“先快速增加后缓慢增加”的表达模式,这与油脂的积累模式大体一致,而在萌发后阶段oleosin 14.9的蛋白表达量一直在下降,推测总油体的表面积减少。这与油体含量和油脂的降解模式一致,也进一步说明oleosin蛋白的变化与油脂的含量有一定的相关性。
[1] 程红焱,宋松泉.种子的贮油细胞器:油体及其蛋白[J].植物学通报,2006,23(4):418-430.
[2] HUANG A H. Oleosins and oil bodies in seeds and other organs[J]. Plant Physiology, 1996, 110(4): 1055-1061.
[3] MURPHY D J, VANCE J. Mechanisms of lipid-body formation[J]. Trends in Biochemical Sciences, 1999, 24(3): 109-115.
[4] LEPRINCE O, VAN AELST A C, PRITCHARD H W, et al. Oleosins prevent oil-body coalescence during seed imbibition as suggested by a low-temperature scanning electron microscope study of desiccation-tolerant and-sensitive oilseeds[J]. Planta, 1997, 204(1): 109-119.
[5] 韦存虚,钦风凌,李爱民,等.油菜种子油体的观察和大小分析[J].中国油料作物学报,2009,31(4):445-448.
[6] TZEN J T C, CAO Y Z, LAURENT P, et al. Lipids, proteins, and structure of seed oil bodies from diverse species[J]. Plant Physiology, 1993, 101(1): 267-276.
[7] TING J T, LEE K, RATNAYAKE C, et al. Oleosin genes in maize kernels having diverse oil contents are constitutively expressed independent of oil contents[J]. Planta, 1996, 199(1): 158-165.
[8] SILOTO R M, FINDLAY K, LOPEZ-VIILAOBOS A, et al. The accumulation of oleosins determines the size of seed oilbodies inArabidopsis[J]. Plant Cell, 2006, 18(8):196l-1974.
[9] HU Z, WANG X, ZHAN G, et al. Unusually large oilbodies are highly correlated with lower oil content inBrassicanapus[J]. Plant Cell Reports, 2009, 28(4): 541-549.
[10] SHIMADA T L, SHIMADA T, TAKAHASHI H, et al. A novel role for oleosins in freezing tolerance of oilseeds inArabidopsisthaliana[J]. Plant J, 2008, 5:798-809
[11] HENEEN W K, KARLSSON G, BRISMAR K, et al. Fusion of oil bodies in endosperm of oat grains[J]. Planta, 2008, 228(4): 589-599.
[12] 董劲松,石东乔,高建芹,等.甘蓝型油菜油体数量及面积之和与含油量的相关性[J].植物学报,2009,44(1):79-85.
[13] TZEN J T, HUANG A H. Surface structure and properties of plant seed oil bodies[J]. The Journal of Cell Biology, 1992, 117(2): 327-335.
[14] FRANDSEN G I, MUNDY J, TZEN J T C. Oil bodies and their associated proteins, oleosin and caleosin[J]. Physiologia Plantarum, 2001, 112(3): 301-307.
[15] 占志勇.油桐种仁不同发育时期表达蛋白质组学研究[D].北京:中国林业科学研究院,2013.
Oilbodiesmicrostructureobservationofpeanutseedsatdifferentdevelopmentalstages
WANG Yun, LIU Ting,HE Xiaoyan, ZHANG Xingguo, MA Xingli, YIN Dongmei
(College of Agronomy , Henan Agricutural University, Zhengzhou 450002,China)
To study the relationship between the oil content and the oil bodies content, the dynamic changes of different varieties of peanut seed oil bodies (Hua U 606 and Hua 17) at different development and postgermination stages were observed by using laser scanning confocal microscopy. The results showed that the the oil bodies between the two varieties have almost the same change trend, with the only difference in the number and the size of the oil body. With the development of peanut seeds, oil bodies increased gradually and gradually concentrated in the central cell, arranged more closely. While in the post germination of the seed the number of oil bodies declined and the oil bodies arranged along the wall of the cotyledon cell in 30 DAG. Further study on the content of the oil bodies, showed that the content of the oil bodies increased in the seed development while in the seed postgermination the content of the oil bodies decreased.
peanut; laser scanning confocal microscopy; oil content; oil bodies
2017-01-26
河南省重大科技专项(161100111000);河南省现代农业产业技术体系(S2014-05-G03)
王允(1988-),女,河南驻马店人,博士研究生,主要从事花生的遗传育种研究。
殷冬梅(1972-),女,河南南阳人,教授。
1000-2340(2017)06-0775-06
S 565
A
常思敏)

