鲜切甘薯不同部位褐变机理差异
王礼群,刘 硕,杨春贤,张欣怡,姚世响,邓丽莉,曾凯芳,*
(1.西南大学食品科学学院,重庆 400715;2.西南大学生命科学学院,重庆市甘薯工程技术研究中心,重庆 400715)
鲜切甘薯不同部位褐变机理差异
王礼群1,刘 硕1,杨春贤2,张欣怡1,姚世响1,邓丽莉1,曾凯芳1,*
(1.西南大学食品科学学院,重庆 400715;2.西南大学生命科学学院,重庆市甘薯工程技术研究中心,重庆 400715)
以‘渝薯17’甘薯为实验材料,将鲜切甘薯分为皮部、周边以及中心3 个部位。通过对冷藏过程中鲜切甘薯不同部位褐变情况、褐变底物酚类物质含量、褐变相关酶活力的比较研究,探讨鲜切‘渝薯17’不同部位的褐变机理及差异。结果表明,绿原酸是甘薯褐变的主要底物,鲜切甘薯不同部位褐变存在差异,皮部褐变最严重,周边次之,中心最弱。皮部总酚和游离酚含量均显著高于周边和中心组织(P<0.05),其中主要底物绿原酸含量为周边和中心组织的3~4 倍。多酚氧化酶(polyphenoloxidase,PPO)是引起皮部组织褐变的主要酶,苯丙氨酸解氨酶对酚类物质的积累起促进作用;周边组织褐变由PPO和过氧化物酶(peroxidase,POD)协同作用催化;中心组织褐变则主要由POD引起。
鲜切甘薯;酶促褐变;绿原酸;多酚氧化酶;过氧化物酶
甘薯(Ipomoea batatas Lam.)是我国四大经济作物之一,产量居世界之首,而川渝地区甘薯种植面积居全国第一[1-2]。甘薯中富含淀粉、维生素以及抗氧化物质如多酚等,是天然的“生理碱性”食物,具有调节体内酸碱平衡、提高免疫力、促进消化和防癌等作用[3-5]。随着消费者对食物原有营养价值的重视,鲜食甘薯在甘薯产业中所占比率越来越大[6]。近年来,鲜切果蔬凭借其便捷、高利用率以及高营养价值保留度等特点在我国快速发展,逐渐进入人们的生活[7-8]。但由于鲜切甘薯加工过程中受到机械伤害,伤口处极易发生褐变,营养价值降低,制约了鲜切甘薯的发展;因此对鲜切甘薯褐变机理和有效控制措施的研究具有重要意义。
目前对果蔬褐变的研究结果表明,果蔬的褐变主要为酶促褐变,即果蔬在受到切割伤害后,酚-酚酶原本的细胞分区被破坏,从而使得酚类物质和酚酶接触,在氧气作用下酚类物质被氧化产生醌类物质,聚合成为黑褐色物质,产生褐变[9-10]。苯丙氨酸解氨酶(L-phenylalanin ammonia-lyase,PAL)是广泛存在于植物中的苯丙烷代谢途径关键酶,可将苯丙氨酸转化生成酚类物质,参与各种酚类物质的合成。此外,PAL与植物诱导抗病及抗病信号通路相关[11-12]。已有的研究表明,甘薯的褐变也属于酶促褐变,多酚氧化酶(polyphenol oxidase,PPO)是产生褐变的氧化酶,绿原酸是主要作用底物[13]。过氧化物酶(peroxidase,POD)也是与褐变密切相关的一类酶,它可以清除活性氧抵御逆境,也可以与酚类物质结合促进褐变[11,14]。但与一般果蔬不同的是,甘薯的褐变分布不均匀[15],具有明显的组织特异性,而目前对鲜切甘薯不同部位褐变机理差异的研究较少。
以‘渝薯17’甘薯为实验材料,通过对鲜切甘薯在冷藏过程中不同部位褐变底物含量变化、褐变相关酶(PPO、POD、PAL)活力变化以及与褐变相关因素的研究,明确鲜切甘薯不同部位的褐变机理及其差异,为鲜切甘薯褐变控制以及保鲜技术开发提供针对性的理论参考,也为甘薯产业的发展提供新的思路。
1 材料与方法
1.1 材料与试剂
实验所用‘渝薯17号’采收于西南大学合川农厂甘薯实验基地。
丙酮(分析纯) 重庆川东化学试剂厂;交联聚乙烯吡咯烷酮(crosslinking polyvingypyrrolidone,PVPP)北京拜尔迪生物技术有限公司;儿茶酚(化学纯) 中国医药集团上海化学试剂公司;绿原酸(色谱纯) 上海原叶生物技术有限公司;愈创木酚(化学纯) 中国佘山化工厂;L-苯丙氨酸(生化试剂) 上海康达氨基酸厂;β-巯基乙醇(分析纯) 中国化学医药集团化学试剂公司。
1.2 仪器与设备
UV1000紫外分光光度计 天美(中国)科学仪器有限公司;Synergy H1mg全自动酶标仪 美国BioTek公司;3400N扫描电子显微镜 日本Hitachi公司;3H16R1高速冷冻离心机 湖南赫西仪器装备有限公司;DZF6032真空干燥箱 上海齐欣科学仪器有限公司。
1.3 方法
1.3.1 样品准备
选取大小均匀、无病虫害、无机械损伤的甘薯,洗净后去表皮,切成厚度为0.5 cm的甘薯片,放入塑料托盘,保鲜袋封装,置于4 ℃恒温冰箱中贮藏8 d。按皮部、周边和中心3 个部位取样(图1),皮部为从边缘起向内0.5 cm左右的圆环组织,中心为以中心点为圆心、半径为1 cm的组织,其余部位为周边组织,每隔1 d取样1 次。

图1 鲜切甘薯不同部位分区图Fig. 1 Parts of fresh-cut sweet potato
1.3.2 褐变度的测定
褐变度的测定参考文献[16],采用消光值法并稍作修改。随机取1.0 g甘薯组织,加入液氮研磨3 min至呈粉末状,待液氮挥发干后加入10 mL预冷蒸馏水,混匀后,离心10 min(3 500 r/min、4 ℃),取上清液于340 nm波长处测定吸光度A340nm,以A340nm表示褐变度值。
1.3.3 酚类物质含量测定
采用福林-酚法[17]测定总酚含量。取1.0 g样品,加入液氮研磨3 min至呈粉末状,待液氮挥干后加入4 mL丙酮摇匀1 min后静置提取3 h,离心10 min(10 000 r/min、4℃),收集上清液作为待测样液。取0.2 mL待测液,加入0.5 mL福林-酚试剂,振荡后静置3 min,加入0.5 mL、0.1 g/mL Na2CO3溶液,定容至10 mL,摇匀后置于25 ℃的恒温水浴中保温2 h,于765 nm波长处测定吸光度,以绿原酸为标品制作标准曲线,根据标准曲线计算总酚含量。总酚含量以每千克鲜甘薯中绿原酸的质量计,单位为mg/kg。实验重复3 次。
游离酚及酯化酚含量测定:委托北京农业质量标准与检测技术研究中心测定,游离酚含量的测定参照农业标准NY/T 2012—2011《水果及制品中游离酚酸含量的测定》[18],酯化酚测定方法参照NY/T 2795—2015《苹果中主要酚类物质的测定高效液相色谱法》[19]进行。实验重复3次。
1.3.4 PPO、POD活力的测定
粗酶液提取参照文献[20]。随机称取2.0 g样品,加入5 mL 0.1 mol/L pH 6.8的磷酸缓冲液(含有0.1 mol/L PVPP),研成匀浆,离心15 min(12 000 r/min、4℃),上清液即为PPO和POD的粗酶液。
PPO活力的测定参照Pizzocaro等[21]的方法,稍作修改。取0.1 mol/L pH 4.4的醋酸缓冲液2.5 mL,加入1 mL 0.2 mg/mL的儿茶酚底物,再加入0.5 mL粗酶液后充分摇匀,测量3 min内吸光度在410 nm波长处的变化,每分钟吸光度变化0.01为1 个酶活力单位(U)。实验重复3 次。
POD活力的测定参照文献[20]。取2.7 mL 0.1 mol/L的磷酸盐缓冲液(pH 6.8),加入0.1 mL 0.04 g/mL的愈创木酚和0.5 mL体积分数0.5%的H2O2,最后加入0.1 mL粗酶液,室温测定3 min内溶液在470 nm波长处吸光度的变化,每分钟吸光度变化0.1为1 个酶活力单位(U)。实验重复3 次。
1.3.5 PAL活力测定
参照Lister等[22]的方法。取1.0 g样品,加入5.0 mL 50 mmol/L的硼酸提取液(含40 g/L PVPP、2 mmol/L乙二胺四乙酸、5 mmol/L β-巯基乙醇,pH 8.8),离心30 min(10 000 r/min、4℃),上清液即为粗酶液。设置反应管和对照管,两支试管中均加入3.4 mL 50 mmol/L的硼酸缓冲液(pH 8.8)置于37℃水浴锅中平衡10 min,反应管加入0.5 mL酶液和0.5 mL 20 mmol/L L-苯丙氨酸,对照管加入1 mL、pH 8.8的硼酸缓冲液。在290 nm波长处测量吸光度,然后保温平衡反应60 min,加入0.1mL 6 mol/L的盐酸终止反应。再次测量溶液在290 nm波长处的吸光度,根据保温前后样品管溶液吸光度的变化,计算PAL活力,1 h内吸光度变化0.01为1 个酶活力单位(U)。实验重复3 次。
1.3.6 鲜切甘薯显微结构的观察
按照西南大学材料学院扫描电子显微镜样品制作要求处理。取样后用体积分数2.5%的戊二醛固定,固定好的样品先用体积分数为30%、50%、80%、90%乙醇各脱水1 次,再用100%乙醇脱水2 次,每次10 min,然后用体积分数50%、70%、90%、95%的叔丁醇各置换1 次,再用100%的叔丁醇置换2 次,每次置换时间为10 min,完成后放入真空干燥箱中干燥2 h,干燥后的样品利用TB-5型离子溅射仪镀金膜以增加样品的导电性,采用3400N扫描电子显微镜对样品进行观察、拍照、记录。
1.4 数据分析
利用Origin Pro 9软件统计分析所有数据,计算标准差并制图;应用SPSS 22软件进行方差分析(ANOVA),利用邓肯式多重比较对差异显著性进行分析。P<0.05表示有显著性差异,P<0.01表示差异极显著。
2 结果与分析
2.1 鲜切甘薯贮藏期间不同部位褐变度变化

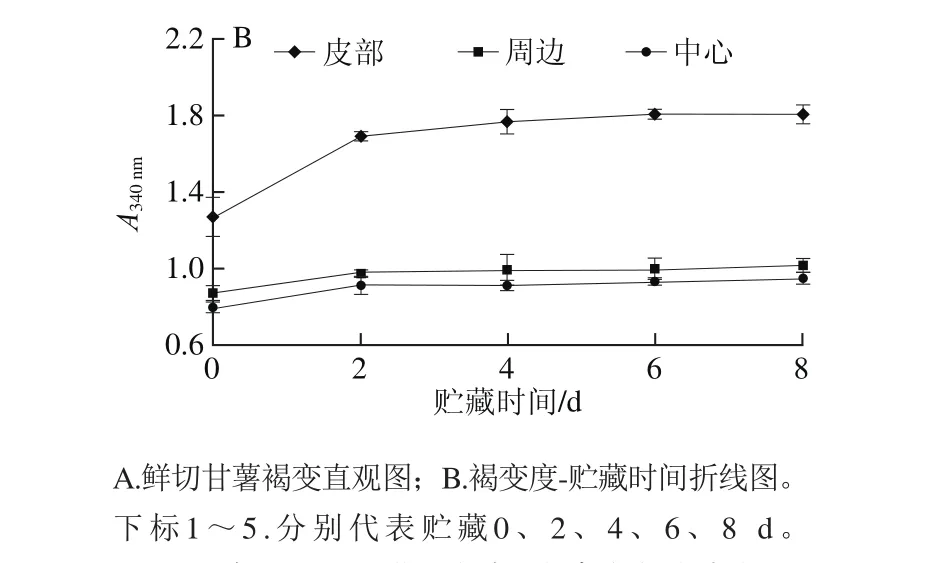
图2 鲜切甘薯贮藏过程中不同部位褐变度变化Fig. 2 Changes in browning degree in different parts of fresh-cut sweet potato during storage
甘薯鲜切后,在4 ℃条件下贮藏8 d,不同部位的褐变情况如图2所示。贮藏过程中,随贮藏时间延长,鲜切甘薯褐变度增大,不同部位的褐变程度依次为:皮部>周边>中心。在0~2 d内,不同部位褐变速率增加幅度均较大,其中皮部组织褐变最快;2~8 d内鲜切甘薯不同部位的褐变度虽然也在增加,但增加速率较小。
2.2 鲜切甘薯贮藏期间不同部位酚类物质含量变化
2.2.1 鲜切甘薯贮藏期间不同部位总酚含量变化
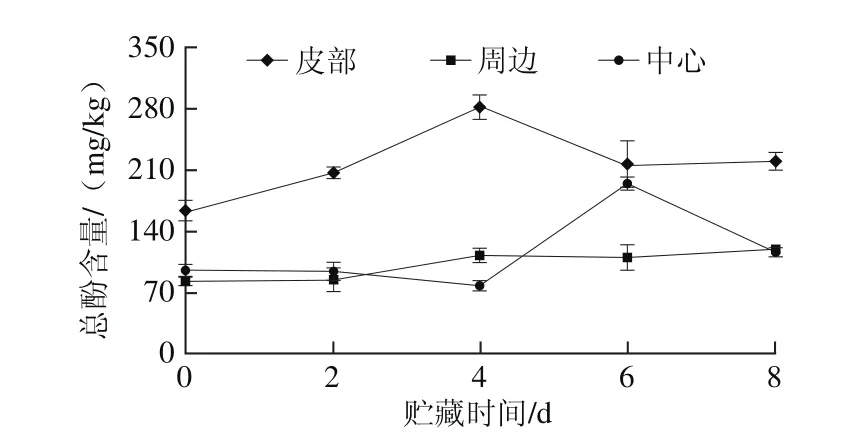
图3 鲜切甘薯贮藏期内不同部位总酚含量变化Fig. 3 Changes in total phenol contents in different parts of fresh-cut sweet potato during storage
贮藏期间鲜切甘薯不同部位总酚含量变化如图3所示。0~4 d,随贮藏时间延长,皮部总酚含量增加,4 d时总酚含量最高,4~6 d内逐渐减少,6 d后总酚含量有小幅度的增加;周边组织总酚含量在整个贮藏期中变化不大,在0~4 d内小幅度增加;中心组织0~2 d内总酚含量变化不大,2~6 d内略下降后快速上升,6~8 d内快速下降。鲜切甘薯皮部总酚含量显著高于周边和中心组织,进一步从底物的角度说明了鲜切甘薯不同部位褐变存在差异。
2.2.2 鲜切甘薯贮藏期间不同部位游离酚和酯化酚含量变化
为了更深入了解甘薯褐变过程不同部位褐变底物酚类物质含量的变化特性,对3 个部位组织中游离酚及酯化酚的含量进行进一步测定。由褐变度测定结果可知,鲜切甘薯在0~2 d内快速褐变,6 d后褐变度变化不显著,因此选择0、2、6 d作为游离酚及酯化酚的测定时间点。
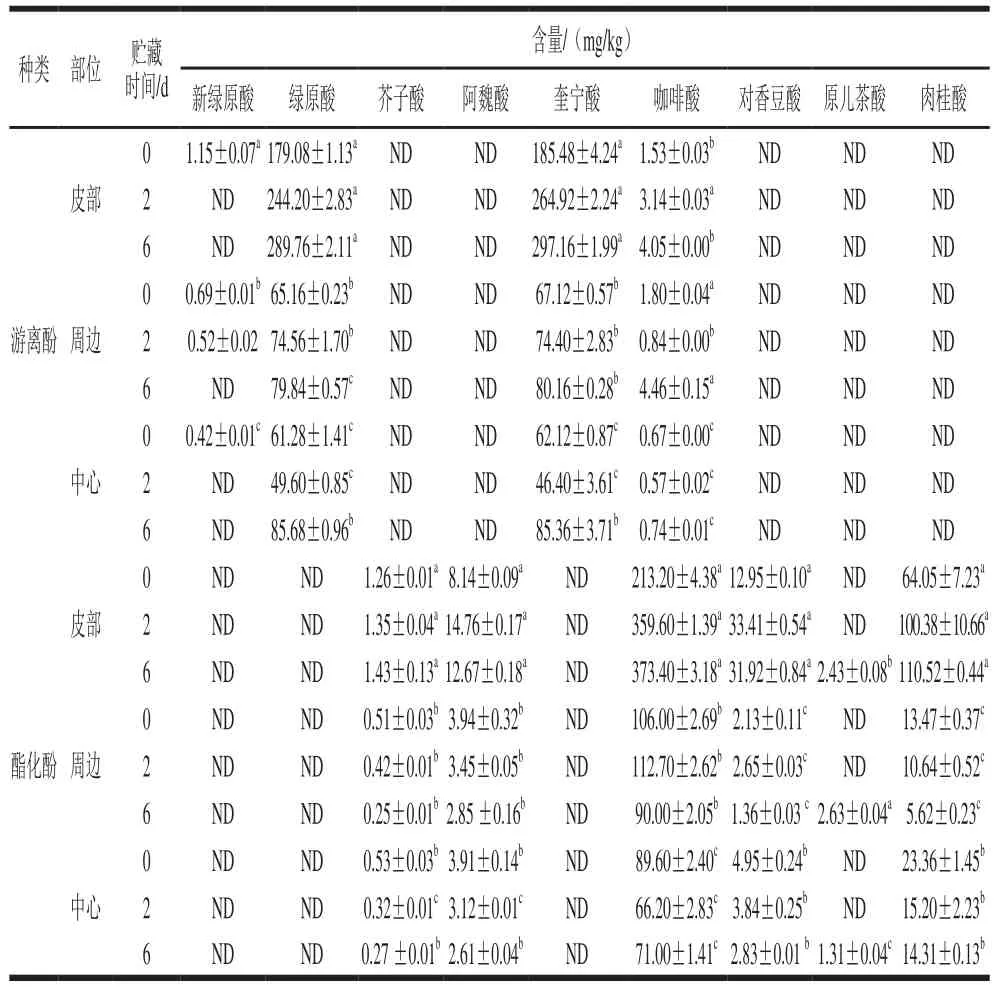
表1 鲜切甘薯贮藏期间不同部位酚类物质种类及含量Table 1 Phenol composition of different parts of fresh-cut sweet potato during storage
根据表1可知,‘渝薯17’中的游离酚主要是绿原酸和奎宁酸,其次有少量的咖啡酸以及新绿原酸;酯化酚类主要是咖啡酸、对香豆酸和肉桂酸,还有少量的芥子酸和阿魏酸。鲜切甘薯皮部组织中咖啡酸、奎宁酸以及绿原酸的含量均要显著高于其他2 个部位(P<0.05),皮部绿原酸及奎宁酸是周边和中心组织的3~4倍,这进一步从底物的角度解释了甘薯皮部褐变最严重的原因。在贮藏过程中,褐变最明显的皮部咖啡酸、奎宁酸以及绿原酸在前期快速积累,在PAL的作用下,肉桂酸含量也显著上升,但由于向咖啡酸和奎宁酸的转化,积累速率较慢;贮藏后期,各类酚酸物质的积累速率缓慢,甚至消耗速率大于合成速率。
在贮藏期间,鲜切甘薯3 个部位酚类物质含量变化趋势存在差异。皮部和周边组织的绿原酸含量在0~6 d内随着贮藏时间的延长增加,而中心组织呈现先下降后上升的趋势。贮藏期间,鲜切甘薯3 个部位咖啡酸含量变化趋势不同,皮部组织咖啡酸含量整体呈现上升趋势,尤其前期上升速率快,周边组织酯化咖啡酸含量前期上升缓慢,后下降,而游离咖啡酸变化与其相反;这可能由两者的相互转化引起,中心组织咖啡酸含量先下降后有所回升。其他次要酚类物质变化也存在差异,贮藏6 d时,3 个部位都出现了少量的原儿茶酸。
植物中的绿原酸主要通过苯丙氨酸和莽草酸的代谢途径合成。奎宁酸和数目不等的咖啡酸在酶的作用下可以生成咖啡酰奎宁酸和绿原酸,对香豆酸和咖啡酸在酶的作用下可以生成香豆酰咖啡酸和绿原酸,对香豆酸在一定酚酶的催化下可以转化成为咖啡酸[23-28]。根据PAL的代谢途径以及各类酚酸的含量推测,甘薯中的绿原酸可能主要由咖啡酸与奎宁酸结合得到,咖啡酸与对香豆酸的合成途径是甘薯中绿原酸的次要来源。
2.3 鲜切甘薯贮藏期间不同部位褐变相关酶活力的变化
2.3.1 鲜切甘薯贮藏期间不同部位PPO的活力
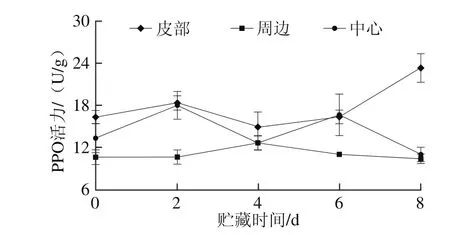
图4 鲜切甘薯贮藏期间不同部位的PPO活力Fig. 4 PPO activity in different parts of fresh-cut sweet potato during storage
如图4所示,贮藏过程中,鲜切甘薯不同部位PPO活力变化趋势不同。皮部组织PPO活力在0~4 d先上升再下降,4 d后再上升,且上升速率较快;周边组织PPO活力与皮部变化相反,前期先下降后上升,在4 d时活力最大,但总体活力低于皮部和中心;中心组织PPO活力在2 d和4 d均达到峰值。不同部位酶活力变化也说明了鲜切甘薯不同部位褐变因素存在差异,PPO是参与褐变的主要酶,这与之前郁志芳[13]、袁洁[29]等对甘薯以及王磊[30]对马铃薯的研究结果一致。
2.3.2 鲜切甘薯贮藏期间不同部位的POD活力
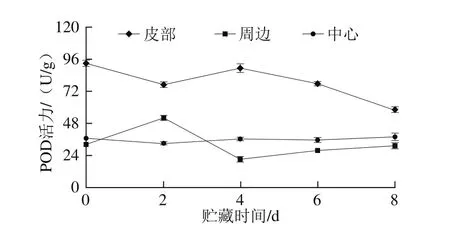
图5 鲜切甘薯贮藏期间不同部位POD活力变化Fig. 5 Changes in POD activity in different of parts of fresh-cut sweet potato during storage
贮藏期间,鲜切甘薯贮藏期间不同部位的POD活力变化如图5所示,皮部组织POD活力先降低后上升,4 d后又下降,在8 d时活力最低;周边组织POD活力在0~4 d呈现先上升后下降的趋势,贮藏后期活力又缓慢上升,与皮部活力变化趋势相反;中心组织POD活力在整个贮藏期呈现总体上升的趋势,在后期活力高于周边组织。POD在褐变中的作用主要体现在褐变的后期。结合褐变度和PPO、POD之间的关系可以发现,虽然皮部组织后期PPO活力升高,在底物绿原酸充足的情况下,褐变程度却不再显著变化。在周边组织的褐变中,PPO和POD的活力均不高,但两者的变化趋势却截然相反,且周边组织中这两个关键酶的活力变化规律均与皮部组织相反;因此周边的褐变可能是PPO和POD协同作用而导致。对于中心组织而言,前期PPO活力较高,但褐变却不明显,随着贮藏时间的延长,POD活力缓慢升高,褐变度的增大趋势大于皮部和周边组织;因此,推测鲜切甘薯中心部位的褐变主要由POD控制。程双等[31]在之前的研究中证实POD也会参与甘薯褐变。也有研究认为,POD可能被低温抑制,而在褐变中不起主要作用[11]。程丽林[32]发现导致不同品种马铃薯发生褐变的酶种类不同。根据甘薯褐变情况及酶活力的变化,推测在甘薯中,PPO和POD对褐变作用可以概括为:PPO起主要作用,后期PPO和POD协同参与褐变的作用强于POD。
2.3.3 鲜切甘薯贮藏期间不同部位的PAL活力
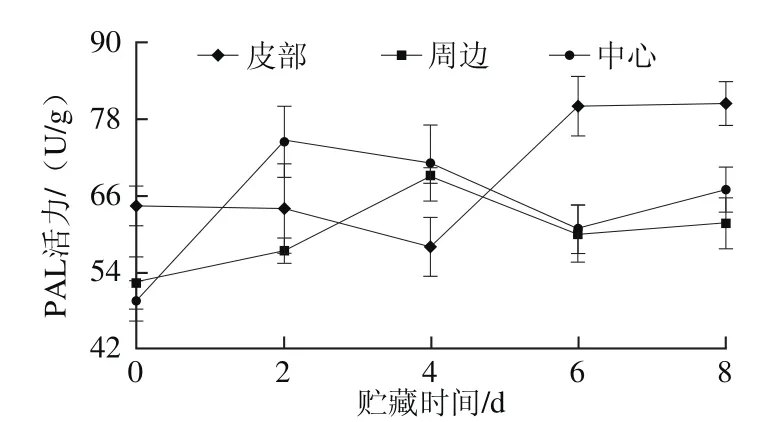
图6 鲜切甘薯贮藏期间不同部位PAL活力Fig. 6 PAL activity in different parts of fresh-cut sweet potato during storage
如图6所示,在贮藏过程中,皮部组织PAL前期活力变化不大,后期随贮藏时间延长,PAL活力逐渐升高;周边和中心变化趋势相同,后期活力大小差异不大,两者与皮部PAL活力的变化趋势相反,前期周边和中心组织PAL活力快速升高,分别在第4天和第2天时达到最大值,之后活力降低,贮藏末期活力回升。PAL在褐变中主要是将组织内的一些氨基酸转化为可作为酶促褐变底物的酚类物质;同时,PAL也可增强植物对外界刺激的抵御能力[33]。肉桂酸是PAL反应途径中一个重要的中间产物,目前还没有研究表明肉桂酸可参与酶促褐变,但却是合成反应底物绿原酸的前体物质。甘薯皮部肉桂酸含量比周边和中心组织均要高,皮部组织褐变主要底物绿原酸的含量也高于周边和中心。PAL在甘薯中可能促进肉桂酸转化,从而使绿原酸含量增加。郑剑英[34]通过研究发现,低温对甘薯中PAL和PPO有胁迫作用,在贮藏初期酶活性受到抑制,这可能也是本实验中甘薯在贮藏期间不同部位的PAL活力与酚类物质的含量变化趋势存在差异的原因。
2.4 鲜切甘薯贮藏期间不同部位显微结构变化
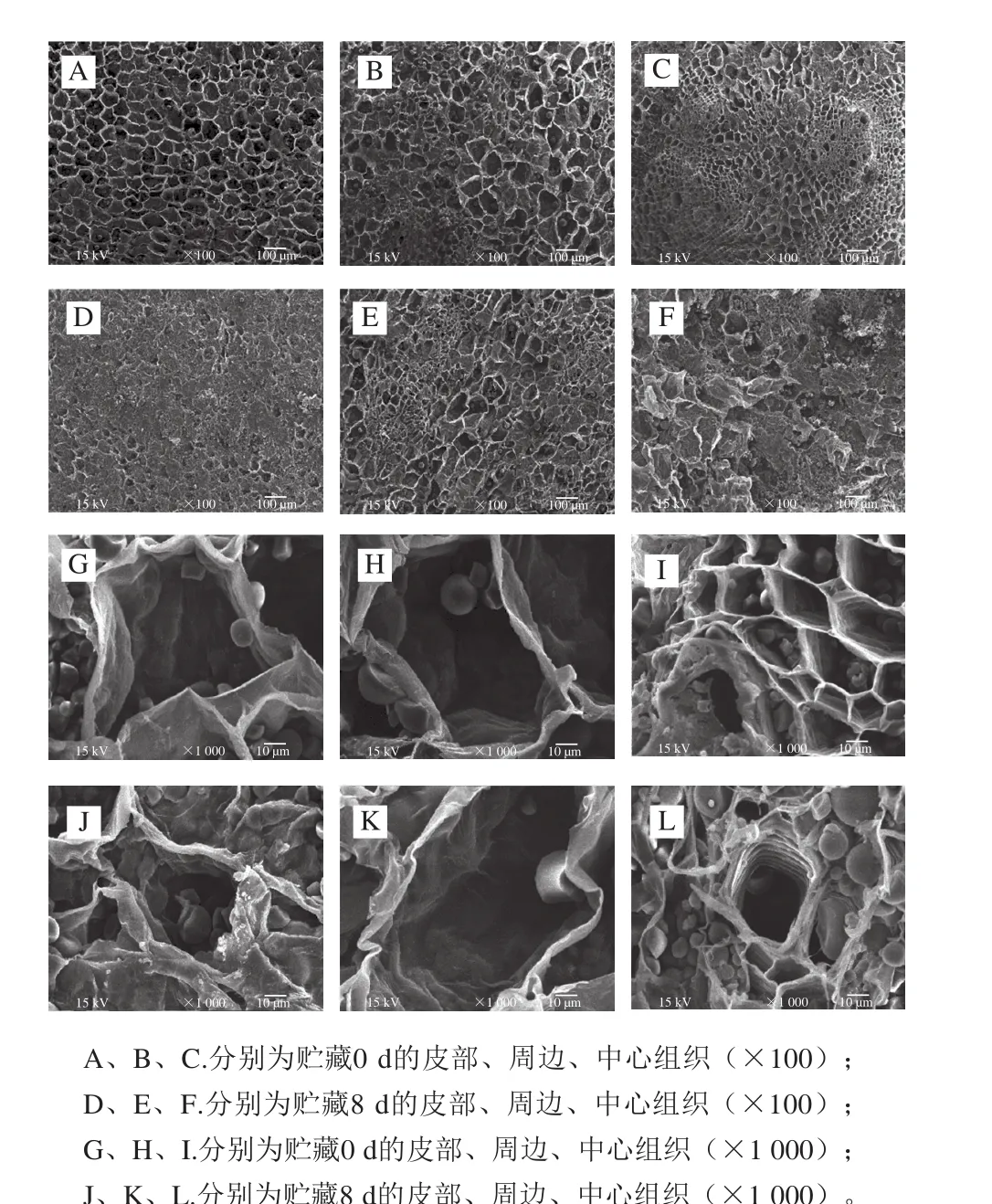
图7 鲜切甘薯贮藏期间不同部位的显微结构变化Fig. 7 Changes in microstructure of fresh-cut sweet potato during storage
如图7所示,贮藏期间,鲜切甘薯不同部位的显微结构也存在差异。0 d时,皮部组织孔洞大小均匀,分布有序;周边组织孔洞之间大小不同,分布较杂乱;中心孔洞大小也不均匀,小孔洞呈簇状分布在较大的孔洞中。贮藏至8 d时,3 个部位表面结构均会发生一定程度的塌陷,淀粉颗粒形态也发生变化,相较于贮藏后期,鲜切初期的淀粉颗粒更饱满。根据王兆升[35]在鲜切生姜褐变机理研究中的结论推测:甘薯鲜切后,在贮藏过程中,细胞壁降解变薄,细胞被结构改变,进一步破坏酚-酚酶区域间的保护,从而使得更多的酚类物质与氧化酶结合,促进了甘薯的褐变。
3 结 论
甘薯鲜切后受到外界刺激会迅速发生褐变,且褐变分布不均匀,靠近皮层的部位褐变速率最快且最严重,皮部组织褐变主要由PPO作用引起,周边组织主要受PPO和POD协同作用,中心组织褐变主要是POD起作用。PAL可导致酚类物质的积累,但对低温贮藏的甘薯作用不大。甘薯中绿原酸合成的前体物质主要是奎宁酸和咖啡酸,而对香豆酸与咖啡酸是甘薯中绿原酸的次要来源。
[1] 国家统计局农村社会经济调查司. 中国农村统计年鉴—2014[M].北京: 中国统计出版社, 2014: 87-89.
[2] 联合国粮农组织数据库[EB/OL]. [201701-02]. http://faostat3.fao.orb/browse/Q/QC/E.
[3] GRACE M H, YOUSEF U U, GUSTAFSON S J, et al. Phytochemical changes in phenolics, anthocyanins, ascorbicacid, and carotenoids associated with sweet potato storage and impacts on bioactive properties[J]. Food Chemistry, 2014, 145(4): 717-724. DOI:10.1016/j.foodchem.2013.08.107.
[4] OKE M O, WORKNEH T S. A review on sweet potato postharvest processing and preservation technology[J]. African Journal of Agricultural Research, 2013, 8(40): 4990-5003.
[5] 周郑坤, 郑元林. 甘薯营养价值与保健功能的再认识[J]. 江苏师范大学学报(自然科学版), 2016, 34(4): 16-19; 87.
[6] 钮福祥, 马代夫, 戴起伟, 等. 我国甘薯产业发展概况及政策建议: 基于全国627户农户问卷调查[J]. 江苏农业科学, 2012, 40(11):438-441. DOI:10.15889/j.issn.1002-1302.2012.11.066.
[7] OMS-OLIU G, SOLIVA-FORTUNY R, MARTÍN-BELLOSO O.Effect of ripeness on the shelf-life of fresh-cut melon preserved by modified atmosphere packaging[J]. European Food Research and Technology, 2007, 225(3/4): 301-311. DOI:10.1007/s00217-006-0415-9.
[8] 沈元凯. 鲜切果蔬类产业的技术发展及展望[J]. 山西农经, 2014(6):89-90. DOI:10.16675/j.cnki.cn14-1065/f.2014.06.020.
[9] 马跃, 胡文忠, 程双, 等. 鲜切对果蔬生理生化的影响及其调控方法[J]. 食品工业科技, 2010, 31(2): 338-341. DOI:10.13386/j.issn1002-0306.2010.02.066.
[10] HE Q, LUO Y G. Enzymatic browning and its control in fresh-cut produce[J]. Stewart Postharvest Review, 2007, 3(6): 1-7. DOI:10.2212/spr.2007.6.3.
[11] 刘程惠, 胡文忠, 王艳颖, 等. 不同贮藏温度下鲜切甘薯的生理生化变化[J]. 食品工业科技, 2012, 33(17): 342-345; 349. DOI:10.13386/j.issn1002-0306.2012.17.049.
[12] 王英珍, 程瑞, 张绍铃, 等. 采前茉莉酸甲酯(MeJA)处理对梨果实抗病性的影响[J]. 果蔬学报, 2016, 33(6): 694-700. DOI:10.13925/j.cnki.gsxb.20150517.
[13] 郁志芳, 夏志华, 陆兆新. 鲜切甘薯酶促褐变机理的研究[J]. 食品科学, 2005, 26(5): 54-59.
[14] 郑亚男, 胡文忠, 姜爱丽, 等. 茉莉酸甲酯对鲜切甘薯伤害防御反应的研究[J]. 食品工业科技, 2012, 33(2): 368-372. DOI:10.13386/j.issn1002-0306.2012.02.081.
[15] 姜绍通, 罗志刚, 潘丽军. 甘薯中多酚氧化酶活性的测定及褐变控制[J]. 食品科学, 2001, 22(3): 19-22.
[16] 王清章, 刘怀超, 孙颉. 莲藕贮藏中褐变度及多酚氧化酶活性的初步研究[J]. 中国蔬菜, 1997(3): 4-6.
[17] SLINKARD K, SINGLETON V L. Total phenol analysis: automation and comparison with manual methods[J]. American Journal of Enology and Viticullture, 1977, 28(1): 49-55.
[18] 农业部. 水果及制品中游离酚酸含量的测定: NY/T 2012—2011[S].北京: 中国农业出版社, 2011: 1-8.
[19] 农业部. 苹果中主要酚类物质的测定高效液相色谱法: NY/T 2795—2015[S]. 北京: 中国农业出版社, 2015: 1-7.
[20] PUTTER J. Methods of enzymatic analysis[M]. New York: Academy Press, 1974: 685-689.
[21] PIZZOCARO F, TORREGGIANI D, GILARDI G. Inhibition of apple polyphenoloxidase (PPO) by ascorbic acid, citric acid and sodium chloride[J]. Journal of Food Processing and Preservation, 1993, 17(1):21-30. DOI:10.1111/j.1745-4549.1993.tb00223.x.
[22] LISTER C E, LANCASTER J E, WALKER J R L. Developmental changes in enzymes of flavonoid biosynthesis in the skins of red and green apple cultivars[J]. Journal of the Sience of Food and Agriculture, 1996, 71(3): 313-320. DOI:10.1002/(SICI)1097-0010(199607)71:3<313:AID-JSFA586>3.0.CO;2-N.
[23] 罗佳丽. 鲜切紫薯褐变机理及控制技术研究[D]. 重庆: 西南大学,2013: 19-24.
[24] NIGGEWEG R, MICHAEL A J, MARTIN C. Engineering plants with increased levels of the antioxidant chlorogenicacid[J]. Nature Biotechnology, 2004, 22(6): 746-754. DOI:10.1038/nbt966.
[25] RHODES M J C, WOOLTORTON L S C. The enzymic conversion of hydroxycinnamic acids to p-coumarylquinic and chlorogenic acids in tomato fruits[J]. Phytochemistry, 1976, 15(6): 947-951. DOI:10.1016/S0031-9422(00)84376-9.
[26] ULBRICH B, ZENK M H. Partial purification and properties of hydroxycinnamoyl-CoA: quinatehydroxycinnamoyltransferase from higher plants[J]. Phytochemistry, 1979, 18(6): 929-933. DOI:10.1016/S0031-9422(00)91451-1.
[27] 赵昱, 赵军, 李湘萍, 等. 咖啡酰奎尼酸类化合物研究进展[J]. 中国中药杂志, 2006, 32(11): 869-874.
[28] 吕萌. 苯丙烷代谢及其中间产物阿魏酸对棉纤维发育影响的研究[D].乌鲁木齐: 新疆农业大学, 2010: 10-14.
[29] 袁洁, 霍凯, 唐玉婷, 等. 不同甘薯品种鲜切薯块褐变度的筛选及其聚类物分析[J]. 分子植物育种, 2014, 12(5): 929-936. DOI:10.13271/j.mpb.012.000929.
[30] 王磊. 马铃薯酶促褐变机理的研究[D]. 南昌: 南昌大学, 2012: 17-18.[31] 程双, 胡文忠, 马跃, 等. 鲜切甘薯酶促褐变调控的研究[J]. 食品工业科技, 2011, 32(6): 158-160. DOI:10.13386/j.issn1002-0306.2011.06.057.[32] 程丽林. 影响鲜切马铃薯褐变相关酶及底物的研究[D]. 泰安: 山东农业大学, 2015: 18-19.
[33] OJEDA G A, SGROPPO S C, ZARITZKY N E. Application of edible coatings in minimally processed sweet potatoes (Ipomoea batatas L.)to prevent enzymatic browning[J]. International Journal of Food Science and Technology, 2013, 49(3): 876-883.
[34] 郑剑英. 不同处理对低温下甘薯糖代谢、能量代谢和酚类代谢的调控研究[D]. 杭州: 浙江农林大学, 2015: 36-40.
[35] 王兆升. 鲜切生姜褐变机理及保鲜关键技术研究[D]. 泰安: 山东农业大学, 2012: 57-60.
Mechanism of Browning in Different Parts of Fresh-Cut Sweet Potato
WANG Liqun1, LIU Shuo1, YANG Chunxian2, ZHANG Xinyi1,YAO Shixiang1, DENG Lili1, ZENG Kaifang1,*
(1. College of Food Science, Southwest University, Chongqing 400715, China; 2. Sweet Potato Engineering Technology Research Center, College of Life Sciences, Southwest University, Chongqing 400715, China)
In this paper, fresh-cut sweet potato ‘Yushu No. 17’ was divided into three parts including skin, peripheral and central part. The mechanism of browning in different parts of fresh-cut sweet potato was studied by measuring the browning index, the content of phenolic compounds and the activity of browning-related enzymes. The results showed that chlorogenic acid was the major browning substrate in sweet potato. There were differences in browning among different parts of freshcut sweet potato, with the most severe browning occurring in the skin, followed by the peripheral and central parts. The contents of total and free phenols in the skin were significantly higher than those in the peripheral and central tissues(P < 0.05), with a 3 to 4-fold increase being observed in the content of chlorogenic acid. Polyphenol oxidase (PPO) was the major enzyme responsible for the browning process of skin tissue. L-phenylalanine ammonia-lyase promoted the accumulation of phenolic substances. The browning process of peripheral tissue was catalyzed by PPO and peroxidase (POD), while that of central tissue was mainly caused by POD. The moisture content of sweet potato tissue decreased with storage time.
fresh-cut sweet potato; enzymatic browning; chlorogenic acid; polyphenol oxidase; peroxidase
10.7506/spkx1002-6630-201801043
TS255.3
A
1002-6630(2018)01-0285-06
王礼群, 刘硕, 杨春贤, 等. 鲜切甘薯不同部位褐变机理差异[J]. 食品科学, 2018, 39(1): 285-290.
10.7506/spkx1002-6630-201801043. http://www.spkx.net.cn
WANG Liqun, LIU Shuo, YANG Chunxian, et al. Mechanism of browning in different parts of fresh-cut sweet potato[J]. Food Science,2018, 39(1): 285-290. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201801043. http://www.spkx.net.cn
2017-05-15
重庆市社会事业与民生保障科技创新主题专项(Cstc2015shms-ztzx80010);西南大学本科生科技创新项目(SPXY201605)
王礼群(1996—),女,本科生,研究方向为食品科学与工程。E-mail:wangliqun8393@163.com
*通信作者简介:曾凯芳(1972—),女,教授,博士,研究方向为农产品加工与贮藏工程。E-mail:zengkaifang@163.com

