葡萄籽多酚对糖尿病大鼠的降血糖作用及其机制
仇 菊,朱 宏,卢林纲*
(农业部食物与营养发展研究所,北京 100081)
葡萄籽多酚对糖尿病大鼠的降血糖作用及其机制
仇 菊,朱 宏,卢林纲*
(农业部食物与营养发展研究所,北京 100081)
目的:研究葡萄籽多酚对糖尿病大鼠的降血糖作用,并从胰岛细胞损伤及胰岛素表达的角度探讨其作用机制。方法:以链脲佐菌素腹腔注射至雄性SD大鼠,建立Ⅱ型糖尿病大鼠模型,成模后随机分为模型组、阿卡波糖阳性对照组和葡萄籽多酚组。通过为期8 周的葡萄籽多酚(50 mg/(kg·d),以体质量计)干预,观察大鼠空腹血糖水平、胰岛素水平、葡萄糖耐受性变化,并采用免疫组化法检测胰岛病变及胰岛素表达。结果:葡萄籽多酚可明显降低糖尿病大鼠的空腹血糖水平(P<0.05),提高对葡萄糖的耐受性,促进胰岛素分泌,改善胰岛细胞损伤,增加胰腺中胰岛素的表达(P<0.05),增加血清中超氧化物歧化酶的活力及降低丙二醛的含量(P<0.05)。结论:长期低剂量的葡萄籽多酚干预可以有效调节糖尿病大鼠的血糖水平。葡萄籽多酚通过修复胰岛损伤促进胰岛素分泌降低空腹血糖水平,改善葡萄糖耐受程度,这一作用可能与其显著的体内抗氧化功效相关。
葡萄籽多酚;降血糖;胰岛素;胰岛细胞损伤
Ⅱ型糖尿病又称为非胰岛素依赖型糖尿病,患者占患糖尿病总人数的90%以上。在全世界范围内Ⅱ型糖尿病患者的数量持续增加,特别是目前我国Ⅱ型糖尿病患者高达1.1亿 人以上,糖尿病前期患者近5亿 人[1-2]。胰岛素治疗和口服降血糖药物虽然具有最为直接的效果,但是临床应用过程中往往容易带来低血糖、肝脏受损、乳酸中毒等副作用[3]。大量的流行病学研究表明,Ⅱ型糖尿病通过饮食和生活方式的改变很大程度上是可以预防的[4]。因此,从食物中寻找天然、无毒的改善糖尿病的功能性食物成分正成为食品科学和营养学领域研究的热点。植物多酚作为植物的次生代谢产物具有安全无副作用的特点,可以利用其优异的抗氧化效果发挥降血糖、降血脂、抗癌、肝损伤保护等多种生理功能[5-8]。
我国葡萄种植面积广、产量高,每年作为酿造葡萄酒和饮料葡萄下脚料的葡萄籽超过10万 t,而其综合利用水平仍有待提高。葡萄籽多酚作为葡萄籽提取物的主要成分,是一类含有苯环结构的天然多酚类有机化合物,是目前国内外公认的清除自由基极为有效的天然抗氧化剂[9]。葡萄籽多酚被报道具有多种生理活性,如抗氧化、延缓衰老、降血压、降血脂、抗癌、抗炎、抗辐射等[10-13]。葡萄籽多酚的主要成分是原花青素,也是诸多研究中报道的重要功能组分。Pinent等[14]的研究中发现,葡萄籽原花青素可以促进葡萄糖在骨骼肌细胞和脂肪细胞中的吸收。另有报道指出葡萄籽原花青素可通过降低Ⅱ型糖尿病大鼠血清中细胞黏附因子的水平从而减轻视网膜的损伤[15]。也有实验证实葡萄籽原花青素能降低糖尿病大鼠尿蛋白,改善肾小球高滤状态,对晚期糖基化终产物的形成具有显著的抑制作用[16]。但关于葡萄籽多酚的体内降血糖功效,以及如何通过调节胰腺组织和胰岛功能来发挥降糖作用的机制仍不明确。
因此,本实验以链脲佐菌素(streptozotocin,STZ)诱导建立Ⅱ型糖尿病大鼠模型,通过为期8 周的低剂量葡萄籽多酚干预,观察大鼠血糖指标及相关代谢因子的变化,解析葡萄籽多酚对Ⅱ型糖尿病大鼠高血糖的影响,并从胰岛损伤及胰岛素表达改善的角度探讨其作用机制。
1 材料与方法
1.1 动物、材料与试剂
雄性SD大鼠(SPF级,7 周龄,SCXK(京)2016-0006) 北京维通利华实验动物技术有限公司。
葡萄籽多酚 陕西中鑫生物技术有限公司;阿卡波糖北京索莱宝生物科技有限公司;STZ 美国Sigma公司;血糖试剂盒 深圳迈瑞生物医疗电子股份有限公司;胰岛素试剂盒 北京伊普瑞斯科技有限公司;超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒、丙二醛(malondialdehyde,MDA)检测试剂盒 南京建成生物工程研究所;大鼠胰岛素免疫组化染色试剂盒 上海研生实业有限公司;胰岛素抗体 北京中原领先科技有限公司;葡萄糖 北京化学试剂厂;其他常用试剂 国药集团化学试剂北京有限公司。
1.2 仪器与设备
YP2001N天平 上海精密科学仪器有限公司;T-214分析天平 北京赛多利斯仪器系统有限公司;HR2006搅拌机 飞利浦电子香港有限公司;THZ-82A水浴恒温振荡器 金坛市荣华仪器制造有限公司;DHG-9240A电热恒温鼓风干燥箱 上海精宏实验设备有限公司;Anke LXJ-IIB离心机 上海安亭科学仪器厂;BS400全自动生化分析仪 深圳迈瑞生物医疗电子股份有限公司;TU-1900双光束紫外-可见分光光度计 北京普析通用仪器有限公司;Kieltec Analysister全自动凯氏定氮仪 丹麦FOSS仪器有限公司。
1.3 方法
1.3.1 基本化学组分的测定
采用美国分析化学家协会国标方法AOAC984.13、AOAC996.11、AOAC945.16、AOAC942.05、AOAC985.29和AOAC993.29方法分别测定葡萄籽多酚提取物的基本化学成分。
1.3.2 多酚含量的测定
总多酚和酚酸类化合物含量根据Qiu Ju等[17]的报道进行测定;原花青素含量的测定及计算根据Kanamoto等[18]的报道进行;花青素的含量采用Xu Jinrui等[19]的研究方法测定。
1.3.3 动物模型的建立及饲喂
将48 只雄性SD大鼠分为4 组(空白组、STZ模型组、阿卡波糖组(阳性组)、葡萄籽多酚组),每组12 只。运用STZ诱导剂分别腹腔注射STZ模型组、阿卡波糖组、葡萄籽多酚组进行造模,剂量为35 mg/kg(以体质量计,下同)。
小鼠饲养于温度为(23±2)℃和相对湿度为50%~60%的条件下,12 h光照循环,饲喂标准饲料,自由饮食和饮水。适应实验室环境1 周,进行实验。每天同一时间灌胃样品1 次,连续给药8 周。葡萄籽多酚灌胃剂量为50 mg/kg,阳性对照组灌胃阿卡波糖10 mg/kg。
1.3.4 空腹血糖浓度的测定及口服葡萄糖耐受实验
口服葡萄糖耐受实验(oral glucose tolerance test,OGTT)在最后1 周进行,禁食16 h后,实验动物口服2 g/kg的葡萄糖溶液。按照说明书中的操作用葡萄糖氧化酶法测量0、30、60、90、120、180 min的葡萄糖水平。
1.3.5 血液胰岛素水平及胰腺免疫组化染色
胰岛素水平、胰腺中胰岛素的免疫组化染色运用相关试剂盒进行测定。免疫组化切片在高倍镜下拍摄3 个视野,将采集的图像应用Image-pro Plus 5.1图像分析系统进行分析,所得数据作免疫组织化学染色阳性信号灰度值分析。
1.3.6 血液及组织中抗氧化指标的测定
血液及胰腺组织中SOD活力和MDA含量按照试剂盒方法进行测定。取小鼠胰腺组织,在预冷的生理盐水中漂洗后滤纸拭干。称量后放入pH 7.4 Tris-HCl溶液中匀浆,然后4 ℃离心取上清液,存于-80 ℃备用。
1.3.7 肝糖原、肌糖原的含量测定
采用苯酚-硫酸法进行测定。称取35~50 mg肝脏标本或100~150 mg肌肉标本,加入硫酸钠饱和的30%氢氧化钾溶液0.5 mL,浸没样品,100 ℃水浴30 min至样品呈黄色透明状,冰水浴冷却。加入95%乙醇1 mL提取可溶性糖,冰水浴30 min,4 000 r/min离心30 min,弃上清液。用3 mL蒸馏水溶解沉淀物,取0.5 mL溶液加入试管中,补水至1 mL,加入1.0 mL 5%苯酚,摇匀并迅速加入浓硫酸5.0 mL,静置10 mim,摇匀后30 ℃水浴20 min。490 nm波长处测定吸光度。
1.4 数据统计分析
运用SAS 8.0分析软件,采用Tukey-Kramer的多重比较事后检验法对数据进行分析,所得结果以 ±s表示,P<0.05表示有显著性差异。
2 结果与分析
2.1 葡萄籽多酚提取物的成分
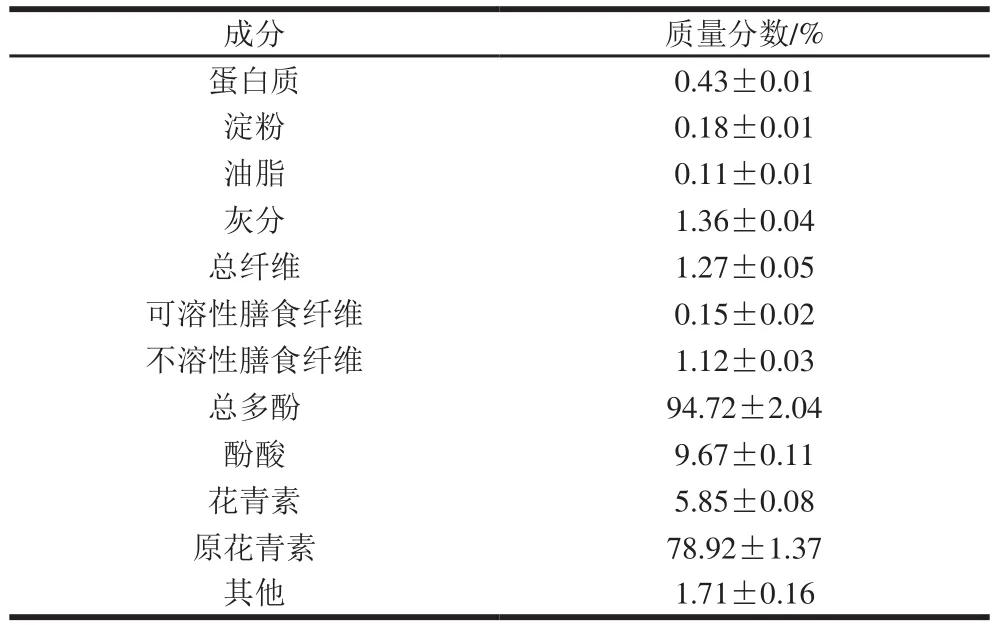
表1 葡萄籽多酚提取物的成分Table 1 Chemical composition of grape seed polyphenol extract
由表1可知,葡萄籽多酚提取物中含有极少量不溶性膳食纤维和灰分,另有微量蛋白质、淀粉及油脂被检测到。因此,葡萄籽总多酚样品的质量分数接近95%,为高纯度提取物。葡萄籽中多酚的最主要成分为原花青素,其余为酚酸和花青素类成分。
2.2 葡萄籽多酚对糖尿病大鼠空腹血糖的影响
如图1所示,STZ模型组的糖尿病大鼠的空腹血糖浓度((19.11±2.94)mmol/L)显著高于空白组((7.55±0.90)mmol/L)(P<0.05),表明高血糖大鼠模型建立成功。与STZ模型组相比,葡萄籽多酚能够显著降低糖尿病大鼠的空腹血糖水平(P<0.05),但降低后的血糖浓度((11.88±1.40)mmol/L)未能恢复到空白组的水平(P<0.05)。葡萄籽多酚降低糖尿病大鼠空腹血糖的效果上与阳性对照阿卡波糖((12.68±2.47)mmol/L)相似。这说明,葡萄籽多酚对糖尿病大鼠的血糖有所改善,但并不能使大鼠已受损的糖代谢完全恢复至正常水平。葡萄籽多酚的降血糖作用可能与其抗氧化特性及对胰腺功能的改善作用有关;因此,随后的实验对胰岛素水平及组织功能,以及抗氧化指标进行了测定。

图1 葡萄籽多酚对糖尿病大鼠空腹血糖的影响Fig. 1 Effect of grape seed polyphenols on fasting serum glucose of diabetic rats
2.3 葡萄籽多酚对糖尿病大鼠葡萄糖耐受性的影响
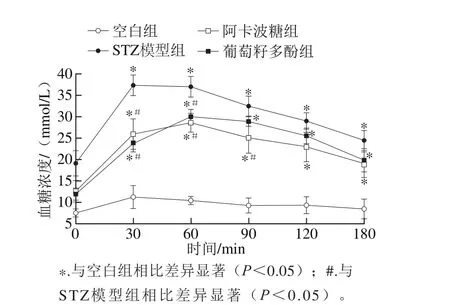
图2 葡萄籽多酚对糖尿病大鼠葡萄糖耐受性的影响Fig. 2 Effect of grape seed polyphenols on glucose tolerance of diabetic rats
如图2所示,与空白组相比,其他各组大鼠在给予葡萄糖后血糖浓度迅速上升。STZ模型组糖尿病大鼠的血糖浓度在给予葡萄糖30 min后升至最大值,随后逐渐降低。而葡萄籽多酚显著降低了糖尿病大鼠在30 min时升高的血糖浓度,并持续抑制升高的血糖浓度至90 min,随后血糖浓度缓慢降低。从给予葡萄糖后30~90 min,葡萄籽多酚组和阿卡波糖组大鼠的血糖浓度均显著低于STZ模型组(P<0.05),而葡萄籽多酚组与阿卡波糖组的大鼠血糖浓度无显著差异(P>0.05)。本研究采用的葡萄籽多酚由酚酸、花青素、原花青素组成。酚酸、花青素及低聚原花青素等小分子酚类在肠道内的吸收较快,可能在30~60 min发挥了降血糖作用[20-21],而原花青素聚合物则可能在60~120 min逐渐被吸收进入血液,发挥降血糖作用[22-24]。
2.4 葡萄籽多酚对糖尿病大鼠胰岛素水平的影响
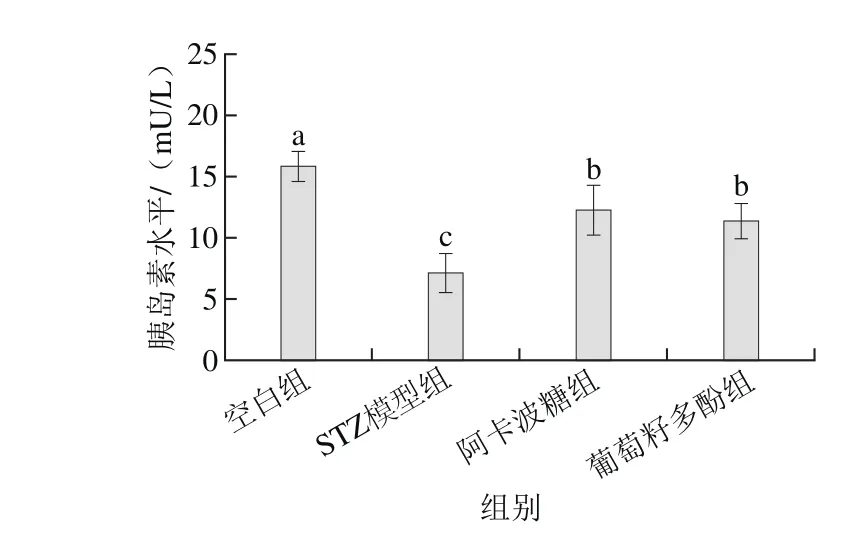
图3 葡萄籽多酚对糖尿病大鼠胰岛素水平的影响Fig. 3 Effect of grape seed polyphenols on serum insulin level of diabetic rats
如图3所示,S T Z模型组糖尿病大鼠的胰岛素水平((7.47±1.25)mU/L)显著低于空白组((16.48±1.84)mU/L)(P<0.05),而葡萄籽多酚可以使胰岛素水平显著升高至(11.39±1.27)mU/L(P<0.05)。葡萄籽多酚升高糖尿病大鼠胰岛素水平的效果与阿卡波糖相近,但均未能恢复到空白组大鼠的胰岛素水平(P<0.05)。
2.5 葡萄籽多酚对糖尿病大鼠胰腺中胰岛素表达的影响
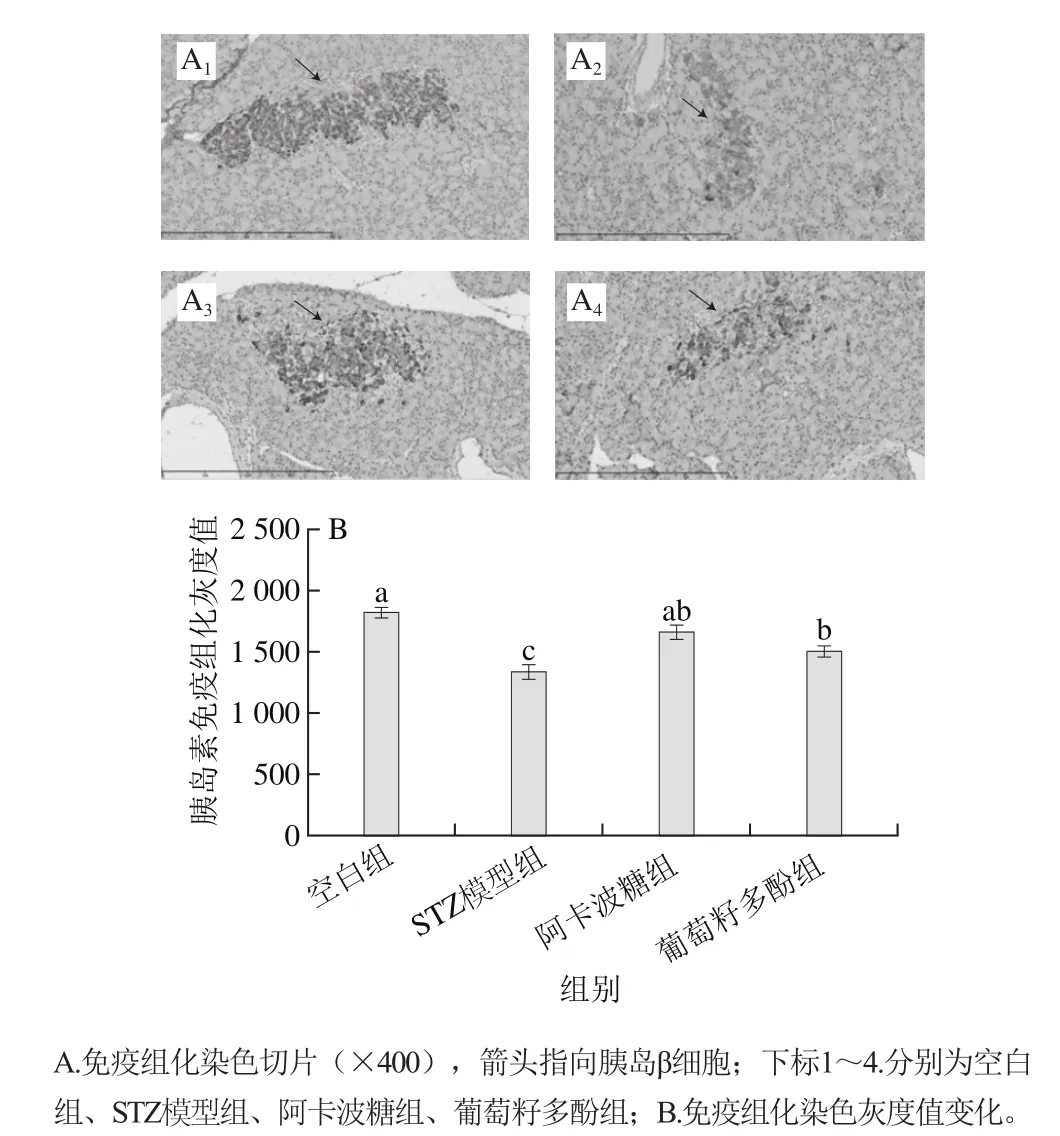
图4 葡萄籽多酚对糖尿病大鼠胰腺中胰岛素表达的影响Fig. 4 Effect of grape seed polyphenols on insulin expression in pancreas of diabetic rats
由图4A可以看出,空白组胰岛分布均匀、大小适中,细胞无异常,胰岛素表达最强。而STZ模型组糖尿病大鼠的胰岛萎缩,β细胞数量减少;部分出现胰岛代偿性肥大,比正常胰岛体积大2~3 倍,β细胞变性;部分胞浆内可见小脂滴,β细胞核凋亡。葡萄籽多酚和阿卡波糖均不同程度地改善了胰岛损伤,使得胰岛数量增加,大小较均一,β细胞变性减轻,凋亡细胞数量减少。
如图4B所示,葡萄籽多酚和阿卡波糖可以显著提高糖尿病大鼠的胰岛素水平(P<0.05)。阿卡波糖的效果更为显著,可使糖尿病大鼠的胰岛素分泌恢复到正常大鼠水平。葡萄籽多酚则未能使胰岛素分泌恢复至正常水平(P<0.05)。
2.6 葡萄籽多酚对糖尿病大鼠抗氧化指标的影响
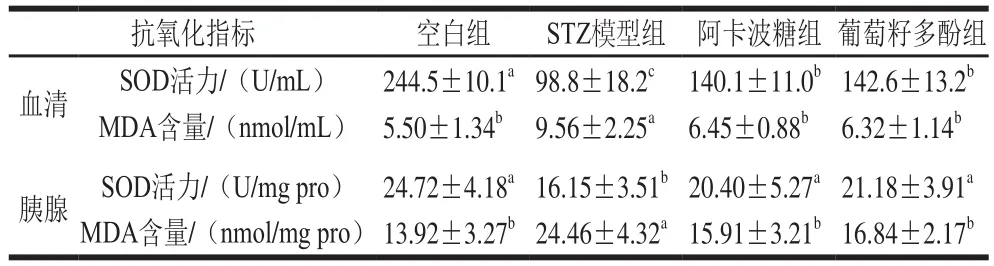
表2 葡萄籽多酚对糖尿病大鼠抗氧化指标的影响(n=12)Table 2 Effect of grape seed polyphenols on antioxidant indexes in pancreas and serum of diabetic rats (n= 12)
由表2可以看出,STZ模型组糖尿病大鼠的血清中SOD的活力显著低于空白组(P<0.05),而葡萄籽多酚与阿卡波糖均使得SOD活力有所升高。同样地,STZ模型组血清MDA含量显著高于空白组(P<0.05),而葡萄籽多酚与阿卡波糖均抑制了MDA含量的升高,使得糖尿病大鼠的MDA含量恢复到正常大鼠的水平。
大鼠胰腺组织也呈现出相同的变化规律。如表2所示,与STZ模型组相比,在给予葡萄籽多酚后,糖尿病大鼠胰腺组织中SOD活力显著升高(P<0.05);阿卡波糖组和葡萄籽多酚组胰腺组织中MDA的含量与STZ模型组相比均显著性降低(P<0.05)。结果表明,葡萄籽多酚对STZ诱导的糖尿病小鼠有显著的抗氧化作用。
2.7 葡萄籽多酚对糖尿病大鼠肝糖原、肌糖原含量的影响
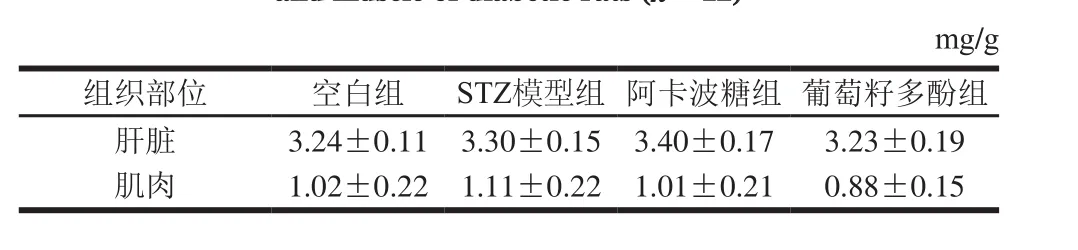
表3 葡萄籽多酚对糖尿病大鼠糖原含量的影响(n=12)Table 3 Effect of grape seed polyphenols on glycogen contents in liver and muscle of diabetic rats (n= 12)
如表3所示,各组大鼠的肝糖原和肌糖原水平在为期8 周的干预实验里未发生显著变化。高脂饲料诱导的糖尿病大鼠会发生糖耐量降低,从而影响糖原合成及糖原异生作用的正常发挥,而本研究采用一次性注射STZ诱导糖尿病模型,可能促使大鼠出现急性糖代谢异常,而未使得糖原含量发生明显变化[25-26]。经葡萄籽多酚低剂量干预后,糖尿病大鼠体内的糖储备功能在8 周内未能发生显著变化。这也说明葡萄籽多酚在发挥降血糖作用的同时不会给糖尿病大鼠带来肝脏受损、乳酸中毒等副作用[3]。
3 讨 论
糖尿病是由遗传因素、免疫功能失调、自由基毒素等多种致病因子作用于机体导致胰岛功能减退、胰岛素抵抗等而引发的糖、蛋白质、脂肪、水和电解质等一系列代谢紊乱的综合征。在生物活性成分降血糖研究中,STZ诱导的糖尿病大鼠模型最为常用。STZ可通过在大鼠体内产生过量自由基使β细胞功能受损、胰岛素合成减少,从而引发糖尿病。与此同时,高血糖导致的脂质代谢紊乱会引起氧化应激升高,破坏机体的抗氧化能力,加重β细胞损伤持续恶化[27]。本研究结果表明,葡萄籽多酚可以降低STZ诱导的糖尿病大鼠的空腹血糖水平,增强其葡萄糖耐受性,这与王颖等[28]关于葡萄籽原花青素提取物在四氧嘧啶诱导的糖尿病大鼠中的降血糖功效相一致。Pinent等[14]的研究通过测定骨骼肌细胞和脂肪细胞中葡萄糖吸收证实葡萄糖原花青素促进葡萄糖吸收作用。但葡萄籽多酚如何通过调节胰腺组织状态及胰岛素表达水平改善胰岛功能仍不明确。
胰岛素作为调控血糖水平的激素,可促进组织细胞对葡萄糖的摄取和利用,促进糖原合成,抑制糖异生[29]。本研究结果显示,糖尿病大鼠模型中的胰岛素分泌量显著降低,而葡萄籽多酚可显著提高血清胰岛素水平,其作用效果与阿卡波糖相当。胰腺内胰岛中央区的β细胞是胰岛素表达的主要场所,因此胰腺组织状态对于胰岛素分泌及其重要[29]。本研究则采用免疫组化染色法分析胰岛素在胰腺中的表达。结果显示,葡萄籽多酚对STZ诱导的糖尿病大鼠的胰岛萎缩、β细胞变性及凋亡均有所改善,表明葡萄籽多酚是通过修复胰岛损伤促进胰岛素分泌来发挥降血糖作用。
葡萄籽多酚含有大量酚羟基,对超氧阴离子自由基、羟自由基及过氧化自由基具有显著的清除能力,其抗氧化能力是VC的20 倍、VE的50 倍[30]。但是葡萄籽多酚在STZ诱导的糖尿病大鼠中的抗氧化活性如何仍不明确。本研究结果显示,葡萄籽多酚可以提高糖尿病大鼠体内SOD活力并降低MDA含量。这一结果表明,葡萄籽多酚通过修复胰岛损伤发挥降血糖作用可能与其改善氧化应激状态有关,但所涉及具体的代谢信号通路有待于进一步研究。
综上所述,本研究结果显示长期低剂量的葡萄籽多酚干预可以有效调节糖尿病大鼠的血糖水平。葡萄籽多酚通过修复胰岛损伤促进胰岛素分泌,从而降低空腹血糖,改善葡萄糖耐受。葡萄籽多酚的降血糖作用可能与其显著的体内抗氧化功效相关。
[1] XU Y, WANG L M, HE J, et al. Prevalence and control of diabetes in Chinese adults[J]. The Journal of the American Medical Association,2013, 310(9): 948-959. DOI:10.1001/jama.2013.168118.
[2] ZHENG J S, LIN M, FANG L. Effects of n-3 fatty acid supplements on glycemic traits in Chinese type 2 diabetic patients: a doubleblind randomized controlled trial[J]. Molecular Nutrition and Food Research, 2016, 60(10): 2176-2184. DOI:10.1002/mnfr.201600230.
[3] RAZ I, ELDOR R. Rational therapy for diabetes: early recognition of adverse effects and avoidance of disruptive false alarms[J].Diabetes-Metabolism Research and Reviews, 2012, 28(4): 321-324.DOI:10.1002/dmrr.2265.
[4] HU F B. Globalization of diabetes: the role of diet, lifestyle, and genes[J].Diabetes Care, 2011, 34(6): 1249-1257. DOI:10.2337/dc11-0442.
[5] STAGOS D, AMOUTZIAS G D, MATAKOS A, et al. Chemoprevention of liver cancer by plant polyphenols[J]. Food and Chemical Toxicology,2012, 50(6): 2155-2170. DOI:10.1016/j.fct.2012.04.002.
[6] CASTROG G D, QUINTANS L N, MACIELM E, et al. Preventive effects of plant polyphenols in the promotion of mammary cancer and testicular damage induced by alcohol drinking[J]. Polyphenols in Human Health and Disease, 2014, 2: 1181-1190. DOI:10.1016/B978-0-12-398456-2.00089-X.
[7] 吴伟青, 陈静, 刘超群, 等. 绿茶多酚对小鼠酒精性肝损伤的保护作用[J]. 食品科学, 2011, 32(13): 310-313. DOI:10.3969/j.issn.1009-3079.2006.01.010.
[8] 赵伟, 李建科, 何晓叶, 等. 几种常见植物多酚降血脂作用及机制研究进展[J]. 食品科学, 2014, 35(21): 258-263. DOI:10.7506/spkx1002-6630-201421051.
[9] BAGCHI D, BAGCHI M, STOHS S J, et al. Free radicals and grape seed proanthocyanidin extract: importance in human health and disease prevention[J]. Toxicology, 2000, 148(2/3): 187-197. DOI:10.1016/S0300-483X(00)00210-9.
[10] QUIÑONES M, GUERRERO L, FERNÁNDEZ-VALLINAS S, et al.Involvement of nitric oxide and prostacyclin in the antihypertensive effect of low-molecular-weight procyanidin rich grape seed extract in male spontaneously hypertensive rats[J]. Journal of Functional Foods,2014, 6: 419-427. DOI:10.1016/j.jff.2013.11.008.
[11] PONS Z, MARGALEF M, BRAVO F I, et al. Grape seed flavanols decrease blood pressure via Sirt-1 and confer a vasoprotective pattern in rats[J]. Journal of Functional Foods, 2016, 24: 164-172.DOI:10.1016/j.jff.2016.03.030.
[12] PONS Z, GUERRERO L, MARGALEF M, et al. Effect of low molecular grape seed proanthocyanidins on blood pressure and lipid homeostasis in cafeteria diet-fed rats[J]. Journal of Physiology and Biochemistry, 2014, 70(2): 629-637. DOI:10.1007/s13105-014-0329-0.
[13] PONS Z, MARGALEF M, BRAVO F I, et al. Acute administration of single oral dose of grape seed polyphenols restores blood pressure in a rat model of metabolic syndrome: role of nitric oxide and prostacyclin[J]. European Journal of Nutrition, 2016, 55: 749-758.DOI:10.1007/s00394-015-0895-0.
[14] PINENT M, BLAY M, BLADÉ M C, et al. Grape seed-derived procyanidins have an antihyperglycemic effect in streptozotocininduced diabetic rats and insulinomimetic activity in insulin-sensitive cell lines[J]. Endocrinology, 2004, 145(11): 4985-4990. DOI:10.1210/en.2004-0764.
[15] 李宇杰, 张召锋, 戴小倩, 等. 葡萄籽原花青素对Ⅱ型糖尿病大鼠视网膜病变的影响[J]. 食品科学, 2013, 34(7): 245-249. DOI:10.7506/spkx1002-6630-201307051.
[16] LI X H, XU L, GAO H Q, et al. Effects of grape seed proanthocyanidins extracts on AGEs and expression of bone morphogenetic protein-7 in diabetic rats[J]. Journal of Nephrology, 2008, 21(5): 722-733.
[17] QIU Ju, REN Changzhong, FAN Junfeng, et al. Antioxidant activities of aged oat vinegar in vitro and in mouse serum and liver[J]. Journal of Science and Food Agriculture, 2010, 90(11):1951-1958. DOI:10.1002/jsfa.4040.
[18] KANAMOTO Y, YAMASHITA Y, NANBA F, et al. A black soybean seed coat extract prevents obesity and glucose intolerance by upregulating uncoupling proteins and down-regulating inflammatory cytokines in high-fat diet-fed mice[J]. Journal of Agricultural and Food Chemistry, 2011, 59(16): 8985-8993. DOI:10.1021/jf201471p.
[19] XU Jinrui, ZHANG Mingwei, LIU Xinghua, et al. Correlation between antioxidation and the content of total phenolics and anthocyanin in black soybean accessions[J]. Agricultural Sciences in China, 2007,6(2): 150-158. DOI:10.1016/S1671-2927(07)60029-7.
[20] YI W, AKOH C C, FISCHER J, et al. Absorption of anthocyanins from blueberry extracts by Caco-2 human intestinal cell monolayers[J].Journal of Agricultural and Food Chemistry, 2006, 54(15): 5651-5658.DOI:10.1021/jf0531959.
[21] ZHANG L, WANG Y J, LI D X, et al. The absorption, distribution,metabolism and excretion of procyanidins[J]. Food and Function,2016, 7(3): 1273-1281. DOI:10.1039/c5fo01244a.
[22] APPELDOORN M M, VINCKEN J P, GRUPPEN H, et al.Procyanidin dimers A1, A2, and B2 are absorbed without conjugation or methylation from the small intestine of rats[J]. Journal of Nutrition,2009, 139(8): 1469-1473. DOI:10.3945/jn.109.106765.
[23] TSANG C, AUGER C, MULLEN W, et al. The absorption,metabolism and excretion of fl avan-3-ols and procyanidins following the ingestion of a grape seed extract by rats[J]. British Journal of Nutrition, 2005, 94(2): 170-181. DOI:10.1079/BJN20061795.
[24] SHOJI T, MASUMOTO S, MORIICHI N, et al. Apple procyanidin oligomers absorption in rats after oral administration: analysis of procyanidins in plasma using the porter method and high-performance liquid chromatography/tandem mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2006, 54(3): 884-892. DOI:10.1021/jf052260b.
[25] 张泽生, 张梦娜, 高云峰, 等. D-手性肌醇对STZ诱导的2型糖尿病大鼠糖原合成的影响[J]. 中国食品添加剂, 2016, 1(7): 66-71.DOI:10.3969/j.issn.1006-2513.2016.07.003.
[26] 姜广坤, 肖洪彬, 李凤金, 等. 高脂诱导糖耐量低减大鼠模型骨骼肌中相关蛋白的表达[J]. 中国实验方剂学杂志, 2014, 20(21): 183-186.DOI:10.13422/j.cnki.syfjx.2014210183.
[27] 郝颖, 柴瑞华, 于世家. 改良链脲佐菌素(STZ)诱导大鼠糖尿病模型及其饲养方法[J]. 中华中医药学刊, 2008, 26(4): 784-785.DOI:10.13193/j.archtcm.2008.04.113.haoy.084.
[28] 王颖, 张桂芳, 徐炳政, 等. 葡萄籽原花青素提取物对糖尿病小鼠血糖的影响[J]. 天然产物研究与开发, 2012, 24(9): 1191-1195.DOI:10.3969/j.issn.1001-6880.2012.09.008.
[29] KITABCHI A E, TEMPROSA M, KNOWLER W C, et al. Role of insulin secretion and sensitivity in the evolution of type 2 diabetes in the diabetes prevention program: effects of lifestyle intervention and metformin[J]. Diabetes, 2005, 54(8): 2404-2414.
[30] BAGCHI D, BAGCHI M, STOHS S J, et al. Free radicals and grape seed proanthocyanidin extract: importance in human health and disease prevention[J]. Toxicology, 2000, 148(2/3): 187-197. DOI:10.1016/S0300-483X(00)00210-9.Cordyceps sinensis CAMT 63341
Hypoglycemic Effect of Grape Seed Polyphenols in Diabetic Rats and Its Underlying Mechanism
QIU Ju, ZHU Hong, LU Lingang*
(Institute of Food and Nutrition Development, Ministry of Agriculture, Beijing 100081, China)
Objective: To investigate anti-diabetic effect of grape seed polyphenols (GSP) in type Ⅱ diabetic rats, and to illustrate its underlying mechanism from the perspective of pancreatic islet damage and insulin expression. Methods: A rat model of type Ⅱ diabetes was established by injecting streptozotocin (STZ) to male SD rats. The diabetic rats were randomly divided to STZ model group, GSP treatment group (50 mg/(kg·d)), and acarbose treatment group (positive control group). GSP was administrated to diabetic rats at a dose of 50 mg/kg mbper day for 8 weeks. Serum glucose, insulin, oral glucose tolerance test (OGTT), serum superoxide dismutase (SOD) and malondialdehyde (MDA) were tested after the last administration. Islet cell damage and insulin expression were detected using immunohistochemical staining. Results: GSP decreased serum glucose level, increased OGTT, and promoted insulin secretion in diabetic rats (P < 0.05). In addition, GSP improved STZ-induced islet cell damage and increased insulin expression (P < 0.05). Serum SOD activity was increased by administration of GSP, while MDA content was decreased signif i cantly (P < 0.05). Conclusion: A long-term intervention with low-dose GSP can effectively regulate blood glucose in diabetic rats. GSP promotes insulin secretion by rescuing islet cell damage, thereby decreasing fasting serum glucose level and increasing OGTT, which may be associated with its potent antioxidant activity in vivo.
grape seed polyphenols; hypoglycemia; insulin; islet cell damage
10.7506/spkx1002-6630-201801034
TS201.4
A
1002-6630(2018)01-0226-06
仇菊, 朱宏, 卢林纲. 葡萄籽多酚对糖尿病大鼠的降血糖作用及其机制[J]. 食品科学, 2018, 39(1): 226-231.
10.7506/spkx1002-6630-201801034. http://www.spkx.net.cn
QIU Ju, ZHU Hong, LU Lingang. Hypoglycemic effect of grape seed polyphenols in diabetic rats and its underlying mechanism[J]. Food Science, 2018, 39(1): 226-231. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201801034. http://www.spkx.net.cn
2016-09-01
中国农业科学院科技创新工程项目
仇菊(1984—),女,副研究员,博士,研究方向为功能食品的营养与健康。E-mail:qiuju@caas.cn
*通信作者简介:卢林纲(1963—),男,研究员,硕士,研究方向为活性成分营养功能评价。E-mail:lulingang@caas.cn

