川陈皮素对高脂膳食诱导大鼠的降脂减肥及预防脂肪肝形成作用
冯孔龙,朱晓艾,陈 彤,彭 勃,张立群,戴伟杰,刘 欣,曹 庸,*,陈运娇,*
(1.华南农业大学食品学院,广东 广州 510642;2.广东省天然活性物工程技术研究中心,广东 广州 510642;3.广州中医药大学基础医学院,广东 广州 510006)
川陈皮素对高脂膳食诱导大鼠的降脂减肥及预防脂肪肝形成作用
冯孔龙1,2,朱晓艾1,2,陈 彤1,2,彭 勃1,2,张立群3,戴伟杰1,2,刘 欣1,2,曹 庸1,2,*,陈运娇1,2,*
(1.华南农业大学食品学院,广东 广州 510642;2.广东省天然活性物工程技术研究中心,广东 广州 510642;3.广州中医药大学基础医学院,广东 广州 510006)
目的:研究川陈皮素对高脂膳食诱导的大鼠体质量、血脂和肝脏的影响。方法:将56 只雄性SD大鼠随机分为7 组,即正常组、高脂对照组、阳性对照组(奥利司他和力平之)和川陈皮素低、中、高剂量组(高脂饲料+0.02%、0.04%、0.08%川陈皮素),对正常组饲喂普通饲料,其余各组分别饲喂相应的高脂饲料,连续喂养6 周后,考察不同时期大鼠血清血脂水平变化,检测大鼠体质量、体内脂肪质量、脏器变化及肝脏组织形态变化。结果:川陈皮素可以有效抑制高脂膳食大鼠的体质量增长,降低Lee’s指数、食物利用率和脂肪系数;降低血清中总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)和低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)水平,其中降低TG作用显效较快,降低血清TC和LDL-C作用需要较长时间;同时可降低肝脏指数、血清中谷草转氨酶和谷丙转氨酶水平,改善肝脏脂肪变性情况。结论:川陈皮素具有预防肥胖、辅助降血脂及预防肝脏脂肪变性的作用。
川陈皮素;高脂膳食;大鼠;预防肥胖;降血脂;预防脂肪肝
近年来,肥胖、高脂血症、心血管疾病、脂肪肝和代谢综合征已经成为社会公众健康的巨大威胁。目前患者大都服用减肥药和调脂药来控制肥胖和改善血脂异常,然而这些药物的副作用明显,如奥利司他会引起油性便、脂溶性维生素缺乏和肝损害[1],他汀类药物会引起肌肉损害和肝脏损害等不良反应[2],不能满足人类对健康的要求,因此开发安全、绿色的天然活性产品来代替减肥降脂药物成为当下研究的热点。
多甲氧基黄酮(polymethoxy flavones,PMFs)是一类以2-苯基色原酮为母核具有两个或两个以上甲氧基的天然黄酮类化合物,具有低极性和较高的口服生物利用度,存在于柑橘属植物中,特别是甜橙和柑橘的果皮[3]。PMFs具有抗癌、抗炎、抗病毒、抗肿瘤、抗氧化以及抗动脉粥样硬化等多种生物活性[4-10],自21世纪以来受到广泛研究和关注。目前已有研究证明柑橘黄酮提取物和柑橘PMFs具有调控脂质代谢、降血脂和预防肥胖的作用[9-12]。膳食中添加羟基化PMFs可以抑制高脂饮食诱导的小鼠模型的脂肪生成和体质量增加[13]。Guo Jingjing等[14]研究发现,富含PMFs的陈皮提取物能够预防肥胖、改善肝脏脂肪变性和预防2型糖尿病。

图1 川陈皮素结构式Fig. 1 Structural formula of nobiletin
川陈皮素,又称蜜橘黄酮,结构式如图1。它是柑橘属植物果皮中含量十分丰富的PMFs之一,具有高渗透性和较高的生物利用度[15]。大量研究已经证实川陈皮素具有抗癌[16-17]、抗炎[7,18]、抗动脉粥样硬化活性[9,19]、抗氧化[18,20]等多种生物活性。目前国内外多以柑橘皮提取物或PMFs混合物为对象进行研究,但是由于生物活性物质在体内作用的复杂性,其发挥作用的具体成分尚不明确,并且研究关于川陈皮素单体预防肥胖、降低甘油三酯(triglyceride,TG)和预防脂肪肝形成等方面的作用在国内外还鲜有报道。本研究以高脂膳食诱导的SD大鼠为动物模型,通过膳食干预途径,考察川陈皮素在不同时期对大鼠血脂水平变化的影响,以目前常用的减肥药奥利司他和调脂药力平之作为阳性对照,研究陈皮中川陈皮素对高脂膳食诱导的大鼠体质量、血脂和肝脏的影响,探究川陈皮素在实际应用中的适宜剂量和产生效果的周期,为开发天然预防肥胖、降脂保肝保健品提供实验依据。
1 材料与方法
1.1 动物、材料与试剂
SPF级雄性SD大鼠,56 只,体质量180~200 g,购自广东省医学实验动物中心,实验动物质量合格证明编号:44007200024596,使用许可证号:SYXK(粤)2014-0136。
普通饲料购自广东省医学实验动物中心;高脂饲料购自广东省医学实验动物中心,配方为:猪油15%、蔗糖20%、酪蛋白10%、胆固醇1.2%、胆盐0.2%、磷酸氢钙1%、石粉0.5%、盐0.2%、基础饲料51.9%。
川陈皮素(纯度98%)由广东省天然活性物工程技术研究中心自制。
奥利司他胶囊 重庆植恩药业有限公司;力平之胶囊 法国利博福尼制药公司;福尔马林 天津富宇精细化工;苏木精-伊红(hematoxylin-eosin,HE)染液南京建成生物工程研究所。
1.2 仪器与设备
AL104电子天平 瑞士梅特勒-托利多公司;7600-020全自动生化分析仪 日本日立公司;D3024R高速冷冻型微型离心机 美国赛洛捷克公司;RM2235石蜡切片机 德国徕卡公司;Motic BA400光学显微镜 日本奥林巴斯公司。
1.3 方法
1.3.1 动物分组及饲养条件
根据《保健食品功能学评价程序和检验方法》的规定,在给予高热量、高脂食物诱发大鼠肥胖和脂代谢紊乱的同时给予受试样品,考察受试样品预防大鼠肥胖和降脂的效果。
选择健康的成年雄性SD大鼠56 只,适应性喂养1 周后,随机分配为7 组,每组8 只,分别为:正常组(饲喂普通饲料)、高脂对照组(饲喂高脂饲料)、奥利司他组(饲喂高脂饲料+0.06%奥利司他(粉末))、力平之组(饲喂高脂饲料+0.035%力平之(粉末));川陈皮素低、中、高剂量组(饲喂高脂饲料+0.02%、0.04%、0.08%川陈皮素)。动物饲养于华南农业大学实验动物中心SPF级动物实验室,4 只/笼,群养,饲养温度23~26 ℃,相对湿度40%~70%,采用10 h∶14 h昼夜间断照明。实验周期为6 周,实验期间动物自由进食和饮水。
1.3.2 样品采集
在饲喂过程中,第0、4周末对各组大鼠进行眼眶静脉丛取血,采血前禁食12 h后,并使用无水乙醚麻醉。喂养6 周末,各组大鼠禁食12 h,处死前称体质量,测量体长,麻醉后快速摘眼球取血,颈椎脱臼致死,快速分离肝脏、心脏、脾脏、肾脏、肾周脂肪垫和睾丸周脂肪垫,用生理盐水漂洗脏器,滤纸吸干,并称脏器和组织质量。
1.3.3 指标的测定
1.3.3.1 大鼠体质量及摄食量的测定
实验期间每天记录大鼠生长状况(大鼠的毛色、进食、排便及活动等情况),每周称量1 次体质量并记录饲料消耗情况。按照公式(1)计算食物利用率。

式中:Δm为同期内体质量的增量/g;m为同期内的摄食量/g。
1.3.3.2 Lee’s指数的测定
Lee’s指数(肥胖指数)大鼠断颈椎处死,称量体质量,将大鼠平摊仰卧,用卷尺准确测量大鼠鼻尖至肛门的长度作为体长,按照公式(2)计算Lee’s指数。

式中:m为大鼠处死前体质量/g;L为体长/cm。
1.3.3.3 脏器指数的测定
分离大鼠肝脏、肾脏、脾脏、心脏,称质量,按照公式(3)计算各脏器指数。

式中:m为大鼠处死前体质量/g;m1为各脏器质量/g。
1.3.3.4 脂肪系数的测定
剖腹取大鼠体内脂肪(包括双肾周脂肪组织和睾丸周脂肪组织)称质量,按照公式(4)计算脂肪系数。

式中:m为大鼠处死前体质量/g;m1为大鼠体内各脂肪组织质量/g。
1.3.3.5 血清生化指标的测定
将第0、4、6周末采集的血液样本,25 ℃放置2 h后,3 000 r/min离心10 min,离心取上层血清,-80 ℃冰箱中保存,备用。取血清200 μL用全自动生化分析仪测定大鼠血清总胆固醇(total cholesterol,TC)、TG、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)浓度,谷草转氨酶(glutamic oxalacetic transaminase,AST)、谷丙转氨酶(alanine transaminase,ALT)活力。并按照公式(5)计算动脉硬化指数(atherosclerosis index,AI)。

式中:cTC为血清TC浓度/(mmol/L);cHDL-C为血清HDL-C浓度/(mmol/L)。
1.3.3.6 肝脏切片染色观察
采用HE染色法,取肝脏同一部位的组织经10%福尔马林固定液固定、脱水、石蜡包埋、常规切片、HE染色,染色切片在光学显微镜下进行观察和图像分析,观察病理组织学变化。
1.4 数据统计分析
数据采用SPSS 18.0软件进行统计分析,以 ±s表示,采用单因素方差分析,方差齐时多组间比较采用Duncan’s新复极差法,方差不齐时多组间比较采用Dunnett’s T3法。
2 结果与分析
2.1 大鼠一般生长状况
实验期间环境控制良好,温、湿度均处于正常的范围。各组大鼠未见明显异常,体毛色泽均无变化,饮食、活动状况良好;奥利司他组大鼠出现油性便,并且排便量明显增多,有腹泻现象,粪便呈黄褐色长颗粒状;其余各组大鼠粪便呈黑褐色长颗粒状,尿液正常,有少量撒食现象。
2.2 川陈皮素对高脂膳食大鼠体质量、Lee’s指数、摄食量和食物利用率的影响
由表1可知,各组大鼠初始体质量无显著差异(P>0.05),实验结束时,高脂对照组大鼠体质量和Lee’s指数显著高于正常组(P<0.05)。与高脂对照组相比,川陈皮素高剂量组和奥利司他组大鼠的体质量和Lee’s指数显著降低(P<0.05)。奥利司他组和川陈皮素低、中、高剂量组的大鼠体质量增加量分别比高脂对照组低18.57%、11.04%、10.91%、13.66%(P<0.05)。其中川陈皮素高剂量组大鼠最终体质量、体质量增加量和Lee’s指数与奥利司他组相比无显著差异(P>0.05),说明川陈皮素高剂量的减肥效果与减肥药奥利司他相当。

表1 川陈皮素对大鼠体质量、Lee’s指数、摄食量和食物利用率的影响Table 1 Effect of nobiletin on body weight, Lee’s index, food intake and food utilization rate in rats
平均摄食量和食物利用率也是影响大鼠体质量变化的关键因素,由表1可知,高脂对照组、力平之组和各剂量组的平均摄食量都显著少于正常组(P<0.05),这可能是由于富含胆固醇、高热量的饲料容易使大鼠产生饱腹感,在一定程度上抑制了大鼠的食欲,减少了摄食量,但高脂对照组大鼠的食物利用率明显提高(P<0.05),导致大鼠体质量增加量明显增加(P<0.05)。川陈皮素低、中、高剂量组的摄食量与高脂对照组相比差异不显著(P>0.05),但是它们体质量增加量显著降低,故食物利用率显著降低(P<0.05),表明川陈皮素能够有效抑制大鼠对高脂饲料的转化和吸收,从而表现出预防肥胖的作用;同时可以说明川陈皮素不是通过减少食物摄取量来抑制大鼠体质量的增长。
2.3 川陈皮素对高脂膳食大鼠体内脂肪的影响

表2 川陈皮素对大鼠脂肪湿质量和脂肪系数的影响Table 2 Effect of nobiletin on fat wet weight and fat to body weight ratio in rats
由表2可知,高脂对照组大鼠肾周脂肪垫和睾丸周脂肪垫质量均显著高于正常组(P<0.05),体内总脂肪质量和脂肪系数比正常组分别增加了60.09%、40.51%(P<0.05),表明高脂饮食容易造成体内脂肪的堆积。与高脂对照组相比,奥利司他组、力平之组和川陈皮素低、高剂量组大鼠的体内脂总肪质量分别降低了26.26%、36.09%、17.75%、20.48%(P<0.05)。脂肪系数可以直观地表示出动物个体的肥胖程度,与高脂对照组相比,川陈皮素低剂量和高剂量大鼠的脂肪系数显著降低(P<0.05),分别降低11.44%、22.42%,其中高剂量川陈皮素减少体内脂肪堆积的效果与减肥药奥利司他相比无显著差异(P>0.05),说明川陈皮素能够有效抑制大鼠体内的脂肪堆积,从而起到控制体质量增长的作用。
2.4 川陈皮素对高脂膳食大鼠脏器指数的影响

表3 川陈皮素对大鼠脏器指数的影响Table 3 Effect of nobiletin on organ coeff i cients of rats
由表3可知,川陈皮素低、中、高剂量干预后,高脂膳食大鼠的心脏指数、脾脏指数和肾脏指数与喂食普通饲料的正常组大鼠相比,均无显著性差异(P>0.05),说明川陈皮素对大鼠的心脏、脾脏和肾脏没有毒副作用。肝脏指数是动物的一项重要生理指标。当肝脏指数出现补偿性增生时,肝脏的解毒负荷也相应增加[21]。高脂对照组大鼠肝脏脏器指数比正常组大鼠显著增加了62.80%(P<0.05),出现了肝脏肿大现象。奥利司他组、川陈皮素低、中、高剂量组比高脂对照组分别显著下降了22.22%、7.55%、10.27%、17.40%(P<0.05),表明奥利司他和川陈皮素能防止大鼠肝脏增大,维持正常肝脏脏器指数,减小脂肪肝等疾病的发生概率。然而力平之组大鼠肝脏指数高于高脂对照组,但无显著差异(P>0.05),出现肝脏肿大现象,这与文献[22-23]报道相符。
2.5 川陈皮素对高脂膳食大鼠血清血脂水平的影响
2.5.1 血清TC水平

图2 各组大鼠血清TC水平Fig. 2 Serum TC levels of rats
由图2可知,第0周末,各实验组的大鼠TC水平无明显的差异(P>0.05),高脂对照组的血清TC水平在整个实验期间保持上升趋势,第4周末和第6周末比正常组分别增加了31.24%、72.61%(P<0.05)。低、高剂量川陈皮素和力平之都能显著抑制血清TC水平的增加,有明显的剂量-效应关系,从第4周末开始增势逐渐减缓,并在随后2 周持续缓慢下降。第6周末,与高脂对照组相比,川陈皮素低、高剂量组大鼠的血清TC水平显著降低了26.93%、29.99%(P<0.05),说明川陈皮素能显著降低SD大鼠血清TC水平。
2.5.2 血清TG水平
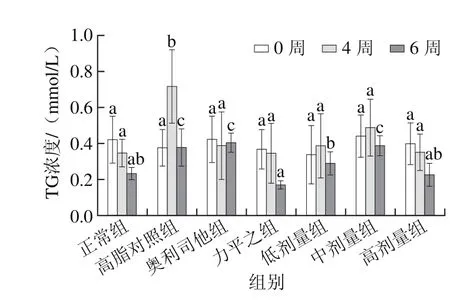
图3 各组大鼠血清TG水平Fig. 3 Serum TG levels of rats
由图3可知,在整个实验期间,正常组、力平之组和高剂量组的大鼠血清TG水平一直持续下降,然而高脂对照组和川陈皮素低、中剂量组大鼠TG水平从实验开始持续上升,到第4周末开始逐渐下降。长期喂食高脂饲料的高脂对照组大鼠血脂TG水平并非持续增加,到达一定程度时大鼠机体会进行自我调节[24]。第4周末,相对于高脂对照组,奥利司他组、力平之组和川陈皮素低、中、高剂量组的大鼠血清TG水平分别降低45.96%、51.94%、46.03%、31.98%、51.02%(P<0.05)。随后2 周时间内,力平之组和低、高剂量组大鼠TG水平显著下降54.97%、23.18%、40.13%(P<0.05),其中力平之组和川陈皮素高剂量组与正常组之间无显著差异(P>0.05),说明川陈皮素能显著降低SD大鼠血清TG水平。
2.5.3 血清HDL-C水平
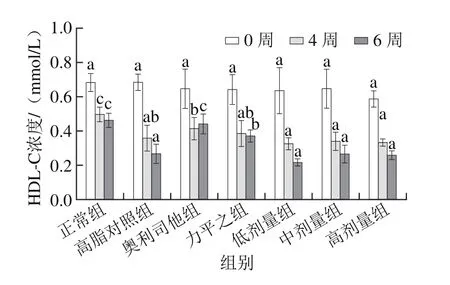
图4 各组大鼠血清HDL-C水平Fig. 4 Serum HDL-C levels of rats
由图4可知,在第4、6周末,各组血清HDL-C水平均有持续下降的趋势。相对于正常组,喂食高脂饲料的高脂对照组大鼠血清HDL-C水平显著下降(P<0.05),说明高脂饮食能够引起HDL-C水平的降低。川陈皮素低、中、高剂量组的HDL-C水平与高脂对照组相比均无显著性差异(P>0.05),说明川陈皮素对大鼠血清HDL-C水平的影响较小。
2.5.4 血清LDL-C水平

图5 各组大鼠血清LDL-C水平Fig. 5 Serum LDL-C levels of rats
如图5所示,实验开始时各组大鼠血清LDL-C水平无明显差别,在川陈皮素干预6 周后,低、中、高剂量组也能够显著地抑制LDL-C水平增加(P<0.05),实验结束时与高脂对照组相比分别降低了47.93%、27.46%、54.98%(P<0.05)。其中川高剂量陈皮素对LDL-C水平降低效果最好,优于力平之组,最终接近于正常组水平,并且已经恢复到实验初期的水平,说明川陈皮素能有效降低SD大鼠血清LDL-C水平。
2.5.5 血清AI

图6 各组大鼠血清AIFig. 6 Serum AI levels of rats
由图6可知,在第4、6周末,高脂对照组大鼠的AI显著高于正常组(P<0.05),说明动脉粥样硬化发生的可能性极高。与高脂对照组相比,川陈皮素高剂量组和力平之组大鼠的AI显著降低(P<0.05),虽然与正常组相比存在较明显的差异,但已经较好地抑制大鼠AI的进一步增加,在一定程度上预防心血管疾病的发生。
以上结果表明,与高脂对照组相比,川陈皮素能够有效降低血清TC、TG和LDL-C水平,降低AI,并且降低TG作用显效较快,降低血清TC和LDL-C作用需要较长时间,具有降血脂功效,从而降低动脉粥样硬化和心血管疾病发生和发展的风险。
2.6 川陈皮素对高脂膳食大鼠肝脏的保护作用
2.6.1 川陈皮素对高脂膳食大鼠肝功能的影响
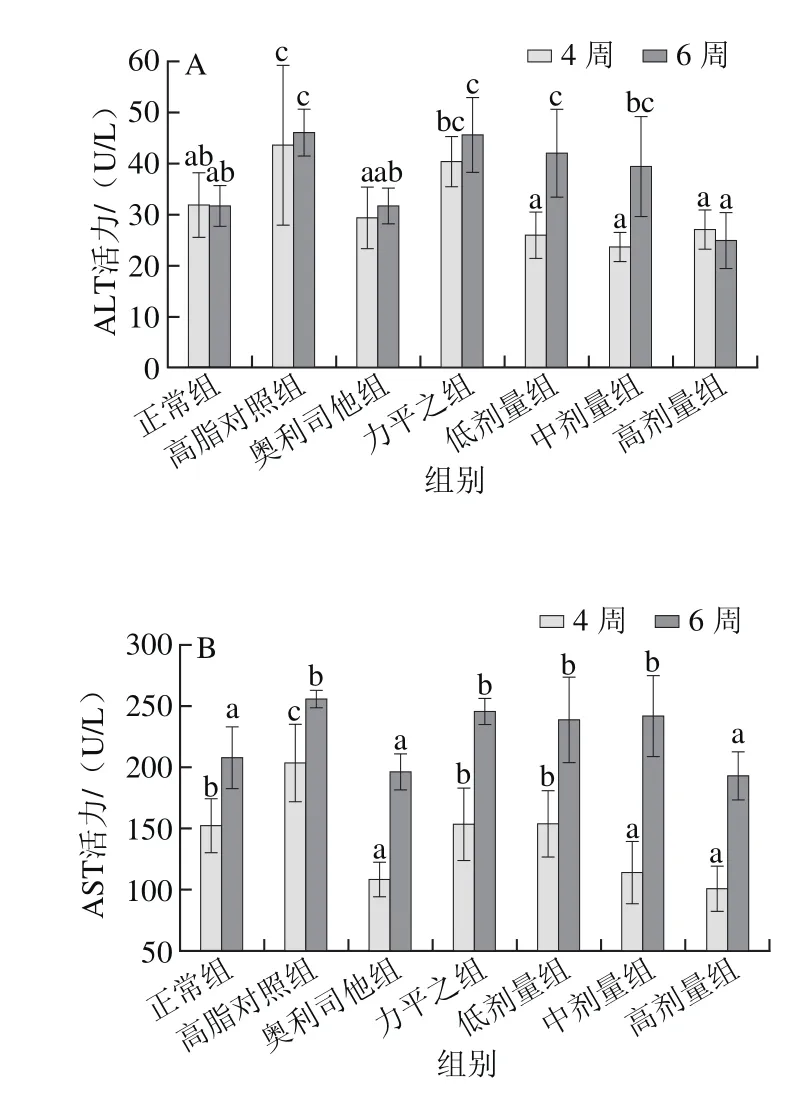
图7 各组大鼠血清ALT(A)和AST(B)水平Fig. 7 Serum ALT (A) and AST (B) levels of rats
如图7所示,与正常组相比,高脂对照组大鼠血清中的ALT和AST活力显著升高(P<0.05),说明高脂饮食会引起肝功能的损害。第4周末,与高脂对照组相比,奥利司他组、川陈皮素低和中、高剂量组血清ALT和AST水平显著降低(P<0.05)。随着饲喂时间延长,各组血清ALT和AST活力均有所增加,力平之组、低剂量组和中剂量组低于高脂对照组,但均无显著性差异(P>0.05),表明其6 周后不再表现出降低的作用。而奥利司他和高剂量均能持续显著降低血清ALT和AST活力(P<0.05),其中高剂量的抑制效果更为显著,实验结束时分别降低了46.01%、24.56%,并且与正常组水平相当,表明川陈皮素具有预防或缓解由高脂膳食诱导的肝损伤,保护肝脏的作用。
2.6.2 肝脏组织形态学分析


图8 肝脏病理HE染色观察(×100)Fig. 8 Histopathological examination of liver tissues from rats (× 100)
如图8所示,正常组大鼠肝脏中肝小叶结构清晰,肝细胞排列致密整齐、形态清晰,细胞质丰富均匀,未见脂肪变性现象。高脂对照组大鼠肝小叶结构不清晰,肝索解离,肝血窦消失,肝细胞肿胀且排列松散,胞质内充满了大小、数量不等的脂滴小空泡以及大空泡,肝脏脂肪变性严重,属于重度脂肪肝。奥利司他组大鼠肝细胞形态比较正常,有少数脂滴空泡,与正常组较接近。力平之组大鼠肝组织脂肪中度变性,其肝小叶结构仍难以辨认,肝细胞胞浆中可见存在较多的脂滴小空泡和大空泡,部分细胞核边缘化。然而与高脂对照组相比,川陈皮素低、中、高剂量组大鼠肝脏脂肪变性得到明显的改善,肝小叶结构逐渐恢复,且脂滴空泡数量明显减少。尤其是川陈皮素高剂量组大鼠肝小叶结构大部分得到改善,肝索排列整齐,肝细胞结构清晰,肝细胞浆出现零星脂滴,这一结果与肝脏脏器指数和血清ALT、AST活力的结果对应,表明川陈皮素可以改善肝细胞脂肪变性,具有预防脂肪肝作用。
3 讨 论
本研究结果表明,川陈皮素同时具有预防肥胖、降血脂和保护肝脏的效果,其中川陈皮素高剂量组的减肥效果优于力平之,接近于奥利司他;改善血脂异常的效果与力平之接近,优于奥利司他。在改善肝细胞脂肪变性方面,川陈皮素和奥利司他效果较好,而力平之效果相对较差。因此川陈皮素能够改善高脂膳食引起的肥胖,同时对肝脏具有保护作用,也适用于预防血脂异常和预防脂肪肝等相关疾病。
体质量、脂肪系数与Lee’s指数是反映大鼠肥胖程度的重要指标。Lee等[25]研究发现,在切除卵巢的C57BL/6J小鼠模型中,口服50、100 mg/(kg·d)的川陈皮素可降低小鼠体质量,减少体内白色脂肪组织,降低血浆TG和脂联素水平,改善肥胖和血脂异常等症状。本研究发现川陈皮素可以有效抑制雄性SD大鼠体质量增加,降低食物利用率、Lee’s指数和脂肪指数,其中川陈皮素高剂量组与高脂对照组差异性最明显,并且该组大鼠摄入样品量与奥利司他组样品摄入量几乎相等,分别为19.56、19.39 mg/(d·只),说明两者抑制体质量增长效果相当。以上结果表明川陈皮素能够有效抑制大鼠对高脂饲料的转化与吸收和大鼠体内的脂肪堆积,控制体质量增长,从而预防肥胖。
目前有关柑橘黄酮调节脂质代谢研究甚多,柑橘黄酮可以减少巨噬细胞对氧化低密度脂蛋白的摄取和巨噬细胞内胆固醇酯的积累,抑制肝脏脂质积累和脂蛋白的过量生产,从而降低动脉粥样硬化发生和发展的风险,然而降脂机制尚未完全明确[26]。Lin Yuguang等[27]研究发现,川陈皮素能够抑制HepG2细胞脱辅基蛋白B(Apo B)的分泌,有效抑制胆固醇和TG的合成,并且对LDL-受体活性没有影响。川陈皮素也可以调控3T3-L1脂肪细胞的脂质代谢[28]。本实验发现川陈皮素能显著降低SD大鼠血清TC、TG和LDL-C水平,但对HDL-C水平影响较小。力平之能显著降低血清TG水平,轻度降低TC和LDL-C水平,升高HDL-C水平,其中高剂量川陈皮素降低TC和LDL-C效果优于力平之,降低TG效果与其相当。本实验在不同时期(0、4、6 周)对各组大鼠采血,发现低、中、高剂量川陈皮素表现出明显的时间-效应关系,其中降低TG作用显效较快,于第4周末降低TG效果已经显著;但降低血清TC和LDL-C水平需要较长时间,直至饲喂到第6周末才表现出显著效果。
肝脏作为机体脂质、糖类及蛋白质代谢的中心器官,代谢性疾病往往与肝组织发生病变有密切关系。脂肪肝则是由于肥胖、高脂饮食、饮酒、糖尿病等各种原因导致过多的脂肪沉积在肝细胞内而形成。体外实验研究表明,川陈皮素能够抑制白细胞介素1β诱导的肝细胞的一氧化氮合酶基因的表达,可能是与其抗炎活性有关,因此川陈皮素存在治疗肝脏疾病的潜力[29]。本研究中,川陈皮素能够有效降低SD大鼠的肝脏指数和肝功能指标ALT、AST水平,同时对肝细胞脂肪变性有改善作用,减少肝脏损伤,从而达到保护肝脏的作用。本研究也发现力平之组大鼠的肝脏指数、血清ALT和AST水平与高脂对照组无显著性差异,肝病理检查发现其未能改善肝细胞脂肪变性,与阎明[22]和吕瑞娟[30]等的研究结果一致。
综上所述,川陈皮素能够抑制高脂膳食诱导大鼠的体质量和脂肪组织增长;降低血清中TC、TG和LDL-C水平;降低血清ALT和AST水平,改善肝脏脂肪变性。结果证明川陈皮素具有预防肥胖、辅助降血脂和保护肝脏作用,具有潜在的应用价值,但是其作用机理有待进一步深入探讨。
[1] 訾梅, 李祥霞. 奥利司他的不良反应及安全应用[J]. 药物不良反应杂志, 2007, 9(3): 182-185. DOI:10.3969/j.issn.1008-5734.2007.03.008.
[2] 居锡萍. 血脂异常的药物治疗[J]. 中国医药指南, 2012, 10(34): 95-99. DOI:10.3969/j.issn.1671-8194.2012.34.057.
[3] TRIPOLI E, LA GUARDIA M, GIAMMANCO S, et al. Citrus flavonoids: molecular structure, biological activity and nutritional properties: a review[J]. Food Chemistry, 2007, 104(2): 466-479.DOI:10.1016/j.foodchem.2006.11.054.
[4] DONG Y, CAO A L, SHI J R, et al. Tangeretin, a citrus polymethoxyf l avonoid, induces apoptosis of human gastric cancer AGS cells through extrinsic and intrinsic signaling pathways[J]. Oncology Reports, 2014, 31(4): 1788-1794. DOI:10.3892/or.2014.3034.
[5] WU X, SONG M Y, RAKARIYATHAM K, et al. Anti-inf l ammatory effects of 4’-demethylnobiletin, a major metabolite of nobiletin[J].Journal of Functional Foods, 2015, 19: 278-287. DOI:10.1016/j.jff.2015.09.035.
[6] LEE Y Y, LEE E, PARK J, et al. Anti-inf l ammatory and antioxidant mechanism of tangeretin in activated microglia[J]. Journal of Neuroimmune Pharmacology, 2016, 11(2): 294-305. DOI:10.1007/s11481-016-9657-x.
[7] 郭珊珊. 多甲氧基黄酮的抗炎活性及相关分子机制研究[D]. 青岛:中国海洋大学, 2012: 9-10.
[8] MANTHEY J A, GUTHRIE N. Antiproliferative activities of citrus flavonoids against six human cancer cell lines[J]. Journal of Agricultural and Food Chemistry, 2002, 50(21): 5837-5843.DOI:10.1021/jf020121d.
[9] MULVIHILL E E, BURKE A C, HUFF M W. Citrus flavonoids as regulators of lipoprotein metabolism and atherosclerosis[J]. Annual Review of Nutrition, 2016, 36(1): 275-299. DOI:10.1146/annurevnutr-071715-050718.
[10] LI S M, PAN M H, LO C Y, et al. Chemistry and health effects of polymethoxyflavones and hydroxylated polymethoxyflavones[J].Journal of Functional Foods, 2009, 1(1): 2-12. DOI:10.1016/j.jff.2008.09.003.
[11] YEN J H, WENG C Y, LI S, et al. Citrus fl avonoid 5-demethylnobiletin suppresses scavenger receptor expression in THP-1 cells and alters lipid homeostasis in HepG2 liver cells[J]. Molecular Nutrition & Food Research, 2011, 55(5): 733-748. DOI:10.1002/mnfr.201000226.
[12] ASSINI J M, MULVIHILL E E, HUFF M W. Citrus fl avonoids and lipid metabolism[J]. Current Opinion in Lipidology, 2013, 24(1): 34-40. DOI:10.1097/MOL.0b013e32835c07fd.
[13] LAI C S, HO M H, TSAI M L, et al. Suppression of adipogenesis and obesity in high-fat induced mouse model by hydroxylated polymethoxyf l avones[J]. Journal of Agricultural and Food Chemistry,2013, 61(43): 10320-10328. DOI:10.1021/jf402257t.
[14] GUO Jingjing, TAO Hanlin, CAO Yong, et al. Prevention of obesity and type 2 diabetes with aged citrus peel (Chenpi) extract[J]. Journal of Agricultural and Food Chemistry, 2016, 64(10): 2053-2061.DOI:10.1021/acs.jafc.5b06157.
[15] MANTHEY J A, CESAR T B, JACKSON E, et al. Pharmacokinetic study of nobiletin and tangeretin in rat serum by high-performance liquid chromatography-electrospray ionization-mass spectrometry[J].Journal of Agricultural and Food Chemistry, 2011, 59(1): 145-151.DOI:10.1021/jf1033224.
[16] CHEN C, ONO M, TAKESHIMA M, et al. Antiproliferative and apoptosis-inducing activity of nobiletin against three subtypes of human breast cancer cell lines[J]. Anticancer Research, 2014, 34(4): 1785-1792.
[17] 邱培菊. 5-羟基多甲氧基黄酮抗结肠癌活性及其分子机制研究[D].青岛: 中国海洋大学, 2010: 3-6.
[18] ZHANG L, ZHANG X J, ZHANG C, et al. Nobiletin promotes antioxidant and anti-inflammatory responses and elicits protection against ischemic stroke in vivo[J]. Brain Research, 2016, 1636: 130-141. DOI:10.1016/j.brainres.2016.02.013.
[19] WHITMAN S C, KUROWSKA E M, MANTHEY J A, et al. Nobiletin,a citrus fl avonoid isolated from tangerines, selectively inhibits class a scavenger receptor-mediated metabolism of acetylated LDL by mouse macrophages[J]. Atherosclerosis, 2005, 178(1): 25-32. DOI:10.1016/j.atherosclerosis.2004.07.034.
[20] 单杨, 李高阳, 李忠海. 柑橘皮中多甲氧基黄酮的体外抗氧化活性研究[J]. 食品科学, 2007, 28(8): 100-103. DOI:10.3321/j.issn:1002-6630.2007.08.020.
[21] 战芳珍, 吴思群. 脂肪肝与体重指数、血脂的相关分析[J]. 中国水电医学, 2007(2): 87-88. DOI:10.1192/bjp.bp.109.070441.
[22] 阎明, 吕瑞娟, 贾晓青, 等. 两种调脂药物对高脂血症性脂肪肝治疗的实验性研究[J]. 中华肝脏病杂志, 2001, 9(6): 355-357.DOI:10.3760/j.issn:1007-3418.2001.06.013.
[23] MANCINI F P, LANNI A, SABATINO L, et al. Fenof i brate prevents and reduces body weight gain and adiposity in diet-induced obese rats[J]. FEBS Letters, 2001, 491(1/2): 154-158. DOI:10.1016/S0014-5793(01)02146-9.
[24] 何文森, 司晓静, 王慧慧, 等. 二十八烷醇调节大鼠脂质代谢的研究[J]. 现代食品科技, 2016, 32(10): 28-33. DOI:10.13982/j.mfst.1673-9078.2016.10.005.
[25] LEE Y S, ASAI M, CHOI S S, et al. Nobiletin prevents body weight gain and bone loss in ovariectomized C57BL/6J mice[J].Pharmacology & Pharmacy, 2014, 5(10): 959-965. DOI:10.4236/pp.2014.510108.
[26] MULVIHILL E E, HUFF M W. Protection from metabolic dysregulation, obesity, and atherosclerosis by citrus flavonoids:activation of hepatic PGC1 alpha-mediated fatty acid oxidation[J].PPAR Research, 2012, 2012: 1-9. DOI:10.1155/2012/857142.
[27] LIN Yuguang, VERMEER M A, BOS W, et al. Molecular structures of citrus flavonoids determine their effects on lipid metabolism in HepG2 cells by primarily suppressing ApoB secretion[J]. Journal of Agricultural and Food Chemistry, 2011, 59(9): 4496-4503.DOI:10.1021/jf1044475.
[28] SAITO T, ABE D, SEKIYA K. Nobiletin enhances differentiation and lipolysis of 3T3-L1 adipocytes[J]. Biochemical and Biophysical Research Communications, 2007, 357(2): 371-376. DOI:10.1016/j.bbrc.2007.03.169.
[29] YOSHIGAI E, MACHIDA T, OKUYAMA T, et al. Citrus nobiletin suppresses inducible nitric oxide synthase gene expression in interleukin-1 beta-treated hepatocytes[J]. Biochemical and Biophysical Research Communications, 2013, 439(1): 54-59. DOI:10.1016/j.bbrc.2013.08.029.
[30] 吕瑞娟, 任登先, 闫明. 脂肪肝的发病机理和治疗研究进展[J]. 甘肃科学学报, 2001, 13(2): 57-64. DOI:10.3969/j.issn.1004-0366.2001.02.015.
Hypolipidemic and Anti-Obesity Effect of Nobiletin and Its Role in Prevention of Fatty Liver in High Fat Diet-Fed Rats
FENG Konglong1,2, ZHU Xiaoai1,2, CHEN Tong1,2, PENG Bo1,2, ZHANG Liqun3, DAI Weijie1,2, LIU Xin1,2,CAO Yong1,2,*, CHEN Yunjiao1,2,*
(1. College of Food Science, South China Agricultural University, Guangzhou 510642, China;2. Guangdong Engineering Research Center of Natural Active Substance, Guangzhou 510642, China;3. College of Fundamental Medical Science, Guangzhou University of Traditional Chinese Medicine, Guangzhou 510006, China)
Objective: The effect of nobiletin on the body weight, serum lipids and liver of rats exposed to a high-fat diet were investigated. Methods: Totally 56 male SD rats were randomly divided into seven groups: normal control group, highfat diet control group, positive control groups (orlistat and fenof i brate), and low-, middle- and high-dose nobiletin groups(high-fat diet + 0.02%、0.04%、0.08% nobiletin). The rats in the normal control group were fed normal diet, while the remaining groups were fed high-fat diet plus the corresponding drugs for six weeks. Then serum lipid parameters, body weight, body fat weight, organ weight to body weight ratios and liver histopathology were examined. Results: Nobiletin could inhibit body weight gain induced by high-fat diet in rats, reduce Lee’s index, food utilization rate and fat to body weight ratio, and decrease serum total cholesterol (TC), triglyceride (TG), and low-density lipoprotein cholesterol (LDL-C)levels with the fastest rate of decrease being observed for TG. Compared with the high-fat control group, liver index and serum glutamic oxalacetic transaminase (AST) and alanine transaminase (ALT) activities in the nobiletin treatment groups were decreased, and fatty degeneration of the liver was improved. Conclusion: Nobiletin can reduce serum lipids and prevent obesity and fatty liver.
nobiletin; high-fat diet; rats; obesity prevention; hypolipidemic; prevention of fatty liver
10.7506/spkx1002-6630-201801032
R151.1
A
1002-6630(2018)01-0213-08
2016-10-20
广东省天然活性物工程技术研究中心项目(2016B090920093);广东省教育厅科研项目(2013gjhz0003);广东省自然科学基金博士启动项目(2015A030310118)
冯孔龙(1992—),男,硕士研究生,研究方向为食品科学。E-mail:fkonglong@163.com
*通信作者简介:曹庸(1966—),男,教授,博士,研究方向为食品化学与营养。E-mail:caoyong2181@scau.edu.cn
陈运娇(1984—),女,讲师,博士,研究方向为食品化学与营养。E-mail:yunjiaochen@scau.edu.cn
冯孔龙, 朱晓艾, 陈彤, 等. 川陈皮素对高脂膳食诱导大鼠的降脂减肥及预防脂肪肝形成作用[J]. 食品科学, 2018, 39(1):213-220.
10.7506/spkx1002-6630-201801032. http://www.spkx.net.cn
FENG Konglong, ZHU Xiaoai, CHEN Tong, et al. Hypolipidemic and anti-obesity effect of nobiletin and its role in prevention of fatty liver in high fat diet-fed rats[J]. Food Science, 2018, 39(1): 213-220. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201801032. http://www.spkx.net.cn

