山慈菇多糖的提取及其抗氧化作用的研究
房宇坤,宁安红,刘 磊,钟民涛,周绍正,黄 敏
(大连医科大学 基础医学院 微生物教研室,辽宁 大连 116044)
论著
山慈菇多糖的提取及其抗氧化作用的研究
房宇坤,宁安红,刘 磊,钟民涛,周绍正,黄 敏
(大连医科大学 基础医学院 微生物教研室,辽宁 大连 116044)
目的提取山慈菇多糖,测定其总糖含量并对其体外抗氧化能力进行初步研究。方法采用热水浸提法提取山慈菇多糖,并通过脱蛋白,醇沉等方法分离纯化山慈菇多糖。采用苯酚-硫酸法测定山慈菇多糖的含量。通过邻苯三酚自氧化法、Fenton法和DPPH法测定山慈菇多糖溶液及对照组VC溶液在浓度分别为0.5 mg/mL,1 mg/mL,2 mg/mL,4 mg/mL时对超氧阴离子、DPPH自由基及羟自由基的清除率。结果苯酚-硫酸法测得分离纯化后的山慈菇多糖的浓度为30 mg/mL。山慈菇多糖溶液及VC清除超氧阴离子,DPPH自由基及羟自由基的效率随浓度的增加而增强,两组内差异具有显著性意义(P<0.05,P<0.001)。结论山慈菇多糖在体外具有明显清除超氧阴离子、羟自由基和DPPH自由基的作用,并且在体外的抗氧化作用均随其浓度的增大而增大。
山慈菇多糖;多糖含量的测定;体外抗氧化
山慈菇,为兰科植物杜鹃兰、独蒜兰或云南独蒜兰的干燥假鳞茎。习称“冰球子”,别名还有金灯、朱姑、鹿蹄草等。山慈菇味甘、微辛,性凉。具有清热解毒,消痈散结等功效,常用于痈肿疔毒,瘰疬痰核,蛇虫咬伤,瘸瘕痞块。中医临床上常与其它药物作为配伍治疗癌症[1]。据文献报道,山慈菇的提取液可以对小鼠4T1乳腺癌细胞有明显的抑制作用[2]。而且山慈菇提取物具有明显的抑制血管生成的作用[3]。除此之外山慈菇多糖可能是通过诱导荷瘤鼠脾细胞分泌TNFα和IL-2等细胞因子,从而抑制移植性肝癌H22的生长[4]。
越来越多的研究显示抗氧化是预防衰老的重要步骤,因为自由基或氧化剂会将细胞和组织分解,影响代谢功能,会引起不同的健康问题。例如常见的癌症、动脉硬化、糖尿病、白内障、心血管病、老年痴呆、关节炎等,这些疾病都被认为与自由基相关。如果能够消除过多的氧化自由基,对于许多自由基引起的及老化相关疾病都能够预防。同时,许多人工合成的抗氧化食品添加剂例如丁基羟基茴香醚(BHA),丁化羟基甲苯(BHT)等毒性较大。所以,国内外对研究和开发天然抗氧化剂十分重视。由于中药多糖对机体的毒副作用小,并具有增强免疫力等独特的药理作用,成为中草药抗氧化成分的研究和新的发展方向。但是目前有关山慈菇多糖的提取以及山慈菇多糖的体外抗氧化作用的研究作者未见文献报道。本研究通过提取山慈菇的多糖并测定山慈菇多糖的含量,并在体外测定其抗氧化能力,为山慈菇的用药和开发提供重要的理论依据。
1 材料和方法
1.1 主要材料与试剂
山慈菇原料:购于百信大药房 南京鹿江中药饮片厂(产地:贵州,批号:391101,日期:2016年4月18日,自然晒干),DPPH (1,1-二苯基-2-三硝基苯肼,coolaber);三氯乙酸、VC(抗坏血酸coolaber)、邻苯三酚(焦性没食子酸)、D-无水葡萄糖、苯酚、浓硫酸、硫酸亚铁、过氧化氢、水杨酸、无水乙醇、石油醚、丙酮、无水乙醚等均为国产分析纯。
1.2 主要仪器与设备
723紫外-可见分光光度计(上海菁华科学技术仪器有限公司);DU215CD电子分析天平(梅特勒-托利多);酶标仪(Thermo设备有限公司);RE-10/20L旋转蒸发器(上海况胜实业有限公司),HH数显恒温水浴锅(国华电器有限公司)、超纯水机(Thermo设备有限公司)、XFB-500粉碎机(吉首市中诚制药器械厂)、低温冷冻离心机(Eppendorf 5810R);数显电热培养箱HPX-9082 MBE(上海博讯实业有限公司);真空冷冻干燥机FD-1-50(北京博医康实验仪器有限公司)。
1.3 实验方法
1.3.1 山慈菇多糖的提取
自然干燥后的山慈菇25 g粉碎,过40目筛,按1∶15固液比,水浴温度100 ℃、浸提时间2 h、热水浴中回流浸提3次,冷却后过滤,合并上清液;上清液减压浓缩至约150 mL后,加入等体积的10%三氯乙酸除蛋白[5],离心20 min后取上清,加入一定体积95%乙醇[6],使其终浓度为75%进行沉淀,所得沉淀依次用无水乙醇、丙酮洗涤,真空冷冻干燥后得粗多糖样品粉末。
1.3.2 总糖含量的测定
苯酚-硫酸比色法[7]测定总糖含量,其测定原理是:多糖或寡糖被浓硫酸在适当高温下水解可以产生单糖,并迅速脱水成糠醛衍生物,该衍生物在强酸条件下与苯酚起显色反应生成橙色物质,在波长490 nm处和一定浓度范围内,其吸光度Y值与糖浓度X呈线性关系[8],测得的标准曲线如图1。
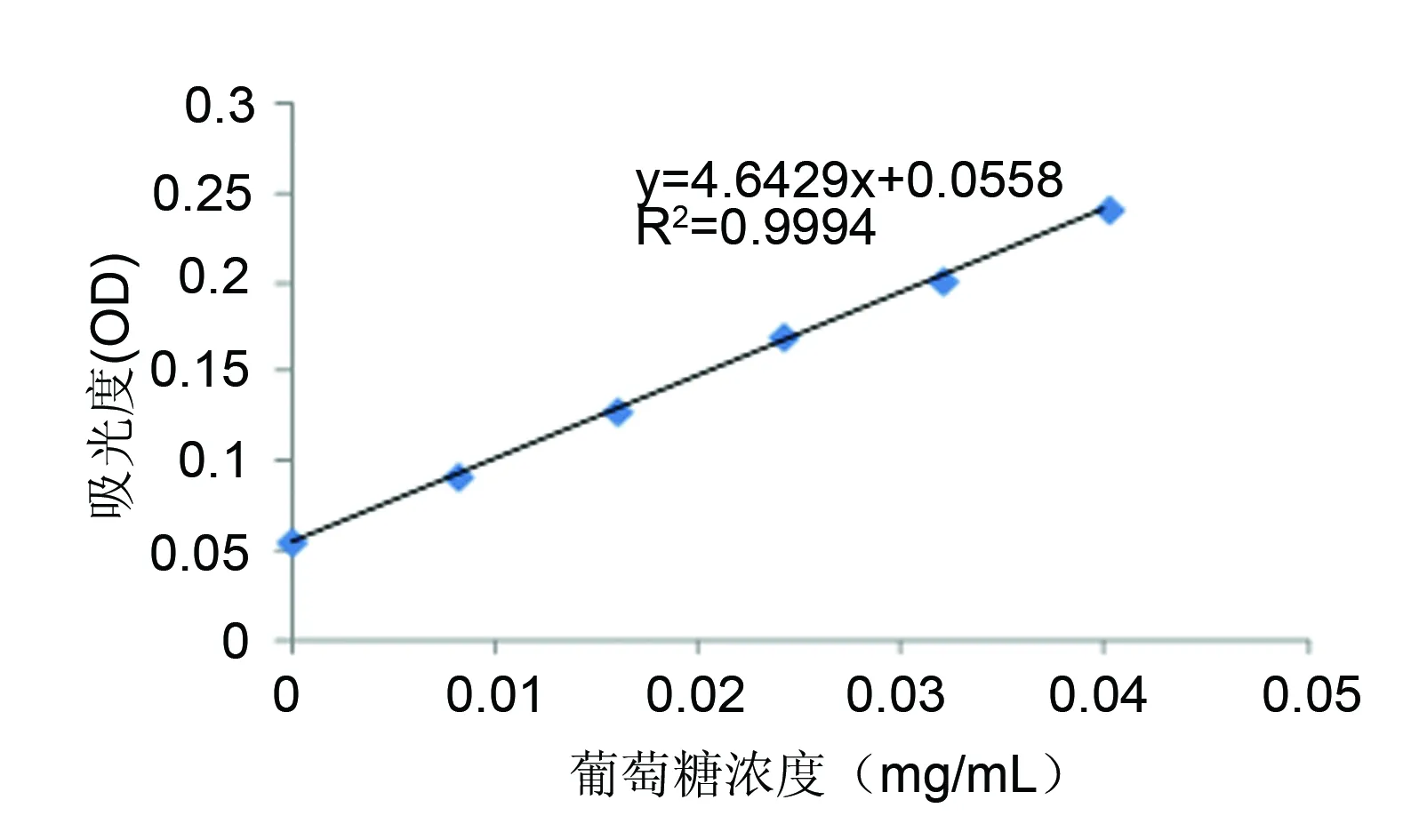
图1 葡萄糖标品标准曲线Fig 1 Standard curve of glucose
1.3.3 对超氧阴离子自由基(O2-)清除率的测定(邻苯三酚法)[9]
配制50 mmol·L-1的Tris-HCl 缓冲溶液(pH=8.2)25 ℃水浴20 min后,加入不同浓度的山慈菇多糖溶液(0.5 mg/mL,1 mg/mL,2 mg/mL,4 mg/mL),同时以相同浓度及剂量抗坏血酸作对照组。再加入0.4 mL浓度为7 mmol·L-1的邻苯三酚,反应4 min 后加入10 mmol·L-1的HCl 溶液1.00 mL 终止反应,以蒸馏水为参比液,在320 nm 处测吸光度值,A1为样品加入缓冲溶液及邻苯三酚后的吸光度;A2为样品加入缓冲溶液后的吸光度;A0为缓冲溶液加入邻苯三酚后的吸光度。实验重复3次。其清除率可用下列公式计算:
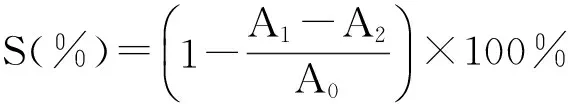
1.3.4 清除DPPH自由基的能力(DPPH法)[10]
称取DPPH粉末7.88 mg,配置成2×10-4mol·L-1DPPH工作液(无水乙醇为溶剂),置于棕色瓶备用。在干净的96孔板中,每孔分别加入180 μL的DPPH工作液,分别加入20 μL浓度为0.5 mg/mL,1 mg/mL,2 mg/mL,4 mg/mL的山慈菇多糖溶液和VC溶液,混匀;在37 ℃条件下反应30 min后,将96孔板放入酶标仪中于515 nm波长处检测样品吸光度(A1);取20 μL无水乙醇代替样品多糖溶液测得空白吸光度(A0);以180 μL无水乙醇代替DPPH溶液测得样品本来的吸光度(A2)。每个检测做4个复孔,取其平均值[11]。并以抗坏血酸溶液做对照。实验重复3次。清除率计算公式:
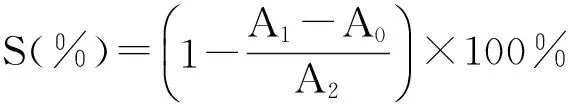
1.3.5 清除羟自由基的能力(Fenton法)[12]
在干净的96孔板中,依次加入50 μL 6 mmol·L-1FeSO4和50 μL 6 mmol·L-1的H2O2,混匀, 每孔分别加入50μL的不同浓度的山慈菇多糖溶液和VC溶液(0.5 mg/mL,1 mg/mL,2 mg/mL,4 mg/mL),静置10 min;然后加入50 μL 6 mmol·L-1的水杨酸,在37 ℃条件下反应30 min后,将96孔板放入酶标仪中于510 nm波长处检测样品吸光度(A1);取50 μL蒸馏水代替水杨酸测得吸光度(A0);以50 μL蒸馏水代替多糖样品溶液测得吸光度(A2)。每个检测做4个复孔,取其平均值[13]。并以同等浓度的抗坏血酸(VC)溶液做对照。实验重复3次。清除率计算公式:
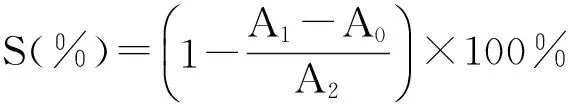
1.4 统计学方法
采用SPSS16.0进行数据处理及其统计分析,数据均以均值±标准差表示,两组间的比较采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 山慈菇多糖的含量
依照1.3.2的方法,测得山慈菇多糖一定浓度溶液吸光值,代入标准曲线方程中,计算得出山慈菇多糖的浓度为30 mg/mL。
2.2 山慈菇多糖清除超氧阴离子能力的测定
山慈菇多糖溶液及VC清除超氧阴离子的效率随浓度的增加而增强,两组内差异具有显著性意义(P<0.05,P<0.001)。在多糖溶液浓度为4 mg/mL,清除率达到50%,而同等浓度的VC组清除率为73%;浓度越低,山慈菇多糖的清除率和相对的VC清除率相差减少,在最低浓度0.5 mg/mL时,山慈菇多糖的清除率为15%而VC的清除率为18%。见图2。
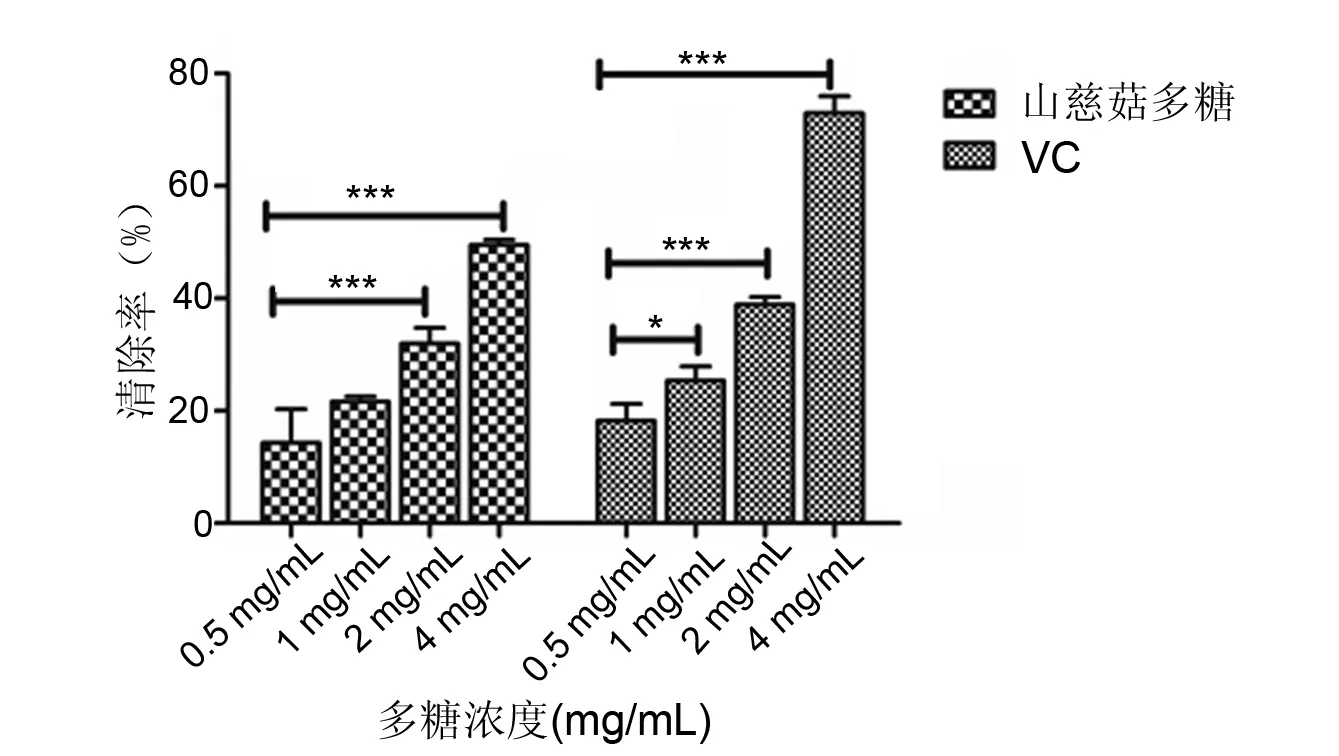
*P<0.05,***P<0.001图2 山慈菇多糖清除超氧阴离子的能力Fig 2 Scavenging effect of polysaccharides from Rhizoma Pleionis to superoxide anion radicals
2.3 山慈菇多糖清除DPPH自由基的能力
山慈菇多糖溶液及VC清除DPPH自由基的效率随浓度的增加而增强,两组内差异具有显著性意义(P<0.05,P<0.001)。同浓度下,山慈菇多糖没有抗坏血酸(VC)的清除率高。在多糖溶液浓度为4 mg/mL,清除率为45.8%,而同等浓度的VC组清除率为71.6%。见图3。
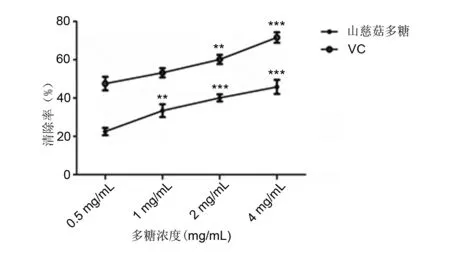
与多糖浓度0.5 mg/mL相比,**P<0.01,***P<0.001图3 山慈菇多糖对DPPH 自由基的清除作用Fig 3 Scavenging effect of polysaccharides from Rhizoma Pleionis to DPPH radicals
2.4 山慈菇多糖清除羟自由基的能力
山慈菇多糖溶液及VC清除羟自由基(·OH)的效率随浓度的增加而增强,两组内差异具有显著性意义(P<0.05,P<0.001)。1 mg/mL、2 mg/mL及4 mg/mL浓度下,山慈菇多糖没有VC的清除率高。浓度为0.5 mg/mL时,山慈菇多糖对羟自由基的清除能力(52.7%)明显高于VC(29.3%)。见图4。
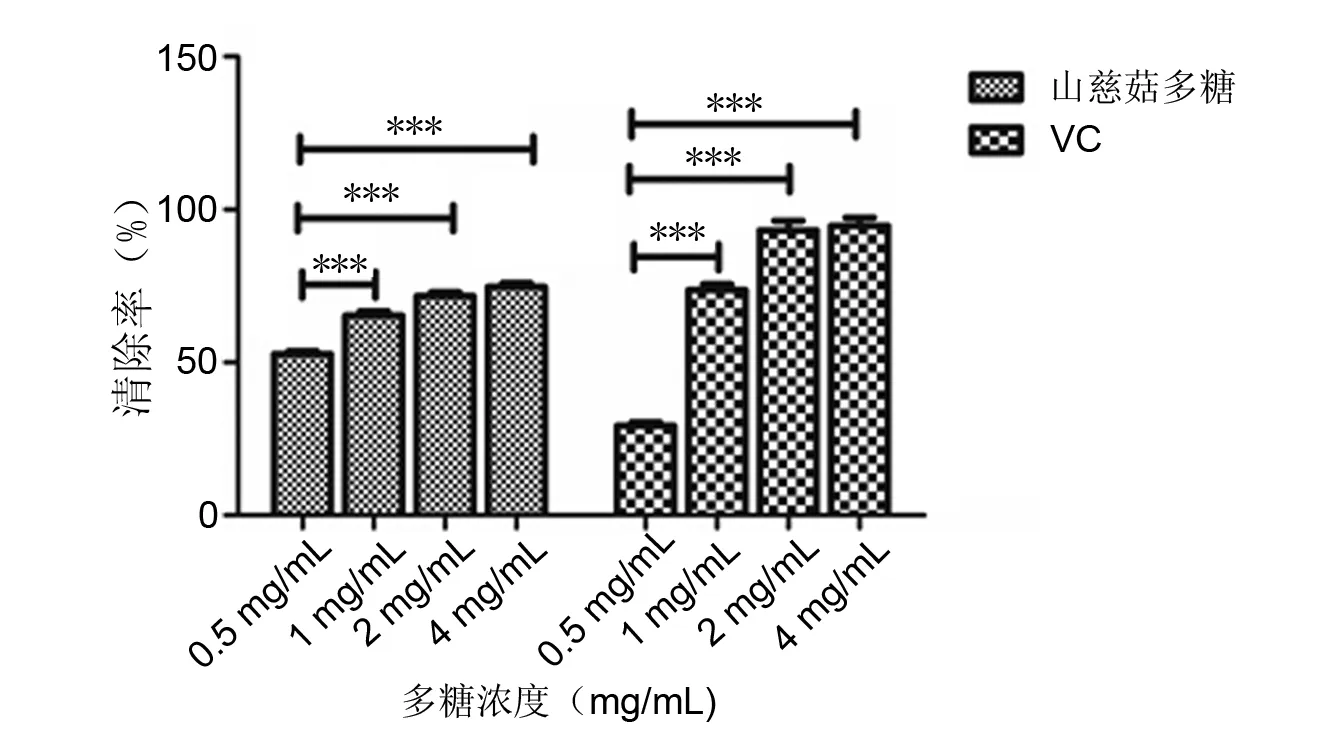
***P<0.001图4 山慈菇多糖对羟自由基的清除作用Fig 4 Scavenging effect of polysaccharides from Rhizoma Pleionis to hydroxyl radicals
3 讨 论
人体因为与外界的持续接触,包括呼吸(氧化反应)、外界污染、放射线照射等因素不断的在人体体内产生自由基[14]。人体在不可避免地产生自由基的同时,也在自然产生着抵抗自由基的抗氧化物质,以抵消自由基对人体细胞的氧化攻击。当人体内氧化与抗氧化作用失衡,倾向于氧化时,便会在机体内产生氧化应激[15]。由氧化应激水平升高诱发的最常见疾病有心脏病、癌症、骨关节炎、风湿性关节炎、糖尿病以及神经退化性问题如阿尔兹海默症[16]、帕金森病。所以选择有利于人体健康并且抗氧化效果好的有效成分已经成为现在研究的热点。中药多糖是近些年被研究证明具有免疫调节,抗氧化,抗炎,抗肿瘤,抗辐射,抗病毒,降血脂,降血糖等多种功能。许多中药多糖被研究证明具有良好的抗氧化作用。比如灵芝多糖在体内能够通过提高CAT(过氧化氢酶)的活性,降低LPO(过氧化脂质)和MDA(丙二醛)的含量起到抗氧化的作用[17]。近年来,研究表明中药复方多糖有明显的抗氧化作用[18],而且一些研究结果显示中药复方多糖组分间具有协同的作用[19],从而提高了中药复方多糖的抗氧化能力。
本实验通过实验室提取制备山慈菇多糖,测定其总糖含量。在温度100 ℃、固液比1∶15、时间2 h及提取次数3次的工艺条件提取后,用苯酚-硫酸比色法测定山慈菇总糖浓度为30 mg/mL。并通过邻苯三酚自氧化法,DPPH和Fenton法来共同测定山慈菇多糖的体外抗氧化作用,其中Fenton体系代表了水溶性自由基体系,而DPPH代表了脂溶性自由基体系;实验结果表明山慈菇多糖溶液清除超氧阴离子,DPPH自由基的清除率虽然没有同等浓度下的VC的清除率强,但是仍然有较明显的清除作用,并随着多糖浓度的增加,清除能力增强。而且,在清除羟自由基的实验中,山慈菇多糖高浓度虽然没有抗坏血酸对羟自由基的清除作用明显,但是在浓度为0.5 mg/mL时,山慈菇多糖对羟自由基的清除能力高于VC,这表明低浓度的山慈菇多糖溶液仍然具有很强的羟自由基的清除能力。另外,山慈菇多糖对超氧阴离子,羟自由基,DPPH自由基的清除率都具有明显的量效关系。
尽管,山慈菇多糖在同等浓度下的抗氧化作用效果不如VC,但是其抗氧化作用的发现仍然具有很重要的意义。众所周知,VC是人体的高效抗氧化剂,还有许多重要的生物合成过程中也需要VC参与作用。但是大量服用VC后突然停药会出现药物的戒断反应。而且肾功能较差,胃酸分泌异常的人也不宜多服用VC。山慈菇的抗氧化作用虽然没有VC的抗氧化作用强,但是山慈菇作为药食同源的野生植物,也常常与其它中药配伍使用,其多糖的副作用较小,这对多糖的抗氧化作用具有非常重要的营养及药理意义,对于开发山慈菇具有非常重要现实意义,但是其体内抗氧化能力有待进一步研究探明和确证其抗氧化作用和作用机制。
[1] 李劲, 邓志芳, 高雯琪, 等. 中药“龙泉复方”的不同配伍对肿瘤细胞系HepG-2和EC-1增殖的影响[J]. 中南民族大学学报(自然科学版), 2011, 30(1): 46-49.
[2] 刘银花, 钟世军, 曾涛, 等. 山慈菇提取液对小鼠4T1乳腺癌细胞抑制作用机制的研究[J]. 湖北农业科学, 2016(1): 134-137.
[3] 李余先, 杜刚, 官丽丽, 等. 山慈菇提取物抑制血管形成的药效学研究[J]. 吉林农业, 2015(11): 76-77.
[4] 徐小娟, 蔡懿鑫, 毛宇, 等. 山慈菇多糖对荷H22肝癌小鼠的抗肿瘤机制研究[J]. 食品研究与开发, 2015, 36(7): 23-25.
[5] Liang JR, Ai XX, Gao YH, et al. MALDI-TOF MS analysis of the extracellular polysaccharides released by the diatom Thalassiosira pseudonana[J]. J Appl Phycol, 2012, 25(2): 477-484.
[6] Du N, Tian W, Zheng D, et al. Extraction, purification and elicitor activities of polysaccharides from Chrysanthemum indicum[J]. Int J Biol Macromol, 2016, 82: 347-354.
[7] Wang Y, Jing Y, Leng F, et al. Establishment and Application of a Method for Rapid Determination of Total Sugar Content Based on Colorimetric Microplate[J]. Sugar Tech, 2016, 19(4): 424-431.
[8] 吴荣昆, 黄小流, 刘美金, 等. 井冈山马齿苋多糖的体外抗氧化作用及总糖含量测定[J]. 井冈山大学学报(自然科学版), 2016, 37(2): 102-106.
[9] Zhang QA, Wang X, Song Y, et al. Optimization of Pyrogallol Autoxidation Conditions and Its Application in Evaluation of Superoxide Anion Radical Scavenging Capacity for Four Antioxidants[J]. J AOAC Int, 2016, 99(2): 504-511.
[10] Wang N, Zhang Y, Wang X, et al. Antioxidant property of water-soluble polysaccharides from Poria cocos Wolf using different extraction methods[J]. Int J Biol Macromol, 2016, 83: 103-110.
[11] Grajeda-Iglesias C, Salas E, Barouh N, et al. Antioxidant activity of protocatechuates evaluated by DPPH, ORAC, and CAT methods[J]. Food Chem, 2016, 194: 749-757.
[12] Maja Kozarskia, Anita Klausb, Dragica Jakovljevicc, et al.Dietary polysaccharide extracts of Agaricus brasiliensis fruiting bodies: chemical characterization and bioactivities at different levels of purification[J]. Food Res Int,2014:53-64.
[13] 陈玲, 曹诗林, 李炳辉, 等. 知母多糖提取物生物活性的研究[J]. 辽宁中医杂志, 2013, 40(2): 309-312.
[14] Valko M, Jomova K, Rhodes CJ, et al. Redox-and non-redox-metal-induced formation of free radicals and their role in human disease[J]. Arch Toxicol, 2016, 90(1): 1-37.
[15] Phaniendra A, Jestadi DB, Periyasamy L. Free radicals: properties, sources, targets, and their implication in various diseases[J]. Indian J Clin Biochem, 2015, 30(1): 11-26.
[16] Wojtunik-Kulesza KA, Oniszczuk A, Oniszczuk T, et al. The influence of common free radicals and antioxidants on development of Alzheimer's Disease[J]. Biomed Pharmacother, 2016, 78: 39-49.
[17] Zhang J, Meng G, Zhai G, et al. Extraction, characterization and antioxidant activity of polysaccharides of spent mushroom compost of Ganoderma lucidum[J]. Int J Biol Macromol, 2016, 82: 432-439.
[18] 商云霞, 朱晓庆, 谷新利, 等. 中药复方多糖对鸡红细胞免疫功能和SOD活性的影响[J]. 江苏农业科学, 2015, 43(4): 214-217.
[19] 徐小芳, 罗燕, 赵民, 等. 中药复方多糖对鸡抗氧化功能的影响[J]. 中国农业科学, 2009, 42(2): 706-713.
ExtractionandantioxidantactivityofpolysaccharidesfromRhizomaPleionis
FANG Yukun, NING Anhong, LIU Lei, ZHONG Mintao, ZHOU Shaozheng, HUANG Min
(DepartmentofMicrobiology,DalianMedicalUniversity,Dalian116044,China)
ObjectiveTo extract polysaccharides from Rhizoma Pleionis and investigate its antioxidative activity in vitro.MethodsThe polysaccharides were extracted by hot water fromRhizomaPleionisand purified by phenol-sulfuric acid colorimetry. The antioxidative effects were determined by autoxidation of pyrogallol method,DPPH free radical scavenging assay and Fenton method. VC was used as a control with the concentration of 0.5, 1, 2 and 4 mg/mL.ResultsThe content of polysaccharide fromRhizomaPleioniswas 30 mg/mL. It had the function of removing superoxide anion radicals, DPPH free radicals and hydroxyl free radical. The scavenging effect enhanced with the increase of polysaccharide concentration. At the concentration of 0.5 mg/mL, the polysaccharide fromRhizomaPleionis’s capacity to scavenge hydroxyl free radical was higher than VC.ConclusionThe polysaccharides fromRhizomaPleioniscould have antioxidative effects by scavenging superoxide anion radicals, DPPH free radicals and hydroxyl free radicals.
polysaccharides fromRhizomaPleionis;polysaccharides of content determination;antioxidant activity in vitro
国家自然科学基金项目(30770018)
房宇坤(1991-),女,硕士研究生。E-mail:476796625@qq.com
黄 敏,教授。E-mail:huangminchao@163.com
10.11724/jdmu.2017.06.02
R73
A
1671-7295(2017)06-0527-05
房宇坤,宁安红,刘磊,等.山慈菇多糖的提取及其抗氧化作用的研究[J].大连医科大学学报,2017,39(6):527-531.
2017-08-24;
2017-11-11)

