强直性脊柱炎患者血清和关节液中IL-17、IL-4水平变化及意义
孟景红,赵海涛,陈海英
(河北医科大学第三医院,石家庄050051)
强直性脊柱炎患者血清和关节液中IL-17、IL-4水平变化及意义
孟景红,赵海涛,陈海英
(河北医科大学第三医院,石家庄050051)
目的探讨强直性脊柱炎(AS)患者血清和关节液中IL-17、IL-4水平变化及意义。方法选取初治AS患者42例(观察组),体检健康者20例(对照组)。采用ELISA法检测两组血清及观察组关节液IL-17、IL-4,计算IL-17/IL-4;采用Pearson相关分析法分析AS患者血清IL-17、IL-4、IL-17/IL-4与血小板数量、白细胞数量、红细胞沉降率(ESR)、CRP、Bath强直性脊柱炎病情活动指数(BASDAI)的相关性。结果观察组血清IL-17水平及IL-17/IL-4均高于对照组,血清IL-4水平低于对照组,组间比较P均<0.01。观察组关节液中IL-17、IL-4水平均高于血清(P均<0.01)。AS患者血清IL-17、IL-17/IL-4与血小板数量、ESR、CRP、BASDAI呈正相关(P<0.05或<0.01);IL-4与血小板数量、ESR、CRP、BASDAI呈负相关(P<0.05或<0.01);IL-17、IL-4、IL-17/IL-4与白细胞数量均无相关性(P均>0.05)。结论AS患者血清及关节液中均存在IL-17水平升高、IL-4水平降低、IL-17/IL-4失衡,检测IL-17、IL-4水平变化有助于了解AS病情程度、疾病活动度及判断患者预后。
强直性脊柱炎;白细胞介素17;白细胞介素4;血清;关节液
强直性脊柱炎(AS)是一种主要侵犯人体中轴骨关节系统及外周大关节的慢性进行性自身免疫性疾病,主要累及滑膜关节、软骨关节以及肌腱、韧带附着骨等部位,以骶髂关节炎为主要临床表现,致残率较高。目前认为,AS的发生与免疫系统失调、炎症反应、遗传等因素有关,但确切发病机制尚未阐明。IL-17是由辅助性T细胞17(Th17)产生的前炎症细胞因子,具有促进炎症反应的作用;IL-4是由Th2细胞分泌的细胞因子,可抑制细胞免疫、促进体液免疫。目前,关于IL-17、IL-4与AS发生、发展关系的报道较少。本研究探讨AS患者血清和关节液中IL-17、IL-4水平变化及意义。
1 资料与方法
1.1 临床资料 选取2015年10月~2016年6月我院收治的初治AS患者42例(观察组),诊断均符合1984年修订的AS纽约标准。其中男33例、女9例,年龄18~52(32.4±9.3)岁,病程0.25~40(18.2±8.0)年,均累及膝关节,白细胞数量[4~10(6.5±1.9)]×109/L,血小板数量[219~639(365.9±92.7)]×109/L,红细胞沉降率(ESR)10~122(55.4±27.8)mm/h,CRP 8~99(42.6±26.0)mg/L,Bath强直性脊柱炎病情活动指数(BASDAI)2~9(4.8±2.0)。排除其他免疫相关性疾病及严重心、肝、肾等疾病患者。选择同期体检健康者20例为对照组,男16例、女4例,年龄19~47(29.5±8.4)岁。两组性别、年龄具有可比性。
1.2 血清及关节液IL-17、IL-4检测 分别采集两组清晨空腹静脉血3 mL,室温静置20 min,3 000 r/min离心20 min,收集血清,置于-80 ℃冰箱保存待测;抽取AS患者膝关节内关节液5 mL,静置2 h,抽取上清液,置于-80 ℃冰箱保存待测。采用ELISA法检测血清及关节液IL-17、IL-4,具体步骤参照试剂盒(RD生物科学公司)说明书。计算IL-17/IL-4。
2 结果
2.1 血清和关节液IL-17、IL-4及IL-17/IL-4 观察组血清IL-17水平及IL-17/IL-4均高于对照组,血清IL-4水平均低于对照组,组间比较P均<0.01,见表1。观察组关节液IL-17、IL-4水平均高于血清(P均<0.01),见表2。

表1 两组血清IL-17、IL-4水平及IL-17/IL-4比较
注:与对照组比较,*P<0.01。

表2 观察组血清和关节液中IL-17、IL-4水平及IL-17/IL-4比较
注:与血清比较,*P<0.01。
2.2 AS患者血清IL-17、IL-4、IL-17/IL-4与白细胞数量血小板数量、ESR、CRP、BASDAI的相关性 AS患者血清IL-17、IL-17/IL-4与血小板数量、ESR、CRP、BASDAI均呈正相关(P<0.05或<0.01);IL-4与血小板数量、ESR、CRP、BASDAI均呈负相关(P<0.05或<0.01);IL-17、IL-4、IL-17/IL-4与白细胞数量均无相关性(P均>0.05)。见表3。
3 讨论
AS的主要发病机制可能是具有一定遗传背景的易感个体出现免疫功能紊乱,导致细胞因子网络失衡,开启瀑布式炎症反应,激活更为广泛的效应机制,最终导致关节破坏及修复的病理过程[1]。Th17、调节性T细胞(Treg)是除Th1、Th2细胞亚群外的另一对免疫调控细胞。IL-17是由Th17细胞产生的前炎症细胞因子,介导防御胞外病原微生物感染[2]。IL-4是由Th2细胞分泌的抗炎症细胞因子。研究发现,IL-17/IL-4失衡可能是关节炎的启动环节,纠正IL-17/IL-4失衡可能阻止疾病的进展[3]。
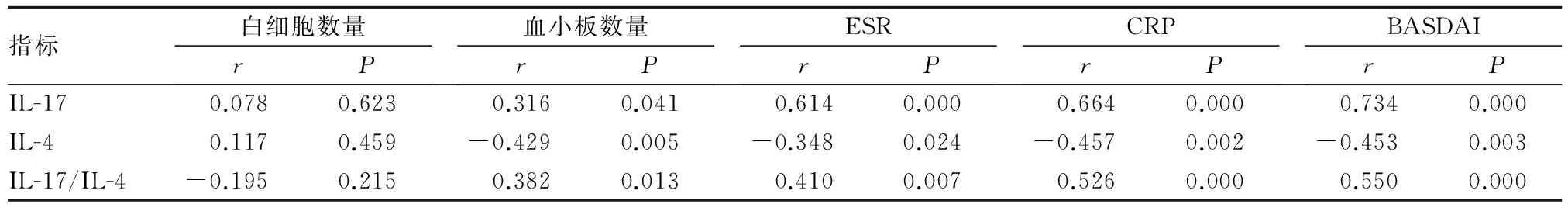
表3 AS患者血清IL-17、IL-4、IL-17/IL-4与白细胞数量血小板数量、ESR、CRP、BASDAI的相关性
IL-17与受体结合后被激活,促进趋化因子、集落刺激因子和黏附分子表达或释放,招募炎症细胞尤其是嗜中性粒细胞,刺激巨噬细胞产生IL-1β、TNF-α、IL-6和前列腺素E2(PGE2)等因子,诱导并促进炎症反应,导致细胞浸润和组织破坏,影响感染、肿瘤和自身免疫性疾病等病理过程[1]。研究发现,在系统性红斑狼疮、类风湿关节炎、银屑病、多发性硬化症及幼年特发性关节炎等多种自身免疫性疾病中IL-17水平均升高,参与上述疾病的发生、发展[4~6]。在自身免疫性疾病动物模型中,IL-17缺乏可阻止疾病发生;在实验性关节炎的发生过程中阻断IL-17表达,可以阻止关节及骨质破坏[7],提示IL-17是多种自身免疫病重要的致病因子,具有增强病理性免疫反应和促进炎症反应的作用。Mcinnes等[8]报道,IL-17可诱导破骨细胞生成,与破骨细胞IL-17受体结合,促进骨破坏的发生,在关节损伤中发挥重要作用。Koenders等[9]发现,在关节炎症发生的早期阶段,IL-17和TNF-α对炎症的发展及关节骨质的破坏具有协同诱导作用;但关节炎一旦发生,IL-17可以不依赖TNF-α而单独发挥促炎及破坏骨质的作用。IL-17是关节炎和骨质破坏发生的独立危险因素[10]。关节腔内持续注射IL-17可以促进关节炎的发生,其可能通过对病理性滑膜进行持续性的炎性刺激,并且激活滑膜细胞及炎性细胞的抗凋亡机制,从而使这些细胞聚集在关节腔,最终形成病理性损伤[10]。在动物关节炎病变组织局部分离出的单个核细胞高表达 IL-17,且病灶内IL-17表达量与疾病的严重程度密切相关[11]。
IL-4是由Th2细胞分泌的细胞因子,主要作用于B细胞、T细胞、巨噬细胞和肥大细胞等靶细胞,可抑制Th1和细胞毒T淋巴细胞(Tc1)增殖及产生细胞因子,抑制细胞免疫、促进体液免疫,增强杀伤细胞的特异性及非特异性杀伤功能[12]。IL-4能够抑制单核-巨噬细胞产生IL-1β、TNF-α、IL-8、PGE等,下调活化的单核-巨噬细胞分泌氧自由基[13]。随着IL-4水平逐渐降低,其抑制炎症反应的能力逐渐减弱,自身的免疫稳态遭到破坏,促进免疫相关性疾病的发生、发展。动物研究发现,抗IL-4抗体可使小鼠胶原诱导性关节炎加重,系统给予IL-4可阻止小鼠关节炎症进展及关节组织学改变,显著减轻急性关节炎症状。IL-4还可通过抑制损伤性蛋白酶-基质金属蛋白酶来降低关节损伤程度[14]。在胶原诱导性关节炎动物模型中通过腺病毒载体植入IL-4基因,可抑制炎性介质IL-6、IL-12、IL-17和滑膜骨蛋白原配体的产生,从而阻止软骨及骨质的破坏[15,16]。去除IL-4基因的小鼠关节炎程度明显加重[17]。但是,Wang等[18]研究发现,AS患者血清IL-4水平明显降低。上述研究结果提示,在免疫相关性关节炎的发病过程中IL-4可通过不同的机制阻止关节炎的发生及发展。在胶原诱导的关节炎发生初期,IL-4可通过T细胞抑制IL-17产生,进而减轻关节局部的炎症反应,但在疾病后期却不能发挥相似的作用[19,20]。
本研究结果显示,AS患者血清IL-17水平及IL-17/IL-4均较健康对照者明显升高,IL-4水平较健康对照者明显降低,提示IL-17促进AS发生,IL-4则抑制AS发病,IL-17/IL-4失衡促进关节炎的发生。上述结果与动物实验研究结果一致[21]。AS患者膝关节液中IL-17水平高于血清,且本研究AS患者病变均累及膝关节,提示IL-17在关节病变和骨质破坏中可能占据更重要的地位;关节液中IL-4水平高于其血清水平,提示在关节炎发生时IL-4有向关节炎症部位聚集的倾向,以恢复局部IL-17/IL-4平衡,控制局部炎症反应。血小板数量、ESR、CRP、BASDAI均为评价AS患者病情程度、疾病活动度及预后的指标。AS患者血清IL-17水平均与血小板数量、ESR、CRP、BASDAI呈正相关,IL-4与血小板数量、ESR、CRP、BASDAI呈负相关,提示血清IL-17、IL-4水平可以反映AS疾病活动度,检测二者水平有助于判断患者预后。血清IL-17、IL-4水平均与白细胞数量无相关性,可能与白细胞数量受多种因素影响有关。
综上所述,AS患者血清及关节液中均存在IL-17水平升高、IL-4水平降低、IL-17/IL-4失衡,检测IL-17、IL-4水平变化有助于了解AS病情程度、疾病活动度及判断患者预后。
[1] Harrington LE, Mangan PR, Weaver CT, et al. Expanding the effector CD4 T-cell repertoire: the Th17 lineage[J]. Curr Opin immunol, 2006,3(18):349-356.
[2] Lubberts E. Th17 cytokines and arthritis[J]. Semin Immunopathol, 2010,32(1):43-53.
[3] Lowesl MA, Kikuchil T, Fuentes-Duculanl J, et al. Psoriasis vulgaris lesions contain discrete populations of Th1 and Th17 T cells[J]. J Invest Dermatol, 2008,5(128):1207-1211.
[4] 武树朋.血清GM-CSF、TNF-α及IL-17在类风湿关节炎中的表达及相关性[J].中华风湿病学杂志,2017,12(37):3041-3042.
[5] 白雪,高美华,王好玉等.TH17细胞相关细胞因子IL-17和IL-23在系统性红斑狼疮中的表达及其意义[J].现代生物医学进展,2013,10(13):1937-1940.
[6] Agarwal S, Misra R, Aggarwal A. Interleukin 17 levels are increased in juvenile idiopathic arthritis synovial fluid and induce synovial fibroblasts to produce proinflammatory cytokines and matrix metalloproteinases[J]. J Rheumatol, 2008,3(35):515-519.
[7] Koenders MI, Lubberts E, Opper Walgreen B, et al. Blocking of
IL-17 during reactivation of experimental arthritis prevent joint inflammation and bone erosion by decreasing RANKL and IL-1[J]. Am J Pathol, 2005,167(1):141-149.
[8] Mcinnes IB, Liew FY. Cytokine networks-towards new therapies for rheumatoid arthritis[J]. Nat Rev Rhrumatol, 2005,1(1):31-39.
[9] Koenders MI, Lubberts E, Van de Loo FA, et al. Interleukin-17 acts independently of TNF-alpha under arthritic conditions[J]. J Immunol, 2006,176(10):626-629.
[10] Benedetti G, Miossec P. Interleukin 17 contributes to the chronicity of inflammatory diseases such as rheumatoid arthritis[J]. Eur J Immunol, 2014,2(44):339-347.
[11] Lubberts E. IL-17/Th17 targeting: on the road to prevent chronic destructive arthritis[J]. Cytokine, 2008,41(2):84-91.
[12] 刘秀娟,黄胜起,王阿妮,等.白细胞介素-17与细胞核因子-κB受体活化因子配体在强直性脊柱炎患者血清中表达的研究[J].中华风湿病学杂志,2013,11(17):769-771.
[13] Chen WS, Chang YS, Lin KC, et al. Association of serum interleukin-17 and interleukin-23 leves with disease activity in Chinese patients with ankylosing spondylitis[J]. J Chin Med Assoc, 2012,75(7):303-308.
[14] Sarah EW, Danielle D, Taher E, et al. Targeted delivery of cytokine therapy to rheumatoid tissue by a synovial targeting peptide[J]. Ann Rheum Dis, 2013,1(72):129-135.
[15] Lubberts E, Joosten LA, van Den Bersselaar L, et al. Adenoviral vector-mediated overexpression of IL-4 in the knee joint of mice with collagen-induced arthritis prevents cartilage destruction[J]. J Immunol, 1999,163(8):4546-4556.
[16] Joosten LA, Lubberts E, Helsen MM, et al. Protection against cartilage and bone destruction by systemic interleukin-4 treatment in established murine type Ⅱ collagen-induced arthritis[J]. Arthritis Res, 1999,1(1):1.
[17] CaoY, Brombacher F, Tunyoqi-Csapo M, et al. Interleukin-4 regulates proteoglycan-induced arthritis by specifically suppressing the innate immune response[J]. Arthritis Rheum, 2007,3(56):861-870.
[18] Wang J, Zhao Q, Wang G, et al. Circulating levels of Th1 and Th2 chemokines in patients with ankylosing spondylitis[J]. Cytokine, 2016(81):4-10.
[19] Morita Y, Yang J, Gupta R, et al. Dendritic cells genetically engineered to express IL-4 inhibit murine collagen-induced arthritis[J]. J Clin Invest, 2001,107(10):1275-1284.
[20] Sarkar S, Tesmer LA, Hindnavis V, et al. Interleukin-17 as a molecular target in immune-mediated arthritis: immunoregulatory properties of genetically modifed murine dendritic cells that secrete interleukin-4[J]. Arthritis Rheum, 2007,56(1):89-100.
[21] Miossec P, Kolls JK. Targeting IL-17 and T (H)17 cells in chronic inflammation[J]. Nat Rev Drug Discov, 2012,10(11):763-776.
河北省医学科学研究重点课题计划(20130222)。
赵海涛(E-mail: 38558956@qq.com)
10.3969/j.issn.1002-266X.2017.48.016
R593.23
B
1002-266X(2017)48-0051-03
2017-07-12)

