17β-雌二醇诱导大鼠形成垂体泌乳素瘤的可行性及其成瘤机制
何乐,王红云,高华,李艳博,曹磊
(1北京市神经外科研究所,北京100050;2首都医科大学;3首都医科大学附属北京天坛医院)
17β-雌二醇诱导大鼠形成垂体泌乳素瘤的可行性及其成瘤机制
何乐1,王红云1,高华1,李艳博2,曹磊3
(1北京市神经外科研究所,北京100050;2首都医科大学;3首都医科大学附属北京天坛医院)
目的探讨持续皮下给予17β-雌二醇建立大鼠垂体泌乳素瘤模型的可行性及作用机制。方法将20只雌性F344大鼠行双侧卵巢去势,1周后随机分为正常对照组10只、雌二醇组10只。雌二醇组皮下植入含有10 mg 17β-雌二醇的渗透压泵6周制备垂体泌乳素腺瘤模型,MRI显示成瘤率为100%。将雌二醇组10只成瘤大鼠随机分为氟维司群组5只,肌注氟维司群(20 mg/kg);模型组5只,肌注等量溶媒。处理2周结束时,留取血清标本;采用ELISA试剂盒检测血清泌乳素水平;测量靶区组织标本(模型组和氟维司群组均为包含肿瘤组织的垂体,正常对照组为垂体)体积并称质量;取靶区组织标本,分别行HE染色、网状纤维染色、泌乳素免疫荧光染色、透射电镜观察病理学变化;采用荧光定量PCR技术和Western blotting法检测靶区组织雌激素受体R(ER α)、WIF-1、β-catenin mRNA和蛋白表达。结果模型组血清泌乳素水平均高于正常对照组及氟维司群组(P均<0.01)。模型组鞍区组织体积和质量均高于正常对照组和氟维司群组(P均<0.01)。模型组:HE染色显示,垂体细胞的“巢样”排列结构消失,细胞呈无序排列,胞质呈嗜酸性;网状纤维染色可见网状纤维因肿瘤过度生长致明显断裂破坏;免疫荧光显示肿瘤细胞胞质内可见大量泌乳素阳性颗粒分布;电镜下显示肿瘤组织内有大量泌乳素型细胞,可见泌乳素细胞特异性的“错位胞吐”现象。氟维司群组上述病理变化均较模型组减轻。模型组ERα mRNA和蛋白相对表达量均较正常对照组降低、均较氟维司群组升高,WIF-1 mRNA和蛋白相对表达量均较正常对照组及氟维司群组降低,β-catenin mRNA和蛋白相对表达量均较正常对照组及氟维司群组升高,组间比较P<0.05或<0.01。结论持续皮下给予17β-雌二醇6周能够诱导F344大鼠形成垂体泌乳素瘤,成瘤率达100%;其成瘤机制可能为17β-雌二醇作用于ERα,诱导Wnt/β-catenin通路因子WIF-1表达下调、β-catenin表达上调。
垂体泌乳素瘤;17β-雌二醇;雌激素受体α;Wnt/β-catenin通路;大鼠
垂体泌乳素瘤是最常见的功能性垂体腺瘤,约占垂体腺瘤的40%[1]。垂体腺瘤的发病机制研究在体外主要依赖垂体瘤细胞系,如大鼠MMQ细胞系、GH3细胞系等;在体内因人体试验涉及医学伦理报批等问题无法直接进行,需建立垂体瘤动物模型,通过动物实验为人体研究提供实验依据。有研究报道,多巴胺D2受体(D2R)、多发性内分泌腺瘤致病因子1(MEN1)等基因敲除小鼠可自发诱导泌乳素瘤的形成;但上述模型不稳定,成瘤缓慢,且费用较高[2~4]。有文献报道,长期服用雌激素的变性人群泌乳素瘤发生率显著高于普通人群[5]。本课题组前期研究发现,雌激素受体(ER)在人类泌乳素瘤的形成过程中发挥关键作用,且Wnt通路可能参与了肿瘤形成[6]。2015年1月~2016年2月,我们采用17β-雌二醇诱导F344大鼠构建垂体泌乳素瘤模型,现探讨其成瘤机制。
1 材料与方法
1.1 材料 4周龄雌性F344大鼠20只,体质量(60±10)g,SPF级,购于北京维通利华实验动物中心,自由进食、饮水,光照时间12 h。主要试剂及仪器:渗透压泵(Sigma aldrich),氟维司群(单纯雌激素受体拮抗剂)、17β-雌二醇(EDOM),HE染色和网状纤维染色试剂盒(北京中衫金桥生物技术有限公司), 泌乳素ELISA试剂盒(RapidBio),兔抗大鼠ERα、WIF-1、β-catenin抗体(Santa Cruz)。
1.2 动物分组及处理 20只大鼠行双侧卵巢去势,1周后随机分为正常对照组10只、雌二醇组10只。雌二醇组皮下植入含10 mg 17β-雌二醇的渗透压泵,正常对照组皮下植入含有溶媒的渗透压泵。模型制作过程中,每周进行MRI检查(7.0-T Bruker小动物MRI)扫描监测成瘤情况。采用T2-加权成像序列矢冠轴位扫描,具体序列参数:TR/TE 2 000/41 ms;矩阵240×320;扫描野30 mm×30 mm (矢状位),40 mm×30 mm (轴位);层厚0.5 mm。造模6周时,MRI检查结果显示,雌二醇组均有垂体肿瘤形成,信号均匀,肿瘤向上压迫中脑及间脑,提示17β-雌二醇成功诱导泌乳素瘤形成。将雌二醇组10只成瘤大鼠随机分为模型组5只,仅给予溶媒(10%苯甲醇+20%乙醇+70%蓖麻油)肌注;氟维司群组5组,给予氟维司群20 mg/kg肌注;均连续给药2周。
1.3 相关指标观察 三组给药2周结束时,心脏采血,离心后获取血清;断头处死动物,迅速取出靶区组织标本(模型组和氟维司群组均为包括肿瘤组织的垂体,正常对照组为垂体)。①血清泌乳素:采用ELISA法检测血清泌乳素水平。②靶区组织质量和体积:测量靶区组织体积并称质量。③病理学观察:将三组组织标本经石蜡包埋后切片,分别行HE染色和网状纤维染色,操作步骤参照试剂盒说明书,光学显微镜下观察并拍照;泌乳素免疫荧光染色,荧光显微镜下观察并拍照;经负染色后在透射电镜下观察组织超微结构并拍照。④ ERα、WIF-1、β-catenin mRNA表达:取各组组织标本,采用荧光定量PCR技术检测ERα、WIF-1、β-catenin mRNA表达。将正常对照组表达量设为1,计算ERα、WIF-1、β-catenin mRNA相对表达量。⑤ ERα、WIF-1、β-catenin蛋白表达:取各组组织标本,采用Western blotting法检测ERα、WIF-1、β-catenin蛋白表达。将正常对照组表达量设为1,计算ERα、WIF-1、β-catenin蛋白相对表达量。
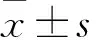
2 结果
2.1 三组血清泌乳素水平比较 正常对照组、模型组、氟维司群组血清泌乳素水平分别为(62±8)、(1 226±93)、(412±57)ng/mL,模型组、氟维司群组均高于正常对照组,氟维司群组低于模型组,组间比较P均<0.01。
2.2 三组靶区组织质量和体积比较 见表1。

表1 各组靶区组织体积和质量比较
注:与正常对照组比较,*P<0.01,△P<0.01;与模型组比较,#P<0.01。
2.3 三组病理学变化 正常对照组:HE染色显示垂体细胞呈“巢样”排列;网状纤维染色示组织网状纤维结构完整;免疫荧光显示垂体中泌乳素阳性细胞散在分布;电镜下可见泌乳素、黄体生成素等不同类型细胞散在分布。模型组:HE染色显示垂体细胞的“巢样”排列结构消失,肿瘤细胞呈无序排列,胞质嗜酸性;网状纤维染色可见网状纤维因肿瘤过度生长致断裂破坏;免疫荧光显示肿瘤细胞胞质内可见大量泌乳素阳性颗粒分布;电镜下显示肿瘤组织可见大量泌乳素细胞,其胞质内可见大量形态不规则、大小不均一、直径100~900 nm的电子致密颗粒物,粗面内质网和高尔基体丰富,线粒体富集,可见泌乳素细胞特异性的“错位胞吐”现象。氟维司群组:HE染色显示细胞体积变小,胞质减少;免疫荧光示泌乳素阳性细胞比例减少;电镜下泌乳素细胞内胞核皱缩,染色质边集,胞质内泌乳素颗粒减少,线粒体肿胀,粗面内质网、高尔基体空泡化明显,呈非典型凋亡表现。
2.4 三组ERα、WIF-1、β-catenin mRNA和蛋白相对表达量比较 见表2。

表2 三组ERα、WIF-1、β-catenin mRNA和蛋白相对表达量比较
注:与正常对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
3 讨论
垂体泌乳素瘤常用的模型有雌激素诱导垂体瘤模型、老年大鼠自发形成垂体瘤、多巴胺受体敲除诱导等[3],其中雌激素诱导模型具有可重复性好、稳定性高的特点。雌激素是一种有丝分裂原,与细胞核内ER结合后启动或修饰下游基因转录[7],使泌乳素基因启动子甲基化水平显著下降,促进泌乳素基因表达[8,9];此外,雌激素对下丘脑多巴胺能神经元具有抑制作用。多巴胺是下丘脑释放的泌乳素抑制因子,其分泌量降低可使垂体泌乳素细胞失去有效控制,导致细胞增殖和瘤变[9,10]。雌激素可促进垂体瘤转化因子和TNF-α表达,二者在垂体瘤形成过程中发挥重要作用[11]。既往多通过腹腔注射人工合成的非甾体雌激素物质己烯雌酚制备垂体泌乳素腺瘤模型[4],成瘤时间至少需要8周。本研究采用持续皮下注射17β-雌二醇建模。17β-雌二醇是雌激素的生理活性形式,与天然雌激素的生物学活性更接近。结果显示,给予17β-雌二醇刺激6周,肿瘤体积增大,质量增加,血清泌乳素水平明显升高,HE染色及免疫组化结果提示大量泌乳素细胞形成,网状纤维染色显示正常的纤维断裂残存,说明肿瘤形成,而非垂体增生。MRI检查结果提示,17β-雌二醇诱导6周泌乳素瘤的成瘤率达100%,说明该方法可重复性好,成瘤率高,且成瘤时间较己烯雌酚缩短。本研究进一步设立氟维司群组,通过给予单纯ER拮抗剂氟维司群抑制ERα表达,结果显示氟维司群可阻断17β-雌二醇的促肿瘤生长作用。
Wnt配体与Wnt受体结合后,抑制GSK-3,进而抑制β-catenin磷酸化,导致β-catenin降解减少,胞质内β-catenin水平升高,继而转入核内,与TCF/LEF转录因子结合,调节下游基因表达[12]。Wnt通路激活促进下游与细胞分化、增殖相关的 cyclin D1、c-myc、PPAR、Tcf-1等基因表达[13]。Semba等[14]研究发现,50%的泌乳素腺瘤和57%的垂体腺瘤其细胞核内均有β-catenin过度表达,且与肿瘤细胞增殖指数Ki-67呈正相关。但是,雌激素诱导泌乳素瘤形成是否与Wnt/β-catenin通路有关尚不明确。本研究结果显示,模型组β-catenin mRNA和蛋白表达水平均较正常对照组显著升高,给予氟维司群拮抗ER表达后β-catenin mRNA和蛋白表达水平均下调。有文献报道,神经细胞中ER-IP3K通路可以与Wnt/β-catenin通路通过GSK-3-β-catenin相互作用,因此在泌乳素细胞中17β-雌二醇可能通过ER-IP3K通路激活GSK-3-β-catenin通路,进而激活Wnt/β-catenin通路促进肿瘤细胞生长[15]。Wnt/β-catenin通路可以被内源性的抑制因子如WIF-1阻断,WIF-1通过与Wnt结合可以阻断Wnt与其配体结合,从而抑制细胞分化与增殖。有文献报道,在人类垂体瘤中WIF-1表达水平下调和细胞核内β-catenin富集相关,且在垂体瘤细胞系GH3中转染WIF-1可抑制细胞增殖[16]。本研究结果显示,模型组ERα mRNA和蛋白相对表达量较正常对照组降低、较氟维司群组升高,WIF-1 mRNA和蛋白相对表达量均较正常对照组及氟维司群组降低,β-catenin mRNA和蛋白相对表达量均较正常对照组及氟维司群组升高,提示17β-雌二醇可能通过Wnt/β-catenin信号通路发挥促进泌乳素瘤发生的作用。
综上所述,持续皮下给予17β-雌二醇6周能够诱导F344大鼠形成垂体泌乳素瘤,成瘤率达100%;其成瘤机制可能为17β-雌二醇作用于ERα,诱导Wnt/β-catenin通路WIF-1表达下调、β-catenin表达上调。
[1] Colao A, Lombardi G. Growth-hormone and prolactin excess[J]. Lancet, 1998,352(9138):1455-1461.
[2] Melmed S. Pituitary tumors[J]. Endocrinol Metab Clin N Am, 2015,44(1):1-9.
[3] Cristina C, García-Tornadú I, Díaz-Torga G, et al. Dopaminergic D2 receptor knockout mouse: an animal model of prolactinoma[J]. Front Horm Res, 2006(35):50-63.
[4] Lines KE, Stevenson M, Thakker RV. Animal models of pituitary neoplasia[J]. Mol Cell Endocrinol, 2016,5(421):68-81.
[5] Mueller A, Gooren L. Hormone-related tumors in transsexuals receiving treatment with cross-sex hormones[J]. Eur J Endocrinol, 2008,159(3):197-202.
[6] Bai JW, Wang Y, Li CZ, et al. Effects of fulvestrant on biological activity and Wnt expression in rat GH3 cells[J]. Neural Regen Res, 2012,7(4):283-289.
[7] Halachmi S, Marden E, Martin G, et al. Estrogen receptor-associatiated proteins: possible mediators of hormone induced transcription[J]. Science, 1994,263(5164):1455-1458.
[8] Schmidt BMW, Gerdes D, Feuring M, et al. Rapid, nongenomic steroid actions-a new age[J]. Front Neuroendocrinol, 2000,21(1): 57-94.
[9] Xu RK, Wu XM, Di AK, et al. Pituitary prolactin-secreting tumor formation: recent developments[J]. Biol Signals Recept, 2000,9(1):19-20.
[10] Azouzi M, Hsu DW, Black PM, et al. The importance of dopamine in the pathogenesis of experimental prolactinomas[J]. J Neurosurg, 1990,72(2):273-281.
[11] Heaney AP, Horwitz GA, Wang Z, et al. Early involvement of estrogen induced pituitary tumor transforming gene and fibroblast growth factor expressionin prolactinoma pathogenesis[J]. Nat Med, 1999,5(11):1317-1321.
[12] Chambers TJ, Giles A, Brabant G, et al. Wnt signalling in pituitary development and tumorigenesis[J]. Endocr Relat Cancer, 2013,20(3):R101-R111.
[13] Baarsma HA, Königshoff M, Gosens R. The WNT signaling pathway from ligand secretion to gene transcription: molecular mechanisms and pharmacological targets[J]. Pharmacol Ther, 2013,138(1):66-83.
[14] Semba S, Han SY, Ikeda H, et al. Frequent nuclear accumulation of beta-catenin in pituitary adenoma[J]. Cancer, 2001,91(1):42-48.
[15] Varea O, Arevalo MA, Garrido JJ, et al. Interaction of estrogen receptors with insulin-like growth factor-Ⅰ and Wnt signaling in the nervous system[J]. Steroids, 2010,75(8-9):565-569.
[16] Elston MS, Gill AJ, Conaglen JV, et al. Wnt pathway inhibitors are strongly downregulated in pituitary tumors[J]. Endocrinology, 2008,149(3):1235-1242.
国家卫生行业公益性科研专项(201402008);首都医科大学基础-临床合作基金资助项目(2016JL16)。
曹磊(E-mail: caolei_163@163.com)
10.3969/j.issn.1002-266X.2017.48.013
R736.4
A
1002-266X(2017)48-0043-03
2017-02-16)

