卡非佐米联合米托坦对人肾上腺皮质癌细胞H295R、SW13增殖及细胞周期的影响
韦庆臣,谭茹尹,杨海燕,黄振兴,梁杏欢,秦映芬,罗佐杰
(广西医科大学第一附属医院,南宁530021)
卡非佐米联合米托坦对人肾上腺皮质癌细胞H295R、SW13增殖及细胞周期的影响
韦庆臣,谭茹尹,杨海燕,黄振兴,梁杏欢,秦映芬,罗佐杰
(广西医科大学第一附属医院,南宁530021)
目的探讨卡非佐米联合米托坦对人肾上腺皮质癌(ACC)细胞H295R、SW13增殖及细胞周期的影响。方法体外培养人ACC细胞H295R、SW13,采用MTT法确定米托坦作用H295R、SW13细胞48 h时的半数有效抑制浓度(IC50)值分别为18.42、62.37 μmol/L,卡非佐米分别为3.86、11.62 μmol/L。将两种对数生长期细胞随机分为对照组、卡非佐米组、米托坦组及序贯给药的卡非佐米→米托坦组、卡非佐米+米托坦组、米托坦→卡非佐米组,给药浓度分别为两种药物IC50值的1/8、1/4、1/2、1、2倍,检测各浓度干预48 h时各组细胞增殖抑制率。根据Chou-Talaly公式计算IC50及2倍IC50作用下两种药物序贯给药时的联合指数(CI)。将两种对数生长期细胞随机分为对照组、米托坦单药组(25、50 μmol/L)、卡非佐米单药组(1 μmol/L)、卡非佐米(1 μmol/L)→米托坦(25、50 μmol/L)组,药物干预48 h时检测细胞增殖抑制率。将两种对数生长期细胞随机分为空白组、米托坦组、卡非佐米组、卡非佐米→米托坦组,后三组以IC50药物浓度干预96 h,采用流式细胞仪检测细胞周期。结果H295R及SW13细胞在IC50及2倍IC50浓度下,卡非佐米→米托坦组细胞增殖抑制率均高于米托坦→卡非佐米组及卡非佐米+米托坦组,米托坦→卡非佐米组均高于卡非佐米+米托坦组,组间比较P均<0.05。H295R和SW13细胞在米托坦、卡非佐米IC50及2倍IC50浓度条件下,卡非佐米→米托坦组和米托坦+卡非佐米组中两药的CI值均<1,且卡非佐米→米托坦组两药的CI值均小于米托坦+卡非佐米组(P均<0.05);米托坦→卡非佐米组中两药的CI值均<1,且均高于卡非佐米→米托坦组和米托坦+卡非佐米组(P均<0.05)。1 μmol/L卡非佐米与25、50 μmol/L米托坦联合的卡非佐米→米托坦组H295R及SW13增殖抑制率分别高于25、50 μmol/L米托坦组(P均<0.05)。四组G1、G2/M、S期细胞百分比比较差异均无统计学意义(P均>0.05)。结论卡非佐米联合米托坦对ACC细胞存在序贯依赖性的协同抑制细胞增殖作用,给予卡非佐米后给予米托坦的抗增殖作用最佳,但两药联合对细胞周期无明显影响。
肾上腺皮质癌;卡非佐米;米托坦;细胞增殖;细胞周期
肾上腺皮质癌(ACC)是来源于肾上腺皮质的恶性肿瘤,临床罕见,年发病率为0.7/100万~2.0/100万[1]。临床对ACC患者多采用手术治疗,术后给予米托坦单药或联合细胞毒药物辅助治疗[2];但患者5年生存率只有16%~47%,已发生肿瘤转移者5年生存率不足10%[3]。米托坦可特异性抑制肾上腺SOAT1酶活性,使游离胆固醇和游离脂肪酸在细胞内堆积,诱发内质网应激,导致细胞凋亡[5]。卡非佐米是新一代高度选择性不可逆蛋白酶体抑制剂,可阻断细胞内泛素—蛋白酶体蛋白降解途径,导致大量泛素化蛋白在细胞内堆积,引起细胞内质网应激,激活未折叠蛋白反应(UPR),导致细胞死亡[6]。上述两种药物均主要通过内质网应激来发挥抗肿瘤作用,两者联用可能存在协同抗肿瘤作用。2016年6~12月我们进行本研究,探讨卡非佐米联合米托坦对人ACC细胞H295R、SW13增殖及细胞周期的影响。
1 材料
ACC细胞株SW13、H295R分别购自中国科学院上海细胞库及北纳创联生物技术研究院。卡非佐米和米托坦粉剂均购自大连美仑生物技术有限公司,DMEM高糖培养基购自美国Hyclone公司,MTT购自上海碧云天生物技术研究所。细胞周期与细胞凋亡检测试剂盒购自BestBio公司。
2 方法与结果
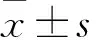
2.2 细胞培养 将SW13及H295R细胞置于含有10% FBS的F12/DMEM 1∶1完全培养液中,于温度37 ℃、湿度90%、5% CO2培养箱内培养,定期观察细胞形态及生长状况,取对数生长期细胞进行实验。
2.3 卡非佐米、米托坦对SW13及H295R细胞的半数有效抑制浓度(IC50)确定 取对数生长期SW13及H295R细胞,分别以4×103个/孔接种于96孔板,培养12 h,待细胞完全贴壁生长后以不同浓度的卡非佐米(0.5、1、2、4、8、16、32 μmol/L)或米托坦(2、4、8、16、32、64 μmol/L)分别处理,每个浓度设6个复孔。药物干预48 h时,各孔加入MTT 20 μL,置于培养箱继续培养4 h;小心吸去上清液,加入DMSO 200 μL,置于摇床振荡混匀10 min;采用酶标仪检测各孔在570 nm波长处的光密度(OD)值,计算细胞增殖抑制率。细胞增殖抑制率=(1-实验组OD值/对照组OD值)×100%。实验重复3次,取平均值。采用GraphPad Prism5.0软件计算卡非佐米、米托坦分别对H295R及SW13细胞的IC50。结果显示,米托坦对H295R和SW13细胞的IC50值分别为18.42、62.37 μmol/L,卡非佐米分别为3.86、11.62 μmol/L。
2.4 卡非佐米联合米托坦对H295R和SW13细胞增殖的影响 取对数生长期SW13及H295R细胞,分别以4×103个/孔接种于96孔板,随机分为对照组、卡非佐米组、米托坦组及序贯给药组卡非佐米联合米托坦组(联合组)。对照组正常培养液培养96 h。卡非佐米组:先给予卡非佐米干预48 h,然后将培养液吸出,加入少量PBS将卡非佐米洗去,加入不含药物的完全培养液继续培养48 h。米托坦组:先给予米托坦干预48 h,然后将培养液吸出,加入少量PBS将米托坦洗去,加入不含药物的完全培养液继续培养48 h。联合组根据给药方式分为如下组别:①先给予卡非佐米后给予米托坦组(卡非佐米→米托坦组):先给予卡非佐米干预48 h,然后将培养液吸出,加入少量PBS将卡非佐米洗去,再用米托坦继续干预48 h。②卡非佐米与米托坦同期组(卡非佐米+米托坦组):先给予卡非佐米和米托坦共同干预48 h,然后将培养液吸出,加入少量PBS将药物洗去,然后加入不含药物的完全培养液继续培养48 h。③先给予米托坦后给予卡非佐米组(米托坦→卡非佐米组):先给予米托坦干预48 h,然后将培养液吸出,加入少量PBS将米托坦洗去,再用卡非佐米干预48 h。各组药物浓度分别设置为两种药物IC50值的1/8、1/4、1/2、1、2倍。参照2.3方法检测上述各组细胞增殖抑制率。结果显示,在IC50及2倍IC50浓度下,两种细胞的卡非佐米→米托坦组细胞增殖抑制率均高于米托坦→卡非佐米组及卡非佐米+米托坦组,米托坦→卡非佐米组均高于卡非佐米+米托坦组,组间比较P均<0.05;其余浓度组间比较差异均无统计学意义(P均>0.05)。见表1。

表1 各组H295R、SW13细胞在IC50及2倍IC50浓度下增殖抑制率比较
注:与同种细胞同浓度米托坦+卡非佐米组比较,△P<0.05;与同种细胞同浓度米托坦组比较,#P<0.05;与同种细胞同浓度卡非佐米组比较,&P<0.05。
2.5 两种药物间作用的联合指数(CI)检测 采用CompuSyn软件以Chou-Talaly公式[8]根据IC50及2倍IC50计算联合组三种给药方式下两药作用的联合指数(CI)。CI值>1、=1、<1分别表示两种药物之间存在拮抗、叠加、协同效应;CI值越小,表示协同效应越大。结果显示,在IC50及2倍IC50浓度下,两种细胞的卡非佐米→米托坦组和米托坦+卡非佐米组CI值均<1,即存在药效的协同作用,且卡非佐米→米托坦组两药的CI值均小于协米托坦+卡非佐米组(P均<0.05);米托坦→卡非佐米组中两药的CI值均>1,且均高于卡非佐米→米托坦组和米托坦+卡非佐米组(P均<0.05),即两药存在拮抗作用。见表2。

表2 H295R及SW13细胞根据IC50及2倍IC50计算所得的CI值比较
注:与卡非佐米→米托坦组比较,*P<0.05。
2.6 低浓度卡非佐米联合米托坦对H295R及SW13细胞增殖的影响 取对数生长期SW13及H295R细胞,分别以4×103个/孔接种于96孔板,随机分为四组,对照组(仅含细胞和培养基)、米托坦组(25、50 μmol/L)、卡非佐米组(1 μmol/L)、卡非佐米(1 μmol/L)→米托坦(25、50 μmol/L)组。给药方法同2.4,药物干预48 h后按1.3方法检测细胞增殖抑制率。结果显示,1 μmol/L卡非佐米与25、50 μmol/L米托坦联合的卡非佐米→米托坦组H295R及SW13细胞增殖抑制率分别高于25、50 μmol/L米托坦组(P均<0.05)。见表3。

表3 各组H295R、SW13细胞增殖抑制率比较
注:与同种细胞同浓度米托坦组比较,△P<0.05;与同种细胞卡非佐米组比较,▲P<0.05。
2.7 细胞周期检测 取对数生长期SW13及H295R细胞,分别以2×105个/孔接种于6孔板,置于培养箱内培养12 h,待细胞完全贴壁生长后随机分为空白组、米托坦组、卡非佐米组、卡非佐米→米托坦组。空白组仅给予培养液培养,米托坦组、卡非佐米组、卡非佐米→米托坦组均以IC50药物浓度干预96 h,给药方法同2.4。采用流式细胞仪检测细胞周期,步骤参照试剂盒说明书。结果显示,两种细胞的各组G1、G2/M、S期细胞百分比比较差异均无统计学意义(P均>0.05)。见表4。
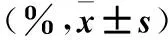
表4 各组不同周期细胞百分比比较
3 讨论
泛素蛋白酶体途径是细胞内蛋白降解的主要途径。与正常细胞相比,肿瘤细胞可无限增殖,其细胞周期及基因表达紊乱,促凋亡蛋白和抗凋亡蛋白表达失调,进而抑制蛋白酶体降解途径,细胞毒作用增强。蛋白酶体抑制剂可特异性地诱导肿瘤细胞发生毒性反应,具有广泛的抗肿瘤活性[6,9]。Nilubol等[10]采用定量高通量筛选技术为人ACC细胞株H295R筛选敏感药物,发现该细胞对蛋白酶体抑制剂硼替佐米敏感,且硼替佐米对H295R的IC50为0.34 μmol/L,略高于临床应用硼替佐米体内可达到的最高血药浓度0.31 μmol/L。目前,关于其他类型的蛋白酶体抑制剂,特别是新一代蛋白酶体抑制剂卡非佐米对ACC影响的研究尚未见报道。本研究将蛋白酶体抑制剂卡非佐米体外作用于人ACC细胞株SW13及H295R,结果显示卡非佐米可显著抑制SW13及H295R细胞增殖,且具有时间和剂量依赖性。卡非佐米对H295R细胞和SW13细胞作用48 h的IC50均高于既往报道[11],提示卡非佐米对SW13及H295R细胞敏感性较低,卡非佐米单药治疗ACC效果可能不佳。我们进一步以1 μmol/L卡非佐米联合米托坦处理ACC细胞,结果显示,对于H295R细胞,联合给药组(卡非佐米 1 μmol/L→米托坦 50 μmol/L)细胞增殖抑制率可达(93.0±2.1)%,较50 μmol/L米托坦单药组显著提高;对于SW13细胞,联合给药组细胞增殖抑制率为(72.0±4.3)%,亦较米托坦单药组提高。说明低剂量(1 μmol/L)的卡非佐米可以作为增敏剂提高米托坦对ACC细胞的增殖抑制作用。
内质网应激反应是细胞的一种适应性应答方式。内质网应激可产生两种截然不同的结局,适当的内质网应激促进细胞存活,剧烈、持续的内质网应激则促进细胞坏死[7,12]。米托坦是目前治疗ACC最常用的药物,内质网应激是其抗肿瘤作用的机制之一[4]。本研究发现,米托坦可呈浓度依赖性抑制人ACC细胞SW13及H295R增殖,H295R细胞对米托坦较SW13细胞更敏感。作用48 h时米托坦对H295R和SW13细胞的IC50(分别为18.42 μmol/L和62.37 μmol/L)均在临床推荐的血药浓度范围(43.75~87.5 μmol/L)内[13],与其他研究结果相似[14]。卡非佐米和米托坦抗肿瘤作用的机制均包括内质网应激,因此推测二者联用可能增加米托坦的抗肿瘤作用。本研究中卡非佐米和米托坦联合应用对H295R和SW13细胞存在序贯依赖性的协同作用。以卡非佐米+米托坦、卡非佐米→米托坦及米托坦→卡非佐米三种给药方式处理H295R和SW13细胞48 h,MTT检测结果显示,在IC50和2倍IC50浓度条件下,卡非佐米+米托坦及卡非佐米→米托坦两种给药方式均可明显抑制H295R和SW13细胞增殖,但后者的抑制作用更显著;两种给药方式下两药的CI值均<1,提示存在药效的协同作用。
目前关于抗肿瘤药物序贯依赖性的抗增殖作用机制尚不完全清楚,干扰细胞周期分布可能与其有关。两种药物序贯给药时,若前一种将细胞阻滞在G1期,则将影响接下来细胞周期特异性毒性药物的作用[15]。有文献报道,卡非佐米可以将甲状腺癌细胞周期阻滞在G2/M期,与其他抗肿瘤药物联合应用时不同给药方案可能产生不同的效果[16]。本研究发现,给予IC50浓度的卡非佐米和米托坦单药或序贯联合处理SW13、H295R细胞,G1、G2/M、S期细胞百分比比较差异均无统计学意义。说明卡非佐米和米托坦序贯用药对细胞增殖抑制作用的差异可能并不是通过影响细胞周期来实现的。Kroiss等[17]研究发现,卡非佐米可以通过增加IRE1磷酸化,引起其下游通路XBP1裂解。XBPI是一种转录因子,其可进入细胞核启动应激反应基因如CHOP、GRP78等转录,进而完成内质网应激反应。米托坦则可以同时增加eIF2α和IRE1磷酸化,导致促凋亡蛋白如Noxa、CHOP、DR5等表达增加,引起细胞凋亡。但本研究卡非佐米联合50 μmol/L米托坦处理H295R细胞时,内质网应激蛋白CHOP蛋白表达和XBP1裂解均较联合25 μmol/L米托坦时减少,这可能是不同的序贯用药顺序对细胞增殖抑制作用差异的主要原因。
综上所述,卡非佐米联合米托坦对ACC细胞存在序贯依赖性的协同抑制细胞增殖的作用,先给予卡非佐米后给予米托坦的给药方式的抗增殖作用最佳,但两药联合对细胞周期无明显影响。
[1] Baudin E. Adrenocortical carcinoma[J]. Endocrinol Metab Clin North Am, 2015,44(2):411-434.
[2] Libe R. Adrenocortical carcinoma (ACC): diagnosis, prognosis, and treatment[J]. Front Cell Dev Biol, 2015(3):45.
[3] Stigliano A, Cerquetti L, Lard P, et al. New insights and future perspectives in the therapeutic strategy of adrenocortical carcinoma (Review)[J]. Oncology Reports, 2017,37(3):1301-1311.
[4] Bapat AA, Demeure MJ, Bussey KJ. A fly in the ointment: reassessing mitotane′s role in the treatment of adrenocortical carcinoma[J]. Pharmacogenomics, 2012,13(11):1207-1209.
[5] Sbiera S, Leich E, Liebisch G, et al. Mitotane inhibits Sterol-O-Acyl transferase 1 triggering lipid-Mediated endoplasmic reticulum stress and apoptosis in adrenocortical carcinoma cells[J]. Endocrinology, 2015,156(11):3895-3908.
[6] Johnson DE. The ubiquitin-proteasome system: opportunities for therapeutic intervention in solid tumors[J]. Endocr Relat Cancer, 2015,22(1):T1-T17.
[7] Martinon F. Targeting endoplasmic reticulum signaling pathways in cancer[J]. Acta Oncol, 2012,51(7):822-830.
[8] Chou TC. Theoretical basis, experimental design, and computerized simulation of synergism and antagonism in drug combination studies[J]. Pharmacol Rev, 2006,58(3):621-681.
[9] Obrist F, Manic G, Kroemer G, et al. Trial Watch: proteasomal inhibitors for anticancer therapy[J]. Mol Cell Oncol, 2015,2(2):e974463.
[10] Nilubol N, Zhang L, Shen M, et al. Four clinically utilized drugs were identified and validated for treatment of adrenocortical cancer using quantitative high-throughput screening[J]. J Transl Med, 2012(10):198.
[11] Redic K. Carfilzomib: a novel agent for multiple myeloma[J]. J Pharm Pharmacol, 2013,65(8):1095-1106.
[12] Zlotorynski E. DR5 unfolds ER stress[J]. Nat Rev Mol Cell Biol, 2014,15(8):498-499.
[13] Kerkhofs TM, Baudin E, Terzolo M, et al. Comparison of two mitotane starting dose regimens in patients with advanced adrenocortical carcinoma[J]. J Clin Endocrinol Metab, 2013,98(12):4759-4767.
[14] De Martino MC, van Koetsveld PM, Feelders RA, et al. Effects of combination treatment with sirolimus and mitotane on growth of human adrenocortical carcinoma cells[J]. Endocrine, 2016,52(3):664-667.
[15] Mahaffey CM, Davies AM, Lara PJ, et al. Schedule-dependent apoptosis in K-ras mutant non-small-cell lung cancer cell lines treated with docetaxel and erlotinib: rationale for pharmacodynamic separation[J]. Clin Lung Cancer, 2007,8(9):548-553.
[16] Zhang L, Boufraqech M, Lake R, et al. Carfilzomib potentiates CUDC-101-induced apoptosis in anaplastic thyroid cancer[J]. Oncotarget, 2016,7(13):16517-16528.
[17] Kroiss M, Sbiera S, Kendl S, et al. Drug synergism of proteasome inhibitors and mitotane by complementary activation of ER stress in adrenocortical carcinoma cells[J]. Horm Cancer, 2016,7(5-6):345-355.
[18] Fassnacht M, Terzolo M, Allolio B, et al. Combination chemotherapy in advanced adrenocortical carcinoma[J]. N Eng J Med, 2012,366(23):2189-2197.
EffectsofcarfilzomibcombinedwithmitotaneonproliferationandcellcycleofhumanadrenocorticalcarcinomaH295RandSW13cells
WEIQingchen,TANRuyin,YANGHaiyan,HUANGZhenxing,LIANGXinghuan,QINYingfen,LUOZuojie
(TheFirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning530021,China)
ObjectiveTo investigate the effects of carfilzomib combined with mitotane on the proliferation and cell cycle of human adrenocortical carcinoma (ACC) H295R and SW13 cells.MethodsHuman ACC H295R and SW13 cells were cultured in vitro. Using MTT to determine the IC50values of mitotane on H295R and SW13 cells at 48 h, which were 18.42 and 62.37 μmol/L, respectively, and those of carfilzomib were 3.86 and 11.62 μmol/L. These two cell lines in the logarithmic growth phase were randomly divided into the control group, carfilzomib group, mitotane group, and the carfilzomib → mitotane group, carfilzomib + mitotane group, and the mitotane →carfilzomib group (namely according to the sequential administration). The concentrations of the two drugs were 1/8, 1/4, 1/2, 1, 2 times of IC50values, respectively. The inhibitory rate of cell proliferation was measured at 48 h. The combine index (CI) of the two drugs was calculated according to the Chou-Talalay formula. These two cells in the logarithmic growth phase were randomly divided into the control group, mitotane monotherapy group (25 and 50 μmol/L), carfilzomib monotherapy group (1 μmol/L), carfilzomib (1 μmol/L) → mitotane (25 and 50 μmol/L) group. The inhibitory rate of cell proliferation at 48 h after drug intervention was detected. These two cells in the logarithmic growth phase were randomly divided into the blank group, mitotane group, carfilzomib group, carfilzomib → mitotae group, and the latter three groups were intervened at the drug concentration of IC50for 96 h, and flow cytometry was used to detect the cell cycle.ResultsThe proliferation inhibitory rates of H295R and SW13 cells were significantly higher in the carfilzomib→mitotane group than in the mitotane→carfilzomib group and the carfilzomib+ mitotane group at the concentrations of IC50and 2-fold IC50; the mitotane→carfilzomib group was higher than the carfilzomib+ mitotane group; there were significant differences between every two groups (allP<0.05). CI value<1 was found in both the carfilzomib→mitotane group and the mitotane + carfilzomib group at the concentrations of IC50and 2-fold IC50in H295R and SW13 cell lines, and the CI value in the carfilzomib→mitotane group was lower than that in the mitotane + carfilzomib group (allP<0.05); CI value >1 was found in the mitotane→carfilzomib group, which was greater than that of the carfilzomib→mitotane group and the mitotane + carfilzomib group (allP<0.05). The proliferation inhibitory rates of H295R and SW13 cells were significantly higher in the carfilzomib (1 μmol/L)→mitotane (25 and 50 μmol/L) group than in the mitotane group (25 and 50 μmol/L), respectively. There was no significant difference in the percentage of cells in the G1, G2/M, and S phases between these four groups (P>0.05).ConclusionThere are sequence-dependent antiproliferative effects of mitotane and carfilzomib on H295R and SW13 cell lines, and the sequential administration of carfilzomib followed by mitotane exhibits the strongest anticancer activity, but the combination of these two drugs has no significant effect on the cell cycle.
adrenocortical carcinoma; carfilzomib; mitotane; cell proliferation; cell cycle
国家自然科学基金资助项目(81060220)。
韦庆臣(1990-),男,住院医师,研究方向为内分泌代谢疾病及相关肿瘤。E-mail: 947343812@qq.com
罗佐杰(1958-),男,教授,研究方向为内分泌代谢疾病及相关肿瘤。E-mail: zluo888@163.com
10.3969/j.issn.1002-266X.2017.48.007
R736.6
A
1002-266X(2017)48-0023-05
2017-05-14)

