尾静脉移植高表达Aqp1基因的骨髓间充质干细胞对股骨骨折大鼠骨愈合的影响
孟凡彪,刘宝华,刘佐君
(深圳大学医学院,广东深圳518060)
尾静脉移植高表达Aqp1基因的骨髓间充质干细胞对股骨骨折大鼠骨愈合的影响
孟凡彪,刘宝华,刘佐君
(深圳大学医学院,广东深圳518060)
目的探讨尾静脉移植高表达水通道蛋白1(Aqp1)基因的骨髓间充质干细胞(MSCs)对股骨骨折大鼠骨愈合的影响。方法利用慢病毒系统建立稳定高表达Aqp1基因的MSCs(简称Aqp1-MSCs),采用Dun 趋化小室系统实时验证MSCs、Aqp1-MSCs迁移速率。建立SD大鼠股骨骨折模型,并随机分为观察组和对照组各10只,建模2天分别由尾静脉移植Aqp1-MSCs及MSCs。移植后4周行X线检查,观察骨折愈合情况;取骨折股骨标本,采用micro-CT扫描后进行皮质骨3D重建,检测重建皮质骨的新骨生成比(BV/TV)及骨密度(BMD);应用四点断裂实验分析愈合后股骨的力学参数,即骨折部位承受最大力、能量与韧性。结果Aqp1-MSCs与MSCs均具有定向趋向性,Aqp1-MSCs及MSCs迁移速率分别为(5.18±0.29)、(2.44±0.21)μm/10 min(P<0.05)。观察组和对照组BV/TV分别为0.18±0.01、0.15±0.02(P>0.05),BMD分别为(587.20±16.53)、(511.60±27.89)mgHA/ccm(P<0.05)。两组骨折部位承受的最大力和能量比较差异均无统计学意义(P均>0.05),观察组组织韧性高于对照组(P<0.05)。结论尾静脉移植Aqp1-MSCs可促进股骨骨折大鼠骨愈合;通过Aqp1诱导MSCs迁移可能是其作用机制。
股骨骨折;骨髓间充质干细胞;水通道蛋白1;细胞迁移;大鼠
骨折多发生于交通事故、运动意外、跌倒等。大部分骨折治疗效果较好,但愈合周期长、延迟愈合或骨不连等临床问题尚需解决[1]。骨髓间充质干细胞(MSCs)是来源于骨髓的具有成骨、成脂与成软骨三系分化能力的成体干细胞,其在体外易大量扩增,且免疫原性较低。目前,临床已有成功应用MSCs治疗骨折的报道[2]。水通道蛋白1(Aqp1)是最早鉴定出负责细胞水分运输的七次跨膜蛋白[3],广泛分布于各个组织,主要表达在内皮细胞,可促进肿瘤血管新生[4]。本课题组前期研究发现,Aqp1通过调节β-catenin、FAK表达,促进MSCs迁移到骨折损伤部位[5]。2014年9月~2016年6月我们进行本研究,探讨尾静脉移植高表达Aqp1基因的MSCs(简称Aqp1-MSCs)对股骨骨折大鼠骨愈合的影响。
1 材料
SD大鼠20只,雌雄不限,6~8周龄,体质量200 g左右,购于广东省医学实验动物中心(动物许可证号:44007200041000)。所涉及的动物移植实验均通过深圳大学医学院实验动物伦理委员会批准。
主要试剂:质粒小提试剂盒、凝胶回收试剂盒购于Axygen公司(杭州),低糖DMEM细胞培养液、0.25%胰蛋白酶与opti-MEM培养液购于美国Gibco公司,脂质体2000(LipofectamineTM2000)购于美国Invitrogen公司,克氏针(φ1.2 mm)购于美国Stryker公司。高分辨率X射线仪(MX-20)购于美国Faxitron公司,viva CT 40购于瑞士Scanco Medical公司。Aqp1抗体、GAPDH抗体购自美国Santa Cruz公司。
2 方法与结果
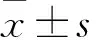
2.2 Aqp1-MSCs构建 采用PCR法将大鼠Aqp1基因(NM_012778.1)构建到载体plenti6-V5中,用于慢病毒包装。将质粒pCMV-VSVG 2.8 μg、pMDLg-RRE 5.28 μg、pRSV-REV 4 μg、pLenti6-Aqp1 8 μg 与500 μL Opti-MEM混匀在一个EP管,同时将50 μL PEI与500 μL Opti-MEM混匀在另一个Ep管。将两管内容物混匀并室温放置15 min,加入到70%融合的293T培养皿中,培养6 h换成新鲜培养液,培养48 h收集培养液上清,即为病毒粗提液。根据病毒滴度,将相应的病毒粗提液加入铺有MSCs的6孔板中,培养24 h换液。采用blasticidin(10 μg/mL)筛选2周得到Aqp1-MSCs细胞株,进行Western blotting检测验证。结果显示,慢病毒感染MSCs的感染效率接近100%。高表达Aqp1并未影响MSCs形态,筛选出Aqp1-MSCs细胞株。
2.3 Aqp1-MSCs迁移速率检测 采用Dun 趋化小室分析。将无血清培养液置于内室,将含血清培养液置于外室,分别覆盖含70%融合Aqp1-MSCs及MSCs的盖玻片。将盖玻片置于连有摄像机的倒置显微镜上,利用软件Kinetic(Kinetic Imaging Ltd,英国)记录桥(bridge)上细胞迁移轨迹,并用内置软件分析细胞迁移的方向与速率。结果显示,Aqp1-MSCs与MSCs均具有定向趋向性。对迁移速率连续300 min追踪分析发现,Aqp1-MSCs及MSCs的迁移速率分别为(5.18±0.29)、(2.44±0.21)μm/10 min,两者比较P<0.05。
2.4 Aqp1-MSCs对股骨骨折愈合的影响
2.4.1 大鼠骨折模型建立及Aqp1-MSCs移植 根据文献[6]报道方法建立大鼠股骨骨折模型。将20只SD大鼠随机分为观察组和对照组各10只。两组均在常规麻醉状态下暴露股骨,利用电锔在股骨骨干处进行横切截断,并插入克氏针进行内固定。利用数字化X射线仪对骨折情况进行评估。结果显示,骨折类型为横形断裂,无粉碎性骨折、斜形骨折与螺旋骨折。骨折手术后2天,观察组和对照组分别由尾静脉移植Aqpl-MSCs及MSCs,细胞数均为1×106个。
2.4.2 大鼠骨折愈合情况及骨折愈合后骨折部位的力学分析 移植后4周对骨折股骨进行X线照射检查,结果显示两组骨折表面均愈合。将大鼠麻醉处死,取骨折股骨标本。将两组股骨标本置于塑料圆柱形管中进行micro-CT扫描(电压70 keV、电流114 μA)。扫描以生长板为起点至远端7.98 mm处,每一层扫描厚度为19 μm(总计420层)。采用半自动方法确定轮廓,以区分骨小梁中的皮质骨。根据CT扫描图像对皮质骨进行3D重建[7],参数为:sigma=1.2,support=2,threshold=190。利用内附软件评估3D重建皮质骨的新骨生成比(BV/TV)及骨密度(BMD)。BV指新骨形成量,TV是骨总量。结果显示,观察组较对照组骨折沟变浅、骨痂减少,即骨折愈合更好。观察组及对照组BV/TV分别为0.18±0.01、0.15±0.02,两组比较P>0.05,观察组及对照组BMD分别为(587.20±16.53)、(511.60±27.89)mgHA/ccm,两组比较P<0.05。
在亨氏材料试验机(H25KS; Hounsfield Test Equipment)上设置250 N的总力,应用四点断裂试验分析愈合后股骨的力学参数。将股骨标本水平放置在支持的两点上,对骨折位置以5 mm/min进行施压,压力方向与骨干方向垂直,致骨断裂,利用内置软件分析骨折部位承受的最大力、能量与韧性。
结果显示,两组骨折部位承受的最大力和能量比较差异均无统计学意义(P均>0.05),观察组组织韧性高于对照组(P<0.05)。见表1。

表1 两组骨折愈合后骨折部位承受的最大力、能量及组织韧性比较
注:与对照组比较,*P<0.05。
3 讨论
MSCs是一种多潜能成体干细胞,其临床应用是再生医学研究的热点,为治疗组织损伤提供了新的可能,目前已应用于治疗糖尿病、心肌梗死、炎症、骨折等多种疾病[8~10]。在MSCs应用中的瓶颈问题是如何将MSCs移植到体内。原位注射MSCs的方式较为直接有效,但临床创伤较大,不利于重复应用[11,12];通过血液循环输入是有效而无创的方法,但由循环系统输入MSCs需要细胞具有较强的迁移能力才能到达损伤部位[13,14]。文献报道,体外培养的MSCs形态较体内原始细胞大,不易穿过毛细血管[15];血液移植的MSCs大部分被潴留在肺部,影响肺的正常生理功能,并降低治疗效果。因此,提高MSCs的迁移能力对提高其干预效果具有重要意义。
研究证实,Aqp1可促进肿瘤细胞迁移及肿瘤内血管生成[12]。本课题组前期研究发现,Aqp1通过调节FAK与β-catenin表达促进MSCs迁移到骨折部位[5]。本研究首先构建稳定转染Aqp1的MSCs细胞系,利用Dun 趋化小室系统实时观察Aqp1对MSCs迁移的影响,进一步采用大鼠骨折模型在体内分析Aqp1-MSCs对骨折愈合的影响。结果显示,Aqp1-MSCs迁移速度较MSCs显著提高,Aqp1-MSCs移植可促进骨折愈合,提高骨折部位的BMD与韧性。上述结果说明,Aqp1对MSCs介导的骨折修复具有促进作用。由于Aqp1对MSCs迁移的促进作用,因而骨折愈合能力的增强可能是更多的MSCs到达损伤部位进行修复。本研究中Aqp1-MSCs移植并未显著提高骨折大鼠BV/TV。新骨形成质量与骨折部位微环境、骨折个体骨折创伤面、愈合过程中炎症反应及后期血管形成等因素均有关,单纯改变迁移速度可能不足以影响新骨形成。
综上所述,尾静脉移植Aqp1-MSCs可促进股骨骨折大鼠骨愈合;通过Aqp1诱导MSCs迁移可能是其作用机制。
[1] Einhorn TA, Gerstenfeld LC. Fracture healing: mechanisms and interventions[J]. Nat Rev Rheumatol, 2015,11(1):45-54.
[2] Cheung WH, Chin WC, Wei FY, et al. Applications of exogenous mesenchymal stem cells and low intensity pulsed ultrasound enhance fracture healing in rat model[J]. Ultrasound Med Biol, 2013,39(1):117-125.
[3] Benga G. The first discovered water channel protein, later called aquaporin 1: Molecular characteristics, functions and medical implications[J]. Mol Aspects Med, 2012,33(5-6):518-534.
[4] Saadoun S, Papadopoulos MC, Hara-Chikuma M. et al. Impairment of angiogenesis and cell migration by targeted aquaporin-1 gene disruption[J]. Nature, 2005,434(7034):786-792.
[5] Meng F, Rui Y, Xu L, et al. Aqp1 enhances migration of bone marrow mesenchymal stem cells through regulation of FAK and β-catenin[J]. Stem Cells Dev, 2013,23(1):66-75.
[6] Huang S, Xu L, Sun Y, et al. Systemic administration of allogeneic mesenchymal stem cells does not halt osteoporotic bone loss in ovariectomized rats[J]. PLoS One, 2016,11(10):e0163131.
[7] Liu Y, Rui Y, Cheng TY, et al. Effects of sclerostin antibody on the healing of femoral fractures in ovariectomised rats[J]. Calcif Tissue Int, 2016,98(3):263-274.
[8] Li L, Hui H, Jia X, et al. Infusion with human bone marrow-derived mesenchymal stem cells improves β-cell function in patients and non-obese mice with severe diabetes[J]. Scientific Reports, 2016,6(1):37894.
[9] Zhang D, Fan GC, Zhou X, et al. Over-expression of CXCR4 on mesenchymal stem cells augments myoangiogenesis in the infarcted myocardium[J]. J Mol Cell Cardiol, 2008,44(2):281-292.
[10] Zhang ZH, Zhu W, Ren HZ, et al. Mesenchymal stem cells increase expression of heme oxygenase-1 leading to anti-inflammatory activity in treatment of acute liver failure[J]. Stem Cell Res Ther, 2017,8(1):70.
[11] Kim HJ, Park JS. Usage of human mesenchymal stem cells in cell-based therapy: advantages and disadvantages[J]. Dev Reprod, 2017,21(1):1-10.
[12] Tomita Y, Dorward H, Yool AJ, et al. Role of aquaporin 1 signalling in cancer development and progression[J]. Int J Mol Sci, 2017,18(2):pii:E299.
[13] 王彦超,邓蓉蓉,叶亚东,等.补肾活血舒筋方含药血清对大鼠骨髓间充质干细胞增殖、迁移的影响及其机制[J].山东医药,2017,57(16):38-40.
[14] Wang K, Li Y, Zhu T, et al. Overexpression of c-Met in bone marrow mesenchymal stem cells improves their effectiveness in homing and repair of acute liver failure[J]. Stem Cell Res Ther, 2017,8(1):162-172.
[15] Bara JJ, Richards RG, Alini M, et al. Concise review: bone marrow-derived mesenchymal stem cells change phenotype following in vitro culture: implications for basic research and the clinic[J]. Stem Cells, 2014,32(7):1713-1723.
EffectsoftransplantationofAqp1-MSCsviacaudalveinonhealingprocessofratswithfemurfracture
MENGFanbiao,LIUBaohua,LIUZuojun
(ShenzhenUniversitySchoolofMedicine,Shenzhen518060,China)
ObjectiveTo investigate the effects of transplantation of bone marrow mesenchymal stem cells (MSCs) with high expression of aquaporin 1 (Aqp1) via caudal vain on the healing process of rats with femoral fractures.MethodsMSCs (Aqp1-MSCs) stably expressing Aqp1 gene were established by lentivirus system, and the migration rates of MSCs and Aqp1-MSCs were verified by Dun chemotactic chamber system. Twenty SD rats with femur fractures were randomly divided into the observation group and the control group with 10 in each. Aqp1-MSCs and MSCs via caudal vein were administrated 2 days after surgery. The fractured femur were examined by X ray to observe the healing process 4 weeks after transplantation. Furthermore, the femora were collected and scanned using micro-CT for 3D remodeling to examine the new cortical bone formation ration (BV/TV)and bone density (BMD). In addition, four points break analysis was used to examine the mechanical parameters of femora such as the maximal force, energy, and stiffness.ResultsAqp1-MSCs and MSCs had specific chemotaxis, and the migration rates of Aqp1-MSCs and MSCs were (5.18±0.29) and (2.44±0.21) m/10 min, respectively. The BV/TV of the observation group and control group were 0.175%±0.01% and 0.15%±0.02%, respectively (P>0.05). The BMD of the two groups were (587.2±16.53) and (511.6±27.89) mgHA/ccm, respectively (P<0.05). No significant difference was found in the maximal force and energy between these two groups (bothP>0.05), while the stiffness of the observation group was significantly higher than that of the control group (P<0.05).ConclusionTransplantation of Aqp1-MSCs via caudal vain can promote the healing process of rats with femoral fractures by Aqp1 inducing the migration of MSCs.
femoral fracture; bone marrow mesenchymal stem cells; aquaporin-1; cell migration
深圳市科技创新计划基金资助项目(CXZZ20140903103747508)。
孟凡彪(1986-),男,博士后,研究方向为干细胞治疗骨相关疾病。E-mail: mfanbiao@szu.edu.cn
刘佐君(1982-),男,博士后,研究方向为干细胞与再生医学。E-mail: liu-zuo-jun@163.com
10.3969/j.issn.1002-266X.2017.48.004
Q291;R683
A
1002-266X(2017)48-0012-03
2017-04-06)

