MoS2为基纳米复合材料的制备及性能研究进展
宋晓琳,陈贵锋,关丽秀,任 慧,陈士强,陈洪建,陶俊光
(1.河北工业大学材料科学与工程学院 新型功能材料重点实验室,天津 300130)(2.河北工业大学理学院,天津 300130)
青年园地
MoS2为基纳米复合材料的制备及性能研究进展
宋晓琳1,陈贵锋1,关丽秀2,任 慧1,陈士强1,陈洪建1,陶俊光1
(1.河北工业大学材料科学与工程学院 新型功能材料重点实验室,天津 300130)(2.河北工业大学理学院,天津 300130)
二硫化钼(MoS2)是一种层状过渡族金属硫化物材料,由于其单层独特的电子结构及物理化学性能被广泛地应用在各个领域,包括光降解有机染料、电化学析氢及太阳能电池等方面。近几年,二硫化钼纳米材料由于比表面积较大、禁带宽度窄、优秀的电学性能及其较高的电子迁移率等,引起人们的强烈关注,但其内部存在缺陷,因此作为一种单一的半导体材料,限制了其在许多方面的应用。介绍了MoS2的不同形貌结构及其最新的制备方法,除此之外,可以通过MoS2界面改性处理的手段耦合其他半导体,增加其活性位点,降低电子空穴的复合速率,提高其循环稳定性。最后,对其在环境和能源方面的应用进行总结介绍。
MoS2;纳米复合材料;光催化;电化学析氢;电池性能
1 前 言
新世纪以来,在经济快速发展的同时,人类面临诸多问题,例如环境污染与能源浪费等。目前在使用的资源中,石油和煤炭资源越来越紧张,利用半导体作为催化剂或制备太阳能电池等方向越来越引起研究者的关注[1]。目前,许多半导体材料或是复合材料被用来降解有机染料,比如TiO2/Ag2O[2]、CdS/ZnO[3]、CuO/MoS2[4]等。在众多半导体材料中,MoS2作为一种新型的二维材料,由于其独特的性能引起人们的研究兴趣,除了在光催化方面有潜力[5],在电催化[6]、储氢媒介[7]、太阳能电池及锂离子电池[8]、场效应晶体管[9-10]、发光二极管[11]、柔性器件[12]、润滑剂、吸附剂及其制备二硫化钼的层间化合物方面[13]都有很大用途。
二硫化钼(MoS2)是一种二维层状结构,其比表面积大、吸收能力强,硫原子与钼原子之间的连接依靠共价键,并且层面之间依靠较弱的范德瓦尔斯力连接,因而层与层之间相互作用力较弱,便于其他小离子如锂离子插入制备层间化合物[13],例如:Hu等人通过剥层重堆法制备了纳米二硫化钼的夹层化合物。二硫化钼地球储量丰富,其体材料的禁带宽度较窄达到1.2 eV,单层片状的禁带宽度达到1.8 eV[4,8],在前人的研究中,以MoS2为基的异质结制备中,宽禁带半导体材料被经常用来进行光催化研究,比如:TiO2、WO3、ZnO和SiC等功能材料,但这些催化剂只能吸收太阳光中的很少一部分紫外光(少于5%)。为了提高光催化活性及其对太阳光的利用率,人们尝试了各种办法。例如Zhou等人[14]通过将表面改性的二氧化钛纳米带与二硫化钼纳米花复合来提高复合材料的催化活性。Wang等人[15]通过两步法将MoS2颗粒涂层覆盖在TiO2表面制备的复合材料能有效地在可见光的范围内降解苯酚。Liu等人将水热法制备的二硫化钼纳米片与二氧化钛纳米纤维复合,研究了复合材料的光催化性能[16]。
研究发现,块状的二硫化钼电化学析氢性能较差,实验和计算研究结果表明二硫化钼的电化学析氢性能与二硫化钼边缘的活性位点有关[17]。因此,增加二硫化钼的活性位点数能有效地提高其析氢反应(HER)性能。Li与Huang课题组[6]研究表明,以MoS2与SnO2水热法制备的纳米花/片异质结构能提高其光催化性能和析氢性能。Xie等人制备缺陷丰富的二硫化钼纳米片来增加活性位点提高电化学析氢性能[18]。
另外,MoS2的电子迁移率较高(200 cm2·V-1·s-1)[19],所以可以被广泛地应用在电池、场效应晶体管及光致二极管等方面。但由于其循环稳定性较差[20],研究者常常将二硫化钼纳米材料与其它一些半导体材料复合来提高其在锂离子电池、太阳能电池和电容器等应用领域中的循环稳定性能。Du等人将MoS2纳米片与TiO2纳米管复合制备的锂离子电池锂离子电池在循环100周期后比电容仍可保留在472 mA·h·g-1[21]。Yan[9]等人将三元共聚物驰豫铁电体与少层的二硫化钼纳米片复合,制备出新型场效应晶体管,该晶体管显示出较好的电流开/关比性能。Srivastava[10]通过垂直二硫化钼/h-BN/二硫化钼的夹层制得门感应层间隧道场效应晶体管,降低阈值的斜度。Luan[11]等人制备的发光二极管的脉冲峰值功率最高。
近年来,二硫化钼及其他半导体纳米材料在合成、改性和应用等方面都取得了极大的进展。本文中,我们较详细地介绍了二硫化钼的结构,不同形貌的二硫化钼材料的制备,及其以二硫化钼为基的复合材料在光催化、电化学析氢及其在电池性能等方面的应用研究最新研究进展。
2 晶体的结构及复合材料的形成
2.1 MoS2的晶体结构
二硫化钼是一种类石墨烯的二维过渡族金属硫化物,MoS2主要存在以下3种结构:六方晶相(2H型和3R型)和四方晶相(1T型),这里的首字母是指在晶胞中存在X-M-X的周期数,X代指S原子,M代指Mo原子。此3种结构中2H呈现半导体性质,1T结构呈现金属特性。热力学不稳定相1T和3R型会向2H稳定相转变。MoS2晶体是由多个分子层通过范德瓦尔斯力结合,层与层之间的距离是0.69 nm,单个分子层由两层硫原子和一层钼原子组成,类似三明治夹层结构[19]。
2.2 MoS2为基复合材料的合成
诸多方法可以用来制备MoS2和其他半导体的复合材料,其中MoS2纳米材料的制备方法包括水热法、溶剂热法、CVD法、剥离法、高温硫化法及其电化学沉积法,制备的纳米材料形貌也多种多样。接下来这部分我们将简要介绍几种不同形貌的MoS2与其他功能半导体材料复合体的制备方法,包括纳米花、纳米片、量子点及其在复合材料中所起的作用。
2.2.1 纳米花结构
主要通过水热法制备二硫化钼纳米花材料,并与其他半导体材料复合制备成异质结构,该异质结的形成能很好地提高复合材料的性能。TiO2作为一种功能性氧化物材料,通常水热法制备TiO2@MoS2复合材料主要通过两步法,以Liu等人[16]做的研究为例进行介绍。首先第一步通过静电纺丝技术来制备表面带孔的二氧化钛纳米纤维;第二步通过水热法将硫源(硫脲)与钼源(钼酸钠)搅拌成透明液,在加入一定量的二氧化钛纳米纤维制成悬浊液,经过一段反应得到的黑色粉末是复合材料。
图1是二硫化钼在二氧化钛纳米纤维表面的生长示意图[16]。从图中可以看出,为使二硫化钼与二氧化钛形成较好的化学结合,需要在二氧化钛表面产生二硫化钼的成核点,为其提供足够的生长条件。Chen课题组[22]将表面光滑的二氧化钛纳米带通过3种不同改性方法制成疏松多孔的结构并与二硫化钼复合。此实验中,不同方法改性的二氧化钛纳米带表面复合的二硫化钼其形貌差别较大,进而影响了复合材料的电子结构与催化性能。Chen等人通过水热法制备偏钛酸纳米带,并对其进行酸、碱的改性处理,退火后得到表面疏松的TiO2纳米带,最后将其置于生长二硫化钼的溶液中,一定时间后得到黑色复合材料如图2。这种方法大大增加了纳米片的比表面积,并使得表面的不饱和位数目增加,便于与二硫化钼复合提高催化活性。除了TiO2,Tan等人分别制备出MoS2纳米片与ZnO纳米颗粒,将两者在聚醚酰亚胺(PEI)溶液混和,通过水热法制备复合结构。其中PEI层逐渐旋涂在MoS2纳米花上形成MoS2-PEI的复合材料,之后将MoS2-PEI的复合材料与ZnO纳米颗粒超声搅拌得到MoS2-PEI-ZnO异质结构,通过这种方法制备的异质结构增加了电荷移动及其催化与场发射性能[23]。
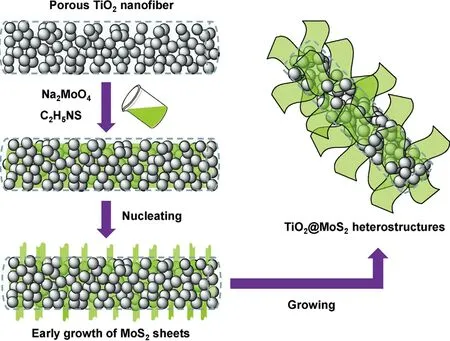
图1 生成MoS2/TiO2复合材料两步法示意图[16]Fig.1 Schematic of two-step method for synthesizing MoS2/TiO2 composites [16]
另外,Chen[22]等人通过酸与碱分别处理二氧化钛纳米带表面,大大增强了MoS2在二氧化钛纳米带上的复合,形成以化学键结合致密的异质结界面。图2是制得的样品扫描电镜(SEM)照片。图2a、2b分别是氢氧化钠和盐酸改性的二氧化钛纳米带(TiO2-NH)与复合材料(TiO2@MoS2-NH);图2c、2d分别是硫酸改性的纳米带(TiO2-H)及其复合材料(TiO2@MoS2-H);图2e、2f分别是氢氧化钠/盐酸/硫酸改性的纳米带(TiO2-NHH)及其复合材料(TiO2@MoS2-NHH)。从图中可以发现TiO2-H与TiO2-NHH的表面相比TiO2-NH的表面变得粗糙,说明硫酸能使纳米带表面形成小颗粒;而且TiO2-NHH的表面比TiO2-H表面的颗粒较多,表明碱溶液能使纳米带表面变得疏松[24]。图2右侧图为复合材料(40% MoS2)的SEM照片,从中可以看出,改性的纳米带表面存在二硫化钼的成核点,便于与二硫化钼复合。并且不同改性的纳米带上生长的二硫化钼的形貌差异较大,这对于其界面处的电子行为有一定影响,能进一步影响催化性能。此前,Zhou[14]等人将二氧化钛纳米带通过硫酸改性复合弯曲的二硫化钼纳米片,有效地提高了电子空穴的分离,增强了光催化析氢反应,其中二硫化钼主要增强催化的吸收范围,提高降解率。

图2 3种方法改性的二氧化钛纳米带和其TiO2@MoS2复合材料的SEM照片:(a)和(b)NaOH / HCl;(c)和(d)H2SO4;(e)和(f)NaOH / HCl / H2SO4[22]Fig.2 SEM images of the modified TiO2 nanobelts by three methods and the corresponding SEM images of TiO2@MoS2 composites: (a) and (b) NaOH / HCl; (c) and (d) H2SO4; (e) and (f) NaOH / HCl / H2SO4 [22]
2.2.2 纳米片结构
二硫化钼成为最近析氢材料领域的研究热点,主要原因是其新奇的结构特征。不同于零维和一维材料,二维半导体材料是优秀的助催化剂,有较大的比表面积;另一方面,纳米尺度的二维材料有大量的活性位点促进析氢反应。Yuan等人[25]将二维的MoS2纳米片负载在暴露(001)面的二维TiO2纳米片上用来增强界面接触,如图3a和图3b所示。二维的MoS2@TiO2催化剂负载0.5wt% MoS2纳米片显示了较高的析氢性能,达到2145 μmol·h-1·g-1,是纯TiO2纳米片的36.4倍。更重要的是,二维的MoS2@TiO2复合材料的催化活性高于TiO2纳米片负载贵金属复合材料的催化活性。异质结提高光催化活性的主要因素是半导体材料和催化剂之间存在较大的、紧密的界面接触,提高了TiO2到MoS2有效的电荷传递,增强了MoS2在TiO2复合电极的光电流响应,这项工作构建了一个高效的催化剂界面工程。

图3 TiO2纳米片/MoS2纳米片复合材料的生长过程示意图(a),复合材料的SEM照片(b)[25];二硫化钼与石墨烯薄膜杂交的TEM照片(c),不同层数的异质薄膜的PL强度(d)[27]Fig.3 The growth mechanism of TiO2/MoS2 composites (a) , SEM image of the above composites (b) [25]; TEM image of MoS2/Graphene hybrids (c) , PL intensity of different layers of heterogeneous thin films (d) [27]
最近,Ye课题组已经提出了一个简单的溶液过程,在阳离子表面活性剂(CTAB)协助下将少层MoS2[26]与表面氧化石墨烯复合,这些阳离子表面活性剂可以通过静电相互作用,促进表面氧化石墨烯与二硫化钼的组装并调节两者之间的电荷不相容性。MoS2表面的微观结构(层数)可以通过使用不同的阳离子表面活性剂来控制。Patil[27]等人用二硫化钼纳米片与石墨烯的杂化薄膜来制备超级电容器,其微观结构和性能如图3c和3d所示。
2.2.3 量子点
由于量子效应的存在,改变量子点大小可以大范围调整光学带隙,进而影响发光现象。除制备二维材料的量子点外,将其他材料的量子点与二维纳米片复合所得的功能材料,也具有广阔的应用前景。Li等人通过声波超声法剥离溶解在N-甲基吡咯烷酮(NMP)中的块状MoS2,过滤出大块材料,继续超声之后离心得到MoS2量子点,将其与还原氧化石墨烯(RGO)复合,得到稳定性较高的异质结构,其电流密度在过电势64 mV时达到较大的10 mA/cm2[28]。TiO2虽被认为在近些年是最有效的光催化剂之一,但其禁带宽度大限制其只能吸收紫外光。在MoS2量子点生成过程中,Li课题组[5]通过在钼源与硫源的混合溶液中加入P25颗粒与氧化石墨烯(GO),将混合溶液置于二甲基乙酰胺(DMAc)溶液中,水热条件下反应得到MoS2-graphene-TiO2复合材料(MGT)。量子点的生成条件最重要的是GO片与Mo源在一个相对合适的环境中,没有石墨烯存在的情况下,很难得到量子点。反应制得的MGT复合材料的比表面积增大,催化性能增强。
Carcia[29]课题组制备了二硫化钼量子点(如图4a和图4b),通过在悬浊液中的激光照射来研究其光催化析氢性能。中科院Xing等人[30]对制备的二硫化钼量子点进行调节,并优化其功函数,并且用MoS2量子点及其量子点堆积的薄膜分别组装有机太阳能电池,测得J-V曲线如图4d所示,结果显示用紫外-臭氧照射后量子点组装电池效率最高。
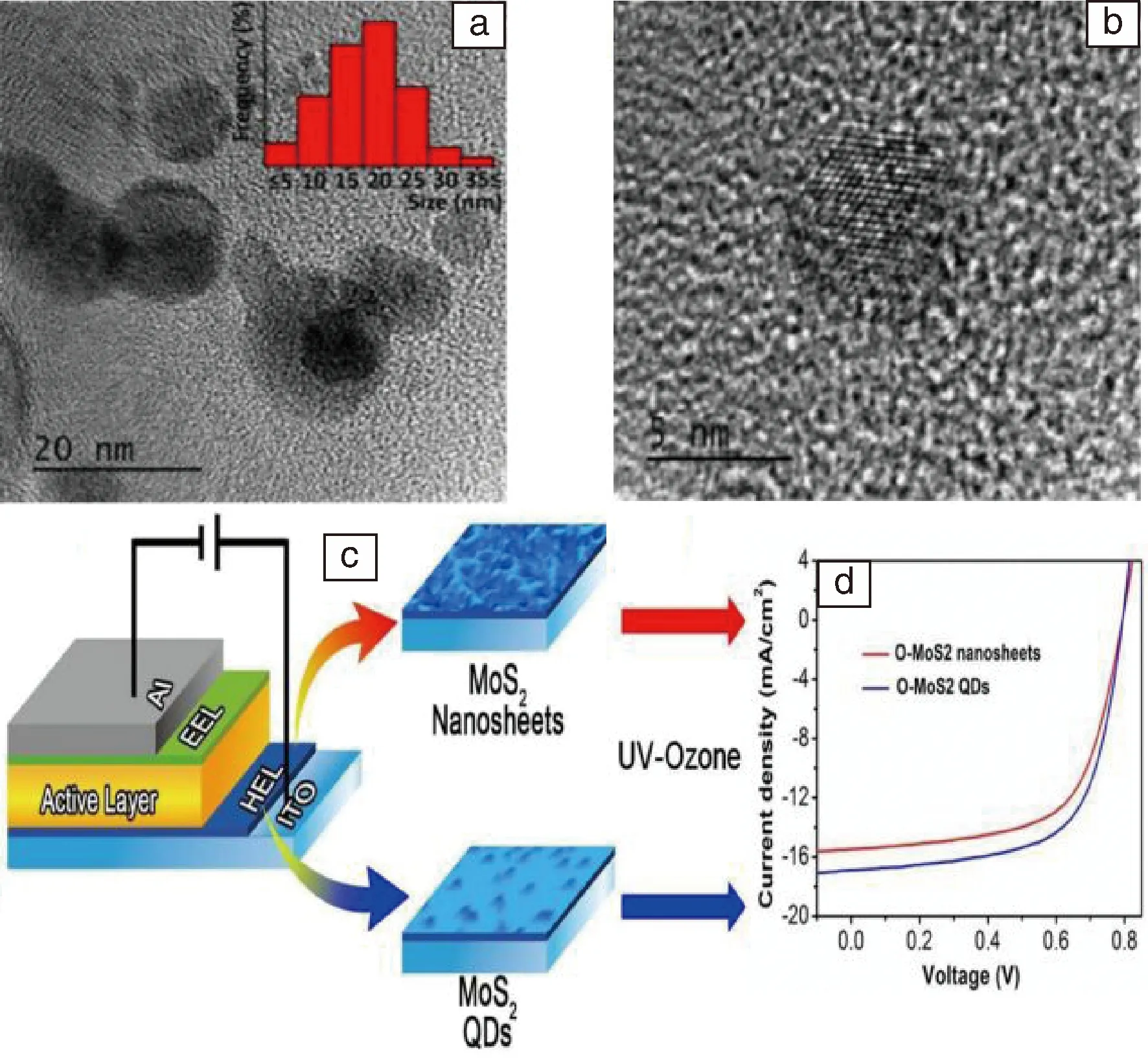
图4 MoS2量子点的HRTEM照片(a),MoS2量子点层面间距(b)[29] ;有机太阳能电池的装置结构示意图(c),有机太阳能电池的J-V曲线(d)[30] Fig.4 HRTEM image of MoS2 quantum dot (a) and in-plane spacing of MoS2 quantum dots (b) [29]; Structure schematic (c) and J-V curve (d) of the organic solar cell [30]
2.2.4 二维薄膜材料
合成MoS2薄膜主要是通过化学气相沉积法(CVD)。Lee等[31]通过气相沉积法在蓝宝石和SiO2衬底上生长出大尺寸单层的二硫化钼薄膜,通过X光电子能谱(XPS)、PL测试研究其电子结构和性能。Huang等[32]通过界面应力形成垂直异质结器件,利用CVD法制备MoS2薄膜,在垂直方向引入界面压力,光照前后器件的势垒高度发生变化,影响其电学和光学性能。该方面研究将有助于进一步了解在界面压力存在下,基于二维材料的异质结器件的电荷输运性质如何改变,最终使电子和光电器件的设计具有新颖的功能。Kim等通过多层过渡金属双硫化合物,将单层(ML)MoSe2和ML MoS2垂直堆叠,提供了一个方便的方式设计二维激子系统。研究中发现薄膜之间的电荷会发生转移,最后呈现出显著增强的PL现象[33]。Wu等[34]报道了一种CVD法制备的大尺寸高质量的二硫化钼薄膜,制备的薄膜尺寸可达到25 μm,图5为用此法在不同基底上生长的MoS2薄膜的SEM照片。

图5 不同衬底生长的MoS2薄膜:(a)蓝宝石,(b) SiO2,(c) 玻璃衬底; AFM测试的黑线之间的单层薄膜厚度(d) [34]Fig.5 Morphologies of MoS2 thin films on different substrates: (a) sapphire, (b) SiO2, (c) glass; Monolayer film thickness characterized by AFM line profile (d) [34]
3 MoS2为基复合材料的应用研究
通过不同方法制备各种形貌的MoS2,由于其较好的离子交换/插入性能,以及优异的吸收、光催化性能,MoS2纳米材料一直在光催化降解有机染料、电化学析氢及其电池性能的应用方面备受关注。
3.1 光催化性能研究
探索光降解性能研究方面,研究者们将氧化物与MoS2复合来研究其对催化性能的影响,然而目前很少有研究涉及其电子结构的变化对能带位置是否偏移的影响。氧化物与二硫化钼形成的复合材料,可以有效增加电子空穴对的分离,提高量子产率,使得催化剂表面增加对光的吸收,具体来说是不同复合材料的能带位置发生了变化。
3.1.1 可见光的吸收及其能带位置变化
Chen[22]等对二氧化钛纳米带进行不同的酸改性和碱改性,导致形貌差异较大,进而影响了界面电子性能。硫酸改性降低了二氧化钛表面的功函数,影响了导带能级差值(CBO)。
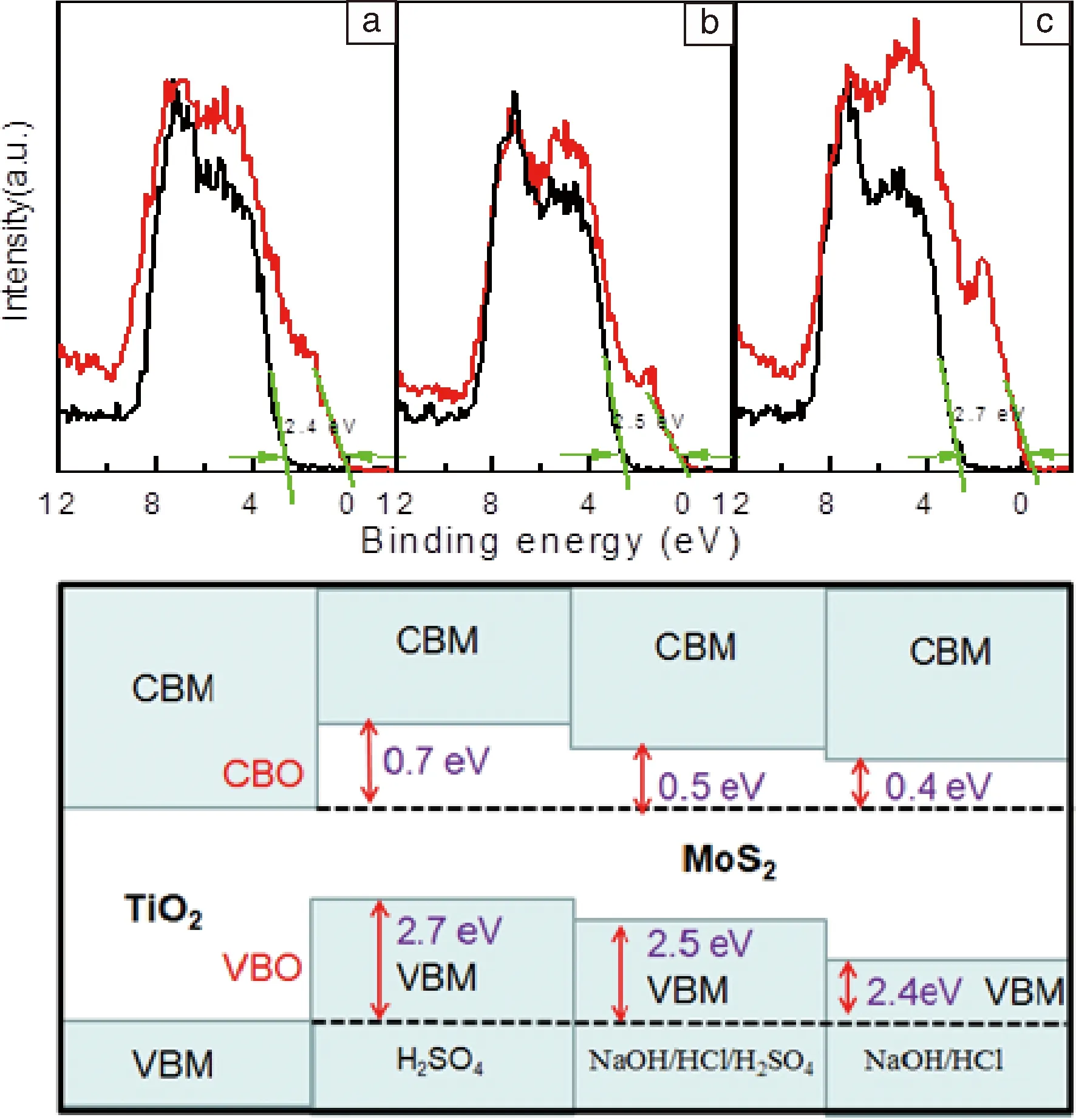
图6 不同改性TiO2纳米带(黑线)及其TiO2@MoS2复合材料(红线)价带值:(a)TiO2-NH,(b)TiO2-NHH,(c)TiO2-H;不同改性的TiO2@MoS2复合材料能带结构示意图(d)[22]Fig.6 Valence band spectra of the modified TiO2 nanobelts and their composites with MoS2: (a)TiO2-NH,(b)TiO2-NHH,(c)TiO2-H;Diagram showing the energy band structures of the TiO2@MoS2 composites (d) [22]
图6显示了不同改性TiO2纳米带及以其为基的TiO2@MoS2复合材料的价带值,价带能级差值(VBO)从2.4 eV增加到2.7 eV,显然不同表面处理对界面电子行为有重要的作用。经H2SO4改性处理后,由于界面态作用使得VBO增加,当VBO变化大于Ti-O分离的变化,VBO可以部分影响表面处理的电子分布。另一原因是由于MoS2与TiO2的界面反应使得MoS2能带有不同的能量值。界面电子结构不同进而会影响电荷转移性能和催化性能(如图8a和图8b)。硫酸改性的二氧化钛的复合材料的VBO差值最大,理论上MoS2/TiO2-H的催化性能最好,其次是MoS2/TiO2-NHH,最后是MoS2/TiO2-NH材料,其复合材料吸收范围可用紫外可见光谱(UV-vis)测试,基本可以扩展到整个范围。
3.1.2 电子/空穴的分离及提高光催化性能
Zhou[2]等人用硫酸改性二氧化钛纳米带表面,并将其与Ag2O粒子复合得到Ag2O/TiO2异质结构,提高了其光催化性能。新加坡Zhou等人[14]将制备的TiO2纳米带用稀硫酸改性,后与MoS2纳米片复合,得到的异质结构催化性能较好。TiO2和MoS2的能带带隙值分别是3.2和1.2 eV,第一步的反应机制是在光源的照射下MoS2纳米颗粒价带上的电子吸收能量直接跃迁到导带上,然后在价带上留下空穴;第二步反应机制是TiO2的价带低于MoS2的,所以TiO2的价带可以作为光生电子的接受者,吸收来自MoS2导带上的电子。光生电子能够捕获一些溶液中的有机分子去形成单一小分子。同时,空穴将会向反方向移动捕获MoS2纳米颗粒,这样光生电子和空穴能有效分离。Cao等人将二硫化钼纳米片杂交在TiO2表面来降解罗丹明B,如图7,界面耦合的材料相比其他几种材料的光降解性能好,吸收波长范围广、性能好[35]。

图7 不同材料降解染料的染料浓度-时间曲线(a); TiO2/MoS2复合前后的PL峰(b);TiO2/MoS2复合材料催化反应机制示意图(c)[35]Fig.7 The photodegrading curves of different materials (a) ; the PL spectra before and after the composites formtion (b) ; Schematic of catalytic reaction mechanism of TiO2/MoS2 composite (c) [35]
3.2 MoS2为基复合材料的电化学析氢反应(HER)的研究
目前人们发现MoS2是一种很有效的催化剂甚至会取代Pt电极,但是活性位点和较差的导电性限制了MoS2析氢性能的提高。根据其合成方法,二硫化钼的活性位点主要位于MoS2边缘或面内缺陷点。Xie[18]等人研究发现MoS2的电化学析氢性能受到Mo边缘不饱和的S原子与MoS2纳米片的缺陷影响,但是边缘的活性位点不稳定、容易蜷缩,限制其应用,所以制备MoS2为基的复合材料是一种简便弥补的方法。
如前所述,3种不同方法改性的二氧化钛纳米带与二硫化钼复合制备的复合材料中,界面电子性能不同,进一步影响了能带结构。Song等人[36]对其电化学析氢性能进行了研究,如图8。图8a为3种不同改性方法制备的MoS2/TiO2复合材料在相同浓度下对应的HER极化曲线,图8b是与之对应的线性塔菲尔(Tafel)曲线。
从图8a中可以看出,纯MoS2粉末的HER性能较差,但是改性处理后的复合材料的HER性能较好,说明复合材料的界面连接起到了积极的作用;复合材料的HER性能与Pt电极相比尚有提高的空间。MoS2/TiO2-NH、 MoS2/TiO2-NHH和MoS2/TiO2-H的起始电位分别是236,210和153 mV,经硫酸改性的复合材料的初始电位较低,并且阴极电流密度较大,约是纯MoS2粉末的10倍。从图8b我们可以看出,塔菲尔斜率大大降低,从140.7降低到了66.9 mV/dec,其中MoS2/TiO2-H的塔菲尔斜率最低,但与目前报道中二硫化钼纳米片在导电衬底上的数据(40 mV/dec)还有一些差距。Zhu等人[1]研究了MoS2/TiO2纳米带复合材料的电化学阻抗性能(如图8c和8d),4% MoS2/TiO2的圆半径最小,说明其HER性能最好。
Jaramillo[37]等人通过将Mo在H2S气氛中沉积的方法在Au(111)表面上制备二硫化钼纳米颗粒(如图9a),该制备方法能够控制活性位点的数目及其位置,因此能很好地提高催化析氢反应。
Besen等人[38,39]用H2S退火手段添加边缘H原子,该制备手段得到的二硫化钼颗粒既有单层也有多层,单层结构如图9c所示,析氢效果也优于多层,其原因归于电子可以从底部快速转移。但在多层结构中(如图9d),电子从底部转移后还需要通过传输通道才达到所有的边缘,电子在贯穿每一层的时候都会受到阻力,但边缘电导率测试表明,电荷可以沿着基板边缘的活性点位形成低电阻通道。虽有待进一步证实,但目前研究表明,垂直堆叠的MoS2纳米片在光催化领域的应用具有很好的前景。

图8 3种不同改性方法制备的MoS2/TiO2复合材料的HER极化曲线(a)及其塔菲尔曲线(b)[36];MoS2/TiO2纳米带的TEM照片(c);黑暗条件下测试的电化学阻抗的结果(d)[1]Fig.8 HER polarization curves (a) and Tafel curves (b) of MoS2/TiO2 composites[36]; HRTEM image of MoS2 /TiO2 composites (c) ; The test result of electrochemical impedances under dark condition (d) [1]

图9 MoS2纳米片生长在Au(111)平面的STM照片(a)[37];纳米片暴露的Mo与S边缘的球棍模型(b),单层纳米片(c)、多层纳米片堆积(d)中电荷传导路径模型 [38, 39]Fig.9 STM of MoS2 nanoplate on Au(111) (a) [37]; Molecular model of a plate exposing both Mo and S-edges (b) ,schematics of the difference in conductivity to the activesites on nanoplates (c) and nanoparticles (d)[38, 39]
3.3 电池性能的研究
因二硫化钼层面间以较弱的范德华力形式结合,使得外来小尺寸离子较易插入,该特性为MoS2在制备锂离子电池、太阳能电池等方面应用奠定了基础。He等人[40]将MoS2与TiO2纳米颗粒复合制得3种类型的染料双层薄膜异质结。研究表明,以MoS2@TiO2异质薄膜为光电阳极的太阳能电池转换效率达到6.05%,是纯TiO2的1.5倍。Hung等人[41]在MoS2与TiO2的对电极中通过加入Co元素来提高染料敏化太阳能电池的光电性能。Gu等人将MoS2纳米片作为空穴层应用在P3HT:PC61BM上来提高有机太阳能电池的效率,使之达到8.11%[42]。Mao等人通过水热法将二硫化钼纳米片与二氧化钛纳米带复合得到锂离子电池,经过几次充放电,电池的稳定性保持较好[20],如图10a~10c所示。Chen等人[43]将三维少层的MoS2材料与TiO2制得3D FL-MoS2@TiO2作为锂离子电池阳极,具有优秀的储存能力和良好的循环性能,测试的稳定性曲线较平缓,说明电池的稳定性较好,并且多次充放电后其电容量基本保持不变,如图10d~10f所示。

图10 TiO2/MoS2复合材料的SEM照片(a),电池的3次充放电过程(b),TiO2/MoS2复合材料循环的稳定性(c)[20];3D FL-MoS2@TiO2的SEM照片(d),不同材料的循环稳定性(e),循环多次后不同材料电容量的变化(f)[43]Fig.10 SEM image of TiO2/MoS2 hybrids (a) , discharge/charge curves for the first three cycles (b) , cycling performance of TiO2@MoS2 (c) [20]; SEM image of 3D FL-MoS2@TiO2 (d) , cycling performance of different materials (e) , rate-capability performance of the electrodes of different composites materials (f) [43]
4 结 语
大量研究成果展现了二硫化钼与其他功能材料复合的可能性及其广阔的应用前景。目前,二硫化钼的合成方法有水热法、溶剂热法、CVD法及剥离法等,制备的形貌分为纳米花、纳米片、量子点及其单层或少层的二硫化钼薄膜。由于操作简单、形貌容易控制,水热合成路线法比较受大家欢迎。由于具有较大的表面吸收率、边缘存在的活性位点及其较高的电子迁移率,使得二硫化钼广泛应用在光催化、电化学析氢及锂离子电池等方面。本文重点介绍了3种不同方法改性TiO2纳米带,及将其与MoS2纳米片复合的新方法,阐述了表面改性对界面电子性能的调节,进而影响了光催化性能与电化学析氢性能。最后,介绍了MoS2为基的复合材料在电池方面的应用研究进展。
References
[1] Zhu Yanyan,Ling Qiang,Liu Yanfang,etal.PhysChemChemPhys[J],2015,17:933-940.
[2] Zhou Weijia,Liu Hong,Wang Jiyang,etal.ACSApplMater&Interfaces[J],2015,2(8):2385-2392.
[3] Peng Fengping,Zhou Qiang,Zhang Dunpu,etal.AppliCatalB:Environ[J],2015,165:419.
[4] Li Honglin,Yu Ke,Lei Xiang,etal.DaltonT[J],2015,44:10438.
[5] Gao Weilin,Wang Minqiang,Ran Chenxin,etal.ChemCommun[J],2015,51:1709.
[6] Huang Yunpeng,Miao Yue-e,Zhang Longsheng,etal.Nanoscale[J],2014,6(18):10673-10679.
[7] Ran Weixian(冉维娴).DissertationforMaster(硕士论文)[D].Shandong:Shandong University of Science and Technology,2014:6.
[8] Li Jinjiang,Liu Xinjuan,Pan Likun,etal.RSCAdv[J],2014,4:9647.
[9] Chen Yan,Wang Xudong,Wang Peng,etal.ACSApplMater&Interfaces[J],2016,8:32083.
[10] Srivastava A,Fahad M S.Solid-StateElectron[J],2016, 12(126):96-103.
[11] Luan Chao,Zhang Xiaoyan,Yang Kejian,etal.IEEEJSelTopQuant[J],2016,2(23):11.
[12] Huang Huihui,Cui Yue,Li Qi,etal.NanoEnergy[J],2016,8(26):172-179.
[13] Hu Kunhong(胡坤宏),Chen Hong(陈红),Wang Qian(王倩),etal.JournalofHefeiUniversity(合肥学院学报)[J],2008,2(18):45.
[14] Zhou Weijia,Yin Zhongyou,Du Yaping,etal.Small[J],2013,9(1):140-147.
[15] Wang Jilong,Wei Bo,Xu Lingling,etal.MaterLett[J],2016,179:42-46.
[16] Liu Chengbin,Wang Longlu,Tang Yanhong,etal.ApplCatalB-Environ[J],2015,164:1-9.
[17] Guo Yaxiao,Zhang Xiaoyan,ZhangXueping,etal.JMaterChemA[J],2015,3(31):15927-15934.
[18] Xie Junfeng,Zhang Hao,Li Shuang,etal.AdvMater[J],2013,25(40):5807.
[19] Tao Junguang,Chai Jianwei,Lu Xin,etal.Nanoscale[J],2015,7:2497
[20] Mao Minglei,Mei Lin,Guo Di,etal.Nanoscale[J],2014,6(21):12350-12353.
[21] Du Tian,Wang Ning,Chen Haijun,etal.JPowerSources[J],2015,275:943.
[22] Chen Guifeng,Song Xiaolin,Guan Lixiu,etal.Nanotechnology[J],2016,27:355203.
[23] Tan Yinghua,Yu Ke,Li Jinzhu,etal.JApplPhys[J],2014,116(6):1.
[24] Li Haidong,Wang Yana,Chen Guohui,etal.Nanoscale[J],2016,23:168.
[25] Yuan Yongjun,Ye Zhijun,Lu Hongwei,etal.ACSCatal[J],2016,6:532-541.
[26] Ye Jianbo,Ma Lin,Chen Weixiang,etal.JMaterChemA[J],2016,34:1567.
[27] Patil S,Harle A,Sathaye S,etal.CrtstEngComm[J],2014,16:10845.
[28] Li Feng,Li Jing,Cao Zhuo,etal.JMaterChemA[J],2016,7:1
[29] Baldoví H G, Latorre-Sánchez M, Esteve-Adell I,etal.JNanopartRes[J] 2016,18:240.
[30] Xing Wang,Chen Yusheng,Wang Xinlong,etal.ACSApplMater&Interfaces[J],2016,8:26916.
[31] Lee Y H, Zhang Xinquan,Zhang Wenjing,etal.AdvMater[J],2012,24:2320.
[32] Huang F,Cho B,Chung H S,etal.Nanoscale[J],2016,10:1039.
[33] Kim M,Seo C,Kim H,etal.ACSNano[J],2016,10(6):6211-6219.
[34] Wu S,Huang C,Aivazian G,etal.ACSNano[J],2013,7:2768.
[35] Cao Ling,Wang Rong,Wang Dongxiao,etal.MaterLett[J],2015,160:286-290.
[36] Song Xiaolin,Chen Guifeng,Guan Lixiu,etal.ApplPhysExpress[J],2016,9:095801.
[37] Jaramilo T F,Jorgensen K P,Bonde J,etal.Science[J],2007,317(5834):100-102.
[38] Besenbacher F,Brorson M,Clausen B S,etal.CatalCommun[J],2008,130(1):86-96.
[39] Laursen A B,Kegnaes S,Danl S,etal.Energy&EnvSci[J],2012,5(2):5577-5591.
[40] He Zuoli,Que Wenxiu,Xing Yonglei,etal.JAlloysCompd[J],2016,672:481-488.
[41] Hung Haoche,Lin Yow-Jon,Ke Zunyuan,etal.JMaterSci-MaterElectron[J],2016,27(5):5059-5063.
[42] Gu Xing,Cui Wei,Li Hai,etal.AdvEngMater[J],2013,10:1.
[43] Chen Biao,Zhao Naiqin,Guo Lichao,etal.Nanoscale[J],2015,7(30):12895-12905.
Review on Preparation and Properties of MoS2Based Nanocomposites
SONG Xiaolin1, CHEN Guifeng1, GUAN Lixiu2, REN Hui1, CHEN Shiqiang1, CHEN Hongjian1, TAO Junguang1
(1.Key Laboratory for New Type of Functional Materials in Hebei Province, School of Materials Science and Engineering, Hebei University of Technology, Tianjin 300130, China )(2.School of Science, Hebei University of Technology, Tianjin 300130, China)
MoS2is a prototype of layered transition metal dichalcogenides. Owing to its unique electronic structure and physical and chemical performance, it has been widely used in areas of photocatalytical degradation of organic dyes, electrochemical hydrogen evolution reaction, and solar cells, etc.In recent years, MoS2nanomaterials have drawn increased attention due to its high specific surface area, narrow band gap, excellent electrical properties and high electron mobility. However, its intrinsic defect structures limit its applications in many ways. This review introduces different preparation methods for MoS2with varied structure and morphologies. In addition, MoS2-based functional materials can be engineered by the interface modification with increased active sites, which reduces the electron-hole recombination rate thus increases higher quantum yield and enhances the cycle stability. In the end, we review its applications in areas of environment and energy.
MoS2; nanocomposite materials; photocatalysis; electrochemical hydrogen evolution reaction; battery performance
2016-10-31
宋晓琳,女,1990年生,硕士研究生
陶俊光,男,1981年生,教授,Email:jgtao@hebut.edu.cn
10.7502/j.issn.1674-3962.2017.12.07
TQ136.1+2
A
1674-3962(2017)12-0929-09
(编辑 惠 琼)

