体表电刺激对自主性膀胱排尿功能的影响①
张艳,牛见升,于慧金,李惠玲,曾伟杰,赵力生,叶继萍,孙军弟
体表电刺激对自主性膀胱排尿功能的影响①
张艳1a,牛见升1a,于慧金1a,李惠玲1b,曾伟杰1a,赵力生1a,叶继萍2,孙军弟1a
目的观察体表电刺激联合膀胱功能训练对S2-4脊髓损伤或马尾、盆神经损伤后自主性膀胱患者的疗效。方法2016年1月至2017年8月,采用真实世界研究方法将76例脊髓损伤自主性膀胱患者分为对照组(n=29)和观察组(n=47)。对照组进行常规膀胱功能训练,观察组在对照组基础上联合膀胱肌肉电刺激治疗。于治疗前、治疗3个月后分别检测两组患者排尿日记、尿流动力学指标。结果治疗后,两组24 h尿失禁次数、24 h排尿次数、残余尿量明显减少(t>3.251,P<0.01),每次排尿量显著增加(t>5.000,P<0.001),最大膀胱容量、最大尿流率增加(t>1.922,P<0.05),充盈末期逼尿肌压显著减小(t>8.302,P<0.001);观察组均优于对照组(t>1.919,P<0.05)。结论肌肉电刺激联合膀胱功能训练可进一步改善脊髓损伤自主性膀胱的排尿功能。
脊髓损伤;自主性膀胱;体表电刺激;尿动力学
自主性膀胱是由于脊髓排尿反射中枢或马尾、盆神经损害,使膀胱完全脱离感觉、运动神经支配而成为自主器官。早期主要表现为排尿困难、膀胱膨胀,后期会出现充盈性尿失禁。如未及时得到有效治疗,会出现膀胱进行性萎缩;在此过程中如果并发感染,将加重萎缩的速度。传统的药物和手术治疗难以达到满意的疗效[1-2]。目前对于神经源性膀胱逼尿肌过度活动症的研究较多,而自主性膀胱因膀胱感觉消失导致的尿失禁鲜有疗效确切的报道。本研究总结在本科采用体表电刺激治疗脊髓损伤后自主性膀胱患者的研究资料,并与单纯膀胱功能训练患者进行比较,报道如下。
1 资料与方法
1.1 一般资料
2016年1月至2017年8月门诊及住院的脊髓损伤患者,诊断符合脊髓损伤神经学分类国际标准检查表最新修订及解读[3]。纳入标准:①S2-4脊髓损伤或马尾、盆神经损伤后自主性膀胱患者;②年龄<60岁;③存在明确的排尿功能障碍[4],连续3 d排尿日记显示功能性膀胱容量<300 ml;④尿动力学检查证实膀胱冷热感及膨胀感消失,膀胱内压随容量增加直线上升;⑤病程8~20个月,已过脊髓休克期,病情稳定;⑥无意识障碍及认知障碍,能配合本项目研究,保证在治疗期开始时及治疗结束后1个月内配合各项评价量表的评估,并签署知情同意书。
排除标准:①并发严重心脑血管或肝肾等疾病,意识不清;②骶尾部严重压疮感染或全身感染;③接受长期膀胱造瘘或骶神经电极置入治疗;④伴脊髓或泌尿系统肿瘤。
本研究共纳入符合条件的患者83例,研究过程中脱落7例:因故提前出院终止康复治疗5例,其中观察组2例,对照组3例;治疗过程中因肺部感染转往呼吸科治疗退出本研究2例,均为对照组。研究结束时共获得完整的病例资料76例。以上患者按照具体病情及个人康复治疗意愿,分为对照组(n=29)和观察组(n=47)。两组性别、年龄、病程、损伤平面、损伤程度无显著性差异(P>0.05)。见表1。
本研究经本院医学伦理委员会审核批准。
1.2 方法
对照组采用常规膀胱功能训练,包括间歇导尿和常规康复训练。观察组在对照组基础上接受膀胱肌肉电刺激治疗。
1.2.1间歇导尿
间歇导尿[5-6]是逼尿肌无反射患者膀胱排空的“金标准”[7]。间歇导尿的时间根据残余尿量的多少制定:>300 ml,每4小时导尿1次;200~300 ml,每6小时导尿1次;150~200 ml,每8小时导尿1次;100~150 ml,每12小时导尿1次;连续1周残余尿量<80 ml则停止间歇导尿并每周复查残余尿量。
1.2.2常规康复训练
两组均接受行为管理和各种训练方法诱发排尿反射,加强膀胱的排空功能[8]。①制定饮水计划:6:00~20:00每小时饮水150 ml左右(包括进食时喝汤等);24 h饮水量夏、秋季节2500~3000 ml,冬、春季节2000~2500 ml。②屏气法:在泌尿系超声监测上尿路安全的前提下,通过增加腹部力量来提高膀胱内的压力并使膀胱颈开放而引起排尿,患者身体前倾快速呼吸3~4次,以延长屏气,增加腹压的时间,后做一次深吸气,然后屏住呼吸,向下用力做排便动作。③选定两个间歇导尿时间,间隔12 h,用冷热交替膀胱冲洗,导出残余尿量后,首先使用40℃的生理盐水250 ml进行灌注并保留5 min,使膀胱逼尿肌在温热条件下松弛,导出灌注液。改用4℃的生理盐水250 ml进行膀胱灌注并保留5 min,用冷刺激法使膀胱逼尿肌收缩,再导出灌注液。每天两次,5 d为1个疗程,间隔2 d再进行下1个疗程。反复对患者进行训练从而达到接近正常模式的膀胱排尿方法。3个月后进行疗效评价。

表1 两组患者基线资料比较
1.2.3膀胱肌肉电刺激
于每天膀胱训练前,采用600LY2型膀胱神经和肌肉电刺激治疗仪(无锡华纳医疗科技有限公司),功率100 W,电极片3×3 cm,为了使电刺激能准确地刺激膀胱壁,电刺激时间安排在每次间歇导尿前20 min开始,此时膀胱会保持相对充盈的状态。患者取侧卧位,在放置电极片的位置用棉球蘸无刺激水做皮肤清洁,通过膀胱的体表解剖位置及叩诊法判断膀胱近顶部的两侧壁;电刺激治疗仪的4个电极片分为两组两种颜色,将一种颜色的两个电极片贴在脐与耻骨联合之间膀胱两侧,另一种颜色两个电极片根据骶骨的骨性标志贴在第三骶骨旁开1横指位置骶后孔的位置[9]。频率(40±20)Hz,电流强度根据患者的主观感觉和最大耐受程度确定。对感觉减退及消失者,观察患者电极区肌肉收缩情况,以出现适度肌肉收缩为度,最大不超过50 mA。治疗时间20 min。每天2次,6 d为1个疗程,休息1 d后进行下一个疗程,3个月后进行疗效评价。
1.3 评价指标
两组均在康复医师的指导下由经过培训的护士进行一对一单独施测。
1.3.1排尿日记
记录两组治疗前连续3 d、治疗3个月后连续3 d的排尿日记。排尿日记使用国际尿失禁咨询委员会推荐的短版本[10],包括24 h失禁次数、24 h排尿次数、每次排尿量、残余尿量等,取3 d的平均值。
1.3.2尿流动力学检查
治疗前和治疗3个月后进行尿流动力学检查,包括最大膀胱容量、充盈末期逼尿肌压、最大尿流率等。
1.3.3自主排尿
自主排尿包括膀胱反射的建立,自主、规律控制排尿,残余尿量<80 ml;停止间歇导尿的时间。
各项评价均在治疗前及治疗结束后1个月内完成。
1.4 统计学分析
由未参加实验的专业人员进行。采用SPSS 10.0进行数据分析,计量资料符合正态分布,以(xˉ±s)表示。组内治疗前后比较采用配对t检验,组间比较采用独立样本t检验;计数资料比较采用χ2检验。显著性水平α=0.05。
2 结果
2.1 排尿日记
两组治疗前24 h尿失禁次数、24 h排尿次数、每次排尿量、残余尿量均无显著性差异(P>0.05)。治疗后,两组24 h尿失禁次数、24 h排尿次数、残余尿量明显减少(P<0.01),每次排尿量显著增加(P<0.001),观察组均优于对照组(P<0.05)。见表2。
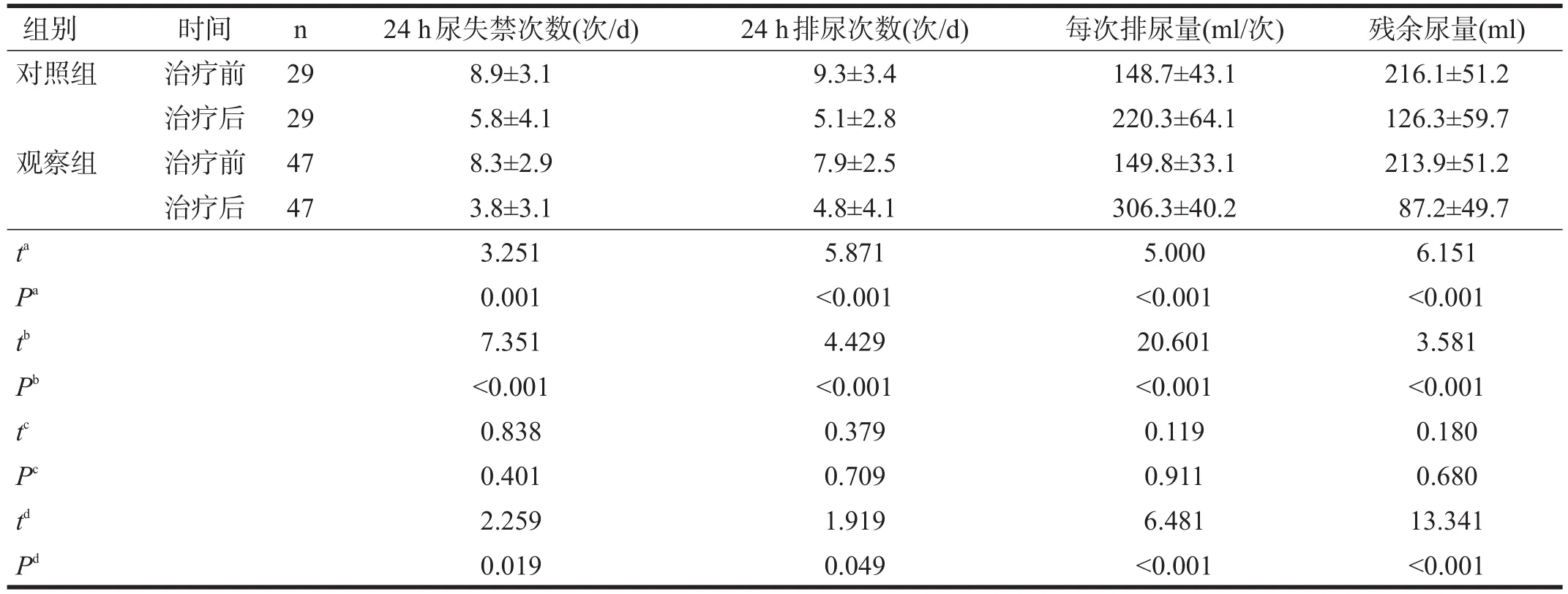
表2 两组治疗前、后排尿日记比较
2.2 尿流动力学检查
两组治疗前最大膀胱容量、充盈末期逼尿肌压、最大尿流率均无显著性差异(P>0.05)。治疗后,两组最大膀胱容量、最大尿流率增加(P<0.05),充盈末期逼尿肌压显著减小(P<0.001),观察组均优于对照组(P<0.05)。见表3。
2.3 自主排尿
观察组恢复自主排尿率高于对照组(P<0.05),自主排尿恢复时间显著少于对照组(P<0.001)。见表4。
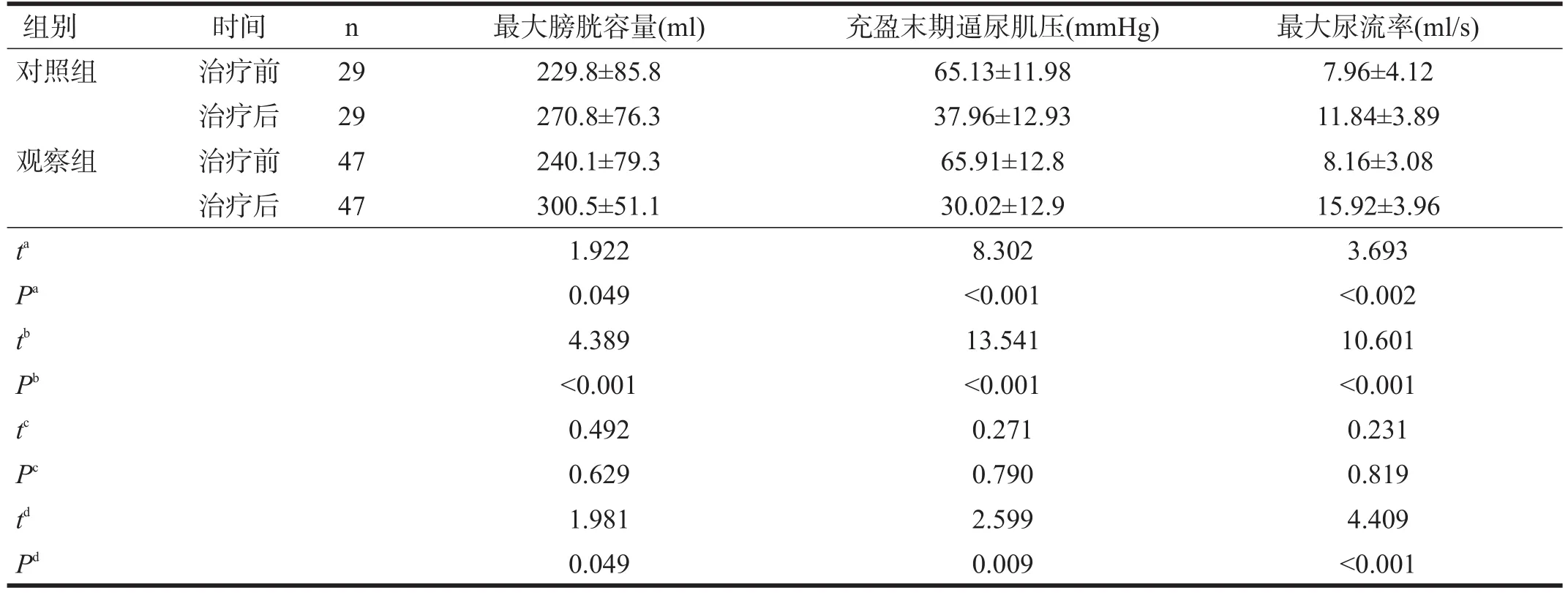
表3 两组治疗前后尿流动力学变化
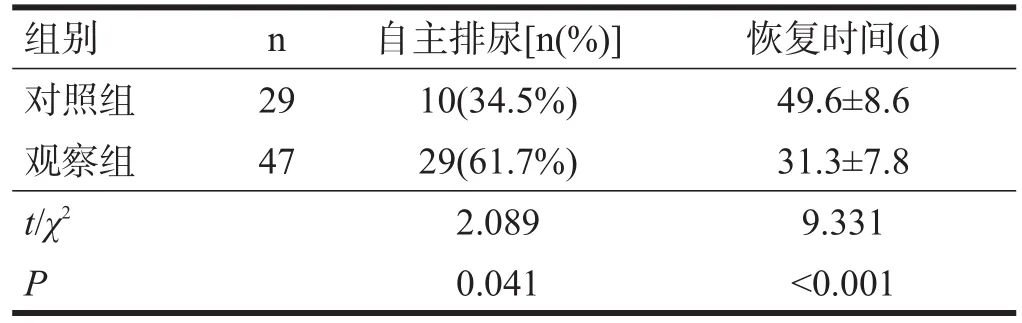
表4 两组自主排尿比较
3 讨论
L2以下骶髓损伤后膀胱的感觉和运动脱离排尿中枢的控制而独立活动,膀胱失去正常排尿及收缩的功能而出现尿失禁。而尿失禁被认为是脊髓损伤后严重的并发症之一。尿失禁患者残余尿量及尿液的滴漏等可引起反复的泌尿系感染,严重时可导致肾功能衰竭,使患者的生活质量受到严重影响。因此,采取各种方法恢复患者的自主性排尿节律,通过消除危险因素、对患者长期正确的康复治疗以达到最佳的生活质量,使患者预期寿命不受脊髓损伤的影响,已成为治疗脊髓损伤患者尿失禁的主要的目的[11]。
本研究纳入S2-4脊髓损伤或马尾、盆神经损伤后自主性膀胱患者,这类患者就诊的主要问题是尿失禁。目前针对脊髓损伤后尿失禁的治疗主要包括药物治疗,膀胱功能训练及A型肉毒毒素经尿道逼尿肌注射。膀胱功能训练已得到广泛的认可[12]。A型肉毒毒素虽然效果确切,但因疗效持续时间短、费用昂贵而无法广泛应用[13-14]。
电刺激可通过激活支配逼尿肌的运动神经纤维促进膀胱收缩和排空,提高膀胱内压;储尿期可抑制逼尿肌的异常反射,激活闭合尿道括约肌,防止尿液外溢,从而实现储尿的功能[15]。
本研究所采用的体表电刺激是在膀胱区域和S3神经孔处的表面电刺激,以改善患者膀胱的感觉功能,使患者重新获得感知膀胱容量的能力,根据尿动力学检查和患者感觉来判断是否需要排空膀胱,以指导患者在膀胱安全容量期及时排空膀胱,达到保护上尿路的目的[16]。
电刺激的一组电极片刺激S3神经孔处所对应的皮肤,间接刺激S2-4神经。电刺激骶神经可明显增加逼尿肌收缩容积,从而减少每周尿失禁次数[17]。有临床资料显示,经体表电刺激治疗神经源性膀胱后,患者单次排尿量增加,残余尿量减少,并且这种治疗效果随着治疗时间的增加而更加明显[18]。陈舜喜等[19]对72例膀胱排尿功能障碍患者经神经肌肉电刺激治疗,同样证明通过体表电刺激联合膀胱功能训练能改善患者尿频、漏尿症状,更好地保护肾脏的功能。还有研究显示,电刺激能诱导神经生长因子的表达,为神经再生创造有利的微环境,使得受损的脊髓神经建立新的轴突联系,加快神经营养因子的传输[20]。体表电刺激还因增强排尿意识、增加盆底肌张力及抑制逼尿肌过度活动等优点,近年来受到学者们关注[21];经过体表电刺激治疗后,患者的膀胱容量得到提高,无抑制性收缩明显减少,对于难治性尿失禁有明确的治疗效果[22]。
本研究所采用的电刺激部位分别是膀胱的两侧和双侧S3神经孔所对应的皮肤。有报道刺激多个神经反射通路可增强脊髓回路的激活,并可能改善膀胱排空[23]。另外刺激强度也是预测膀胱容量增加的重要因素。随着强度的增加,膀胱容量增加的方差显著增加。其他因素没有贡献膀胱容量增加[24]。
本研究采用的膀胱功能训练方法之一是冷热交替的膀胱冲洗方法。谢静茹等[25]的研究显示,体表电刺激联合冷热交替膀胱冲洗的治疗方法能增加膀胱容量,有效地减少患者残余尿量,减少泌尿道感染发生的机会。目前体表电刺激治疗脊髓损伤后排尿功能障碍的作用机理尚不完全清楚,可能与骶神经根部存在较多的抑制和兴奋排尿有关的物质,电刺激后这些物质大量释放,促进排尿功能的恢复[26]。
自主性膀胱患者会出现明显对膀胱容量的感觉减退或完全丧失,所以膀胱内残余尿量可从很少到大量,完全决定于患者对膀胱容量增加的调节能力、膀胱颈部平滑肌和外括约肌的功能以及神经损害的程度。本研究结果显示,经过3个月体表电刺激联合膀胱功能训练治疗后,观察组排尿功能明显好转,尿失禁次数、残余尿量明显减少,膀胱容量增加,逼尿肌压减小,大部分患者实现自主控制排尿,有效保护了上尿路安全,基本实现脊髓损伤尿失禁患者治疗的主要目标。
脊髓损伤后排尿功能障碍不但严重困扰和影响患者的生活质量,同时也给社会、家庭造成较大的精神和经济负担。随着膀胱功能训练及电刺激等其他治疗技术日趋成熟,有望给患者带来更满意的治疗效果。虽然体表电刺激治疗效果和植入性骶神经电刺激相比还不甚满意,但因其操作不侵入、简单易行、无明显不适感,患者依从性较好,可以推广应用。但电刺激的确切作用机制仍需进一步研究,未来研究方向是进一步规范、精确电刺激治疗的部位、刺激强度、刺激频率等参数,电刺激后的近期、远期疗效判定还需要有同质化的标准。本研究病例数量较少,下一步应加大病例样本量进一步观察长期疗效。
致谢
本文统计学部分由兰州大学循证医学中心田金徽教授的团队完成,在此表示由衷的谢意!
[1]Van Rey FS,Heesakkers JP.Applications of neurostimulation for urinary storage and voiding dysfunction in neurological patients[J].Urol Int,2008,81(4):373-378.
[2]Goessaert AS,Everaert KC.Onabotulinum toxin A for the treatment of neurogenic detrusor overactivity due to spinal cord injury or multiple sclerosis[J].Expert Rev Neurother,2012,12(7):763-775.
[3]王一吉,周红俊,李建军,等.脊髓损伤神经学分类国际标准检查表最新修订及解读[J].中国康复理论与实践,2015,21(8):879-882.
[4]廖利民,丛惠伶.神经源性膀胱的诊断与治疗[J].临床外科杂志,2010,18(11):725-727.
[5]刘铁军,赵盟杰,沙可夫.相对安全膀胱容量间歇导尿法保护上尿路的临床研究[J].中国康复理论与实践,2010,16(8):792-793.
[6]熊宗胜,高丽娟,赵超男.间歇导尿在脊髓损伤患者中的应用[J].中国康复理论与实践,2003,9(4):223-225.
[7]Wyndaele JJ.Intermittent catheterization:which is the optimal technique?[J].Spinal Cord,2002,40:432-437.
[8]郭应禄,杨勇.尿失禁[M].济南:山东科学技术出版社,2003:330.
[9]Kennelly M,Dmochowski R,Ethans K,et al.Long-term efficacy and safety of onabotulinum toxin A in patients with urinary incontinence due to neurogenic detrusor overactivity:an interim analysis[J].Urology,2013,81(3):491-497.
[10]廖利民,鞠彦合.第三届国际尿失禁咨询委员会最终推荐意见:神经源性尿失禁部分[J].中国康复理论与实践,2005,11(11):881-882.
[11]廖利民,吴娟,鞠彦合,等.脊髓损伤患者泌尿系管理与临床康复指南[J].中国康复理论与实践,2013,19(4):301-317.
[12]Hattori T.[Diagnosis and treatment of neurogenic bladder][J].[in Japanese].Rinsho Shinkeigaku,2007,47(11):766-768.
[13]D'Ancona CA,Ferreira RS,Rassi MC.Botulinum toxin in neurogenic detrusor overactivity[J].Int Neurourol J,2012,16(3):139-143.
[14]Hikita K,Honda M,Kawamoto B,et al.Botulinum toxin type A injection for neurogenic detrusor overactivity:clinical outcome in Japanese patients[J].Int J Urol,2013,20(1):94-99.
[15]陈国庆,廖利民.骶上脊髓损伤后神经源性膀胱的电刺激治疗[J].中国康复理论与实践,2010,16(12):1117-1120.
[16]吴娟,廖利民,万里,等.电刺激治疗神经源性膀胱感觉功能障碍的疗效观[J].中国脊柱脊髓杂志,2012,22(12):1059-1062.
[17]丛惠伶,廖利民,司同,等.电针调节骶3神经治疗神经源性逼尿肌过度活动的效果研究[J].中华泌尿外科杂志,2010,31(11):741-744.
[18]陈立霞,张杨,岳寿伟.低频电刺激治疗脊髓损伤后神经源性膀胱尿潴留疗效观察[J].山东医药,2014,54(28):55-57.
[19]陈舜喜,郑家鼎,王宏秀.神经肌肉电刺激辅助治疗脊髓损伤神经源性膀胱的临床探析[J].新医学,2014,45(1):57-59.
[20]陈虹,李俊岑,党彦丽,等.电刺激对大鼠脊髓损伤后神经生长因子表达的影响[J].中国康复理论与实践,2012,18(1):33-36.
[21]魏清川,奚颖,马惠,等.体表电刺激治疗急性脑卒中后排尿障碍的临床观察[J].中国康复医学杂志,2012,21(3):235-239.
[22]刘奕,徐贞杰,向连,等.体表神经电刺激治疗脊髓损伤后神经源性膀胱的临床观察[J].中医药导报,2013,19(11):1-3.
[23]Brose SW,Bourbeau DJ,Gustafson KJ.Genital nerve stimulation is tolerable and effective for bladder inhibition in sensate individuals with incomplete SCI[J].Spinal Cord Med,2017,10:1-8.[Epub ahead of print].
[24]McGee MJ,Swan BD,Danziger ZC.Multiple reflex pathways contribute to bladder activation by intraurethral stimulation in person with spinal cord injury[J].Urology,2017,109:210-215.
[25]谢静茹,李娇.体表膀胱及骶神经电刺激联合冷热交替膀胱冲洗法对脊髓损伤后神经源性膀胱功能恢复的影响[J].实用临床医学,2014,15(11):25-27.
[26]Lavelle JP,Teahan S,Kim DY,et al.Medical and minimally invasive treatment of urinary incontinence[J].Rev Urol,1999,1(2):111-119.
Effects of Surface Electrical Stimulation on Urination Function ofAutonomic Bladder
ZHANG Yan1a,NIU Jian-sheng1a,YU Hui-jin1a,LI Hui-ling1b,ZENG Wei-jie1a,ZHAO Li-sheng1a,YE Ji-ping2,SUN Jun-di1a
1.a.Rehabilitation of Spinal Cord Injury,b.Department of Outpatient,Gansu Rehabilitation Center Hospital,Lanzhou,Gansu 730000,China;2.Department of Orthopedics,First People's Hospital of Yunnan Province,Kunming,Yunnan 650032,China
YE Ji-ping.E-mail:1213346203@qq.com
ObjectiveTo observe the effect of electrical stimulation combined with bladder function training on autonomic bladder patients after S2-4spinal cord injury or cauda equina and pelvic nerve injury.MethodsFrom January,2016 to August,2017,76 patients with autonomic bladder after spinal cord injury were divided into control group(n=29)and observation groups(n=47)in real world study.The control group
routine bladder function training,and the observation group received bladder muscle stimulation therapy in addition.The micturition diary and urodynamic indexes were assessed before and three months after treatment.ResultsAfter treatment,the frequency of urinary incontinence and the number of micturition in 24 hours,and residual urine volume significantly reduced(t>3.251,P<0.01),the urine output every time significantly increased(t>5.000,P<0.001),the maximum bladder capacity and urine flow rate increased(t>1.922,P<0.05),and the detrusor pressure in the end of filling period significantly reduced(t>8.302,P<0.001).All the indexes above were better in the observation group than in the control group(t>1.919,P<0.05).ConclusionElectrical muscular stimulation combined with the bladder functional training could improve the urination function in the patients with autonomic bladder after spinal cord injury.
spinal cord injury;autonomic bladder;surface electrical stimulation;urodynamics
R694
A
1006-9771(2017)12-1420-05
[本文著录格式]张艳,牛见升,于慧金,等.体表电刺激对自主性膀胱排尿功能的影响[J].中国康复理论与实践,2017,23(12):1420-1424.
CITED AS:Zhang Y,Niu JS,Yu HJ,et al.Effects of surface electrical stimulation on urination function of autonomic bladder[J].Zhongguo Kangfu Lilun Yu Shijian,2017,23(12):1420-1424.
甘肃省中医药管理局科研课题(No.GZK-2017-58)。
1.甘肃省康复中心医院,a.脊髓损伤康复科,b.门诊部,甘肃兰州市730000;2.云南省第一人民医院骨科,云南昆明市650032。作者简介:张艳(1966-),女,汉族,四川遂宁市人,副主任医师,主要研究方向:脊髓损伤与神经康复。通讯作者:叶继萍。E-mail:1213346203@qq.com。
10.3969/j.issn.1006-9771.2017.12.011
2017-09-30
2017-11-21)

