PCV2 Cap蛋白噬菌体单链抗体库的构建及淘选
周景明,张秋丽,张改平,刘红亮,祁艳华,宋瑞雪,耿 玥,王爱萍(郑州大学 生命科学学院,郑州 450001)
PCV2 Cap蛋白噬菌体单链抗体库的构建及淘选
周景明,张秋丽,张改平,刘红亮,祁艳华,宋瑞雪,耿 玥,王爱萍
(郑州大学 生命科学学院,郑州 450001)
用重组的PCV2 Cap蛋白免疫Balb/c小鼠,从免疫小鼠脾细胞中提取总RNA,经反转录后,扩增抗体重链可变区(VH)和轻链可变区(VL)基因,利用Overlap PCR方法将VH基因和VL基因组装成单链抗体(ScFv)基因,将ScFv基因克隆到噬菌粒载体pCANTAB-5E中,并将重组载体转化至感受态大肠杆菌TG1中,获得PCV2 Cap蛋白的单链抗体文库,经测定抗体库库容为3.58×106。通过辅助噬菌体M13K07拯救,构建鼠源PCV2 Cap蛋白的噬菌体单链抗体库。4 轮生物淘选后,经ELISA方法检测,最终获得3 株能与Cap蛋白特异性结合的噬菌体克隆。
PCV2;Cap蛋白;单链抗体;噬菌体单链抗体库
断奶仔猪多系统衰竭综合征(postweaningmultisystemic wasting syndrome, PMWS)是一种严重危害养猪业的传染性疾病。1992年,PMWS在加拿大爆发[1],表现为仔猪淋巴系统病变,免疫力下降,进而导致患猪被其他多种病原混合感染,生产机能下降,给养猪业造成严重的经济损失。
Beach等[2]和Ellis等[3]在感染PMWS的猪群中分离得到猪圆环病毒Ⅱ型(porcine circovirus type 2,PCV2),并确定PCV2是引起PMWS的主要病原。PCV2属于圆环病毒科、圆环病毒属,是单链环状DNA病毒。它含有2 个主要的开放阅读框ORF1和ORF2,ORF1编码的Rep蛋白与病毒的复制有关,ORF2编码的Cap蛋白与病毒结构相关,是病毒的抗原决定区[4-5],同时也是特异性检测PCV2抗体的理想抗原。
目前,国内外研究人员已建立多种PCV2及其抗体的检测方法,如病毒分离、PCR、ELISA、IFA等实验室检测方法[6-7],以及简单、方便、快速的试纸检测方法。20世纪80年代初基因重组抗体技术的出现[8],使高质量、价廉、易得抗体的制备成为可能,为建立高效率、简单方便的免疫分析检测技术奠定基础[9-12]。但目前尚无有关PCV2Cap蛋白噬菌体单链抗体的报道。
PCV2的Cap蛋白N端核定位序列影响蛋白的可溶性,且与其免疫原性无关[3]。本研究以去除核定位序列的重组Cap蛋白为抗原,利用噬菌体展示技术构建PCV2Cap蛋白鼠源噬菌体抗体库,并进行初步筛选,为鼠源PCV2特异性单链抗体的制备奠定基础。
1 材料与方法
1.1 主要材料
质粒pET28a-ORF2、E.coliTG1、噬菌粒载体pCANTAB-5E由郑州大学生命科学学院分子免疫学实验室保存,辅助噬菌体M13K07购自NEB公司,反转录试剂盒购于Thermo公司,DNA纯化回收试剂盒、SfiⅠ和NotⅠ限制性内切酶、Taq酶、Prime STAR HS DNAPolymerase、T4连接酶购于TaKaRa公司,Balb/c鼠购于河南省实验动物中心。
1.2 PCR引物
鼠源抗体重链、轻链可变区引物[13]由上海生工生物工程股份有限公司合成。根据Overlap PCR的原理,VH接头(VH-L)基因的下游引物与VL接头(L-VL)基因的上游引物重叠25个碱基序列,引物序列见表1。

表1 试验所用的PCR引物序列Table 1 The primers for PCR amplification
注Note: S=G(C); M=A(C);R=A(G);W=A(T).
1.3 重组Cap蛋白的表达与纯化
1.3.1 Cap蛋白的诱导表达及鉴定 将pET28a-ORF2重组质粒转化至大肠杆菌BL21中,培养至对数期,加入1 mmol/L IPTG,30 ℃诱导表达10 h。以pET28a-BL21作对照,进行SDS-PAGE,鉴定目的蛋白表达情况。SDS-PAGE后,进行Western blot鉴定,以鼠抗His单克隆抗体(1∶2 000)作为一抗,HRP标记的羊抗鼠IgG(1∶2 000)作为二抗,用AEC显色液进行显色后观察结果。取诱导后的菌液进行超声破碎并离心,分别取上清与沉淀进行SDS-PAGE分析表达产物的可溶性。
1.3.2 蛋白纯化及质量浓度测定 采用Ni-NTA亲和层析法纯化Cap重组蛋白,0.5 mol/L咪唑洗脱目的蛋白,将收集到的蛋白透析后,用SDS-PAGE鉴定纯化结果,同时利用BCA蛋白定量试剂盒检测蛋白质量浓度。
1.4 Cap蛋白噬菌体抗体库的构建
1.4.1 小鼠免疫及小鼠脾细胞总RNA提取 以重组的Cap蛋白为免疫原免疫Balb/c鼠,免疫剂量为每只50 μg,每次免疫相隔15 d,共进行4 次免疫,第4 次免疫后第10天小鼠尾静脉采血分离血清,利用间接ELISA测定抗体效价,从血清抗体效价较高的小鼠脾细胞中提取总RNA,使用微量紫外分光光度计测定RNA质量浓度,并采用10 g/L琼脂糖凝胶电泳鉴定RNA的完整性。
1.4.2 抗体可变区VH、VL的扩增及拼接 以提取的总RNA为模板,以Oligo(dT)18为引物,参照cDNA合成试剂盒说明书合成cDNA,-80 ℃冻存,备用。以cDNA为模板,扩增抗体VH、VL基因,纯化回收。以回收产物为模板,以带有酶切位点的VH接头、VL接头基因的上下游引物扩增VH和VL接头序列。用10 g/L琼脂糖凝胶电泳鉴定,并切胶纯化回收目的片段。采用Overlap-PCR的方法,将VH-L、L-VL的纯化回收产物按1∶1比例混合,以ScFv全长基因引物扩增目的片段ScFv,10 g/L琼脂糖凝胶电泳鉴定,并将目的片段纯化回收。
1.4.3 Cap蛋白噬菌体单链抗体库的构建 将纯化后的目的片段ScFv和载体pCANTAB-5E分别用SfiⅠ和NotⅠ进行双酶切,酶切后的目的片段与载体以10∶1的比例混合后连接。将连接产物转化到大肠杆菌TG1中,涂布于LB-AG(含100 μg/mL氨苄抗生素及20 g/L葡萄糖)固体培养基上,30 ℃过夜培养,从平板上随机挑取单克隆进行菌液PCR鉴定,计算重组率,并估算库容(库容=克隆数×稀释倍数×重组率)。剩余菌液转入2×YT-AG培养基中,37 ℃培养至对数期,加入M13K07(MOI=20)进行拯救,在2×YT-AK(含100 μg/mL氨苄抗生素和100 μg/mL卡那霉素)培养基中37 ℃过夜培养。经PEG/NaCl浓缩后溶于1 mL TBS,0.22 μm滤膜过滤,构建噬菌体单链抗体库。
1.5 PCV2 Cap蛋白噬菌体抗体库淘选及鉴定
1.5.1 噬菌体抗体库的淘选 以重组的Cap蛋白为包被原,进行淘选。包被质量浓度为100 μg/mL,每孔100 μL,以PBS作为阴性对照,4 ℃过夜;加入200 μL封阻液,4 ℃封闭2 h;加入噬菌体量约为每孔2×1011PFU,37 ℃孵育1 h;TBST[TBS+0.1%(体积分数)Tween-20]洗6次;加入100 μL的Gly-HCl(pH 2.2)室温作用7 min,再加入10 μL的Tris-HCl缓冲液(pH 9.1),中和洗脱下来的噬菌体溶液;取5 μL进行滴度测定,剩余的感染对数生长期的TG1,M13K07辅助侵染扩增,完成第1轮淘选。重复此淘选过程,共4 轮,其中第2、3、4轮包被原的包被质量浓度分别为75、50、25 μg/mL,洗涤次数分别为8、10、12次。
1.5.2 噬菌体抗体初步鉴定 4 轮淘选后,随机挑取24个克隆,以碳酸盐缓冲液稀释重组Cap蛋白,终质量浓度为5 μg/mL,PBS作空白对照,50 g/L脱脂奶封闭。以浓缩后的噬菌体溶液作为一抗,37 ℃孵育2 h,用PBST洗板5次;以HRP标记的anti-M13单克隆抗体作为二抗,37 ℃ 孵育2 h,PBST洗板6 次;用TMB显色剂显色,室温避光显色10 min,2 mol/L H2SO4终止反应,测定450 nm吸光值。
以猪瘟(classical swine fever virus, CSFV)E2蛋白为对照,终质量浓度为5 μg/mL,PBS为空白对照。50 g/L脱脂奶封闭,每孔100 μL噬菌体,孵育2 h,加入HRP标记的anti-M13单抗,孵育2 h,用TMB显色,显色10 min后终止反应,酶标仪测定450 nm吸光值。
在Cap蛋白包被的96孔板(包被质量浓度为10 μg/mL)中加入梯度稀释的噬菌体抗体溶液,以M13KO7为阴性对照;以HRP标记anti-M13单克隆抗体,用TMB显色,室温避光显色10 min后终止反应,酶标仪读取450 nm吸光值。
2 结果与分析
2.1 重组Cap蛋白的表达与纯化
pET28a-ORF2-BL21经IPTG诱导后,用SDS-PAGE分析目的蛋白的表达(图1-A)。结果发现重组表达菌经诱导后在26 ku附近有明显的表达条带,与Cap重组蛋白预期大小一致;表达的蛋白进行Western blot分析(图1-B),结果抗His单克隆抗体可以特异性识别此蛋白,表明Cap重组蛋白得到正确表达;超声破碎后分别取上清和沉淀进行SDS-PAGE分析(图1-C),结果发现重组Cap蛋白主要以可溶性的形式存在于上清中。
将镍柱亲和层析纯化透析后的Cap蛋白进行SDS-PAGE分析(图2-A),结果显示,纯化后仅在目的条带位置约26 ku处存在单一条带,说明纯化效果良好;采用BCA法测定重组Cap蛋白的质量浓度,根据绘制的标准曲线(图2-B)获得目的蛋白的质量浓度为382 μg/mL。
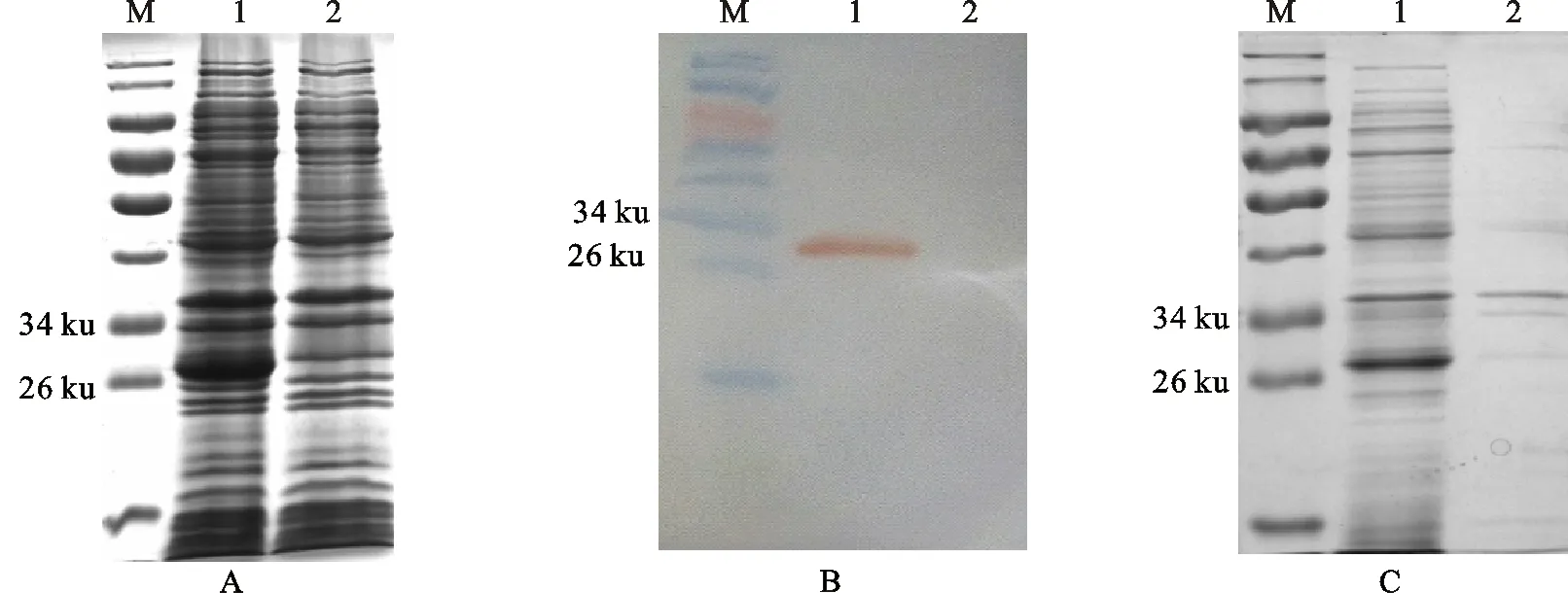
A、B:表达产物鉴定 Express product identification;1.pET-28a-ORF2-BL21表达产物 Induction products of pET-28a-ORF2-BL21; 2. pET-28a-BL21表达产物 Induction products of pET-28a-BL21; C:Cap蛋白的可溶性分析 Solubility analysis of recombined Cap protein;M.蛋白分子质量标准(Thermo 26616) Protein marker;1.诱导上清 Induction supernatant;2. 诱导沉淀 Induction sediment
图1PCV2Cap蛋白的表达及鉴定
Fig.1IdentificationoftheexpressedPCV2Capprotein
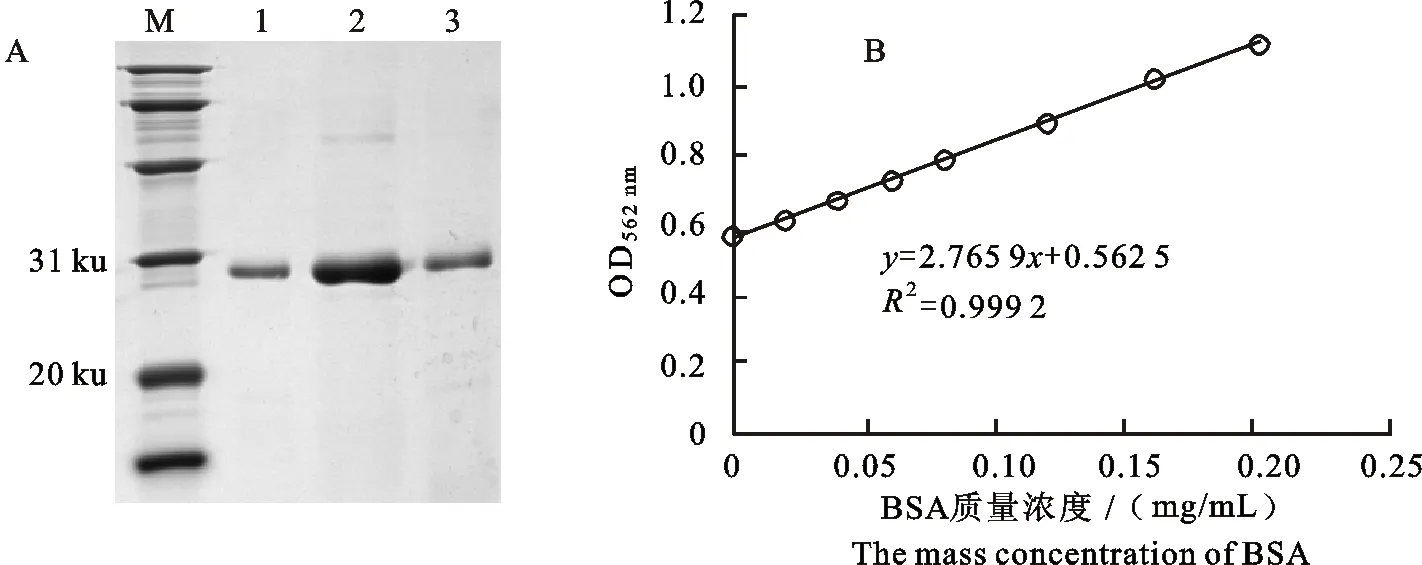
A:Cap蛋白纯化后鉴定 The identification of Cap protein after purification;M.蛋白分子质量标准 Protein marker;1~3.纯化后的Cap蛋白 Purified Cap proteins;B:蛋白质量浓度测定 Determination of protein mass concentration;y.在562 nm处的吸光值OD562nm;x.BSA的质量浓度 The mass concentration of BSA
图2Cap蛋白的纯化及质量浓度检测
Fig.2PurificationandmassconcentrationdetectionofCapprotein
2.2 抗体库构建及淘选结果鉴定
将Cap蛋白免疫的小鼠血清采用间接ELISA检测抗体,结果如图3所示。免疫后,效价最高的3号小鼠血清抗体滴度达到1∶64 000。提取的小鼠脾细胞总RNA经分光光度计测得质量浓度为998 ng/μL,A260/A280为1.92,取2 μL进行10 g/L琼脂糖凝胶电泳鉴定(图4-A),能清晰的看到28S、18S条带,且28S条带较18S的亮,说明提取的RNA完整性良好。以反转录获得cDNA为模板,进行抗体重链和轻链可变区基因的扩增并进行琼脂糖凝胶电泳分析(图4-B),结果表明,扩增的VH基因片段大小约350 bp,VL基因片段大小约320 bp,与预期相符;VH-L、L-VL的扩增结果如图4-C所示,扩增的片段大小约400 bp,与理论相符;VH-L与L-VL随机拼接后获得的ScFv基因片段约750 bp(图4-D),与预期相符。
涂板后,随机挑取19 个克隆进行菌液PCR鉴定(图5),19 个克隆中,有17 个克隆能扩增出约750 bp大小的片段,说明ScFv成功插入到噬菌粒载体pCANTAB-5E中,重组率为89.5%。经计算,初级抗体库库容为3.58×106。
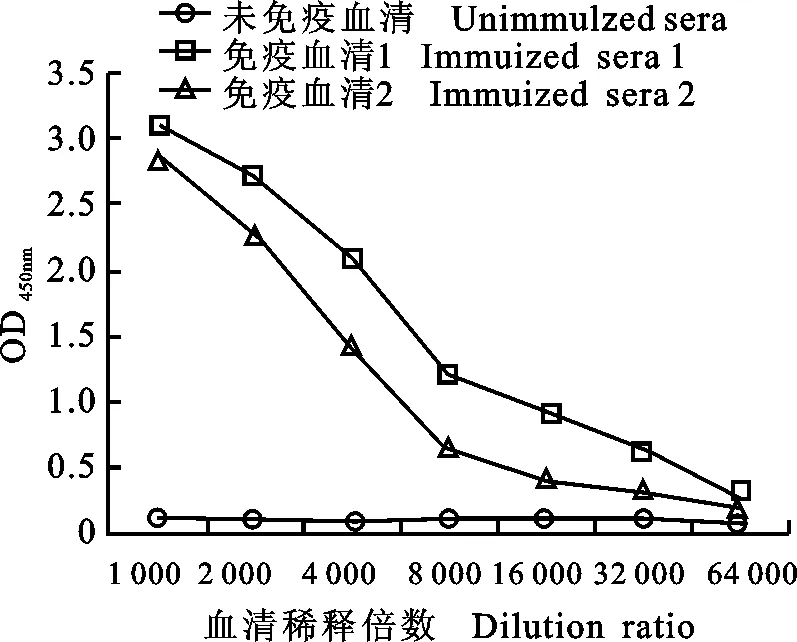
图3 小鼠血清抗体效价ELISA检测Fig.3 The ELISA of anti-serumtiter
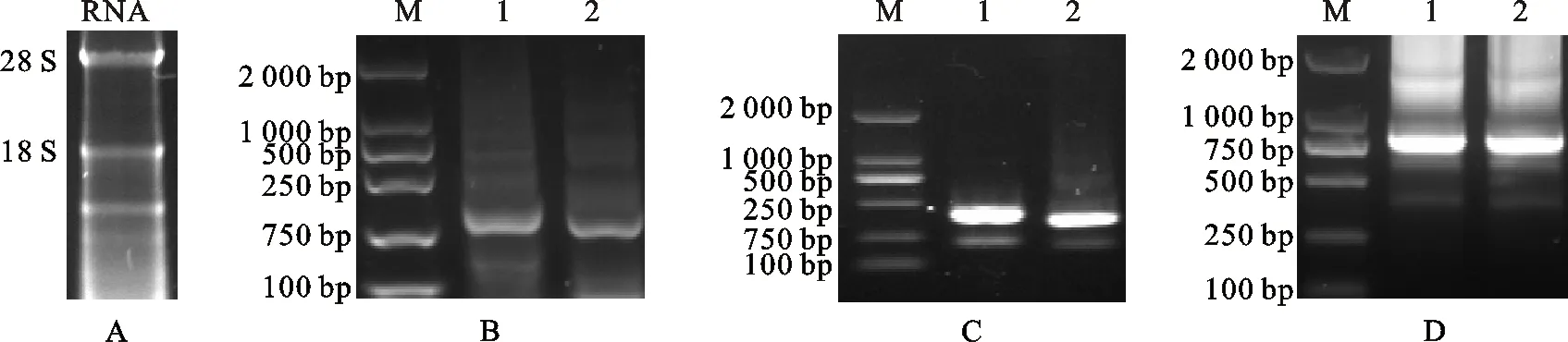
A:脾细胞总RNA The total RNA in spleen cells; B:抗体可变区基因的扩增 Amplified production of antibody variable region gene; M.蛋白分子质量标准 Protein marker;1.VH; 2.VL;C: 抗体可变区接头基因的扩增 Amplification of the gene in the variable region of antibody; 1.VH-L; 2.L-VL; D:目的基因ScFv的拼接与扩增 Splicing and amplification of target geneScFv;1~2.ScFv
图4脾细胞RNA的提取及目的基因PCR鉴定
Fig.4SpleenRNAextractionandPCRproductoftargetgene
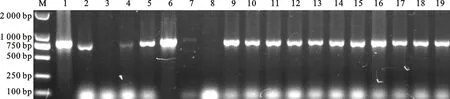
M.DNA marker;1~19.随机挑取的19个克隆 19 clones selected randomly
在4 轮筛选过程中,噬菌体回收率逐轮升高,特异性噬菌体得到显著富集(图6-A)。随机挑取24 个克隆进行ELISA检测,结果如图6-B,24 株克隆中有10 株为阳性克隆(P/N≥3为阳性);选取OD450值较高的3 株噬菌体阳性克隆(1、10、18),通过ELISA法对这3 株噬菌体抗体进行检测,结果如图6-C所示,初步鉴定ScFv-1、ScFv-10、ScFv-18噬菌体抗体可以与Cap蛋白特异性结合;同时对以上3株阳性噬菌体进行扩增,浓缩定量后,按10倍梯度稀释进行间接ELISA检测,结果如图6-D所示,阳性克隆ScFv-P18表现出较高亲和力,可以用于进一步的研究。
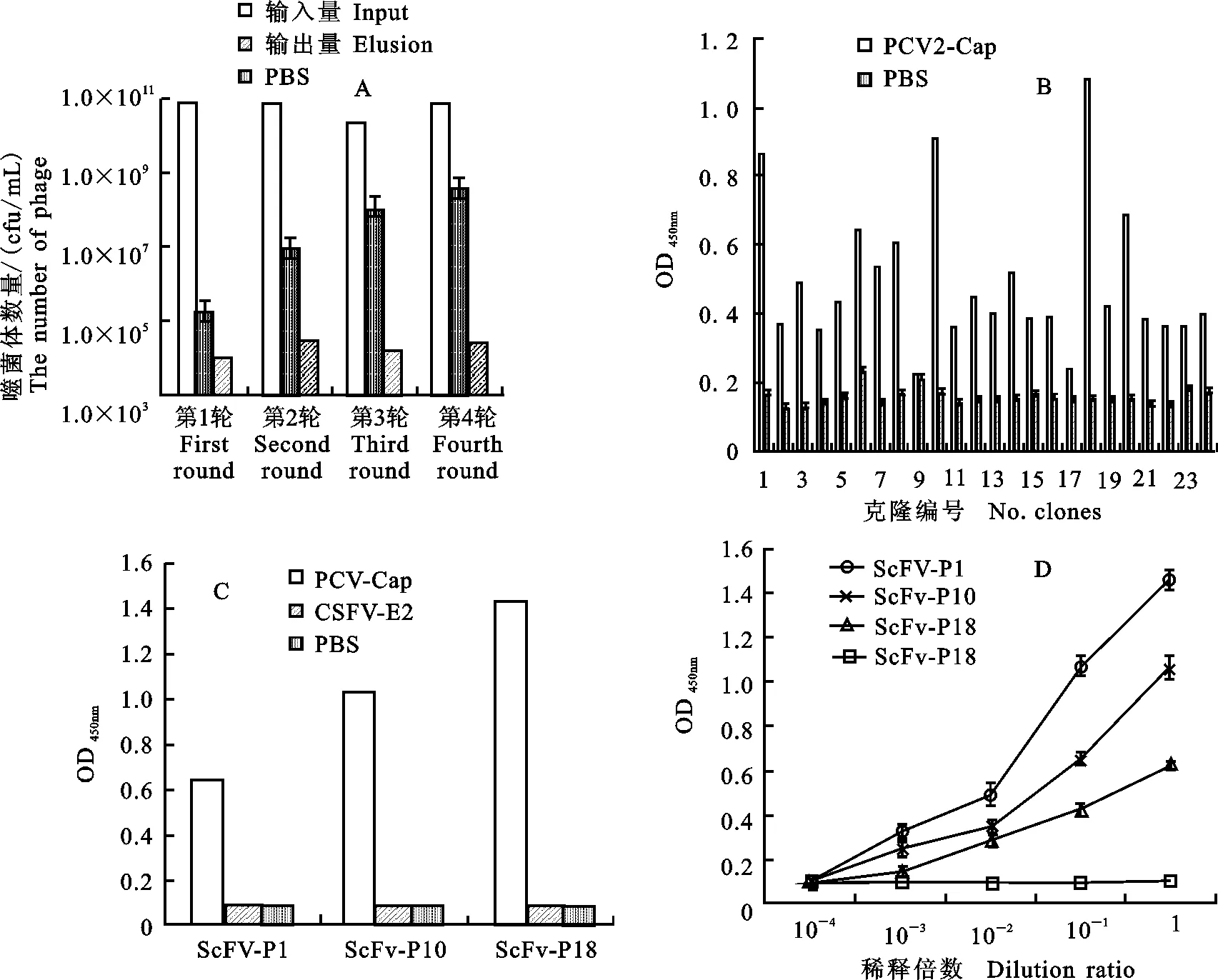
A:噬菌体抗体库的淘选 The panning of phage antibody library; B:噬菌体ELISA鉴定 Identification of phage ELISA;C:阳性噬菌体克隆间接ELISA法检测 Detection of positive phage clones by indirect ELISA method;D:阳性噬菌体克隆定量分析 Quantitative analysis of positive phage clones
图6噬菌体单链抗体库的淘选及鉴定
Fig.6ThescreeningandidentificationofphagedisplayScFvlibrary
3 讨 论
PCV2的早期检测对PCV2的防控起着至关重要的作用,建立快速、灵敏、方便的检测技术,对由PCV2引起的各种疾病的早期诊断及防控具有重要的现实意义。目前,已经有单克隆抗体用于PCV2的检测,但制备单克隆抗体周期长,同时需要进行大量的细胞培养工作,试验要求及费用高,杂交瘤细胞还可能会逐渐失去分泌抗体的能力[14];噬菌体抗体库技术用于基因工程抗体的制备,不仅可以省去繁琐复杂的杂交瘤细胞制备过程,直接从被感染的动物中获取基因抗体,节约时间且特异性强,而且能够进行大规模生产。
本研究以重组的Cap蛋白作为免疫原,成功构建库容为3.58×106的鼠源抗PCV2 Cap蛋白噬菌体单链抗体库,并筛选出3株特异性的阳性噬菌体菌株,与已报道的PCV2 Cap蛋白纳米抗体相比[15],材料来源及操作更简单方便。在4轮淘选过程中,包被蛋白质量浓度逐渐降低,洗涤次数依次增加,以提高筛选的严谨性,获得特异性结合的噬菌体;鉴定过程中,用CSFV主要结构蛋白E2[16-17]作为阴性对照,进行特异性检测,以此作为对照能排除非Cap蛋白(His标签)引起的假阳性,证明筛选出的噬菌体抗体能与Cap蛋白特异性结合。本研究筛选出特异性噬菌体抗体克隆,为特异性单链抗体的制备奠定基础。
Reference:
[1] 王 涛,郭 爽,阴正兴,等.猪圆环病毒2型和猪传染性胸膜肺炎混合感染的诊治[J].中国兽医杂志,2015,51(11):60-62.
WANG T,GUO SH,YIN ZH X,etal.Diagnosis and treatment of mixed infection of PCV2 and porcine contagious pleuropneumoniae[J].ChineseJournalofVeterinaryMedicine,2015,51(11):60-62(in Chinese).
[2] BEACH N M,MENG X J.Efficacy and future prospects of commercially available and experimental vaccines against porcine circovirus type 2(PCV2)[J].VirusResearch,2012,164(1/2):33-42.
[3] ELLIS J,HASSARD L,CLARK E,etal.Isolation of circovirus from lesions of pigs with postweaningmultisystemic wasting syndrome[J].CanadianVeterinaryJournalLaRevueVétérinaireCanadienne,1998,39(1):44-51.
[4] YI J ZH,LIU CH Q.Molecular characterization of porcine circovirus 2 isolated from diseased pigs co-infected with porcine reproductive and respiratory syndrome virus[J].VirologyJournal,2010,7(11):2541-2558.
[5] MISINZO G,DELPUTTE P L,MEERTS P,etal.Porcine circovirus 2 uses heparan sulfate and chondroitin sulfate B glycosaminoglycans as receptors for its attachment to host cells[J].JournalofVirology,2006,80(7):3487-3494.
[6] CAPRIOLI A,MCNEILLY F,MCNAIR I,etal.PCR detection of porcine circovirus type 2(PCV2) DNA in blood,tonsillar and faecal swabs from experimentally infected pigs[J].VeterinaryScience,2006,81(2):287-292.
[7] 元永平,丛丽媛,陈德坤,等.猪圆环病毒Ⅱ型Cap蛋白单克隆抗体的制备及鉴定[J].西北农业学报,2008,17(1):15-19.
YUAN Y P,CONG L Y,CHEN D K,etal.Preparation and characterization of monoclonal antibodies against PCV2Cap recombiant protein[J].ActaAgriculturaeBoreali-occidentalisSinica,2008,17(1): 15-19(in Chinese with English abstract).
[8] BIRD R E,HARDMAN K D,JACOBSON J W,etal.Single-chain antigen-binding proteins[J].Science,1988,242(4877):423-426.
[9] SAPATS S ,GOULD G ,TRINIDAD L ,etal.An ELISA for detection of infectious bursal disease virus and differentiation of very virulent strains based on single chain recombinant chicken antibodies[J].AvianPathology,2005,34(6):449-455.
[10] FOORD A J,MULLER JD,YU M,etal.Production and application of recombinant antibodies to foot-and-mouth disease virus non-structural protein 3ABC[J].JournalofImmunologicalMethods,2007,321(1/2):142-151.
[11] BHATI S,GANGIL R,GUPTA D S,etal.Single-chain fragment variable antibody against the capsid protein of bovine immunodeficiency virus and its use in ELISA[J].JournalofVirologicalMethods,2010,167(1): 68-73.
[12] MEYER T,STRATMANNSELKE J,MEENS J,etal.Isolation ofScFvfragments specific to OmpD ofSalmonellatyphimurium[J].VeterinaryMicrobiology,2011,147(1/2):162-169.
[13] 王 耘.两种Bt毒素单链抗体制备与抗体检测技术研究[D].南京:南京农业大学,2012.
WANG Y.Screening and expression of the single chain variable fragments and development of immunoassay of two Bt endotoxins[D].Nanjing: Nanjing Agricultural University,2012(in Chinese with English abstract).
[14] WANG R ZH,HUANG A L,LIU L C,etal.Construction of a single chain variable fragment antibody(ScFv) against tetrodotoxin(TTX) and its interaction with TTX[J].Toxicon,2014,83(2):22-34.
[15] YANG SH L,SHANG Y J,YIN SH H,etal.Selection and identification of single-domain antibody fragment against capsid protein of porcine circovirus type 2(PCV2) fromC.bactrianus[J].VeterinaryImmunology&Immunopathology,2014,160(1/2):12-19.
[16] VELAZQUEZ-SALINAS L,RISATTI G R,HOLINKA L G,etal.Recoding structural glycoprotein E2 in classical swine fever virus(CSFV) produces complete virus attenuation in swine and protects infected animals against disease[J].Virology,2016,494:178-189.
[17] 周景明,李鹏飞,张改平,等.猪瘟病毒E2蛋白在大肠杆菌中的表达及其可溶性分析[J].西北农业学报,2015,24(11):24-28.
ZHOU J M,LI P F,ZHANG G P,etal.Expression and analysis of soluble E2 protein of classical swine fever virus inEscherichiacoli[J].ActaAgriculturaeBoreali-occidentalisSinica,2015,24(11):24-28(in Chinese with English abstract).
ConstructionandScreeningofAnti-PCV2CapProteinPhageDisplayScFvLibrary
ZHOU Jingming, ZHANG Qiuli, ZHANG Gaiping, LIU Hongliang, QI Yanhua, SONG Ruixue, GENG Yue and WANG Aiping
(School of Life Science, Zhengzhou University, Zhengzhou 450001, China)
Balb/cmice were immunized with recombinant PCV2 Cap protein, and the total RNA was isolated from spleen cells. The variable region of immunoglobulins heavy chain(VH) and light chain(VL) genes were amplified by RT-PCR. TheScFvsequence was constructed by fusingVHgene withVLgene via overlap-PCR, and then the sequence was cloned into the phagemid vector pCANTAB-5E. APCV2 Cap proteinScFvlibrary, which consists of approximately 3.58×106individual colonies, was constructed by transforming the recombinant plasmid into theE.coliTG1 cells. Furthermore, the PCV2 Cap protein phage display library was constructed by infecting the transformed cells with M13K07 helper phage. After four rounds of panning,three Cap protein-specific phage clones were isolated.
PCV2; Cap protein;ScFvantibody; Phage-displayScFvlibrary
2016-12-13
2017-01-05
The National Key Research and Development Project(No.2016YFD0500704); Zhengzhou Science and Technology Innovation Team Project(No.131PCXTD622); Science and Technology Project of Henan Province(No.132102110142).
ZHOU Jingming, male, Ph. D,associate professor,master supervisor. Research area:molecular immunology and immunological detection technology.E-mail:zhoujingming@zzu.edu.cn
WANG Aiping, female, Ph. D, professor,doctoral supervisor. Research area: molecular immunology and immunological detection technology. E-mail: pingaw@zzu.edu.cn
顾玉兰ResponsibleeditorGUYulan)
日期:2017-12-21
网络出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20171221.1650.006.html
2016-12-13
2017-01-05
国家重点研发计划(2016YFD0500704);郑州市科技创新团队(131PCXTD622);河南省科技攻关(132102110142)。
周景明,男,博士,副教授,硕士生导师,从事分子免疫学和免疫学检测技术研究。E-mail:zhoujingming@zzu.edu.cn
王爱萍,女,博士,教授,博士生导师,主要从事分子免疫学和免疫学检测技术研究。E-mail:pingaw@zzu.edu.cn
S852.43
A
1004-1389(2017)12-1754-07

