碳化硅和碳化硼在电催化中的应用
苏 静 王艳辉 董 亮 臧建兵*,
(1燕山大学材料科学与工程学院,亚稳材料制备技术与科学国家重点实验室,秦皇岛 066004)
(2东北大学秦皇岛分校资源与材料学院,河北省电介质与电解质功能材料重点实验室,秦皇岛 066004)
碳化硅和碳化硼在电催化中的应用
苏 静1王艳辉1董 亮2臧建兵*,1
(1燕山大学材料科学与工程学院,亚稳材料制备技术与科学国家重点实验室,秦皇岛 066004)
(2东北大学秦皇岛分校资源与材料学院,河北省电介质与电解质功能材料重点实验室,秦皇岛 066004)
燃料电池是具有广泛应用前景的新能源技术。碳载铂基催化剂(Pt/C)是最常用的燃料电池电极催化剂,不过Pt/C稳定性较差、且成本高昂,严重限制了燃料电池的规模化应用。共价型碳化物碳化硅和碳化硼,由于具有极强的共价键,其物化稳定性优异,成为制备高稳定性、低成本的燃料电池催化剂的重要基础材料。本文总结了相关研究成果,介绍了碳化硅和碳化硼的独特优势,讨论了相关研究的发展方向。
燃料电池;共价性碳化物;碳化硅;碳化硼;电催化
环境和能源问题一直是现代人类社会发展面对的巨大挑战。通过发展新技术,开发利用绿色可再生能源是突破发展瓶颈的必由之路。目前,逐渐成熟的新能源技术包括:太阳能电池技术、风能技术、燃料电池技术等[1-2]。其中燃料电池技术依靠各国政府和机构的大力投入,以及广大研究人员的不懈努力,正不断取得进步和突破。特别是近些年来,燃料电池已经从航空、发电站领域向汽车、军事、电子设备领域渗入,且商业化程度越来越高。燃料电池作为迄今为止能量转化率最高的新能源技术之一,得到了普遍的关注[3]。根据燃料种类、电解质类型等不同,研究者将燃料电池分成氢气燃料电池、直接醇类燃料电池、固体氧化物燃料电池、磷酸燃料电池等等不同类型,甚至有研究者认为Li(Na)-O2等金属空气电池也属于燃料电池一类[4-8]。其中氢气燃料电池、直接醇类燃料电池和金属空气电池是本文讨论的主要类型。氢气燃料电池的能量密度高,无污染,安静,灵活,技术成熟度高,是最有希望解决能源枯竭的方法之一[9];直接甲醇燃料电池(DMFC)是一种清洁高效的能源,可在低温下运行,因此在很多领域具有极大的应用潜力,受到人们的密切关注,但是也有催化剂活性低、甲醇渗透和容易CO中毒的缺点[10];金属空气电池的质量(体积)比能量很高,造价低廉,稳定性好,是具有广阔前景的新能源技术。
商用燃料电池催化剂主要是(如炭黑XC-72)碳载铂基催化剂(Pt/C)[11-12],或者Pt基合金催化剂[13-14]。但是如图1所示,Pt/C中的碳载材料在燃料电池运行过程中容易被氧化,产生结构塌陷进而导致负载的纳米铂颗粒(Pt-NPs)脱落流失,造成催化剂失活[15-16]。此外,Pt/C在醇类燃料电池中容易被CO毒化[17-18],其表面的Pt-NPs易发生迁移、团聚导致催化剂失活[19-20]。Pt/C较差的稳定性成为燃料电池商业化道路上主要障碍之一[21]。碳化硅(SiC)和碳化硼(B4C)都具备高度稳定的共价键,因此它们的晶体结构十分稳定,具有极强的物理和化学稳定性,以及出色的抗氧化能力[22]。因此B4C和SiC替代碳载作铂基催化剂的载体材料是它们在燃料电池领域的重要应用方向。对SiC和B4C进行一些处理或者功能化修饰,可以提高载体与Pt-NPs之间的结合力,进一步提高了催化剂的稳定性,甚至提高催化剂的抗CO中毒能力及其催化活性。与Pt/C类似,合金或者双金属催化剂同样面临上述稳定性问题,所以大量研究中也往往使用SiC和B4C代替碳载。本文综合介绍了原始或者处理后的SiC和B4C在Pt及其合金或者含Pt双金属催化剂中的应用。
另外,Pt是众所周知的稀有金属,其价格十分高昂。根据相关统计结果,使用Pt的花费占燃料电池总成本30%~50%[23]。因此,研发非铂催化剂是推动燃料电池最终商业化的核心技术之一。目前,主要非铂催化剂包括:过渡族金属大环化物、杂原子掺杂的碳材料、过渡族金属碳化物或者它们共同组成的复合材料等[24-26]。基于SiC和B4C出色的稳定性以及独特的分子结构,它们也常常被用于研发制备非铂催化剂。
氢气在工业、医疗等多个领域存在广泛应用,同时也是最常用的燃料电池阳极的燃料之一。铂基催化剂目前还是性能最佳的制氢催化剂[27],但纳米级SiC可用于制备高稳定性、低成本的新型制氢催化剂。
本文基于以上3条线索,归纳分析了SiC和B4C在电催化领域的应用研究进展,讨论了它们在其中的突出优势,以及相关研究发展方向,为后续相关研究工作的开展提供借鉴。
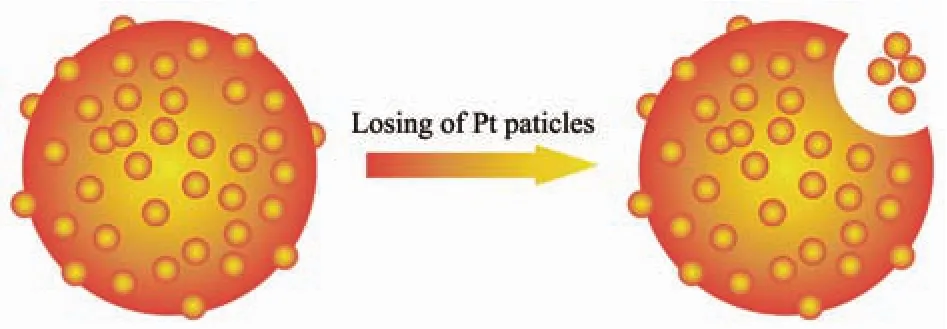
图1 Pt/C催化剂失活原理示意图Fig.1 Pt/C catalyst deactivation schematic diagram
1 铂及其合金、其它金属催化剂
1.1 SiC为载体的催化剂
碳化硅(SiC)是一种物化性能十分稳定的化合物,适合做燃料电池催化剂的载体。相关研究中,SiC的主要形貌为颗粒和纳米线,同时也出现一些基于SiC的复合纳米材料。SiC颗粒的应用研究出现较早,最初只是微米级别,载铂之后用作催化MOR(甲醇氧化反应)[28]。但是微米级的尺寸依然较大,而且SiC只是一种半导体材料,与纳米铂颗粒之间的结合力也较弱。这就使得相关研究一直滞后。随着技术手段的进步,纳米级SiC大量涌现,基于此的燃料电池催化剂研究也开始广泛出现。比如,印度的Rao课题组[29]利用等离子体电弧法制备出nano-SiC,并以其为载体材料制备了铂基催化剂Pt/SiC。制备的Pt/SiC的ESA(有效电化学活性比表面积)达到(78±8)m2·g-1,接近传统商用 Pt/C 的 ESA((85±5)m2·g-1)。 Pt/SiC 催化 ORR(氧还原反应)的起始电位与Pt/C的相当,均为910 mV。Dhiman等[30]以炭黑XC-72为模板,让其与熔融硅或者SiO蒸汽反应,分别制备得到粒径50~150 nm和25~35 nm的SiC颗粒。通过氧化性酸处理,获得含C、O的官能团,作为Pt-NPs的锚定点。在同样的载铂量的情况下,粒径50~150和25~35 nm的SiC为载体的铂催化剂的ESA分别为35.6和55.8 m2·g-1,均高于Pt/C(33.9 m2·g-1)。由于CV曲线中吸氢区存在着几个特征峰,分别对应氢离子吸附在不同的Pt晶面上。研究者发现Pt/SiC具有更多催化活性更高的Pt(111)晶面,使其对ORR和MOR(甲醇氧化反应)的催化活性也高于Pt/C。Lyu等[31]以乙二醇为还原剂,将Pt-NPs负载到了40 nm左右的β-SiC颗粒表面,得到催化剂Pt/SiC。由于SiC的导电性差,Pt/SiC的催化活性很低。因此Lyu等在制备测试电极时,在Pt/SiC中添加了20%(w/w)的炭黑(Vulcan XC-72)为导电剂。使得Pt/SiC/C的ESA(48 m2·g-1)接近Pt/C的ESA(62 m2·g-1)。如图 2 所示,经过 ADT(电化学加速老化试验),Pt/SiC/C的ESA衰减至约22.5%,而Pt/C仅剩余8.9%,进而证明了Pt/SiC稳定性优于Pt/C。Stamatin等[32]则重点研究了Pt/SiC在ADT测试中,纳米SiC表面的结构变化。通过透射电镜(TEM)和X光电子能谱 (XPS)测试结果,研究者认为在ADT过程中,SiC表面Si原子有可能发生了流失,并且其表面出现了轻微氧化现象,但并未出现显著的结构塌陷,这有助于催化剂的稳定性。
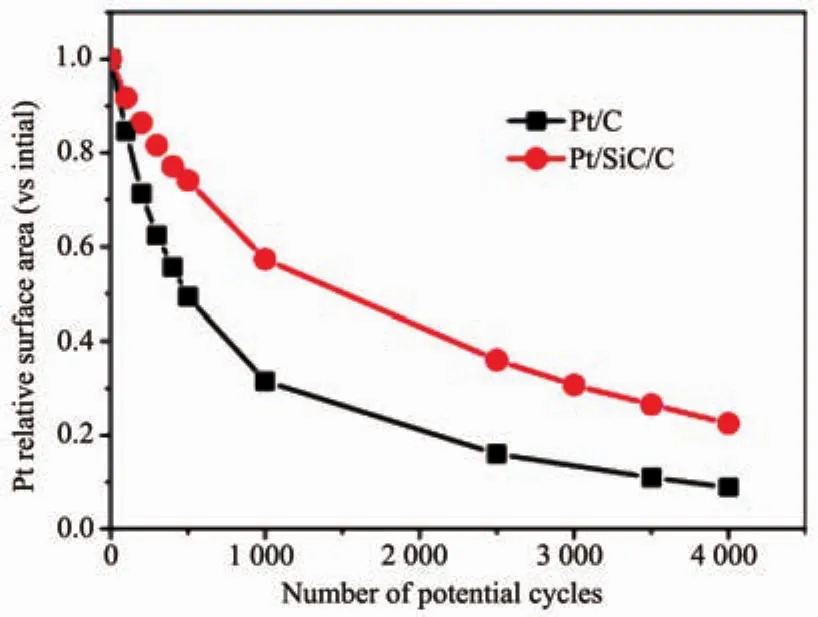
图2 Pt/SiC/C和Pt/C在ADT实验过程的变化情况对比图[31]Fig.2 Before and after ADT,changes of ESA of catalysts related to Pt catalytic surface area with the increased potential cycles[31]

图3 石墨化纳米SiC(a)和酸腐蚀纳米SiC(b)的高分辨透射电镜照片(HRTEM)[34-35]Fig.3 HRTEM images of nano-SiC(a)and nano-SiC after acid corrosion(b)[34-35]
针对SiC与Pt-NPs间结合力弱、导电性差的问题,研究者们提出对SiC纳米颗粒进行表面修饰方法,来提高SiC与Pt-NPs间的结合力,及增加载体导电性。Lobato等[33]将TiO2沉积到微米级SiC表面,热处理之后形成10~100 nm孔径的多孔TiC沉积层,来克服SiC导电性差的问题。由此制备得到的Pt/TiC/SiC的稳定性好,在热磷酸溶液中进行循环伏安实验,400圈以后,ESA仅损失约15%,而商用催化剂ESA损失约为34%。Zang和Dong等[34-35]分别以石墨化纳米SiC和酸腐蚀纳米SiC为载体制备了铂基催化剂Pt/SiC@G和O-C/SiC。如图3所示,2种载体均为核壳结构,只是SiC芯外的壳层分别为纳米石墨碳层和无定型碳。碳层为壳结构能够提高载体的导电性。Pt/SiC、Pt/SiC@G 和 Pt/C 在 0.5 mol·L-1的H2SO4溶液中测到的CV曲线如图4所示,ESA的计算方法,由图4中的图形数据,可以得到Pt/SiC、Pt/SiC@G 和 Pt/C 的 ESA 分别为:25.2、108.1、104.5 m2·g-1。Pt/SiC@G和Pt/C具有相近的活性比表面积。Pt/SiC@G催化ORR的起始电位、半波电位均与Pt/C基本一致。Pt/SiC@G的塔菲尔斜率为-60(低过电势区域)和-120 mV·dec-1(高过电势区域)与一般铂基催化剂相同。但从图5中可见Pt/SiC@G的稳定性明显优于Pt/C,ADT以后,ESA降至ADT之前的53.9%,而Pt/C的ESA则只剩下17.1%。Pt/O-C/SiC的相关结果与Pt/SiC@G相近,ORR活性接近Pt/C,并具有更好的稳定性 (ADT后ESA仅减少28%)。此外,Zhang等[36]使用微蒸发镀技术,在纳米SiC表面修饰了纳米级金属Ti层,Ti与SiC之界面处形成TiC、Ti5Si3等化合物且两者紧密结合在了一起。Ti金属层导电性好,与Pt之间结合力强,使得Pt/Ti-SiC的ESA(107.64 m2·g-1)以及MOR和ORR催化活性远高于Pt/SiC,略好于Pt/C,而且在ADT实验中ESA剩余71.65%,Pt/C仅剩余58.93%。同时由于Ti5Si3的存在,Pt-Ti/SiC在MOR的催化稳定性测试中仅衰减50.90%,而Pt/C衰减约70%。上述实验结果表明SiC为芯结构,很好的支撑了载体结构,避免了载体塌陷情况的发生,是催化剂稳定性提高的重要原因。

图 4 Pt/SiC、Pt/SiC@G 和Pt/C 在 0.5 mol·L-1的 H2SO4溶液中测到的CV曲线Fig.4 CV plots of Pt/SiC@G,Pt/SiC and Pt/C electrocatalysts in 0.5 mol·L-1

图5 Pt/SiC@G与Pt/C的ESA在ADT实验过程的变化情况对比图[34]Fig.5 Variations of the ESA values with cycle number[34]
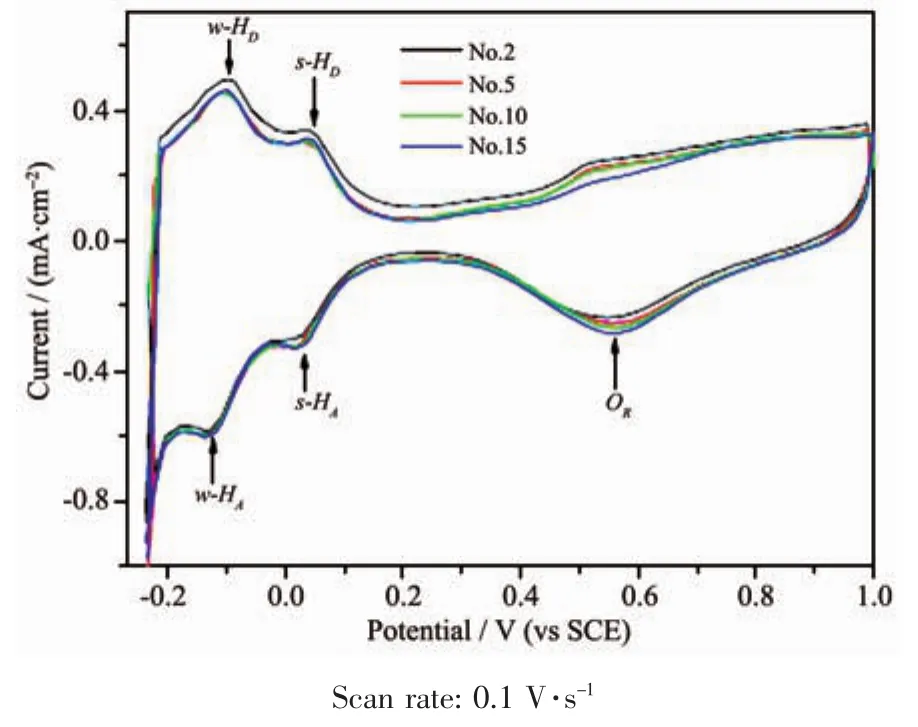
图6 Pt/SiCNWs在0.5 mol·L-1的H2SO4溶液中测到的CV曲线,循环圈数分别为2、5、10和15圈Fig.6 CV plots of of Pt/SiCNWs with scanning numbers of 2,5,10 and 15 cycles in 0.5 mol·L-1H2SO4 solution,the Pt-loading is 50%(w/w)[38]
对SiC表面进行腐蚀活化的方法很多,如Fang等[37]对SiC颗粒进行了表面活化后负载了Pt。首先将SiC颗粒在1 mol·L-1HCl中浸泡24 h,后去离子水洗净至Cl-离子完全去除,随后将其在空气中700 K煅烧4 h,并在423 K的氢气中还原。XPS结果表明在SiC表面有SiO2/SiOxCy形成。在723 K下用氢气还原法得到Pt/SiC,其表现出最好的催化活性和耐CO毒性,文章认为这可能与在723 K还原温度下Pt具有最好的结晶行为有关。
除了颗粒状SiC,SiC纳米线(SiC-NWs)为载体的铂基催化剂的研究也在不断开展。比如Niu等[38]研发了一种简单、高产、低成本的SiC-NWs制备方法,即采用固相-气相反应法,以硅粉、CO以及ZnS为原料制备得到10~30 nm直径的 SiC-NWs。其ORR在0.57 V具有更高的电流密度-290 μA·cm-2,即具有很高的ORR催化活性。见图6所示,同时加速老化试验后的CV曲线无明显变化,说明稳定性优异。Tong等[39]利用溶胶-凝胶法和真空热处理制备得到SiC纳米线,负载Pd纳米颗粒得到Pd/SiC。通过电化学测试,Pd/SiC 的 ESA 为 49.5 m2·g-1,明显高于相同方法制备的Pd/CNT(碳纳米管)的38.6 m2·g-1,也高于无载体的 Pd 纳米颗粒(29.9 m2·g-1)。Pd/SiC对MOR的催化活性和稳定性也优于Pd/CNT。同时,他们也认为SiC不但是高稳定性载体,也具有一定抗毒化的作用。为了提高Pt与SiC载体的结合力,Han等[40]通过原位植入硫氰酸铵的办法等对SiC超细纤维表面进行氮修饰,得到C3N4/SiC复合物。样品进一步在650~800℃处理得等到不同氮含量的N-C/SiC样品。遗憾的是,文章并没有对其催化性能进行进一步分析。
此外,SiC为重要组分的复合纳米材料也常常被用来做铂基催化剂的载体。如You等[41]以SiO2为模板,引入1,10-菲咯啉做碳源,通过1 350~1 450℃热处理得到含有SiC的有序介孔碳(SiC-OMC)。其中1 350℃是最佳热处理温度,SiC-OMC中SiC占比为 10.3%(w/w)。Pt/OMC-1350的ESA能够达到77 m2·g-1。 在 1 000 圈 ADT 测试后,Pt/OMC-1350 的氧还原反应电流密度仅仅衰减了0.16%,而Pt/C衰减了33.4%。与此相似,Jiang等[42]制备出含有SiC的无序多孔碳。其中使用兼具了造孔功能的四乙氧基硅烷做硅源。由此制备的催化剂的MOR催化电流密度)是Pt/C的3倍以上,并且稳定性优异。Dong等[43]同样采用四乙氧基硅烷做硅源,酚醛树脂做碳源,采用先凝胶后热处理的方式,制备出高比表面积的三维多孔状SiC。Pt/SiC的ESA达到87.9 m2·g-1,比 Pt/MWCNTs(多壁碳纳米管)的 67.9 m2·g-1和Pt/C的62.74 m2·g-1都要更高。Pt/SiC具有更好的抗CO中毒能力,相较于Pt/MWCNTs,其催化CO氧化的峰值左移了67 mV,起始电位左移了51 mV。研究者认为SiC载体有效的提高了Pt氧化CO的活性。SiC这一特殊性能也被其他研究发现。Wang等[44]以椰棕为碳源,在真空热处理时引入Si蒸汽,使得石墨层间形成SiC纳米颗粒。以其为载体制备铂基催化剂Pt-SiC/GC,其HRTEM和结构如图7所示。Pt-SiC/GC的MOR催化电流 ()是Pt/C的6.2倍,是PtRu/C的5倍。同时,他们也认为Pt与SiC之间的协同催化作用提高了铂基催化剂抗CO中毒,即其CO氧化峰电位仅为0.58 V(vs SCE),明显低于 Pt/C 的 0.67 V(vs SCE)。
目前受到石墨烯启发,二维材料逐渐兴起。二维SiC片层的研究开始起步。Ganji[45]基于第一原理讨论了SiC片层做铂基催化剂载体的优势。研究者发现Pt与SiC片层之间的吸附能高达-3.828 eV,比石墨烯高约1.28倍。同时能够削弱Pt与O之间结合力,进而能够提高且对ORR的催化活性。
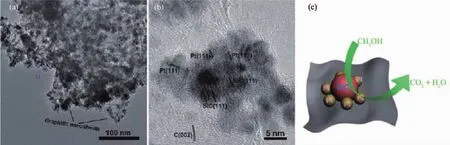
图7 Pt-SiC/GC的HRTEM和结构示意图[44]Fig.7 HRTEM images of Pt-SiC/GC and Structure diagram[44]
1.2 B4C为载体的铂基催化剂
B4C也是高稳定性共价化合物,具有良好的化学稳定性,近年来也作为催化剂载体材料引起人们的关注。早在 1966年,Grubb和 McKee[46]就在Nature上报道了以商用B4C负载Pt作为磷酸燃料电池的电极,结果发现负载在B4C上的Pt比Pt黑或负载在石墨上的Pt表现出更好的活性。
碳化硼(B4C)不会与酸和生物碱发生反应,它的低密度和高化学势使得它成为酸性中最稳定的物质之一。通过协同作用,B4C可能促进催化活性,因而被期望用作燃料电池的催化剂载体材料。据我们所知,关于将B4C作为燃料电池贵金属催化剂载体的研究比较少。Grubb和McKee已经对磷酸燃料电池(PAFCs)的阳极材料B4C载Pt进行了研究,结果表明:Pt的活性变大,并且负载在B4C上的Pt比铂黑和石墨负载Pt在相同表面积的情况下的抗聚集能力更强。2012年,Lv等[47]对纳米B4C负载Pt催化甲醇氧化反应和耐CO毒性做了研究。这也是第一次对纳米B4C为载体的催化剂催化甲醇氧化反应的性能进行研究。研究人员通过乙二醇还原法制备了 Pt/B4C,如图 8(a)所示,其 ESA 达到 88.17 m2·g-1,与传统Pt/C催化剂的62.74 m2·g-1相比,电化学表面积显著提高;为了研究其催化甲醇的电化学活性活性,以扫速0.05 V·s-1测试得到Pt/B4C和Pt/C在0.5 mol·L-1H2SO4和 0.5 mol·L-1CH3OH 溶液中的CV曲线如图8(b)所示,Pt/B4C催化MOR的电流密度为 63 mA·cm-2为 Pt/C 催化剂(37 mA·cm-2)的 1.7倍;如图8(c)所示,Pt/B4C的CO氧化的起始电位和峰值电位与Pt/C相比分别向负方向移动了92和37 mV,同时其耐CO毒性能力也得到提高;如图8(d)所示,Pt/B4C与Pt/C相比较,有约10 mV的微小负位移,证明Pt/B4C的ORR催化活性略高于Pt/C。Jackson等[48]研究了在一种富石墨硼碳材料上负载Pt,纳米颗粒(Pt/BC)的催化剂,结果发现由于Pt与BC之间的电子交互作用,使得Pt在BC表面具有更低的能态,10%、20%和40%(w/w)Pt/BC在酸性介质中的动力学电流密度Ik分别为(3.2±0.3)、(3.7±0.3)和(7.1±0.3)而 10%、20%和 40%(w/w)Pt/C 的动力学电流密度 Ik分别为(1.5±0.7)、(2.4±0.1)和(3.3±0.2)Pt/BC的催化活性比商用Pt/C提高了50%~100%。从300圈的数据开始研究Pt/BC和Pt/C的循环稳定性,Pt/C每10圈损失14.7%的ESA,而Pt/BC每10圈的ESA损失9.8%,Pt/BC减少了1/3的损失率,其循环稳定性也得到了改善。

图8 (a)Pt/B4C和Pt/C的CV曲线对比图;(b)Pt/B4C和Pt/C的电化学催化性能对比;(c)Pt/B4C和Pt/C的CO脱附效果对比;(d)Pt/B4C和Pt/C催化剂在0.5 mol·L-1H2SO4溶液中,旋转速率为1 600 r·min-1的极化曲线[47]Fig.8 (a)Comparison of CV curves for both the catalysts and supports in nitrogen saturated 0.5 mol·L-1H2SO4suspension;(b)Comparison of the electrochemical catalytic performances of Pt/B4C and Pt/C catalysts,measurements were performed in 0.5 mol·L-1H2SO4+0.5 mol·L-1CH3OH solutions with a scan rate of 0.05 V·s-1;(c)CO stripping results of the Pt/B4C and Pt/C catalysts in 0.5 mol·L-1H2SO4solution at a scan rate of 0.02 V·s-1;(d)Polarization curves for the Pt/B4C and Pt/C catalysts obtained with a rotation rate of 1 600 r·min-1in 0.5 mol·L-1H2SO4solution[47]
2 非贵金属催化剂
2.1 SiC基非铂催化剂
众所周知,Pt是一种贵金属,全球储量仅3.8万吨,因此寻找低成本非贵金属催化剂是燃料电池领域的重要方向。
SiC在真空或者保护气氛下,通过高温热处理方式能够实现表层石墨化。以此石墨层为基础,对其进行氮掺杂处理。由于N原子具有更大的电负性,比C原子具有更强的吸引电子的能力,使得掺入的N原子周围的C原子显现一定的正电,改变了O2在C原子上的吸附方式,进而提高碳材料的ORR催化活性,得到高活性的非铂催化剂。不过纳米SiC的石墨化温度也比较高,一般要高于1 300℃,会破坏 C-N 键。 Pan 等[49]利用 HF、HNO3(VHF∶VHNO3=1∶2)混合溶液对纳米SiC表面进行腐蚀处理制得C/SiC,其表面生成纳米非晶无定型碳,降低了热处理温度,使其更容易进行氮的掺杂。然后与三聚氰胺混合进行1 000℃以下的真空热处理,保护了CN键进而实现氮掺杂,得到N-C/SiC。研究者给出C/SiC,N-C/SiC和20%(w/w)Pt/C的LSV曲线,发现NC/SiC的电催化活性不及Pt/C,但其较之无掺杂的C/SiC具有更负的起始电位和更大的氧还原反应电流。N-C/SiC在高电流密度区域和低电流密度区域的塔菲尔斜率分别为-56和-118 mV·dec-1,跟Pt/C的相近。经过ADT测试,N-C/SiC表现出良好的抗氧化性能。N-C/SiC和Pt/C的I-t(计时电流)曲线表明,经过8 000 s反应,N-C/SiC保留了93.2%的电流,而Pt/C只保留了70.6%的电流,即N-C/SiC稳定性更好。另外,Pan等[50]采用SiC、三聚氰胺、氯化镍(NiCl2)混合热处理的方式制备了氮掺杂石墨化碳化硅(N-C/SiC)。使用NiCl2做催化剂可降低SiC石墨化温度至1 000℃,同时混入三聚氰胺即可实现氮掺杂。主要机理是NiCl2受热分解,形成Ni单质和Cl2,Cl2选择性刻蚀掉Si原子,而Ni催化了石墨化过程。用此一步法制备得到N-C/SiC,其在碱性环境中的ORR催化活性较高。Jia等[51]以硫酸氧钛为原料,利用恒温水解法,在纳米SiC表面修饰了TiO2纳米颗粒。然后将其与三聚氰胺混合,并N2保护下热处理,制备得到氮掺杂无定型碳和TiN纳米颗粒共同修饰的碳化硅复合催化剂 (NC-TiN/SiC)。NCTiN/SiC催化 ORR的半波电位(E1/2)为 0.82 V(vs RHE(可逆氢参比电极)),接近 Pt/C(0.86 V),这表明NC-TiN/SiC具有优异的ORR催化活性。经过8 000 s的I-t试验,NC-TiN/SiC保持了初始催化电流的 95.1%,而Pt/C(20%(w/w))仅保留 81.2%,这表明NC-TiN/SiC比Pt/C稳定性更好。
Li等[52]让SiC在CCl4+NH3的气氛下,800℃处理1 h,得到SiC@N-C颗粒。SiC表面形成氮掺杂碳壳结构。再将氨腈和醋酸铁在60℃乙醇中反应3 h后,加入SiC@N-C颗粒,反应过夜。溶液蒸发后的混合物在氩气气氛中950℃热解1 h,得到一种多孔Fe@N-C/SiC@N-C 复合结构,其 ESA 达 75.4 m2·g-1。包裹纳米Fe颗粒的氮掺杂碳纳米管负载在SiC的壳状结构上。这一复合结构在碱性介质中表现出比商用Pt/C更好的ORR催化活性,稳定性和耐甲醇性能。
有研究者认为在石墨结构中掺杂Si也能够用于催化ORR,且活性较高。Zhang等[53]基于密度泛函理论,分析了4层以内的立方SiC片层在碱性环境下的ORR催化活性。通过理论计算,研究者发现立方SiC片层的ORR催化活性甚至优于Pt(111)晶面。这主要是因为O2吸附到SiC表层表面以后,反键轨道电子增多,使得O=O双键更加容易断裂。本文前面还介绍了SiC片层优秀的载体性能,所以可以认为SiC片层在燃料电池催化领域具有巨大应用前景,因此相关制备和性能研究具有重大价值。
2.2 B4C基非铂催化剂
金属空气电池以金属离子为载流子,因此其阴极ORR相对于其他燃料电池有着较大差异。通常可以直接使用碳材料作为催化剂,不过碳材料稳定性差,近几年B4C被挖掘出来,成为替代材料。Song等[54]对B4C作为Li-O2电池的氧电极材料进行了研究。用0.1 V·s1扫速在2.0~4.7 V电压下扫描得到CV曲线,表明B4C电极比TiC和CNT电极具有更好的循环稳定性和循环寿命。TiC和CNT基电极失活迅速主要是其表面氧化钝化过快,但B4C基电极的降解机理在于B4C表面的活性点逐渐减少。B4C的密度与碳接近,表现出高的ORR和OER催化活性,以及良好的化学和电化学稳定性。Song等[55]用溶剂热合成的方法在B4C的表面沉积纳米Ir颗粒,制备Ir/B4C复合Li2CO3电极,进一步提高了B4C作为阴极电极的催化活性和稳定性。在低于4.37 V下该电极几乎完全分解,而未沉积Ir颗粒的B4C电极,其Li2CO3分解仅约4.7%。理论分析表明Li2CO3的高效分解,归因于Ir和B4C的协同效应。Ir对氧有很高的亲和力,能够有效降低Li2CO3的电化学氧化反应的能量势垒。Vineesh等[56]以B4C为基础材料,通过在N2环境中1 400℃下进行热处理,制备得到B掺杂石墨烯(BG)。B原子电负性弱于C原子,因此在石墨结构中掺入B原子带一定正电,成为吸附O2和催化ORR的重要活性位点。通过BET模型计算出的BG的表面积是190 m2·g-1,CV曲线测试结果也表明BG可能具有巨大的电化学活性面积。 BG、PG(原始石墨烯,商用,4到 6层,BET 表面积约为 200 m2·g-1)和 Pt/C(E-TEK)催化 ORR 的 LSV曲线表明,BG比PG有较低的过电位,和Pt/C相近,PG和Pt/C的起始电位仅相差59 mV。对BG在-1.2~0.2 V进行 6 000圈的ADT,其半波电位仅左移8 mV的移动,几乎没有明显的催化活性的衰减。因此BG可用于催化ORR反应,其催化活性和稳定性较高。
3 制氢催化剂
所有燃料电池的运行都需要燃料,因此燃料电池的燃料,来源成为关键问题之一。按燃料的来源,燃料电池又可分为三类。第一类是直接式燃料电池,即其燃料直接用氢气或轻醇类;第二类是间接式燃料电池,其燃料不是直接用氢,而是通过某种方法(如重整转化)将轻醇、天然气、汽油等化合物转变成氢(或氢的混合物)后再供给燃料电池发电;第三类是再生式燃料电池,它是指把燃料电池反应生成的水经过电解分解成氢和氧,再将氢和氧输入燃料电池发电[57]。氢气制备主要是通过电解水来实现,即通过析氢反应(HER)来实现。基于SiC可以制备新型非铂制氢催化剂。He等[58]研究发现在弱酸性溶液中 (pH=6),H2O在SiC表面发生自催化,使得-H和-OH分别吸附在SiC表面。吸附在SiC表面的-H获得电子,形成氢气H2。该反应相较于H2O分子裂解制备H2的反应活化能更低。不过晶粒尺寸对催化活性有着显著影响,研究者发现8 nm以下的SiC才具有极高的催化活性,粒径增加至20 nm,SiC的催化活性明显变差。研究者认为8 nm SiC具有更高的比表面积和更多的边缘。其中的8 nm以下的SiC是通过将微米尺寸的SiC放入HF和HNO3混合溶液,然后进行100℃腐蚀处理制备得到的,且它们的粒径尺寸主要集中在3~4.5 nm之间。

图9 SiC-GD@GNRs随热处理时间发生形貌结构变化[59]Fig.9 Morphology structure changes of SiC-GD@GNRs with the extension of heat treatment time[59]
近期,Fan等[59]制备了纳米 SiC、ND、直列碳纳米管(VA-CNTs)组成的复合材料,用于催化HER。利用电子束蒸发器气化Si单质,将Si低速沉积(0.005 nm·min-1)到VA-CNTs表面,形成1~5 nm的沉积层,然后通入 H2、H2O、CH4混合气体,在 950℃进行真空热处理,在VA-CNTs表面形成1~3 nm SiC为核芯,ND(论文中用GD表示)为壳的2~8 nm的核壳纳米颗粒。在此过程中VA-CNTs被氢气刻蚀,变成纳米条带,进而得到SiC-GD@GNRs。制备过程中,Si单质首先与H2还原出来的C反应形成纳米级SiC,它也是GD的形核点,随着热处理时间延长,GD晶体就会不断长大,具体如图9所示。由于SiC是HER的活性点,所以过长时间热处理会使SiC过多埋入GD表面,减小催化的活性。同时SiC-GD的缺陷减少,也降低了电导率,进而降低了催化活性。SiC-GD@GNRs是一种新的无金属催化剂,HER活性卓越,具有小的起始电位8 mV,塔菲尔斜率约为54 mV·dec-1,在200 mV的条件下的交换电流密度达到77.4 mA·cm-2。该催化剂能够在较低的过电位下产生大的阴极电流,并且稳定很长一段时间。这种材料的合成方式使得我们可以很轻松地制备先进的非金属电催化剂,使得其能够很容易和水裂解装置结合起来。SiC-GD@GNRs可以进入到HER非铂催化剂里面活性最好的行列中,且具有优异的稳定性能。
总体而言,SiC量子点的研究方兴未艾,考虑到它对HER的高催化活性,以及SiC能够提高铂基催化剂抗CO中毒能力等独特性能,可以认为其将来在燃料电池相关催化剂领域可能会展现广阔的应用前景。
4 结 论
本文总结了SiC和B4C两种高稳定性共价型碳化物材料在电催化领域的应用。作为共价型碳化物,SiC和B4C具有极强的共价键,物化稳定性优异,是其成为高稳定性催化剂的主要原因。不过SiC和B4C的导电性较差,与Pt-NPs间的结合力较弱,限制了它们的应用。对SiC和B4C进行改性处理,能够显著提高作为载体材料的优势。其中的改性方法主要是表面的功能化处理,包括表面碳化、氧化、镀覆、氮修饰等等。同时,SiC和B4C还有一些独特的结构特性,因此可用在制备氧还原反应非铂催化剂和制氢催化剂方面。这里主要是借助SiC和B4C高稳定性和结构优势,构建相关催化剂。
SiC和B4C在电催化领域的研究仍然具有广阔发展空间。比如在SiC和B4C的改性方法方面,可以围绕提高可控性、可操作性展开工作,同时进一步优化分析手段,探究其中的相关机理。另外,制备10 nm以下的颗粒状SiC和B4C、制备直径更小且更长的SiC纳米线、以及制备二维的SiC纳米片、Si和B掺杂的石墨烯等,也是后续要就的重点。这些形貌和结构更为独特的纳米材料,也许能够在电催化领域展现不同寻常的性质。所以SiC和B4C在电催化领域应用空间广阔,也必将助力燃料电池的大规模商业化应用。
[1]ZHAI Xiu-Jing(翟秀静),LIU Kui-Ren(刘奎仁),HAN Qing(韩庆).New Energy Technology(新能源技术).Beijing:Chemical Industry Press,2010.
[2]WU Zhi-Jian(吴治坚),YE Zhi-Quan(叶枝全),SHEN Hui(沈辉).Use of New and Renewable Sources of Energy(新能源和可再生能源的利用).Beijing:China Machine Press,2006.
[3]LI Mao-Hua(李茂华),LIU Rui-Quan(刘瑞泉).Chinese J.Inorg.Chem.(无机化学学报),2008,24(2):195-200
[4]QIU Li-Gan(仇立干),WU Lin(吴林),SHI Hui(石慧).Chin.Battery Ind.(电池工业),2001,6:233-236
[5]LIU Chun-Na(刘春娜).Chin.J.Power Sources(电源技术),2015,39:657-658
[6]O′hayre R,Cha S W,Prinz F B,et al.Fuel Cell Fundamentals.New York:John Wiley&Sons,2016.
[7]Sharaf O Z,Orhan M F.Renewable Sustainable Energy Rev.,2014,32:810-853
[8]LIU Chun-Na(刘春娜).Chin.J.Power Sources(电源技术),2014,38(2):199-200
[9]GAO Jian(高建),LIU Jian-Guo(刘建国),LIU Wen-Ming(刘文明),et al.Chinese J.Inorg.Chem.(无机化学学报),2009,25(11):2016-2020
[10]SHAO Yu-Yan(邵玉艳),YIN Ge-Ping(尹鸽平),GAO Yun-Zhi(高云志),et al.Chinese J.Inorg.Chem.(无机化学学报),2004,20(12):1453-1458
[11]Meier J C,Galeano C,Katsounaros I,et al.Beilstein J.Nanotechnol.,2014,5:44-67
[12]PavlišicˇA,JovanovicˇP,Šelih V S,et al.Chem.Commun.,2014,50:3732-3734
[13]Wang Y J,Zhao N,Fang B,et al.Chem.Rev.,2015,115:3433-3467
[14]Baldizzone C,Mezzavilla S,Carvalho H W,et al.Angew.Chem.Int.Ed.,2014,53:14250-14254
[15]Kangasniemi K H,Condit D A,Jarvi T D.J.Electrochem.Soc.,2004,151:E125-E132
[16]Reiser C A,Bregoli L,Patterson T W,et al.Electrochem.Solid-State Lett.,2005,8:A273-A276
[17]Avgouropoulos G,Ioannides T.Appl.Catal.,B,2005,56:77-86
[18]García G,Silva-Chong J,Guillén-Villafuerte O,et al.Catal.Today,2006,116:415-421
[19]Ferreira P J,Shao-Horn Y,Morgan D,et al.J.Electrochem.Soc.,2005,152:A2256-A2271
[20]Koh S,Yu C,Mani P,et al.J.Power Sources,2007,172:50-56
[21]Yu X,Ye S.J.Power Sources,2007,172:133-144
[22]FANG Xiao-Hu(方啸虎).Superhard Materials Science and Technology(超硬材料科学与技术),Beijing:China Building Materials Press,1998.
[23]Bar-On I,Kirchain R,Roth R.J.Power Sources,2002,109:71-75
[24]Gong K,Du F,Xia Z,et al.Science,2009,323:760-764
[25]Qu L,Liu Y,Baek J B,et al.ACS Nano,2010,4:1321-1326
[26]Kramm U I,Lefèvre M,Larouche N,et al.J.Am.Chem.Soc.,2014,136:978-985
[27]Lasia A.Handbook of Fuel Cells-Fundamentals,Technology and Applications.Hoboken:John Wiley&Sons,2010:5
[28]Honji A,Mori T,Hishinuma Y,et al.J.Electrochem.Soc.,1988,135:917-918
[29]Rao C V,Singh S,Viswanathan B.Indian J.Chem.,Sect A,2008,47:1619-1625
[30]Dhiman R,Johnson E,Skou E M,et al.J.Mater.Chem.A,2013,1:6030-6036
[31]Lyu H F,Mu S C,Cheng N C,et al.Appl.Catal.,B,2010,100:190-196
[32]Stamatin S N,Speder J,Dhiman R,et al.ACS Appl.Mater.Interfaces,2015,7:6153-6161
[33]Lobato J,Zamora H,Plaza J,et al.ChemCatChem,2016,8:848-854
[34]Zang J B,Dong L,Jia Y D,et al.Appl.Catal.,B,2014,144:166-173
[35]Dong L,Zang J B,Su J,et al.Int.J.Hydrogen Energy,2014,39:16310-16317
[36]Zhang Y,Zang J B,Dong L,et al.J.Mater.Chem.A,2014,2:10146-10153
[37]Fang L,Huang X P,Vidal-Iglesias F J,et al.Electrochem.Commun.,2011,13:1309-1312
[38]Niu J J,Wang J N.Acta Mater.,2009,57:3084-3090
[39]Tong X,Dong L,Jin G,et al.Fuel Cells,2011,6:907-910
[40]Han C,Wang Y D,Lei Y P,et al.Ceram.Int.,2016,42:5368-5374
[41]You D J,Jin X,Kim J H,et al.Int.J.Hydrogen Energy,2015,40:12352-12361
[42]Jiang L M,Fu H G,Wang L,et al.RSC Adv.,2014,4:51272-51279
[43]Dong L L,Tong X L,Wang Y Y,et al.J.Solid State Electrochem.,2014,18:929-934
[44]Wang L,Zhao L,Yu P,et al.J.Mater.Chem.A,2015,3:24139-24147
[45]Ganji M D,Agheb R,Ganji H D,et al.J.Phys.Chem.Solids,2016,88:47-53
[46]Grubb W,McKee D.Nature,1966,210:192-194
[47]Lv H F,Peng T,Wu P,et al.J.Mater.Chem.,2012,22:9155-9160
[48]Jackson C,Smith G T,Inwood D W,et al.Nat.Commun.,2017,8:15802
[49]Pan H,Zang J B,Dong L,et al.Electrochem.Commun.,2013,37:40-44
[50]Pan H,Zang J B,Li X H,et al.Carbon,2014,69:630-633
[51]Jia Y D,Wang Y H,Dong L,et al.Chem.Commun.,2015,51:2625-2628
[52]Li J Y,Wang J,Gao D F,et al.Catal.Sci.Technol.,2016,6:2949-2954
[53]Zhang P,Xiao B B,Hou X L,et al.Sci.Rep.,2014,4:3821
[54]Song S D,Xu W,Cao R G,et al.Nano Energy,2017,33:195-204
[55]Song S D,Xu W,Zheng J M,et al.Nano Lett.,2017,17:1417-1424
[56]Vineesh T V,Kumar M P,Takahashi C,et al.Adv.Energy Mater.,2015,5:1500658(8 pages)
[57]SUN Jie(孙杰),WU Feng(吴锋),QIU Xin-Ping(邱新平),et al.Chin.J.Power Sources(电源技术),2004,28(7):452-457
[58]He C,Wu X,Shen J,et al.Nano Lett.,2012,12:1545-1548
[59]Fan X J,Peng Z W,Wang J J,et al.Adv.Funct.Mater.,2016,26:3621-3629
Application of Silicon Carbide and Boron Carbide in Electrocatalysis
SU Jing1WANG Yan-Hui1DONG Liang2ZANG Jian-Bing*,1
(1State Key Laboratory of Metastable Materials Science and Technology,College of Materials Science and Engineering,Yanshan University,Qinghuangdao,Hebei 066004,China)(2Key Laboratory of Dielectric and Electrolyte Functional Material Hebei Province,School of Resources and Materials,Northeastern University at Qinghuangdao,Qinghuangdao,Hebei 066004,China)
Fuel cells are considered to be new energy technologies with broad application prospects.Platinum nanoparticles loaded on carbon supports (Pt/C)are commonly used as electrode electrocatalysts for fuel cells,however,Pt based nanocatalysts are unstable in fuel cells and high cost,which severely restricting the scale application of fuel cells.Silicon carbide and boron carbide,which presents excellent physical and chemical stability due to strong covalent bonds,become stable and low cost materials for fuel cell catalysts.The progress of related research is reviewed in this paper,unique advantage of silicon carbide and boron carbide as electrocatalysts is provided,and development tendency is discussed.
fuel cells;covalent carbides;silicon carbide;boron carbide;electrocatalysis
TQ152
A
1001-4861(2018)01-0001-10
10.11862/CJIC.2018.023
2017-09-01。收修改稿日期:2017-11-17。
国家自然科学基金(No.51602043)和中央高校基本科研业务费(No.N152303001)资助项目。
*通信联系人。 E-mail:diamondzjb@163.com

