外源性胆红素在缺血缺氧性脑损伤大鼠中的作用研究
侯立维 孔丽娜
1)郑州大学第二附属医院,河南 郑州 450014 2)郑州大学第三附属医院,河南 郑州 450052
·论著科研之窗·
外源性胆红素在缺血缺氧性脑损伤大鼠中的作用研究
侯立维 孔丽娜
1)郑州大学第二附属医院,河南 郑州 450014 2)郑州大学第三附属医院,河南 郑州 450052
目的探讨外源性胆红素对缺血缺氧性脑损伤(HIBD)大鼠的影响及机制。方法以新生SD大鼠为研究对象,构建HIBD模型,探讨5、10 和15 mg/kg胆红素对大鼠学习记忆的影响,TUNEL检测细胞凋亡程度,RT-PCR检测脑组织VEGF、Caspase-3 mRNA水平。结果与假手术组相比,模型组大鼠平均逃避潜伏、原平台象限停留时间及游泳速度均存在显著性差异(P<0.05)。与模型组相比,胆红素处理各组大鼠平均逃避潜伏、原平台象限停留时间及游泳速度均存在显著性差异(P<0.05)。与低剂量组与高剂量组相比,中剂量组大鼠平均逃避潜伏、原平台象限停留时间及游泳速度均存在显著性差异(P<0.05)。造模后第 3、7、14 天,胆红素处理各组大鼠神经细胞凋亡细胞数明显少于模型组(P<0.05);以中剂量组大鼠神经细胞凋亡细胞数最低。造模后第 3、7、14天,与假手术组相比,模型组大鼠脑组织VEGF、Caspase-3 mRNA水平均存在显著性差异(P<0.05)。与模型组相比,胆红素处理各组大鼠脑组织VEGF、Caspase-3 mRNA水平均存在显著性差异(P<0.05)。与低剂量组和高剂量组相比,中剂量组大鼠脑组织VEGF、Caspase-3 mRNA水平均存在显著性差异(P<0.05)。结论适宜浓度的胆红素可能通过降低脑组织VEGF、Caspase-3表达水平,阻止神经细胞死亡程序,发挥HIBD的神经保护作用。
缺血缺氧性脑损伤;胆红素;VEGF;Caspase-3;大鼠;mRNA
新生儿围生期窒息导致的缺血缺氧性脑损伤(HIBD)是一种危害较大的常见病,病死率和致残率均较高。研究显示,窒息儿中7.5%~57.6%可发生HIBD,严重者在新生儿早期死亡或遗留智力低下、脑瘫、癫痫等神经系统后遗症[1]。作为体内正常的代谢物,胆红素具有双重作用,适宜水平的血清胆红素对机体具有保护作用,而血清胆红素水平过高则对机体产生损伤,尤其是脑组织,可引起胆红素脑病[2-3]。本研究通过建立HIBD大鼠模型,给予不同剂量的外源性胆红素,观察神经元的凋亡和脑损伤程度,旨在寻找外源性胆红素干预HIBD的合适剂量,为脑损伤的早期干预提供新思路。
1 材料与方法
1.1实验动物及分组清洁级新生7 d SD大鼠75只,体质量12~16 g,购于河南省实验动物中心,饲养于动物房,采用随机数字表法分为假手术组、模型组、低剂量组、中剂量组和高剂量组,每组15只。
1.2主要试剂总RNA提取试剂盒(上海超研生物科技有限公司),血管内皮生长因子(VEGF)、Caspase-3试剂盒(上海晶抗生物工程有限公司),TUNEL 测试试剂盒(北京鼎国昌盛生物技术有限责任公司),其他试剂均为分析纯国产试剂。
1.3主要仪器超净工作台(AIRTECH,苏州净化设备有限公司),精密电子天平(Adventurer 公司,美国),紫外分光光度计(上海第三分析仪器厂),酶标仪(上海安亭科学仪器厂)。
1.4动物模型的构建采用经典Rice法制作 HIBD大鼠模型。大鼠置于超净工作台上,乙醚麻醉后分离并两端结扎左侧颈总动脉,回窝恢复 1 h 后,放入常压缺氧箱中,常压缺氧箱上端有2小孔,一孔与测氧仪相连接,另一孔按输入氮气、氧气,控制氧气浓度范围在8%,常压缺氧箱舱内温度控制在(36 ±2)℃,持续缺氧3.5 h。假手术对照组不结扎动脉,不行缺氧处理。模型制作 4 h 后,低剂量组、中剂量组和高剂量组分别腹腔注射5、10 和15 mg/kg胆红素,假手术组、模型组给等量生理盐水,1次/d,连续给药5 d。
1.5标本采集造模后第 3、7、14天,随机处死各组大鼠5只,处死前称质量,麻醉后处死,断头取脑,保留脑脊液,分装于冻存管中,液氮中快速冷冻于-80 ℃ 冰箱保存。
1.6检测指标
1.6.1 水迷宫试验:造模后第8 周进行Morris 水迷宫试验检测大鼠空间学习记忆能力,包括隐蔽平台试验和空间探索试验,记录大鼠的逃避潜伏期、原平台象限停留时间及游泳速度。
1.6.2 TUNEL检测细胞凋亡:脑组织于4%多聚甲醛溶液中固定过夜,石蜡包埋,冰冻切片采用TUNEL进行细胞凋亡检测,严格按TUNEL检测试剂盒说明书操作。显微镜下红色荧光为TUNEL阳性细胞,随机选取6个不重复高倍视野(×200),计算阳性细胞凋亡指数(AI)。计算公式为:AI=(凋亡细胞数/总细胞数)×100%。
1.6.3 RT-PCR检测VEGF、Caspase-3 mRNA水平:Trizol法分别提取各组大鼠总RNA。总RNA采用纯化柱纯化。引物设计:β-actin(239bp)上游引物:5'-AGGCATCCTGACCCTGAAGTA-3’,下游引物:5'-GAGGCATACAGGGACAACACAG-3′;VEGF(175bp)上游引物:5′-CGGACAGACAGACAGACACC-3′,下游引物:5’-CCCAGAAGTTGGACG-AAAAG-3′;Caspase-3(143bp)上游引物:5’-GGAGCAGTTTTGTGTGTGTGAT-3’,下游引物:5’-GAAGAGTTTCGGCTTTCCAGT-3’。逆转录为cDNA,应用RT-PCR检测VEGF、Caspase-3和ACT-A mRNA转录水平。以β-actin作为内参照,同一标本的β-actin产物表达水平校正各自目的基因的表达水平,相对表达水平=目的基因表达水平/β-actin表达水平。
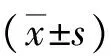
2 结果
2.1 Morris水迷宫试验与假手术组相比,模型组大鼠平均逃避潜伏、原平台象限停留时间及游泳速度均存在显著性差异(P<0.05)。与模型组相比,胆红素处理各组大鼠平均逃避潜伏、原平台象限停留时间及游泳速度均存在显著性差异(P<0.05)。与低剂量组和高剂量组相比,中剂量组大鼠平均逃避潜伏、原平台象限停留时间及游泳速度均存在显著性差异(P<0.05)。见表1。

表1 各组大鼠逃避潜伏、原平台象限停留时间及游泳速度比较
注:与假手术组比较,*P<0.05;与模型组比较,△P<0.05;与低剂量组比较,▲P<0.05;与高剂量组比较,#P<0.05
2.2细胞凋亡造模后第 3、7、14 天,胆红素处理各组大鼠神经细胞凋亡细胞数明显少于模型组(P<0.05);以中剂量组大鼠神经细胞凋亡细胞数最低。见图1。
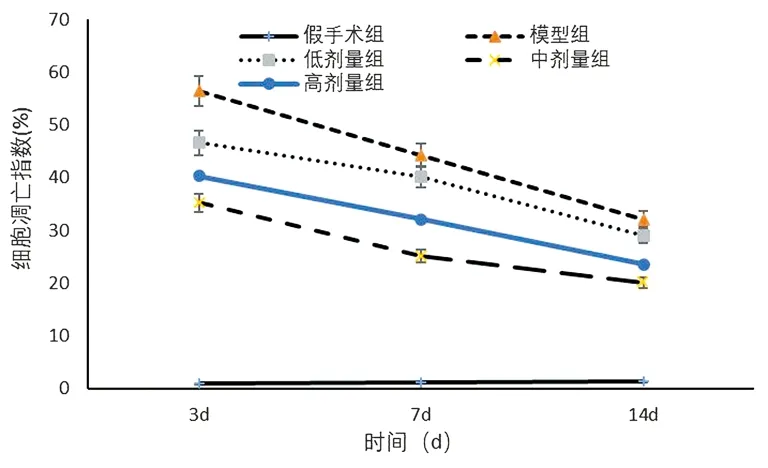
图1 造模后3~14 d内各组大鼠神经细胞凋亡检测结果
2.3 VEGF、Caspase-3 mRNA水平造模后第 3、7、14 天,与假手术组相比,模型组大鼠脑组织VEGF、Caspase-3 mRNA水平均存在显著性差异(P<0.05)。与模型组相比,胆红素处理各组大鼠脑组织VEGF、Caspase-3 mRNA水平均存在显著性差异(P<0.05)。与低剂量组和高剂量组相比,中剂量组大鼠脑组织VEGF、Caspase-3 mRNA水平均存在显著性差异(P<0.05)。见表2。

表2 造模后3~14 d内各组大鼠脑组织VEGF、Caspase-3 mRNA水平比较
注:与假手术组比较,*P<0.05;与模型组比较,△P<0.05;与低剂量组比较,▲P<0.05;与高剂量组比较,#P<0.05
3 讨论
新生儿HIBD是导致新生儿后遗脑性瘫痪、癫痫和智能发育障碍的常见原因,近年来由于新生儿抢救成功率提高和高危妊娠增多,新生儿HIBD的发病率不断上升[4]。但目前尚无特效治疗药物,寻找有效的HIBD治疗药物一直是该领域的研究热点[5]。
作为一种弥漫性损伤,HIBD发病机制十分复杂,涉及多种机制的综合作用过程,而与感觉运动功能和学习记忆等密切相关的海马和皮层等脑的重要区域在此过程中可能受损,从而导致感觉运动功能受损,空间记忆和学习能力下降[6-7]。本研究表明,缺血缺氧可导致大鼠空间学习记忆障碍,细胞凋亡检测结果提示大脑皮质神经元凋亡加快。欧阳福连等[8]报道,HIBD可导致大鼠超微结构损伤和远期神经元减少,导致远期行为学功能障碍。林莉等[9]报道,HIBD幼鼠海马齿状回神经元受到损伤,神经细胞微环境发生改变,处于不增殖状态的内源性神经干细胞可在一定程度上被激活,具备分化成为新神经元的潜质,但其启动自发修复作用有限。
胆红素是人胆汁中的主要色素,是铁卟啉化合物的主要代谢产物。胆红素具有一个延伸的共轭双键系统,生理浓度的胆红素既是超氧自由基的清除剂,又是内源性抗氧化剂[10-11]。1987年胆红素首次被证实具有保护细胞免受活性氧损伤的作用。但当胆红素血清浓度过高则对机体产生损伤,尤其是脑组织,可引起胆红素脑病[12]。本研究显示,造模后第 3、7、14 天,胆红素处理各组大鼠神经细胞凋亡细胞数明显少于模型组(P<0.05);以中剂量组大鼠神经细胞凋亡细胞数最低,表明中低剂量的胆红素对HIBD大鼠有保护作用,可促进感觉运动功能和空间记忆功能的恢复,而高剂量则有毒性作用。高浓度胆红素可影响新生儿代谢、免疫等过程,目前其确切的机制尚不十分清楚,可能与促进细胞凋亡和该过程中的大量细胞因子生成有关[13]。
细胞凋亡是一个十分复杂的过程,多种基因参与凋亡的发生。VEGF是一类促进血管再生的细胞因子,可增加血管通透性,诱导其表达的主要因素是缺血或低氧[14]。Caspase是半胱氨酸天门冬氨酸蛋白酶的简称,与细胞凋亡过程密切相关,是多条凋亡通路的交叉点。研究发现,高胆红素血症脑损伤后检测脑组织中Caspase-3的表达水平变化,可为脑损伤时间、程度的评估提供依据[15]。本研究证实,中低剂量的胆红素可能通过降低脑组织VEGF、Caspase-3表达水平,阻止神经细胞死亡程序发挥HIBD的神经保护作用。
综上所述,适宜浓度的胆红素可能通过降低脑组织VEGF、Caspase-3表达水平,阻止神经细胞死亡程序发挥HIBD的神经保护作用。
[1] VanVelthoven CT,Braccioli L,Willemen HLDM,et al.Therapeutic potential of genetically modified mesenchymal stem cells after neonatal hypoxic-ischemic brain damage[J].Mol Ther,2014,22(3):645-654.
[2] 王军,程萍萍,袁俊英,等.缺血缺氧性脑损伤新生大鼠脑组织神经细胞凋亡情况及 Tau,p-Tau 蛋白表达变化[J].山东医药,2016,56(15):36-38.
[3] 潘晓帆,周其达,秦琳.老年急性缺血性脑卒中患者血清中尿酸,总胆红素以及脂蛋白等相关因素的综合性分析[J].中国现代医学杂志,2016,26(18):44-48.
[4] 李伟,阴怀清,阴崇娟,等.亚低温干预下新生大鼠缺血缺氧性脑损伤HIF-1基因表达变化及意义[J].中西医结合心脑血管病杂志,2013,11(7):847-848.
[5] Wang Y,Cao M,Liu A,et al.Changes of inflammatory cytokines andneurotrophins emphasized their roles in hypoxic-ischemic brain damage[J].Int J Neurosci,2013,123(3):191-195.
[6] 陈美苑,刘青,曾志,等.TPO对新生大鼠缺血缺氧性脑损伤的保护作用[J].暨南大学学报(自然科学与医学版),2014,35(1):37-44.
[7] 闫昆明,刘英,张芮,等.新生大鼠缺血缺氧性脑损伤caspase-3表达与自由基损伤机制的研究[J].中国免疫学杂志,2015,16(8):1094-1097.
[8] 欧阳福连,周细中,方素珍,等.新生大鼠缺血缺氧性脑损伤远期行为学和超微结构改变[J].中国当代儿科杂志,2012,14(5):380-384.
[9] 林莉,刘希婧,荣霞,等.当归对缺血缺氧性脑损伤幼年大鼠神经元的保护作用[J].四川解剖学杂志,2010,18(4):13-15.
[10] 徐发林,王彩红,张彦华,等.枸橼酸咖啡因对新生大鼠缺血缺氧性脑损伤后神经细胞增生与凋亡及长期学习能力的影响[J].临床儿科杂志,2015,33(4):368-372.
[11] 蔡志豪,何源,李卫东,等.重组人促红细胞生成素在足月新生儿严重高间接胆红素血症中的脑保护作用研究[J].检验医学与临床,2015,12(13):1931-1933.
[12] 邓莉,寇国先,曹冬梅.人工肝胆红素特异性吸附治疗对高胆红素血症患者的临床疗效总结以及护理体会[J].中国中西医结合急救杂志,2017,24(4):426-428.
[13] Atari-Hajipirloo S,Nikanfar S,Heydari A,et al.The effect of celecoxib and its combination with imatinib on human HT-29 colorectal cancer cells:Involvement of COX-2,Caspase-3,VEGF and NF-κB genes expression[J].Cell Mol Biol(Noisy-le-Grand,France),2016,62(2):68-74.
[14] 吕少广,刘芳,暴丽莎,等.VEGF 及 Caspase-3 在早产儿脑室周围-脑室内出血后继发脑损伤中的作用[J].解放军医药杂志,2016,28(8):89-93.
[15] Liu XL,Lu J,Xing J.Stabilization of HIF-1α modula-tes VEGF and Caspase-3 in the hippocampus of rats following transient global ischemia induced byasphyxial cardiac arrest[J].Life Sci,2016,151:243-249.
Effectofexogenousbilirubinonhypoxic-ischemicbraindamageinratsanditsmechanism
HOULiwei*,KONGLina
*TheSecondAffiliatedHospitalofZhengzhouUniversity,Zhengzhou450052,China
ObjectiveTo investigate the effect of exogenous bilirubin on hypoxic-ischemic brain damage (HIBD) rats and its mechanism.MethodsThe effects of 5,10 and 15 mg/ kg bilirubin on learning and memory in rats were studied by using HIBD model.TUNEL was used to detect the degree of apoptosis.RT-PCR was used to detect the expression of VEGF and Caspase- 3 mRNA levels.ResultsCompared with the sham operation group,the mean escape latency,the quadrant residence time and the swimming speed in the model group were significantly different (P<0.05).Compared with the model group,the mean escape latency of the rats treated with bilirubin was significantly different (P<0.05).Compared with the low dose group and the high dose group,the the mean escape latency,the quadrant residence time and the swimming speed in the middle dose group were significantly different (P<0.05).The number of apoptotic cells in the neurons of the rats treated with bilirubin was significantly lower than that of the model group at the 3rd,7th and 14th day after model establishment (P<0.05).The number of apoptotic cells in the neurons of the middle dose group was the lowest.There were significant differences in VEGF and Caspase-3 mRNA levels in the model group compared with the sham operation group at the 3rd,7th and 14th day after modeling (P<0.05).Compared with the model group,the levels of VEGF and Caspase-3 mRNA in the brain tissue of the rats treated with bilirubin were significantly different (P<0.05).Compared with the low dose group and the high dose group,the levels of VEGF and Caspase-3 mRNA in the brain tissue of the middle dose group were significantly different (P<0.05).ConclusionThe appropriate concentration of bilirubin may play a neuroprotective effect in HIBD by reducing the expression of VEGF and Caspase-3 in brain tissue and preventing neuronal death.
Hypoxic-ischemic brain injury;Bilirubin;VEGF;Caspase-3;Rats;mRNA
10.3969/j.issn.1673-5110.2017.22.002
河南省基础与前沿技术研究计划项目,编号:142300410065
侯立维(1973-),男,汉族,硕士,副主任医师。研究方向:神经内科学。Email:houliwei@yeah.net
R-332
A
1673-5110(2017)22-0005-04
(收稿2017-09-26)
张喜民

