抗菌肽研究现状及其在食品安全中的应用前景
贾英民, 刘杨柳, 陈 洲
(北京工商大学 食品学院, 北京 100048)

抗菌肽研究现状及其在食品安全中的应用前景
贾英民, 刘杨柳, 陈 洲
(北京工商大学 食品学院, 北京 100048)
针对微生物污染引起的食品安全与耐药菌株引起的环境安全等问题,广谱、高效的新型天然食品防腐剂的开发应用已成为现代食品安全的重要研究趋势。抗菌肽(antimicrobial peptides,AMPs)由于其抑菌谱广、稳定性好,抑菌机制独特、不易残留等优势而备受关注。随着研究的不断深入,AMPs将有望在食品安全的应用中发挥关键性作用。有鉴于此,对近年来国内外抗菌肽(AMPs)的相关研究进行了总结,综述了AMPs资源挖掘、分类情况以及细菌、真菌、寄生虫、病毒、肿瘤细胞的生物抗性、作用机制的研究进展;同时,对AMPs在食品安全中的潜在应用方向、亟待解决的科学问题进行了分析,并提供相应的解决策略,供本领域的研究者参考。
抗菌肽; 食品安全; 研究现状; 应用前景
食品安全问题主要来自食品生产、加工和流通中的化学危害和生物危害,从食品安全监管的规范和科学事实来看,微生物危害将成为食品安全的主要问题。微生物污染引起的食品安全和耐药菌导致的环境安全问题受到人们越来越多的关注,因此,寻求新型高效安全食品防腐剂成为食品产业的科技热点。微生物引起环境安全问题,主要体现在,由于抗生素的过度使用或滥用,导致环境耐药菌株急剧增加,甚至“超级细菌”出现[1],新型高效抗生素替代品已成为业界研究的重中之重。抗菌肽(antimicrobial peptides, AMPs)的研究引起了越来越多的学者关注。AMPs是由宿主产生的能抵御外界微生物侵害、消除体内突变细胞的一类小分子多肽。通常由20~60(少于100)个氨基酸(AA)残基组成,相对分子质量为2 000~7 000 u,又称肽类抗生素(peptide antibiotics)或天然抗生素(natural antibiotics)[2]。由于AMPs化学本质属蛋白质结构,在动物体内被分解为基本单元氨基酸,无残留问题,并且AMPs是小分子肽,没有免疫原性,其抗菌机理特殊,不易产生耐药性。这些在抑菌方面的优势都预示着AMPs在食品安全领域的巨大应用潜力。
1 AMPs资源挖掘及其种类研究
20世纪70年代,Boman等[3-4]相继在果蝇、如眉纹天蚕蛾(Samiacynthia)蛹中发现了具有抗菌活性的多肽;1980年,Hultmark团队[5-6]从诱导的惜古比天蚕(Hyalophoracecropia)蛹淋巴液中分离出3种抗菌成分,并测定了其中两种多肽(P9A、P9B)的氨基酸序列,命名为天蚕素(cecropins),由此定义了首个AMPs。此后,人们陆续从动物、植物和细菌等几乎所有界域的生物体中都发现了AMPs,如防御素(defensins)、蛙皮素(magainins)、杆菌肽(bacitracin)、乳链球菌素(nisin)等。由于AMPs的发现,在生物的生态关系,尤其是在微生物区系内部的微生态关系研究领域产生了诸多科学问题;同时AMPs的生物抗性研究,预示其在食品工业、农业生产和医药领域潜在的巨大应用价值,挖掘AMPs的生物资源成为业界研究热点。经过短短几十年的研究,新型AMPs不断被分离鉴定,目前,AMPs数据库APD已收录有2 837种天然AMPs,其中绝大部分是阳离子AMPs,且以每年100种的速度在增长[7-8]。
由于新注册的AMPs越来越多,为便于系统研究,需对AMPs进行分类整理。AMPs可以根据多种方式进行分类,常见的分类方式主要是依据AMPs的生物学来源,二级结构和生物活性。
根据AMPs的生物学来源可分为3大类,即动物源AMPs(2 169个)、植物源AMPs(343个)和微生物源AMPs(325个)[7]。其中动物源AMPs又可再具体分为哺乳动物AMPs、两栖动物AMPs、鱼肽、昆虫AMPs和其他类动物源AMPs,如cathelicidins、defensins和富组蛋白(histatins)是研究较为深入的动物源AMPs;植物源AMPs主要是指植物防御素,可细分为硫素(thionins)等8个家族。与其他来源的AMPs相比,微生物多样性丰富,从高等生物分离获得的生物活性成分几乎都能找到其产生菌。由于微生物易培养和生长繁殖快等生物特性,利用微生物发酵生产AMPs,具有发酵周期短、生产成本低、操作简便及易于工业化生产等优势,因此,微生物源AMPs更具应用潜力。近些年对AMPs的微生物资源挖掘研究进展较快,细菌来源的AMPs已达近300种,其中nisin、多粘菌素(polymyxin)和由链霉菌产生的多聚赖氨酸(polylysine)等都得到不同程度的应用[9-10]。
利用核磁共振(NMR)光谱分析可测定AMPs的二级结构,基于二级结构类型可将AMPs分为4类(见图1)。1)α族:含有α-螺旋结构,如蛙皮素和LL-37。2)β族:由β-折叠构成,如人α-防御素。3)αβ族:同时含有α-螺旋和β-折叠结构,如β-防御素。4)非αβ族:不含α-螺旋和β-折叠结构,如牛中性粒细胞产生的多肽抗生素indolicidin[11]。在此分类下,解析AMPs结构可用于预测、设计具有某种特定生物抗性的AMPs。
由于APD中仅有约13%的AMPs被测定了二级结构,不能覆盖所有的AMPs,因此,Wang等[12]又建立了系统分类法,即以多肽链的连接方式为依据,将AMPs分为4类(见图2)。Ⅰ类AMPs为线性多肽(UCLL),如LL-37和magainins;Ⅱ类AMPs为侧链连接肽(UCSS),如defensins和羊毛硫抗生素(lantibiotics);Ⅲ类AMPs为侧链- 主链连接的多肽(UCSB),如lassos;Ⅳ类AMPs为环形肽(UCBB),如环肽(cyclotides)。同时每一类还能进一步分类,最终系统覆盖所有种类的AMPs。
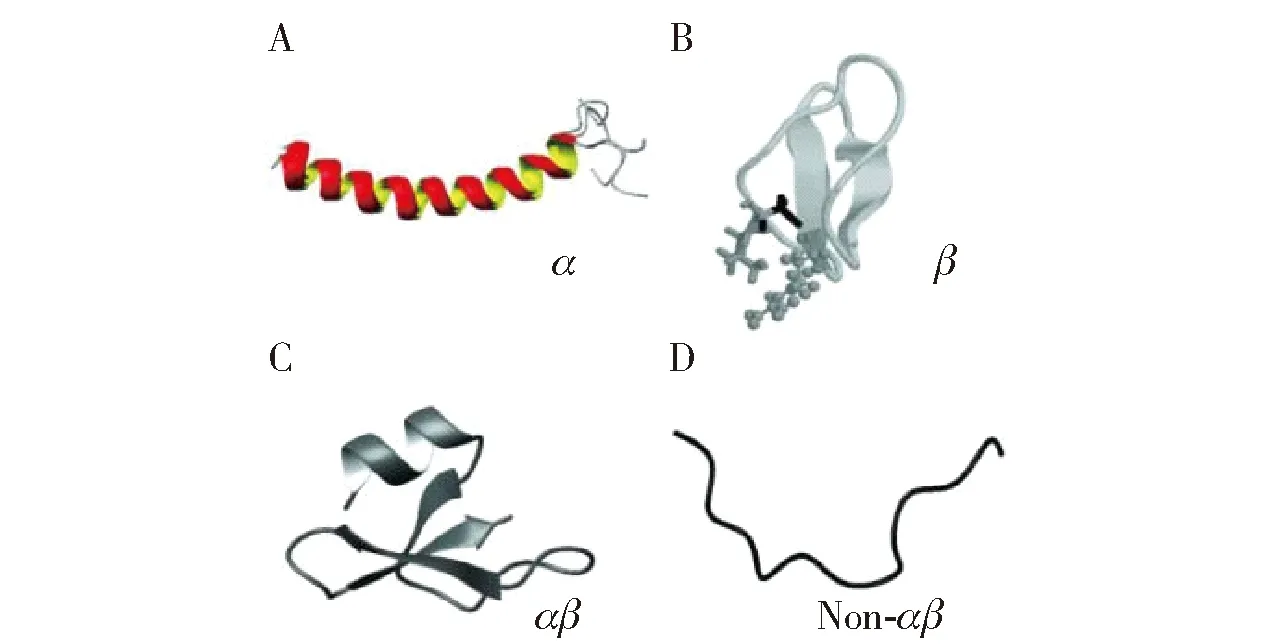
图1 AMPs 3D结构的4种分类Fig.1 Four kinds of 3D structure type of AMPs
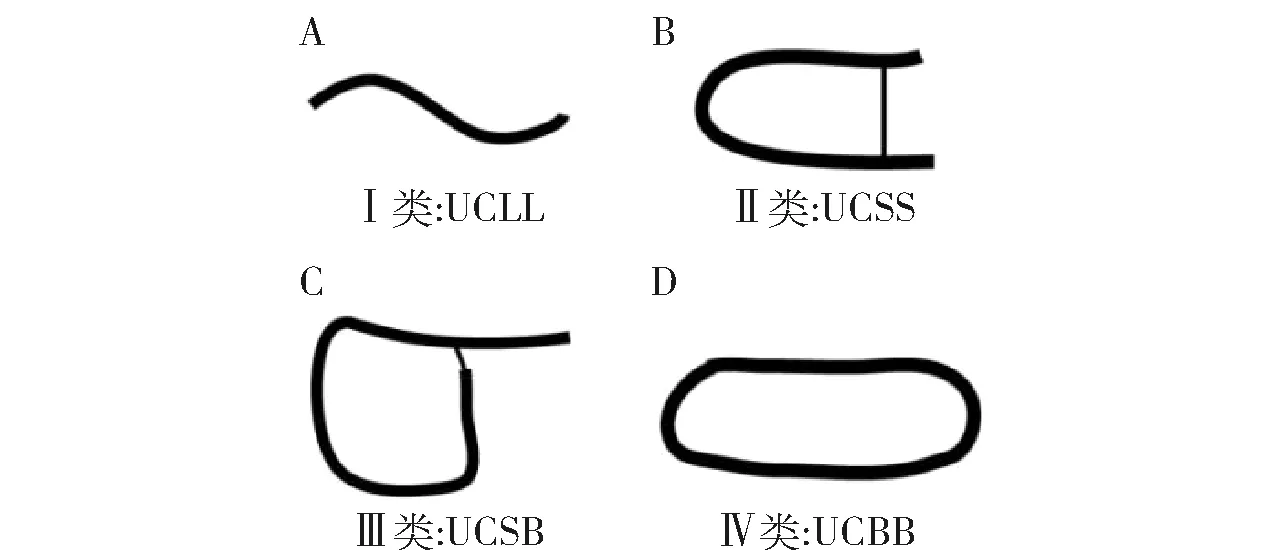
图2 基于多肽链连接方式的AMPs分类Fig.2 Classification of AMPs based on connection mode of polypeptide chain
2 AMPs的生物抗性研究
已有研究表明,不同来源的AMPs或同类生物来源的AMPs在结构和生物抗性等性质方面表现出较大差异。随着研究的深入,发现多种AMPs不仅对某种特定的生物类别产生抗性,多数抗细菌肽对部分真菌、寄生虫、病毒及癌细胞等具有不同程度的杀伤作用,表现出广谱生物抗性;同时,从AMPs结构等多角度着手解析生物抗性机理的研究也不断深入。
2.1 抗细菌活性研究
迄今报道的抗细菌AMPs有2 400多种,多数具有较好的抗菌活性,表现出广谱抗菌特性。AMPs对G+菌和G-菌具有较强抗性,但多数AMPs 抗G+菌的最小抑菌浓度(MIC)明显低于抗G-菌的MIC;有些AMPs仅对G+菌具有较强的抗菌活性,对G-菌的抗菌作用不明显,如nisin[13];也有少数AMPs仅表现抗G-菌活性,如蜜蜂来源的apidaecins[14-15]。
关于AMPs抗菌机理研究报道较多,不同类型AMPs的抗菌机理有所不同,目前学术界普遍认可的机制主要分为胞外抑菌、胞内抑菌和二者共同作用抑菌。
应用模拟膜研究法、荧光标记法、x射线衍射等方法研究AMPs的胞外抑菌机制,发现AMPs主要是先通过静电作用与细胞膜相结合,造成细胞膜的构象改变或者穿孔,从而导致细胞破裂,达到抑菌效果[16]。依据与膜作用方式的差异,胞外抑菌模型分为4种。1)桶板模型(barrel stave model):AMPs以多聚体形式插入细胞膜,形成横跨细胞膜的离子通道,导致胞内物质外流,细胞凋亡。此种机制的AMPs通常含α-螺旋,如抗菌肽 LS3。2)毯式模型(carpet model):AMPs平行于细胞膜排列,使细胞膜稳定性降低,胞内物质流出,致使细胞破裂。此类AMPs通常含β-折叠,如cecropin P1。3)环形孔模型(toroidal pore model):AMPs靠近细胞膜时,细胞膜的疏水区移位,膜疏水中心形成裂口,引发磷脂单分子层向内弯曲,形成孔道,胞内物流出使细胞破裂。这种方式是多数昆虫AMPs的抑菌机制,因此又称为虫洞(孔洞)模型,如lacticin Q。4)凝聚模型:AMPs插入细胞膜后,与磷脂分子形成胶束状复合物,以聚集物的形式跨越细胞膜,进而形成了一个动态的通道,AMPs通过这种机制可以进入细胞内部。其他胞外抑菌机制仅在个别文献中报道,最主要的区别也在于AMPs结合细胞膜方式的不同,图3展示了目前研究报道的AMPs胞外抑菌机制。

图3 AMPs胞外抑菌机制Fig.3 Extracellular antibacterial mechanism of AMPs
AMPs胞内抑菌机制主要有4方面(见图4)。1)与核酸结合,阻断DNA复制和RNA合成,如buforin II,dermaseptin,indolicidin。2)影响蛋白质合成,如昆虫源apidaecins。3)影响隔膜、细胞壁合成,阻碍细胞分裂,如乳酸乳球菌(Lactococcuslactis)IPLA 972合成的Lcn 972,nisin可从细胞壁合成位点或隔膜移除细胞壁前体中的Lipid II。4)影响胞内酶活性,大肠埃希氏菌(Escherichiacoli)质粒编码的 microcin J25可抑制RNA酶活性。Apidaecins能竞争性结合E.coli细胞膜蛋白异构体,抑制细胞分裂蛋白酶活性,并增强细胞浆蛋白UDP-3-O-酰基-N-乙酰氨基葡糖脱乙酰酶活性,致使磷- 脂失去平衡[17-18]。

图4 AMPs胞内抑菌机制Fig.4 Intracellular antibacterial mechanism of AMPs
此外,抑菌机制在某些时期也可能存在胞外和胞内协同的作用模式。由于AMPs的作用靶点不具特异性,因此其不易产生耐药性,降低了使用风险,使其有望替代传统抗生素成为新一代的抗性药物。
2.2 抗真菌活性研究
Magainins能抑杀白色念珠菌(Candidaalbicans),是最早发现的具有抗真菌活性的AMPs[19]。目前,APD中收录了1 043种具有抗真菌活性的AMPs,其中微生物源AMPs为27种。棘白菌素类(echinocandins)能抑杀假丝酵母属(Candidaspp.)和曲霉菌属(Aspergillusspp.),侧孢短芽孢杆菌(Brevibacilluslaterosporus)A60产生的AMPs能抑制辣椒疫霉菌属(Phytophthora)[20]。
类似抗细菌肽作用机理,有关真菌抗性机理研究大部分集中在AMPs对真菌细胞膜的作用,但同时也存在其他可能的作用靶点(见图5)[21-22]。Wang等[23]研究发现,polybia-CP在抵抗真菌方面存在多种作用机制,推测该AMPs能通过静电作用与细胞膜的多糖相结合,进而阻碍真菌细胞膜的合成;同时也能打破细胞氧化还原平衡,诱导增加细胞活性氧ROS含量,干扰线粒体功能,导致真菌死亡。尽管各种抗真菌肽来源、结构、作用机理存在差异,但也正是这种多样性使真菌不易产生抗性,有望在农业病害防治和医药抗真菌方面得到广泛应用。
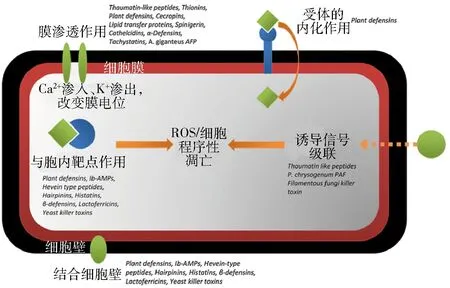
图5 AMPs抗真菌作用机理Fig.5 Antifungal mechanism of AMPs
2.3 抗寄生虫活性研究
1989年,Gwadz等[24]研究发现,magainins和cecropins这两类AMPs能通过终止疟原虫卵囊的发育而阻断子孢子的发育和传播,从而抑制疟原虫的生长代谢,这是首次发现AMPs具有抗寄生虫作用。随后,多种具有抗寄生虫活性的AMPs(APD收录100条数据)不断被纯化分离,但由于寄生虫种类的多样性,尤其是不同宿主中复杂的生命周期以及大量蛋白表达和膜组成的多样性,因此AMPs作用靶点和时期均有所不同。dermaseptin S4及其类似物可诱导利什曼虫(Leishmania)前鞭毛体溶解,富含赖氨酸的magainins合成肽pexiganan能促使利什曼原虫前鞭毛体上的细胞裂解衰亡[25]。Landa等[26]使用tem-porin A(TA)和iseganan IB-367两种AMPs处理体外猪肉绦虫幼虫24 h后,幼虫皮层完全脱落,薄壁组织结构完全破坏;向囊虫病大鼠分别注射IB-367(200 μg)一个月,寄生虫量下降25%,而注射TA(400 μg)下降50%。Akaddar等[27]研究证明,儿茶酚抑素catestatin能通过阻断疟原虫蛋白质的合成而抑制原虫生长;同时,有研究表明,部分AMPs能选择性地作用于被寄生虫感染的红细胞,而对正常细胞无干扰。因此,AMPs在作为抗疟原虫药物方面具有开发应用的潜力[28]。
2.4 抗病毒活性研究
目前APD中收录了179种具有抗病毒活性的AMPs,另有109种具有抗HIV的潜能,涉及不同来源,如昆虫来源的蜂毒肽(melittin)、植物源防御肽、动物源乳铁蛋白肽(lactoferricin)、magainins,微生物源siamycin Ⅱ等品类,可对常见侵染细胞的病毒产生抑制效果。研究发现,θ-defensins能结合单纯疱疹病毒(herpes simplex virus,HSV)的表面糖蛋白B,抑制病毒吸附、融合生物细胞[29]。Matsumura等[30]研究发现,cathelicidin LL-37能降低细胞培养体系中丙型肝炎病毒HCV 抗原(Ag)水平,表明其能阻断HCV的复制。蜂毒肽是由26个氨基酸残基组成的AMPs,在低浓度下也能显著抑制HSV Ⅰ型、Ⅱ型和人类免疫缺陷病毒Ⅰ型(HIV-1)。Lee等[31]研究melittin主要是与HSV脂质双分子层结合,形成包膜穿孔,使病毒凋亡。研究发现,AMPs的抗病毒活性与其二级结构密切相关,多为具有两亲性α-螺旋和β-折叠的阳离子AMPs。
2.5 抗肿瘤细胞活性研究
AMPs作用对象的高选择性,给抗癌药物的开发带来新的希望,可能成为替代传统手术、放化疗的新型多肽类抗肿瘤药物。目前,APD中已收录了205种具有抗肿瘤活性的AMPs,已报道的AMPs在杀伤艾氏腹水瘤EAC、人髓样白血病细胞K552 株、人宫颈癌细胞HeLa、肝癌细胞BEL27402及直肠癌细胞HR8340等癌细胞作用突出[32];多种离体癌细胞,如肉瘤细胞S180、巨噬细胞淋巴瘤U937、人髓样白血病细胞K562等也可被其抑制[33];同时,有研究表明AMPs能选择性杀伤肿瘤细胞,而对正常细胞无毒副作用[34]。
AMPs抗肿瘤机制较抗菌机制更复杂。一方面,与抑菌作用细胞膜机制类似,AMPs可通过与细胞膜结合,破坏细胞膜结构功能,从而促使肿瘤细胞凋亡,如cecropins等具有α螺旋结构的AMPs[35-36];还可能通过胞内作用方式,破坏细胞骨架中微管蛋白,抑制核染色体DNA合成,进而诱导肿瘤细胞凋亡。Niggemann等[37]研究发现,来自植物芽孢杆菌的己环肽能单独阻碍人结肠癌细胞HCT116的DNA的周期合成,最终诱导细胞系凋亡。另一方面,AMPs还可以通过调动机体免疫机能,以抵抗癌细胞的入侵,增强机体防御。sungsanpin是由15个氨基酸组成的链霉菌AMPs。研究表明,基质金属蛋白酶MMP及其抑制剂TIMPs在细胞入侵方面具有重要的调节作用。sungsanpin能浓度依赖式显著增加基质金属蛋白酶组织抑制剂TIMP-1和TIMP-2的mRNA水平,促进抑制剂表达,最终降低人肺腺癌细胞A549的入侵[38]。
此外,在哺乳动物中还发现了AMPs的多种免疫调节活性,如抗炎症、抗感染、促进伤口愈合等功能,预示AMPs在生物体内天然防御系统中有望发挥免疫抵抗机能。
3 AMPs在食品安全中应用
AMPs具有高效广谱抗性,同时具有分子量小、无残留、不易产生耐药性等优势,有望在食品安全方面发挥革命性的作用。AMPs在食品安全领域的应用包括3个层次,其一是在食品原料控制环节应用,替代或减少农药(兽药)的使用,提高食品加工原料的安全品质;其二是在食品防腐保鲜环节,作为高效、安全生物防腐剂应用于食品加工、储运等诸多环节,解决食品防腐剂的残留问题;再者,由于AMPs在农业生产和食品防腐保鲜中应用,将有助于降低抗生素的使用,减少环境耐药性菌株的产生,进而改善食品安全环境条件。
3.1 AMPs在食品原料控制方面的应用
AMPs在食品原料控制方面,主要体现在农业领域的应用。在动物性食品原料生产中,近些年人们主要致力于开发高效、安全的AMPs作为饲料添加剂,取代或部分替代抗生素,建立畜禽、水产动物的无抗养殖技术。研究发现,AMPs可通过增加幼仔成活率、减少腹泻、增加体重、提高生长速度等方面提升畜禽的生长和生产性能。Xiong等[39]以乳铁蛋白、天蚕素、防御素和菌丝霉素制成的AMPs混合饲料饲喂断奶仔猪,能使仔猪腹泻率显著下降(p<0.001),提高了存活率,增强了仔猪生长性能。同时,AMPs饲料在改善小肠黏膜细胞形态,调整肠道菌群,抑制有害菌、增加益生菌,提高机体免疫能力等方面也具有积极作用。Choi等[40]以含60 mg/kg的peptide-P5饲料饲喂20 d龄小肉鸡(Ross 308),实验组肉鸡的肠道总厌氧菌(TAB)、大肠杆菌数量均低于(p<0.05)对照组(无添加抗菌肽饲料),十二指肠、空肠绒毛长度、长度深度比(VH:CD)均高于对照组,表明peptide-P5对幼龄肉鸡的机体免疫具有积极影响。Yoon等[41]使用含peptide-A3和P5抗菌肽饲料饲喂断奶仔猪也得到了与Choi一致的结论。孙全友等[42]使用天蚕素和姜黄素(curcumin)饲喂肉鸡,表明AMPs饲料能显著增殖盲肠内的益生菌,抑制有害菌;雷岷等[43]研究也发现,以添加天蚕素的饲料饲喂肉兔能促进增加脾脏和胸腺指数(p<0.05),增强免疫功能。在水产养殖业中,AMPs通常作为饵料添加剂,其研究主要集中于AMPs对鱼类、水产甲壳类等动物的免疫力及生长性能的提升方面,如罗非鱼、草鱼等鱼类,凡纳滨对虾、河蟹等水产甲壳动物。陈红等[44]研究蝇蛆AMPs作为饵料蛋白添加剂饲喂日本鳗鲡鱼,证明蝇蛆AMPs对于鳗鲡鱼生长性能的提高具有显著影响。覃志彪等[45]研究发现,以5.0~8.0 mL/kg的AMPs(天蚕素含量92%)作为饵料饲喂凡纳滨对虾,对虾虾苗的增重率、成活率生长性能均有所提升。此外,王一娟等[46]研究发现,AMPs在一定程度上还能提高河蟹的免疫力和抗氧化能力。
在植物性原料方面,AMPs主要应用于果蔬采收前后的病害防治。果蔬采前通常是选育具有优良抗病能力的植株,基因重组技术是在此领域较为成熟的一项生物改造技术。Rahnamaeian等[47]研究表明,将metchinkowin 基因转入大麦中,成功表达该基因的大麦对抗白粉病能力得以提高。Badosa等[48]研究发现,Ts-FKLFKKILKVL-NH(2) (BP22)能降低因扩展青霉菌(Penicilliumexpansum)引起的苹果青霉病。Liu等[49]将牡蛎酶解液中提取的CgPep33应用于采摘后的草莓,发现其能有效预防因黑葡萄孢菌(Botrytiscinerea)引发的灰霉病。
3.2 AMPs在食品防腐保鲜方面的应用
食品原料在加工、储运环节中,食品的防腐保鲜是重中之重。天然防腐剂AMPs在食品防腐、保鲜等方面应用潜力巨大,但由于多数AMPs的抑菌机理和生物安全性尚未完全明确,批准在食品上应用的AMPs还较少,主要是nisin和聚赖氨酸。早在1969年,nisin就被FAO/WHO批准使用,主要作为食品防腐剂,已应用于乳品、肉制品、罐装食品、啤酒和果汁等领域的生产和贮藏[50]。聚赖氨酸于2003年被FDA批准为食品添加剂予以使用,我国于2014年批准用作食品防腐剂[51]。其他AMPs的应用多停留在实验室研究阶段,主要是喷涂食品表面、直接或制成纳米颗粒加入食品中。康苏等[52]研究表明,添加0.02%(w/v)cecropin XJ能有效抑制鲜榨番茄汁、葡萄汁中致病菌生长,延长保鲜期,且该结果与相同浓度山梨酸钾的防腐效果无显著差异。Baos等[53]研究表明,与以噬菌体Phage P100处理鱼相比,环肽肠道菌素enterocin AS- 48在4 ℃贮藏条件下,降低生鳕鱼、鲑鱼和烟熏鲑鱼中李斯特菌数量上效果更加显著。LactobacillusgasseriLA39产生的gassericin A可保证肉制品在4 ℃下保存3个月,37 ℃保存2个月,是一种潜在的食品防腐剂[54]。Rivas等[55]将冷冻干燥后复溶的米酒乳杆菌素sakacin Q涂抹在熟猪肉表面,能有效控制李斯特菌的生长。
除了将AMPs直接应用于食品中作为添加剂,AMPs食品包装材料的研究开发在食品储运环节的防腐保鲜方面也将具有广阔的发展前景。Espitia等[56]研发了一种含pediocin和氧化锌纳米粒子(nanoZnO)的可降解甲基纤维素(MC)纳米复合薄膜,可用于食品生物活性包装,能有效抑制S.aureusATCC 6538和L.monocytogenesATCC 15313的生长。Barbosa等[57]使用nisin-纤维素膜包装芒果切片,4 d后接种S.aureus和L.monocytogenes数量(107 CFU/g)降至检测限,6 d后S.aureus降低了6个log单位,并且芒果的感官品质未受影响。
4 问题与展望
由于AMPs广阔的应用前景,极大地吸引了人们的研究和应用开发兴趣。短短几十年的研究历程,AMPs数据库就注册了2 800多种AMPs,并且新注册的AMPs数量仍在快速增加,但无论在食品原料生产还是食品防腐保鲜方面,到目前得到广泛应用的还很少,分析原因,AMPs从研究到应用各环节的主要问题有几个方面。1)对AMPs研究还有待进一步深入,包括AMPs的结构与功能的关系认识还不够充分,不同AMPs抗菌机理不尽相同,还有待进一步系统研究不同AMPs的抗细菌、真菌、甚至病毒或肿瘤细胞等抗性原理。2)更重要的是关于AMPs的安全性评价有待深入开展研究,首先是需要建立AMPs的安全评价体系和评价标准,筛选出不同安全级别的AMPs,同时研究制定出不同用途AMPs的安全标准。3)AMPs的生产成本问题,除在临床上的特效药用外,无论是食品原料生产环节还是食品加工储运环节,AMPs作为新型高效安全饲料添加剂、新型抗菌剂或新型防腐剂,其生产成本也是制约其推广应用的一个重要因素。4)就目前在食品防腐保鲜中准许应用的nisin和聚赖氨酸,因其抗菌谱窄、抑菌活性低等局限性,其应用范围受到制约。Nisin仅对G+菌具有明显抑制作用[50],而天然聚赖氨酸抑菌活性较低,通常与海藻酸钠等物质复配以增强其防腐效果[58]。因此,在食品防腐保鲜领域,还亟待开发抗菌活力高、抗菌谱广的安全AMPs。
AMPs在食品安全领域应用广泛,还需要进一步加强几个方面的研究工作。1) 进一步加强从微生物中选育AMPs 高效菌株。由于微生物的生物多样性,决定了从高等生物能够获得的生物大分子,几乎都能从微生物中分离获得其产生菌株。分离筛选产AMPs 高效菌株仍是AMPs 广泛应用的出发点。2) 加强AMPs生物抗性研究和抗菌机理研究。明确AMPs的抗性特点、抗菌机理对于AMPs的应用开发及应用途径具有重要的理论指导作用。3)加强对AMPs的安全评价机制研究。建立AMPs在食品防腐剂、饲料添加剂等方面的安全评价体系。4)加强对已有AMPs的应用研究。研究获批准许应用的AMPs与天然动植物抗菌成分的配伍,AMPs之间的协同效应,为研制广谱高效复合型天然生物防腐剂、饲料添加剂或农用抗病虫害制剂提供理论指导。鉴于AMPs的无残留,甚至多数对人体有一定免疫调节等营养保健作用等优点,随着人们对食品和环境安全意识的日益增强,AMPs在食品防腐保鲜及食品原料生产中的应用将会有更为广阔的发展前景。
[1] O’NEILL J. Tackling drug-resistant infections globally: final report and recommendations[R/OL]. [2016-05-19]. http:∥apo.org.au/system/files/63983/apo-nid63983-6701.pdf
[2] PANE K, DURANTE L, CRESCENZI O, et al. Antimicrobial potency of cationic antimicrobial peptides can be predicted from their amino acid composition: application to the detection of “cryptic” antimicrobial peptides[J]. Journal of Theoretical Biology, 2017, 419:254-265.
[3] BOMAN H G, NILSSON I, RASMUSON B.Inducible antibacterial defence system inDrosophila[J]. Nature, 1972, 237(5352): 232-235.
[4] BOMAN H G, NILSSON-FAYE I, PAUL K.Characteristics of an inducible cell-free antibacterial reaction in hemolymph ofSamiacynthiapupae[J]. Infection and Immunity, 1974, 10(1) : 136-145.
[5] HULTMARK D, STEINER H, RASMUSON T, et al. Insect immunity: Purification and properties of three inducible bactericidal proteins from hemolymph of immunized pupae ofHyalophoracecropi[J].European Journal of Biochemistry, 1980, 106(1) : 7-16.
[6] STEINER H, HULTMARK D, Å ENGSTROM, et al. Sequence and specificity of two antibacterial proteins involved in insect immunity[J]. Nature, 1981, 292(5820):246-248.
[7] Department of Pathology and Microbiology, University of Nebraska Medical Center. The antimicrobial peptide database[DB/OL]. [2017-11-01]. http:∥aps.unmc.edu/AP/main.php.
[8] WANG G, LI X, WANG Z. APD3: the antimicrobial peptide database as a tool for research and education[J]. Nucleic Acids Research, 2016, 44(Database issue): D1087-D1093.
[9] 陈亮, 李瑞静, 黄亮, 等. 微生物抗菌肽及其在动物生产中的应用[J]. 中国畜牧杂志, 2017, 53(2):15-19.
CHEN L, LI R J, HUANG L, et al. Microorganism antimicrobial peptides and their application in animal production[J]. Chinese Journal of Animal Science, 2017, 53(2):15-19.
[10] 燕晓翠, 杨春蕾, 姚大为, 等. 抗菌肽的国内外研究进展[J]. 天津农业科学, 2017, 23(5):35-41.
YAN X C,YANG C L, YAO D W, et al. Research progress on domestic and abroad of antibacterial peptides[J]. Tianjin Agricultural Sciences, 2017, 23(5):35-41.
[11] WANG G S. Antimicrobial peptides: discovery, design and novel therapeutic strategies[M]. England: CABI, 2010:5-17.
[12] WANG G S. Improved methods for classification, prediction, and design of antimicrobial peptides[J]. Methods Mol Biol, 2015, 1268:43-66.
[13] KAMARAJAN P, HAYAMI T, MATTE B, et al. Nisin Z P, a bacteriocin and food preservative, inhibits head and neck cancer tumorigenesis and prolongs survival[J]. Plos One, 2015, 10(7): e0131008.
[14] AGEITOS J M, SNCHEZ-PÉREZ A, CALO-MATA P, et al. Antimicrobial peptides (AMPs): ancient compounds that represent novel weapons in the fight against bacteria[J]. Biochemical Pharmacology, 2016, 133: 117-138.
[15] 孙超, 陈秀珠, 还连栋, 等. 多肽抗生素apidaecin基因在乳酸乳球菌中的融合表达[J]. 生物工程学报,2001,17(1):20-23.
SUN C, CHEN X Z, HUAN L D, et al. Fusion expre-ssion of a peptide antibiotic-apidaecins gene inLactococcuslactis[J]. Chinese Journal of Biotechnology, 2001, 17(1): 20-23.
[16] NGUYEN L T, HANEY E F, VOGEL H J. The expanding scope of antimicrobial peptide structures and their modes of action[J]. Trends in Biotechnology, 2011, 29(9): 464-472.
[17] BROGDEN K A. Antimicrobial peptides: pore formers or metabolic inhibitors in bacteria[J]. Nature Reviews Microbiology, 2005, 3(3): 238-250.
[18] 王兴顺, 耿艺介, 李文楚, 等. AMPs抗菌机制及其应用研究进展[J]. 微生物学免疫学进展, 2012(4):70-76.
WANG X S, GENG Y J, LI W C, et al. Advanced researches in antibacterial mechanisms of antimicrobial peptides and their application [J]. Progress in Micro-biology and Immunology, 2012(4):70-76.
[19] PHOENIX D A, HARRIS F, DENNISION S R. Magainins-A model for development of eukaryotic antimicrobial peptides (AMPs)[J]. Wiley-VCH Verlag GmbH and Co. KGaA, 2014, 57 (3): 47-70.
[20] ZHAO J, GUO L, ZENG H, et al. Purification and characterization of a novel antimicrobial peptide fromBrevibacilluslaterosporusstrain A60[J]. Peptides, 2012, 33(2): 206-211.
[21] RAUTENBACH M, TROSKIE A M, VOSLOO J A. Antifungal peptides: to be or not to be membrane active[J]. Biochimie, 2016, 130:132-145.
[22] VAN N L, BLEACKLEY M R, ANDERSON M A. Properties and mechanisms of action of naturally occurring antifungal peptides[J]. Cellular and Molecular Life Sciences, 2013, 70(19):3545-3570.
[23] WANG K, JIA F, DANG W, et al. Antifungal effect and action mechanism of antimicrobial peptide polybia-CP[J]. Journal of Peptide Science, 2015, 22(1):28-35.
[24] GWADZ R W, KASLOW D, LEE J Y, et al. Effects of magainins and cecropins on the sporogonic development of malaria parasites in mosquitoes[J]. Infection and Immunity, 1989, 57(9):2628-2633.
[25] SIERRA J M, FUSTE E, RABANAL F, et al. An overview of antimicrobial peptides and the latest advances in their development[J]. Expert Opinion on Biological Therapy, 2017, 17(6):663-676.
[26] LANDA A, JIMENEZ L, WILLMS K, et al. Antimicrobial peptides (temporin A and iseganan IB-367): effect on the cysticerci of taenia crassiceps[J]. Molecular and Biochemical Parasitology, 2009, 164(2):126-130.
[27] AKADDAR A, DODERERKANG C, MARZAHN M R, et al. Catestatin, an endogenous chromogranin Aderived peptide, inhibitsinvitrogrowth ofPlasmodiumfalciparum[J]. Cellular and Molecular Life Sciences, 2010, 67(6):1005-1015.
[28] VALE N, AGUIAR L, GOMES P. Antimicrobial peptides: a new class of antimalarial drugs?[J]. Front Pharmacol. 2014, 5:275.
[29] 朱颜鑫, 江滟. 人防御素的抗病毒活性及机制[J]. 医学综述, 2016, 22(6):1066-1069.
ZHU Y X, JIANG Y. The antiviral activity and mechanisms of human defensin[J]. Medical Recapitulate, 2016, 22(6):1066-1069.
[30] MATSUMURA T, SUGIYAMA N, MURAYAMA A, et al. Antimicrobial peptide LL-37 attenuates infection of hepatitis C virus[J]. Hepatology Research, 2015, 46(9):924-932.
[31] LEE M T, SUN T L, HUANG W C, et al. Process of inducing pores in membranes by melittin[J]. Pnas, 2014, 110(35):14243-14248.
[32] 刘淼, 郑风劲. 抗菌肽的应用前景及研究进展[J]. 四川解剖学杂志, 2012, 20(1):55-57.
LIU M, ZHENG F J. The application and development prospect of antimicrobial peptides[J]. Sichuan Journal of Anatomy, 2012, 20(1):55-57.
[33] 李冠楠, 夏雪娟, 隆耀航, 等. 抗菌肽的研究进展及其应用[J]. 动物营养学报, 2014, 26(1):17-25.
LI G N, XIA X J, LONG Y H, et al. Research progresses and applications of antimicrobial peptides[J]. Chinese Journal of Animal Nutrition, 2014, 26(1):17-25.
[34] 张金花, 赵明才, 贺莉芳, 等. 家蝇胚胎细胞抗菌蛋白对人髓样白血病细胞K562选择性杀伤作用的研究[J]. 重庆医学, 2014, 43(33):4444-4446.
ZHANG J H, ZHAO M C, HE L F, et al. An comparative study of the selective killing action of antibacterial protein from the embryonic cells of the musca domestica on human myeloid leukemia cells K562[J].Chongqing Medicine, 2014, 43(33):4444-4446.
[35] YAN J X, WANG K R, CHEN R, et al. Membrane active antitumor activity of NK-18, a mammalian NK-lysin-derived cationic antimicrobial peptide[J]. Biochimie, 2012, 94(1):184-191.
[36] SHIN S Y, KANG J H, JANG S Y, et al. Effects of the hinge region of cecropin A(1-8)-magainin 2(1-12), a synthetic antimicrobial peptide, on liposomes, bacterial and tumor cells[J]. Biochimica et Biophysica Acta (BBA) - Biomembranes, 2000, 1463(2):209-218.
[37] NIGGEMANN J, BOZKO P, BRUNS N, et al. Baceridin, a cyclic hexapeptide from an epiphytic bacillus strain, inhibits the proteasome[J]. Chembiochem, 2014, 15(7):1021-1029.
[38] UM S, KIM Y J, KWON H, et al. Sungsanpin, a lasso peptide from a deep-seastreptomycete[J]. Journal of Natural Products, 2013, 76(5):873-879.
[39] XIONG X, YANG H S, LI L, et al. Effects of antimicrobial peptides in nursery diets on growth performance of pigs reared on five different farms[J]. Livestock Science, 2014, 167(1):206-210.
[40] CHOI S C, INGALE S L, KIM J S, et al. Effects of dietary supplementation with antimicrobial peptide-P5 on growth performance, nutrient retention, excreta and intestinal microflora and intestinal morphology of broilers[J]. Animal Feed Science and Technology, 2013, 185(1/2):78-84.
[41] YOON J H, INGALE S L, KIM J S, et al. Effects of dietary supplementation with antimicrobial peptide-P5 on growth performance, apparent total tract digestibility, faecal and intestinal microflora and intestinal morphology of weanling pigs[J]. Livestock Science, 2014, 159:53-60.
[42] 孙全友, 徐彬, 王琳燚, 等. 抗菌肽和姜黄素对肉仔鸡生长性能、抗氧化功能及肠道微生物的影响[J]. 中国家禽, 2015, 37(20): 32-36.
SUN Q Y, XU B, WANG L Y, et al. Effects of antimicrobial peptide and curcumin on growth performance, antioxidant performance and intestinal microflora of broilers[J]. China Poultry, 2015, 37(20): 32-36.
[43] 雷岷, 郭志强, 任永军, 等. 天蚕素抗菌肽对肉兔生产性能和免疫器官指数的影响[J]. 中国饲料, 2012, 5(9):25-27.
LEI M, GUO Z Q, REN Y J, et al. The effects of cecropin antimicrobial peptides on growth performance and immune organ index in the meat rabbit[J]. China Feed, 2012, 5(9):25-27.
[44] 陈红, 王广军, 刘邦辉, 等. 蝇蛆抗菌肽对日本鳗鲡生长性能的影响[J]. 广东饲料, 2015, 24(4): 26-27.
CHEN H, WANG G J, LIU B H, et al. The effects of maggot antimicrobial peptides on growth performance ofAnguillajaponica[J]. Guodong Feed, 2015, 24(4): 26-27.
[45] 覃志彪, 梁静真, 龙苏, 等. 抗菌肽对凡纳滨对虾生产性能及机体成分的影响[J]. 南方农业学报,2016,47(4):674-678.
QIN Z B, LIANG J Z, LONG S, et al. Effects of antibacterial peptides on growth performance and body composition ofPenaeusvannamei[J]. Journal of Southern Agriculture, 2016,47(4):674-678.
[46] 王一娟, 何义进, 谢骏, 等. 抗菌肽对河蟹生长、免疫及抗氧化能力的影响[J]. 江苏农业科学,2011,39(2):340-343.
WANG Y J, HE Y J, XIE J, et al. The effects of antimicrobial peptides on growth performance, immunity and antioxidant ability of river crabs[J]. Jiangsu Agricultural Sciences, 2011,39(2):340-343.
[47] RAHNAMAEIAN M, VILCINSKAS A. Defense gene expression is potentiated in transgenic barley expressing antifungal peptide metchnikowin throughout powdery mildew challenge[J]. Journal of Plant Research, 2012, 125(1):115-124.
[48] BADOSA E, FERRÉ R, FRANCRÉS J, et al. Sporicidal activity of synthetic antifungal undecapeptides and control ofPenicilliumrot of apples[J]. Applied and Environmental Microbiology, 2009, 75(17):5563-5569.
[49] LIU Z, ZENG M, DONG S, et al. Effect of an antifungal peptide from oyster enzymatic hydrolysates for control of gray mold (Botrytiscinerea) on harvested strawberries[J]. Postharvest Biology and Technology, 2007, 46(1):95-98.
[50] KO K Y, PARK S R, LIM H S, et al. Improved pretreatment method for determination of nisins A and Z and monitoring in cheese using liquid chromatrography-tandem mass spectrometry[J]. Food Analytical Methods, 2016, 9(1):122-130.
[51] BO T, LIU M, ZHONG C, et al. Metabolomic analysis of antimicrobial mechanisms of ε-poly-L-lysine onSaccharomycescerevisiae[J]. Journal of Agricultural and Food Chemistry, 2014, 62(19):4454-4465.
[52] 康苏,夏丽洁,马纪, 等. 新疆家蚕抗菌肽对鲜榨果汁防腐效果的影响[J]. 食品科技, 2014, 39(6):247-251.
KANG S, XIA L J, MA J, et al. Preservation effects of cecropin XJ proteins in fresh squeezed juice [J]. Food Science and Technology, 2014, 39(6):247-251.
[54] AHMAD V, KHAN M S, JAMAL Q M, et al. Antimicrobial potential of bacteriocins: in therapy, agriculture and food preservation[J]. International Journal of Antimicrobial Agents, 2016, 49(1):1-50.
[55] RIVAS F P, CASTRO M P, VALLEJO M, et al. Sakacin Q produced byLactobacilluscurvatusACU-1: functionality characterization and antilisterial activity on cooked meat surface[J]. Meat Science, 2014, 97(4):475-479.
[56] ESPITIA P J, SOARES N F, TEFILO R F, et al. Physical-mechanical and antimicrobial properties of nanocomposite films with pediocin and ZnO nanoparticles[J]. Carbohydrate Polymers, 2013, 94(1):199-208.
[57] BARBOSA A A, SILVA H G, MATOS P N, et al. Effects of nisin-incorporated films on the microbiological and physicochemical quality of minimally processed mangoes[J]. International Journal of Food Microbiology, 2013, 164(2/3):135-140.
[58] 汤秋冶,潘道东,孙杨赢, 等. ε-聚赖氨酸/海藻酸钠抗菌复合膜的制备及性能研究[J]. 中国食品学报,2016,16(12):101-107.
TANG Q Y, PAN D D, SUN Y Y, et al. Preparation and performance of antimicrobial films based on sodium alginate and ε-poly-L-lysine[J]. Journal of Chinese Institute of Food Science and Technology, 2016,16(12):101-107.
ResearchStatusandApplicationProspectinFoodSafetyofAntimicrobialPeptides
JIA Yingmin, LIU Yangliu, CHEN Zhou
(SchoolofFoodScienceandTechnology,BeijingTechnologyandBusinessUniversity,Beijing100048,China)
For problems of food safety caused by microbial contamination and environmental safety due to drug-resistant strains, the development of emerging natural food additives with broad-spectrum and high-efficiency has been vital study trends in a modern food safety. Antimicrobial peptides(AMPs) are paid much attention for its advantage of broad-spectrum, good stability, unique antimicrobial mechanism of action and lower residue. With the further research, AMPs are expected to play a vital role in the application of food safety. Considering it, AMPs-related researches abroad were concluded in recent years. A review of the exploring and classification situation of AMPs,the development of bio-resistance and mechanism for bacteria, fungi, parasites, virus and tumor cells was provided. Meanwhile, the potential application fields of AMPs in food safety and scientific problems urgent to solve were analyzed. The resolution strategy also is provided for researchers as a reference in the field.
antimicrobial peptides; food safety; research status; application prospect
叶红波)
10.3969/j.issn.2095-6002.2017.06.001
2095-6002(2017)06-0001-09
贾英民,刘杨柳,陈洲. 抗菌肽研究现状及其在食品安全中的应用前景[J]. 食品科学技术学报,2017,35(6):1-9.
JIA Yingmin,LIU Yangliu,CHEN Zhou. Research status and application prospect in food safety of antimicrobial peptides[J]. Journal of Food Science and Technology, 2017,35(6):1-9.
TS201
A
2017-11-02
国家自然科学基金资助项目(31771951)。
贾英民,男,教授,博士生导师,北京工商大学副校长,主要从事食品微生物方面的研究。

