常规超声与MRI对乳腺X线摄影阴性乳腺癌诊断价值的对比研究
董维露,陈亚青,蒋 珺,张玉珍,管文斌
1. 上海交通大学医学院附属新华医院超声科,上海 200092;
2. 上海交通大学医学院附属新华医院放射科,上海 200092;
3. 上海交通大学医学院附属新华医院病理科,上海 200092
常规超声与MRI对乳腺X线摄影阴性乳腺癌诊断价值的对比研究
董维露1,陈亚青1,蒋 珺1,张玉珍2,管文斌3
1. 上海交通大学医学院附属新华医院超声科,上海 200092;
2. 上海交通大学医学院附属新华医院放射科,上海 200092;
3. 上海交通大学医学院附属新华医院病理科,上海 200092
目的:比较常规超声与MRI对乳腺X线摄影阴性乳腺癌的诊断价值。方法:收集上海交通大学医学院附属新华医院乳腺X线摄影检查阴性,并接受常规超声及MRI检查的乳腺疾病患者257例共305个病灶,以术后病理为对照,回顾性分析常规超声与MRI检查对乳腺X线摄影阴性乳腺病灶的检出率及诊断价值。结果:常规超声和MRI对乳腺X线摄影阴性乳腺病灶的总检出率分别为97.38%和90.49%。MRI对导管内病灶的检出率高于常规超声(98.21%和75.00%,P<0.05),两种方法对肿块型病灶的检出率无统计学差异(97.19% 和93.98%,P>0.05)。常规超声和MRI对乳腺X线摄影阴性乳腺癌诊断的灵敏度、特异度、准确率分别为85.37%、74.62%、76.07%,90.24%、58.71%、62.95%,常规超声对乳腺X线摄影阴性乳腺癌的诊断特异度和准确率高于MRI(P<0.001)。常规超声和MRI诊断乳腺X线摄影阴性乳腺癌的受试者工作特征(receive operating characteristic,ROC)曲线下面积分别为0.800和0.745,无统计学差异(P>0.05)。结论:常规超声和MRI对乳腺X线摄影阴性乳腺病灶均具有较高的检出率,其中MRI对导管内病灶的检出率优于常规超声,但常规超声与MRI对乳腺X线摄影阴性乳腺癌的诊断效能相仿,因此常规超声可作为乳腺X线摄影阴性患者的首选检查方法。
超声;磁共振成像;乳腺X线摄影;乳腺癌
乳腺癌是我国女性最常见恶性肿瘤,发病率为22.1/10万,死亡率为5.7/10万,分别位居我国女性恶性肿瘤第1和第6位[1-2]。随着影像学技术的发展和普及,乳腺癌的检出率逐年升高[3-4]。虽然目前乳腺X线摄影(mammography)仍是乳腺癌筛查主要手段[5-6],但其对位于致密型乳腺的病灶易漏诊,导致诊断敏感性降低[7-8],而中国超过2/3的人群为致密型乳腺[9]。常规超声和MRI均具有较高的软组织分辨率,在临床上对乳腺X线摄影为假阴性的乳腺肿瘤有重要诊断价值,但相关研究较少。本研究回顾性分析上海交通大学医学院附属新华医院257例乳腺X线摄影假阴性乳腺患者的常规超声和MRI图像,旨在探讨常规超声与MRI对乳腺X线摄影假阴性乳腺癌的诊断价值。
1 资料和方法
1.1 研究对象
选取2014年1月—2016年9月于上海交通大学医学院附属新华医院行乳腺手术并在术前完成乳腺X线摄影、常规超声及MRI检查的患者共790例。以乳腺X线摄影为阴性,且三种影像学检查间隔时间不超过6个月、既往无乳腺手术史或外伤史的患者为研究对象,共257例305个病灶。患者平均年龄(44.4±11.9)岁(20~82岁),中位年龄43.0岁。213例为单侧乳腺单个病灶,28例为双侧乳腺单个病灶,12例为单侧乳腺两个病灶,4例为一侧乳腺两个病灶且另一侧乳腺单个病灶。161个病灶位于左侧乳腺,144个位于右侧乳腺。病灶平均直径(12.8±7.4)mm(2.4~52.0 mm),中位数为11.0 mm。
1.2 仪器和方法
1.2.1 常规超声检查
采用Mylab Twice型超声诊断仪(ESAOTE,Italy),配备LA523探头,频率8~14 MHz。患者取平卧位,双臂上举充分暴露双侧乳房及腋窝。由一名超声科医师在灰阶超声模式下自乳头上方12点钟开始行顺时针方向扫查,发现病灶后对其大小、回声类型、形态、边缘、纵横比、有无钙化及钙化类型进行观察,然后用彩色多普勒模式观察病灶血流分布、走向及丰富程度,分别在两种超声模式下各保存一张病灶横断面及纵断面图像。
1.2.2 乳腺X线摄影检查
采用Senographe DS全数字化乳腺X线机(GE,USA)。患者取站立位,充分暴露双侧乳腺,分别行头尾位(craniocaudal,CC)及内外侧斜位(mediolateral oblique,MLO)摄片。CC位投照时将乳房放置摄影台中央,MLO位投照时将乳腺推向前上方,加压后采用自动曝光,摄片后标准图像应包含部分胸大肌。
1.2.3 MRI检查
采用3.0 T Signa HDXT 磁共振仪(GE,USA)。患者取俯卧位,充分暴露双侧乳腺,采用乳腺专用相控阵列表面线圈进行横轴位扫描,扫描序列为短时间反转恢复序列(short time inversion recovery,STIR)、扩散加权成像(diffusion weighted imaging,DWI)及动态增强(dynamic contrast enhanced,DCE)。动态增强扫描时先使用T1WI进行1期平扫,随后高压注射器经手背静脉快速(2 mL/s)团注钆喷酸葡胺(gadolinium- gadoliniumdiethylenetriaminepentaacetic acid,Gd-DTPA)(Magnevist),再以同样速率静推15 mL生理盐水冲管,然后连续进行5期动态增强扫描,扫描时间为54 s,每期116层,层厚1.2 mm。
1.2.4 图像分析及分类诊断标准
乳腺X线摄影由一名有5年以上工作经验的放射科医师阅片,将乳腺X线摄影阴性患者纳入研究。另一名有5年以上工作经验的放射科医师按美国放射学院(American College of Radiology,ACR)的乳腺X线分型标准[10],将腺体分为致密型和非致密型两类。常规超声及MRI图像分别由一名有5年以上经验的医师进行乳腺影像报告和数据系统(Breast Imaging Reporting and Data System,BI-RADS)[10]分类,并定义BI-RADS 1类、2类和3类为良性病灶,BI-RADS 4类和5类为恶性病灶。
1.2.5 病理学诊断
所有病灶经手术切除后送至病理科,由一名有5年以上工作经验的病理科医师根据世界卫生组织(World Health Organization,WHO)乳腺肿瘤分类标准作出病理学诊断。
1.3 统计学处理
采用SPSS 20.0软件进行统计分析。率的比较采用χ2检验,定量资料的比较采用独立样本t检验。用Z检验比较受试者工作特征 (receive,operating characteristic,ROC) 曲线的曲线下面积(area under curve,AUC)差异,P<0.05为差异有统计学意义。
2 结 果
2.1 病理学诊断
305个病灶中,术后病理诊断良性264个,其中导管内乳头状瘤38个、纤维腺瘤87个、乳腺病131个、炎性肉芽肿3个、错构瘤1个、叶状肿瘤1个、囊肿2个、脂肪瘤1个;恶性肿瘤41个,其中非特殊型浸润性乳腺癌23个、导管内癌18个。
2.2 常规超声和MRI对乳腺X线摄影阴性病灶的检出率
MRI对乳腺X线摄影阴性恶性病灶的检出率为97.56%(40/41),对乳腺X线摄影阴性良性病灶的检出率为93.12%(257/276)。常规超声对乳腺X线摄影阴性恶性病灶的检出率为90.24%(37/41),对乳腺X线摄影阴性良性病灶的检出率为86.59%(239/276)。MRI对乳腺X线摄影阴性乳腺病灶的总检出率和良性病灶的检出率高于常规超声(P<0.001),但两种方法对恶性病灶的检出率之间差异无统计学意义(P>0.05)。
257例患者中,非致密型乳腺5例(1.95%),致密型乳腺252例(98.05%),分别有6个(1.97%)和299个(98.03%)病灶分布于非致密型和致密型腺体。常规超声和MRI对不同腺体类型病灶的检出率见表1。
305个病灶中,导管内病灶56个,非导管内肿块型病灶249个。导管内病灶最大径的平均值为(10.1±7.0) mm(2.4~40.0 mm),肿块型病灶最大径的平均值为(13.4±7.4) mm(3.0~52.0 mm)。两组病灶最大径的平均值差异有统计学意义(P<0.05)。常规超声及MRI对不同病变类型的检出率见表2。常规超声对肿块型病灶的检出率高于导管内病灶(P<0.05),但MRI对肿块型病灶与导管内病灶的检出率差异无统计学意义(P>0.05)。MRI对导管内病灶的检出率高于常规超声(P<0.05;图1),对肿块型病灶的检出率与常规超声差异无统计学意义(P>0.05;图2)。

图1 乳腺导管内癌MRI与超声表现
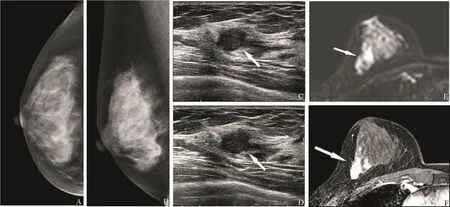
图2 乳腺浸润性癌MRI与超声表现

表1 常规超声和MRI对不同腺体类型病灶的检出率

表2 常规超声和MRI对不同类型病变的检出率
2.3 常规超声和MRI对乳腺X线摄影阴性乳腺癌的诊断价值比较
常规超声和MRI对乳腺X线摄影阴性乳腺癌的诊断结果比较见表3。常规超声对乳腺X线摄影阴性乳腺癌诊断的特异度及准确率高于MRI(P<0.001),但两种方法诊断乳腺X线摄影阴性乳腺癌的灵敏度、阳性预测值及阴性预测值差异均无统计学意义(P>0.05)。
常规超声和MRI诊断乳腺X线摄影阴性乳腺癌的ROC曲线分析见图3,两种方法的AUC分别为0.800和0.745,差异无统计学意义(P>0.05)。

表3 常规超声和MRI对乳腺X线摄影阴性乳腺癌的诊断结果比较
3 讨 论
乳腺X线摄影具有操作简单、全乳腺成像、对钙化检出敏感的特点,用于乳腺癌筛查可明显降低40岁以上患者的死亡率[5,11-12],但其对乳腺癌检出率的高低与腺体类型密切相关。Bae等回顾性分析329例初次乳腺X线摄影阅片阴性,而由常规超声发现病灶的乳腺癌患者的资料,再次阅片结果显示258例乳腺X线摄影为阴性,其中91.1% (235/258)患者腺体类型为致密型乳腺,认为假阴性的原因为乳腺癌被致密的腺体组织遮蔽而显示不清[13]。同样,本研究中高达98.03%(299/305)的病灶分布于致密型乳腺,乳腺X线摄影假阴性的原因与Bae等的分析一致。

图3 ROC曲线分析
除乳腺X线摄影外,常规超声及MRI也是诊断乳腺疾病的主要检查手段,两者均具有较高软组织分辨力、不受患者腺体致密性影响的特点。本研究结果也表明,常规超声与MRI对致密型和非致密型腺体中病灶的检出率差异均无统计学意义(P>0.05)。两种方法对乳腺X线摄影阴性病灶均具有较高的检出率,但MRI显著高于常规超声(P<0.05),原因在于MRI采用全乳腺标准化薄层扫描的标准化操作,避免了人为因素造成的漏检;同时,MRI通过技术改进进一步提高了病灶检出率,如采用脂肪抑制技术而清晰显示乳腺解剖结构,尤其在注射造影剂后明显增加了病灶与正常腺体间的对比度[14-15]。此外,本研究将样本分为肿块型病灶和导管内病灶后,结果显示超声更易检出肿块型病灶,对肿块型病灶的检出率与MRI差异无统计学意义(93.98%和97.19%,P>0.05),但对导管内病灶的检出率显著低于MRI(75.00%和98.21%,P<0.05)。这一方面可能与本研究样本中肿块型病灶的直径大于导管内病灶(13.4 mm和10.1 mm,P<0.05)有关,如袁杰等报道常规超声对病灶的检出率受肿块大小的影响[16]。另一方面,超声较容易显示伴随导管扩张的导管内病变,但部分导管内病灶可不伴有导管扩张,这部分病灶可能因为缺乏扩张导管的对比,其声像图与周围腺体相似而导致漏诊[17];而MRI主要根据注射造影剂后的异常增强来判断病灶有无,其对导管内病灶的检出不受导管扩张与否的影响。
本研究比较分析了常规超声与MRI对乳腺X线摄影阴性乳腺癌的诊断效能,结果表明两种方法诊断乳腺X线摄影阴性乳腺癌的ROC曲线AUC之间差异无统计学意义(0.800和0.745,P>0.05),但MRI的诊断特异度显著低于常规超声(58.71%和74.62%,P<0.001)。据文献报道,MRI诊断乳腺癌的特异度较低主要与以下两种良性肿瘤有关:乳腺病表现具有多样性,是造成MRI假阳性的主要原因之一[18];导管内乳头状瘤的MRI可表现为形态不规则,早期强化,DWI为高信号,时间-强度曲线多为平台型或流出型[19-20],这与浸润性乳腺癌的MRI特征相似,从而造成假阳性。另一方面,常规超声对导管内病变尤其是导管内乳头状瘤的检出率低,反而避免了乳腺癌的假阳性。
虽然MRI对乳腺X线摄影阴性乳腺病灶的检出率高于常规超声,但乳腺MRI的检查费用高,检查程序复杂,必须注射造影剂,其假阳性率高势必导致过度诊断[21],因此不适用于乳腺癌筛查。与乳腺MRI相比,常规超声经济简便,可重复性高,无需注射造影剂;此外,本研究结果显示超声对乳腺X线摄影阴性乳腺恶性病灶的检出率与MRI无统计学差异(97.56%和90.24%,P>0.05),且ROC曲线分析表明超声对乳腺X线摄影阴性乳腺癌的诊断效能与MRI类似。因此,致密型乳腺女性的乳腺癌筛查可优先选择超声,乳腺癌高危人群可进一步选择乳腺MRI。
本研究也有不足之处。首先,入组样本中乳腺恶性和良性肿瘤所占比例相差悬殊,可能对诊断效能的正确判断造成一定影响。其次,本研究未对乳腺X线摄影阴性乳腺病灶的常规超声及MRI影像学特点作进一步分析,未深入研究两种方法漏、误诊的原因。
综上所述,常规超声和MRI对乳腺X线摄影阴性乳腺病灶均具有较高的检出率,其中MRI对导管内病灶的检出率优于常规超声,但两者诊断效能相似,因此常规超声可作为乳腺X线摄影阴性患者的首选检查方法。
[1] FERLAY J, SOERJOMATARAM I, DIKSHIT R, et al. Cancer incidence and mortality worldwide: sources,methods and major patterns in GLOBOCAN 2012 [J]. Int J Cancer, 2015, 136(5): E359-E386.
[2] CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015 [J]. CA Cancer J Clin, 2016,66(2): 115-132.
[3] SIMBRICH A,WELLMANN I, HEIDRICH J, et al.Trends in advanced breast cancer incidence rates after implementation of a mammography screening program in a German population [J]. Cancer Epidemiol, 2016, 44:44-51.
[4] NEAL C H, COLETTI M C, JOE A, et al. Does digital mammography increase detection of high-risk breast lesions presenting as calcifications? [J]. AJR Am J Roentgenol, 2013, 201(5): 1148-1154.
[5] 中国抗癌协会乳腺癌专业委员会. 中国抗癌协会乳腺癌诊治指南与规范(2013版)[J]. 中国癌症杂志, 2013,(8): 637-684.
[6] SIU A L, U.S. PREVENTIVE SERVICES TASK FORCE. Screening for breast cancer: U.S. Preventive Services Task Force recommendation statement [J]. Ann Intern Med, 2016, 164(4): 279-296.
[7] MANDELSON M T, OESTREICGER N, PORTER P L, et al. Breast density as a predictor of mammographic detection: comparison of interval- and screen-detected cancers [J]. J Natl Cancer Inst, 2000, 92(13): 1081-1087.
[8] HOOLEY R J, GREENBERG K L, STACKHOUSE R M, et al. Screening US in patients with mammographically dense breasts: initial experience with Connecticut Public Act 09-41 [J]. Radiology, 2012, 265(1): 59-69.
[9] 杜铁桥, 王永利, 张超, 等. 数字化乳腺X线摄影观察年龄和乳腺密度与乳腺良恶性病变的关系 [J]. 放射学实践, 2009, 24(7): 739-743.
[10] D’ORSI C J, MENDELSON E B, IKEDA D M, et al.Breast imaging reporting and data system [M]. Reston:American College of Radiology, 2003.
[11] LAUBY-SECRETAN B, SCOCCIANTI C, LOOMIS D, et al. Breast-cancer screening—viewpoint of the IARC Working Group [J]. N Engl J Med, 2015, 372(24):2353-2358.
[12] SIU A L. Screening for Breast Cancer: U.S. Preventive Services Task Force Recommendation Statement [J]. Ann Intern Med, 2016, 164(4): 279-296.
[13] BAE M S, MOON W K, CHANG J M, et al.Breast cancer detected with screening US: reasons for nondetection at mammography [J]. Radiology, 2014,270(2): 369-377.
[14] SCHMITZ A C, PETERS N H, VELDHUIS W B, et al.Contrast-enhanced 3.0-T breast MRI for characterization of breast lesions: increased specificity by using vascular maps [J]. Eur Radiol, 2008, 18(2): 355-364.
[15] VAN DER VELDEN T A, SCHMITZ A M, GILHUIJS K G, et al. Fat suppression techniques for obtaining high resolution dynamic contrast enhanced bilateral breast MR images at 7 T [J]. Magn Reson Imaging, 2016, 34(4):462-468.
[16] 袁杰, 朱世亮, 陈荣根, 等. 乳腺导管疾病的高频超声诊断及误诊漏诊原因分析 [J]. 中国超声医学杂志, 2003,19(10): 730-733.
[17] KIM W H, CHANG J M, MOON W K, et al.Intraductal mass on breast ultrasound: final outcomes and predictors of malignancy [J]. AJR Am J Roentgenol, 2013,200(4): 932-937.
[18] GITY M, ARABKGERADMAND A, TAHERI E, et al. Magnetic resonance imaging features of adenosis in the breast [J]. J Breast Cancer, 2015, 18(2): 187-194.
[19] ZHU Y, ZHANG S, LIU P, et al. Solitary intraductal papillomas of the breast: MRI features and differentiation from small invasive ductal carcinomas [J]. AJR Am J Roentgenol, 2012, 199(4): 936-942.
[20] HELLER S L, MOY L. Imaging features and management of high-risk lesions on contrast-enhanced dynamic breast MRI [J]. AJR Am J Roentgenol, 2012, 198(2): 249-255.
[21] SMITH H, CHETLENA L, SCHTTERS, et al. PPV(3)of suspicious breast MRI findings [J]. Acad Radiol, 2014,21(12): 1553-1562.
Comparison of diagnostic value between ultrasound and MRI in breast cancer with negative mammography
DONG Weilu1, CHEN Yaqing1, JIANG Jun1, ZHANG Yuzhen2, GUAN Wenbin3(1. Department of Ultrasound, Xinhua Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai 200092, China; 2.Department of Radiology, Xinhua Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai 200092,China; 3. Department of Pathology, Xinhua Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai 200092, China)
Correspondence to: CHEN Yaqing E-mail: joychen1266@126.com
Objective:To compare the diagnostic value of ultrasound and magnetic resonance imaging (MRI) in breast cancer with negative mammography.Methods:A total of 305 lesions from 257 mammography-negative patients who underwent ultrasound and MRI examinations were retrospectively analyzed. All cases were confirmed by pathology after surgery. The differences in the detection rate for mammography-negative breast lesions and the diagnostic value for mammography-negative breast cancer between ultrasound and MRI were analyzed.Results:The detection rate of MRI and ultrasound for all mammographynegative lesions was 97.38% and 90.49%, respectively. MRI had the higher detection rate than ultrasound for intraductal lesions(98.21% vs. 75.00%, P<0.05), and there was no signif i cant difference between the two methods in the detection rate of mass-like lesions (97.19% vs. 93.98%, P>0.05). The sensitivity, specif i city and accuracy of ultrasound and MRI in diagnosing breast cancer were 85.37%, 74.62%, 76.07% and 90.24%, 58.71%, 62.95%, respectively. The specif i city and accuracy of ultrasound were higher than MRI (P<0.001). The area under receiver operating characteristic (ROC) curves of ultrasound and MRI was 0.800 and 0.745,respectively, and there was no signif i cant difference between the two methods (P>0.05).Conclusion:Both ultrasound and MRI have a high detection rate of mammography-negative breast lesions, and MRI is superior to ultrasound in detection of mammographynegative introductal lesions. The diagnostic value of ultrasound in mammography-negative breast cancer is similar to MRI, therefore,ultrasound should be the preferred method for screening.
Ultrasound; Magnetic resonance imaging; Mammography; Breast cancer
R445.1,R445.2
A
1008-617X(2017)05-0326-06
陈亚青 E-mail: joychen1266@126.com
2017-06-15
2017-08-07)

