不同发育时期鸡下丘脑和卵巢组织中内参基因表达稳定性分析
袁振杰,陈秋月,姜运良,唐 辉,李显耀,康 丽*
1.山东农业大学 动物科技学院与动物医学院,山东 泰安 271018 2.山东农业大学 农学院,山东 泰安 271018
实时荧光定量PCR(Real-time fluorescent quantitative polymerase chain reaction,qRT-PCR)已广泛应用于基因表达方面的研究。在qRT-PCR应用中,由于不同样品间RNA的初始量、cDNA合成效率以及PCR反应扩增效率等存在差别,从而影响目标基因表达差异的准确性,因此,需要引入稳定表达的内参基因予以校正[1]。常用的内参基因多为持家基因,如18S核糖体RNA基因(18S rRNA)、beta-肌动蛋白基因(β-actin)和3-磷酸甘油醛脱氢酶基因(GAPDH)等。然而,近年来的研究表明,在不同类型细胞、组织器官、不同实验处理条件及相同组织的不同发育阶段等情况下,持家基因的表达量并非总是恒定的[2]。因此,在特定目标基因表达研究中对候选内参基因的表达稳定性进行评价,筛选出最为稳定的内参基因,是保证研究结果真实可靠的关键。
家禽的繁殖性状受下丘脑-垂体-性腺轴(Hypothalamus-pituitary-gonad,HPG)的调控,目前,对于鸡性腺轴上功能基因的表达研究较多,但用于内参的持家基因其组织表达稳定性尚不清楚。因此,本研究利用qRT-PCR方法检测鸡性发育过程中下丘脑和卵巢组织中常用内参基因的表达,并采用geNorm、NormFinder和Bestkeeper软件对这些基因的表达稳定性进行分析,筛选出用于鸡性腺轴上基因表达研究最合适的内参基因。
1 材料和方法
1.1 试验动物
分别随机选取30 d、60 d、90 d、100 d、110 d、140 d未开产和140 d开产的济宁百日鸡各4只,颈静脉放血处死后取下丘脑和卵巢组织,迅速投入液氮并保存。试验所用鸡只遗传背景相同,采用相同的饲养管理条件,自由采食、自由饮水、自然光照。
1.2 RNA提取和cDNA合成
使用总RNA提取试剂盒(天根,北京)提取不同发育阶段鸡下丘脑和卵巢组织RNA,用1.2%琼脂糖凝胶电泳检测RNA的完整性,并用紫外分光光度计(Eppendorf,Hamburg,Germany)检测总RNA浓度和纯度,A260/280=1.8~2.0,RNA于-80°C保存备用。
cDNA合成采用PrimerScript RT reagent Kit(TaKaRa,大连)反转录试剂盒,具体操作按说明书,取1µL总RNA,以Oligo-dT18为引物,完成一链cDNA的合成,并于-20°C保存。
1.3 引物设计及合成
根据实时荧光定量PCR引物设计原则,使用DNAMAN 6.0软件,分别设计GAPDH、β-actin和18S rRNA基因的定量PCR引物(见表1),并由上海生物工程有限公司合成。
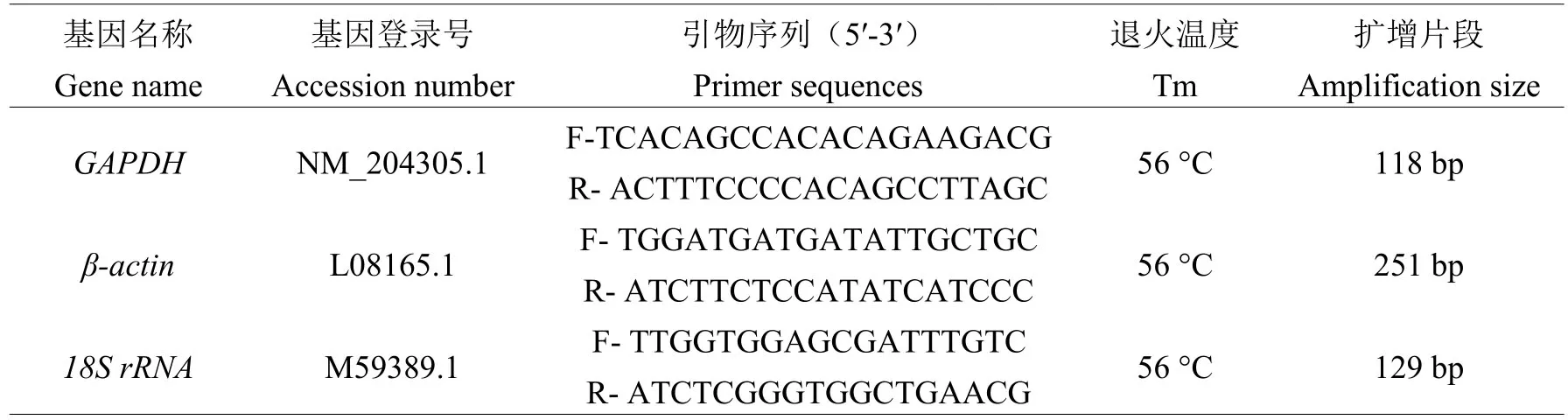
表1 实时荧光定量PCR检测所用候选内参基因的引物信息Table 1 Primer information of candidate reference genes used in qRT-PCR
1.4 实时荧光定量PCR
实时荧光定量PCR(qRT-PCR)反应在Stratagene Mx3000P荧光定量PCR仪上,按照Takara的SYBR premix Ex TaqTMⅡ试剂盒说明书进行,模板、引物浓度及退火温度等经过摸索获得最佳反应条件如下:PCR反应体系为15µL包括cDNA模板1.5µL,上下游引物各0.2µL,2×SYBR Premix Ex TaqTM Buffer 7.5µL,RoxII0.3µL,ddH2O 补足至 15µL;PCR 反应程序为 95°C 预变性 5 min;95°C变性30 s,56°C退火30 s,72°C延伸25 s;在延伸阶段收集荧光信号强度,共40个循环。熔解曲线分析:95°C 1 min;58°C 30 s,95°C,30 s,58~95°C每个循环全程采集荧光信号1次。每个样品均设3个重复,仪器自带软件自动生成标准曲线和熔解曲线,3个基因的溶解曲线均为单一峰,说明内参基因引物特异性好,无引物二聚体和非特异条带扩增。获得3个内参基因标准曲线的相关系数变化范围为0.996~0.998,根据标准曲线计算的扩增效率为97.3~100.8%。
1.5 数据分析
用2-△Ct(△Ct=各样本Ct值−最小Ct值)方法计算各基因表达的相对定量数据,用geNorm、NormFinder和BestKeeper软件对3个内参基因在济宁百日鸡不同发育时期下丘脑和卵巢中的Ct值变化趋势以及表达稳定性进行统计分析。
2 结果与分析
2.1 内参基因Ct值比较
qRT-PCR中,Ct值的大小反应了基因表达的丰度,Ct值越小,基因表达量越高;反之,Ct值越大,基因表达量越低。在同一组织中每个持家基因所用每个cDNA模板量均相同,比较三个基因的Ct值发现,鸡性发育过程中每个内参基因在下丘脑和卵巢组织的表达水平均有一定的变化。如图1所示,在卵巢中β-actin的Ct值最小(中位数=17.01),表明其表达量最高,18S rRNA和GAPDH两个基因表达量相对偏低(中位数分别为17.77,17.86),而在下丘脑组织中,18S rRNA的Ct值最小(中位数=16.83),说明其在下丘脑中表达丰度最高,其次是GAPDH(中位数=19.85),β-actin表达量最低(中位数=20.44)。这也表明三个内参基因在鸡卵巢和下丘脑组织中的表达量存在差异。
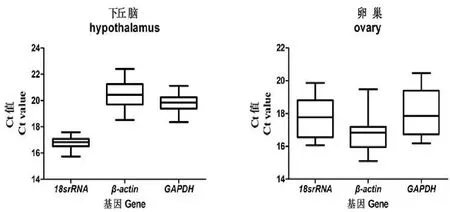
图1 各内参基因在下丘脑和卵巢组织中Ct值比较Fig.1 The Ct values comparison analysis of every reference gene in hypothalamus and ovary tissue
分别对三个内参基因在30 d、60 d、90 d、100 d、110 d、140 d未开产和140 d开产济宁百日鸡7个不同发育阶段下丘脑及卵巢组织中,所有样本的Ct值变化分析发现,不同基因间Ct值最大值(max)和最小值(min)(见表2,表3)的差值大小(极差)存在差异,这个差值越大,说明该基因在各个样本间表达的均一程度越差,在下丘脑中各基因极差值由小到大为18S rRNA(1.85)<GAPDH(2.76)<β-actin(3.89);在卵巢中各基因极差值由小到大为18S rRNA(3.79)<GAPDH(4.29)<β-actin(4.37),但无论在下丘脑还是卵巢组织,β-actin的Ct值极差均表现为最大。
在基因定量表达分析中,有时需要同时选择多个内参基因,分析基因间的表达相关性,可为多个内参基因的选择提供依据。分别对三个内参基因在卵巢及下丘脑组织中表达的相关性进行分析,结果如图2所示,在下丘脑中,β-actin与GAPDH的相关性也最高(相关系数=0.86),而18S rRNA与GAPDH和β-actin的相关性均较低(相关系数=0.42)。在卵巢中,β-actin与GAPDH的相关性最高(相关系数=0.76),18S rRNA与GAPDH的相关性最低(相关系数=0.25)。
2.2 geNorm软件分析
通过2–△Ct算法将qRT-PCR得到的Ct值转换成对应的表达量并输入geNorm程序,然后计算基因表达稳定度M值,并对内参基因的表达稳定度进行排序,M值越小,基因表达越稳定。结果由图3可知,三个内参基因的表达稳定性从大到小排序为:下丘脑中GAPDH(0.599)>β-actin(0.710)>18S rRNA(0.789);卵巢中β-actin(1.070)>GAPDH(1.292)>18S rRNA(1.395)。说明不同发育时期济宁百日鸡的下丘脑中GAPDH表达稳定性最好,而在卵巢中β-actin的表达最为稳定。
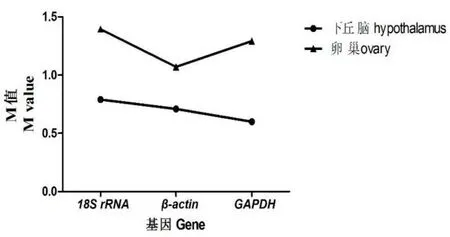
图3 ge Norm软件分析内参基因在发育不同阶段下丘脑和卵巢组织中表达稳定性M值Fig.3 The expression stability(M values)of reference genes in chicken hypothalamus and ovary tissue by geNorm
2.3 Norm Finder软件分析
Norm Finder软件分析内参基因在不同发育阶段济宁百日鸡下丘脑、卵巢组织中的表达稳定性,稳定值越小的基因表达最稳定,比较结果见图4,在下丘脑中3个内参基因的稳定性从大到小为GAPDH(0.161)>β-actin(0.226)>18S rRNA(0.265),而卵巢中稳定性从大到小是β-actin(0.342)>GAPDH(0.517)>18S rRNA(0.573),说明下丘脑和卵巢中表达稳定性最好的分别是GAPDH和β-actin,这与geNorm的分析结果一致。
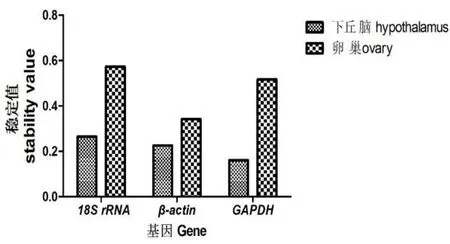
图4 Norm Finder软件分析内参基因在发育不同阶段下丘脑和卵巢组织中的表达稳定值Fig.4 The expression stability values of reference genes in chicken hypothalamus and ovary tissue by Norm Finder
2.4 Bestkeeper软件分析
Bestkeeper软件在每个基因中直接产生配对相关系数和Bestkeeper指数,指数的产生是由所有内参基因Ct值的几何平均数(GM)产生。主要以标准变异系数(SD)和变异相关系数(CV)来判断基因表达的稳定性,SD和CV的值越小,表明基因表达越稳定。从表2的参数信息可以看出,内参基因18S rRNA在济宁百日鸡下丘脑中表达最稳定,其次是GAPDH,相比而言,β-actin最不稳定;而在卵巢中表达最稳定的内参基因是β-actin,其次是18S rRNA,最不稳定的是GAPDH(见表3)。
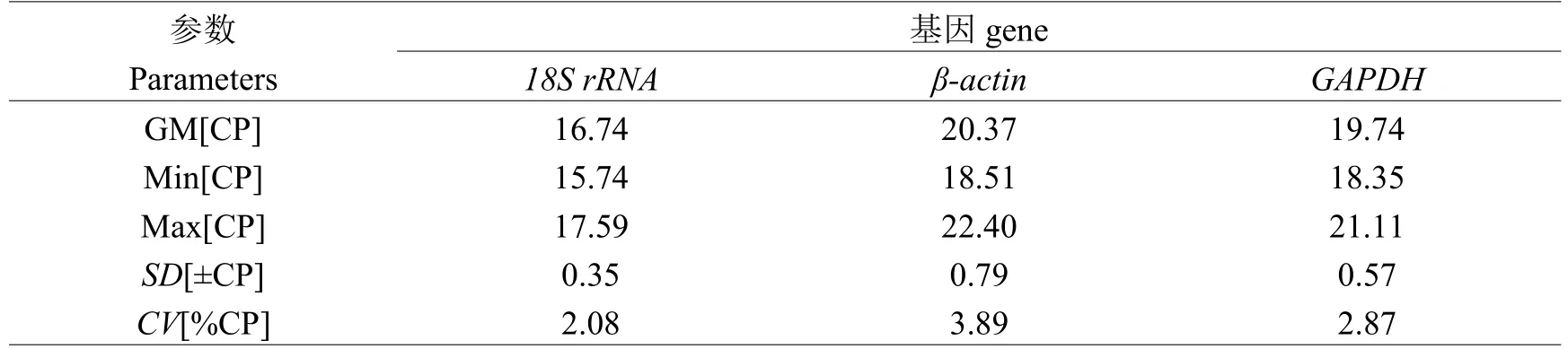
表2 Bestkeeper分析内参基因在济宁百日鸡下丘脑中的表达稳定性相关参数Table 2 The expression stability and related parameters of reference genes analyzed by Bestkeeper in Jining Bairi chicken hypothalamus
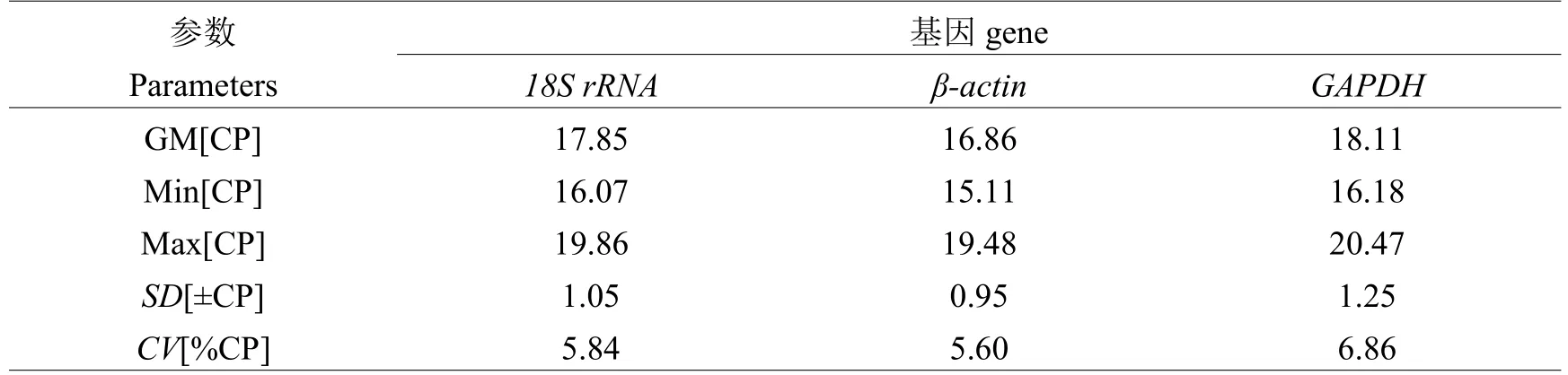
表3 Bestkeeper分析内参基因在济宁百日鸡卵巢中的表达稳定性相关参数Table 3 The expression stability and related parameters of reference genes analyzed by Bestkeeper in Jining Bairi chicken ovary
3 讨论
采用qRT-PCR技术对目标基因表达分析时需要表达稳定的内参基因对反应进行标准化校正,常用的内参基因多为持家基因,但许多研究表明这些持家基因随组织、细胞或实验条件的不同而并非恒定表达。研究表明,在缺氧条件下培养24 h的脑星形胶质细胞中GAPDH表达显著增加,而β-actin表达则明显下降[3]。在血清刺激实验中,GAPDH和β-actin表达均显著升高,不宜用作内参基因,而18S rRNA表达没有变化[5]。王红杨等[4]采用RT-PCR和Western blotting技术对鸡肌肉组织发育早期阶段几个持家基因进行定量分析,发现GAPDH和β-actin表达水平在所检测胚龄期的各时间点差异显著。同样在猪肺脏、心脏、肾脏、胃、肌肉、脂肪和小肠等组织中对持家基因表达的研究发现,GAPDH在肌肉组织中明显上调表达[5]。GAPDH是糖酵解途径中的关键酶,肿瘤发生中都会加强此途径,因此,所研究中若涉及糖代谢变化时则不宜使用GAPDH作为内参,另外,β-actin是细胞骨架肌动蛋白之一,若检测样本中有细胞骨架系统发生异常或目标基因参与细胞骨架形成,此时,则不宜使用β-actin作为内参基因[6]。显然,持家基因的表达并非总是恒定的,若盲目地使用一种看家基因作为内参,可能导致一些基因表达的微小差异难以发现甚至得出错误的结论[1],因此,筛选稳定的内参基因在目标基因表达分析中起着至关重要的作用。
目前,针对鸡生殖轴上基因表达的研究中,多以GAPDH、β-actin和18S rRNA为参照基因。杨玉等[7]在分析能量对蛋鸡卵巢FSHRmRNA表达中发现β-actin在不同时期和不同能量水平下表达恒定,并以此为内参基因分析FSHR是否受能量水平影响并进一步探究和产蛋率的关系。何晶等[8]对FSHR和LHR在海兰褐鸡卵巢和输卵管中的定量分析时以GAPDH为内参,张俊珍等[9]研究CDK5基因在蛋鸡卵巢中的表达时以18S rRNA为内参基因,朱文奇等[10]研究能量水平对文昌鸡下丘脑、卵巢中NPY基因表达的影响时以β-actin为内参基因。而在探究FOXL2与TGFβ家族成员的互作对鸡排卵前卵泡颗粒细胞增殖实验中,则以18S rRNA为内参基因[11]。因此,有必要对这些内参基因在鸡发育不同阶段下丘脑、卵巢组织中的表达稳定性进行分析。
本研究采用geNorm、NormFinder和BestKeeper 3种软件,对持家基因18S rRNA、β-actin和GAPDH在济宁百日鸡7个不同发育时期下丘脑和卵巢组织中的表达稳定性分析结果表明:geNorm和NormFinder的分析结果一致,卵巢中β-actin表达最稳定,其次是GAPDH;下丘脑中GAPDH表达最稳定,其次是β-actin。而BestKeeper分析结果显示卵巢中β-actin最稳定,其次是18S rRNA而不是GAPDH;而下丘脑中最稳定的是18S rRNA,其次是GAPDH。以上差异可能是由于软件之间运用的算法不同所致。我们对3个内参基因在下丘脑和卵巢中的表达量进行了比较发现:在卵巢中β-actin表达最高,18S rRNA表达最低,而在下丘脑中则相反,表明这些内参基因的表达量存在着组织差异。王忠伟等[12]用geNorm分析籽鹅卵巢组织中内参基因稳定性时发现GAPDH的表达最稳定,并且内参基因的最适数目是2个。平行测定2个或以上内参基因有助于发现偏差,得到获得更可靠的分析结果[13-15]。根据18S rRNA在卵巢中的稳定性综合评价,不建议单独作为内参使用,而在下丘脑中,当研究表达丰度较高的基因时则可以考虑使用。在特定基因的定量研究中,目前还没有发现适用于对所有样本进行校正的内参基因。所以,在进行定量分析时,根据样本的不同,选择最合适的2个或2个以上的持家基因作为内参,以尽可能消除不稳定因素带来的影响,从而保证实验结果的准确性和可靠性,本研究发现,在卵巢及下丘脑中β-actin和GAPDH的相关性最好,可同时作为内参基因配合使用。
4 结论
本研究分析了GAPDH、β-actin和18S rRNA三个常用的内参基因在鸡性发育不同阶段下丘脑和卵巢组织中的表达稳定性,结果表明,在鸡性发育不同阶段的卵巢中表达最稳定的内参基因为β-actin,而在下丘脑中为GAPDH。在卵巢中,虽然3个软件分析β-actin表达稳定性最好,但各内参基因Ct值在样本间变化较大,即表达均一性较差,因此,建议在鸡发育不同时期卵巢的中最好同时选用2个内参基因。
[1]张艳君,朱志峰,陆 融,等.基因表达转录分析中内参基因的选择[J].生物化学与生物物理学进展,2007,34(5):546-550
[2]Schmitten TD,Zakrajsek BA.Effect of experimental treatment on housekeeping gene expression:validation by real-time,quantitative RT-PCR[J].Journal of Biochemical and Biophysical Methods,2000,46(122):69-81
[3]徐安定,谭少华,屈 洋.缺氧时星形胶质细胞定量mRNA表达的内参照标准研究[J].中国病理生理杂志,2004,20(5):774-777
[4]王红杨,刘冉冉,赵桂苹,等.鸡肌肉组织实时荧光定量PCR及Western杂交内参基因的筛选[J].畜牧兽医学报,2015,46(7):1107-1113
[5]Nygard AB,Jorgensen CB,Cirera S,et al.Selection of reference genes for gene expression studies in pig tissues using SYBR green qPCR[J].BioMed Central Molecular Biology,2007,8(67):1-6
[6]姜秋红,刘定干,郑如恒,等.S29、18SrRNA和GAPDH基因在肺肿瘤组织中表达的比较[J].肿瘤,2002,22(3):201-203
[7]杨 玉,黄应祥,曹果青,等.能量对蛋鸡卵巢促卵泡素受体mRNA表达及产蛋率的影响[J].动物营养学报,2009,21(4):585-591
[8]何 晶,耿仁德,计 红,等.海兰褐蛋鸡卵巢与输卵管FSHR及LHR基因定量的研究[J].黑龙江八一农垦大学学报,2015,27(2):27-31
[9]张俊珍,王爱荣,范瑞文,等.CDK5在蛋鸡卵巢中的表达研究[J].中国畜牧杂志,2012,48(17):13-17
[10]朱文奇,李慧芳,宋卫涛,等.能量水平对文昌鸡开产前后NPY基因mRNA表达以及开产性状的影响[J].四川农业大学学报,2011,29(3):419-423
[11]Qin N,Fan XC,Xu XX,et al.Cooperative Effects of FOXL2 with the Members of TGF-β Superfamily on FSH Receptor mRNA Expression and Granulosa Cell Proliferation from Hen Prehierarchical Follicles[J].PLoS ONE,2015,10(10):1-19
[12]王忠伟.籽鹅不同发育时期和不同组织内参基因选择的研究[D].黑龙江:黑龙江八一农垦大学,2011
[13]Vandesompele J,Preter KD,Pattyn F,et al.Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes[J].Genome Biology,2001,3(7):research0034
[14]Schmid H,Cohen CD,Henger A,et al.Validation of endogenous controls for gene expression analysis in microdissected human renal biopsies[J].Kidney International,2003,64(1):356-360
[15]陈凤花,王 琳.实时荧光定量RT-PCR内参基因的选择[J].临床检验杂志,2005,23(5):393-395

