QuEChERS-HPLC-MS/MS测定动物源性食品中虫酰肼残留量
王晓晗 ,刘 鹏 ,杨 晨 ,杨长志 *
(1.黑龙江烟草工业有限责任公司,黑龙江 哈尔滨 150010;2.黑龙江出入境检验检疫局,黑龙江 哈尔滨150028)
QuEChERS-HPLC-MS/MS测定动物源性食品中虫酰肼残留量
王晓晗1,刘 鹏2,杨 晨2,杨长志2*
(1.黑龙江烟草工业有限责任公司,黑龙江 哈尔滨 150010;2.黑龙江出入境检验检疫局,黑龙江 哈尔滨150028)
本文建立了动物源性食品中虫酰肼残留量分析方法。样品以乙酸乙腈溶液(1∶99,V/V)为提取剂,经高速匀浆方法提取,样液经过N-丙基乙二胺和十八烷基硅烷净化后,去除样液中脂肪酸、极性色素等极性基质杂质,以乙腈-乙酸-水溶液(梯度洗脱)为流动相经ACQUITY UPLC BEH C18柱(100 mm×2.1 mm,粒度1.7 μm)进行分离后,进行质谱检测分析并确证,外标法定量。方法的相关系数(r)为0.9933,最低检出限为 1μg·kg-1。在 3 种(1、50、25000μg·kg-1)添加水平下,其平均回收率在 79.0%~103.0% 之间,相对标准偏差小于10%(n=6)。本方法是一种快速、准确、灵敏度高的分析动物源性食品中虫酰肼残留量的检测方法。
虫酰肼;液相色谱-串联质谱;动物源性食品
O657.6
虫酰肼(Tebufenozide),别名为米螨(Mimic),是一种新颖的蜕皮激素类杀虫剂,通过干扰昆虫的正常发育使害虫蜕皮而死。该药1994年获得我国的行政保护,并进入了中国市场,在蔬菜、水稻、棉花以及林业病虫害防治方面得到了大面积推广应用。虫酰肼对眼睛和皮肤无刺激性,虽然对高等动物无致畸、致癌、致突变作用,对哺乳动物、鸟类、天敌均十分安全,但其广泛应用可能对人类造成潜在的健康威胁和生态环境的污染和破坏。
目前,日本、美国、欧盟等许多发达国家对猪肉中虫酰肼的残留提出了严格限量要求,最高残留限量规定为0.08~0.02mg·kg-1。而目前对虫酰肼残留的研究多集中在茶叶、水果、蔬菜和粮谷等基质的检测[2-10],关于动物源性食品基质中虫酰肼残留的检测报道不多。庞国芳等[11]利用液相色谱-串联质谱法研究了动物肌肉中461种农药及相关化学品残留量的测定的国家标准(GB/T20772-2008)中包含有虫酰肼的测定,其检测限为0.004mg·kg-1,该国家标准是多残留方法,其前处理比较复杂、耗时多,使用起来不太方便。因此,本文建立了一种以改良的QuEChERS[4,12-14]基质分散方法进行净化,采用高效液相色谱-串联质谱法(HPLC-MS/MS)[13-15]检测动物源性食品中虫酰肼残留量。该方法具有操作方便、分析速度快、灵敏度高、选择性强、定性准确等优点,对于弥补该农药检测方法的不足、解决国外贸易技术壁垒、推动食品安全又快又好的发展具有一定的参考意义。
1 实验部分
1.1 材料与试剂
取有代表性猪肉样品约1000g,将其可食部分切碎后,用组织捣碎机将充分捣碎均匀,装入洁净容器作为试样,密封并标明标记,于-18℃以下保存。
乙腈(HP);乙酸(GR);乙酸钠(AR);NaCl(AR);无水 Na2SO4(AR(650℃灼烧 4h,贮于密封干燥器中备用);虫酰肼标准品 (纯度大于99%德国DR公司)。
N-丙基乙二胺(PSA)吸附剂(40~100μm)、十八烷基硅烷(ODS)键合相(40~100μm),北京安捷飞科技有限公司。实验用水为GB/T6682规定的一级水。
1.2 仪器与设备
超高效液相色谱-质谱/质谱仪(Quattro Premier美国Waters公司);高速匀浆机、旋转蒸发器,德国IKA公司;高速离心机;IKA MS3旋涡混合器;Organomation N-EVAP112氮吹仪;IKAT25均质器。
1.3 分析条件
色谱柱:BEH C18(50mm×2.1mm,1.7μm);流动相A为乙腈,流动相B为0.1%乙酸水溶液;梯度洗脱:0.00~2.00 min:70%A,30%B;2.00~4.00 min:70%~100%A,30%~0%B;4.00~4.50min:100%~70%A,0%~30%B;4.50~5.00min:70%A,30%B。流速 0.25mL·min-1;柱温 25℃;进样量 10μL。
电喷雾离子源:正离子模式;检测方式:多反应监测;毛细管电压:3.0kV;锥孔电压:12V;碰撞气能量(eV):16,8;离子源温度:120℃;去溶剂器温度:350℃;去溶剂气流量:500L·h-1;锥孔气流量:50L·h-1;定性离子对(m/z):353.1/133.1,353.1/297.1;定量离子对(m/z):353.1/297.1。
1.4 标准溶液的配制
准确称取适量的虫酰肼农药标准品,用乙腈配制成100μg·mL-1的标准储备溶液,此溶液转移至储液瓶中避光-18℃下可储存6个月;根据需要使用前再用空白样品基质逐级稀释成质量浓度为0.0004、0.002、0.010、0.04μg·mL-1和 0.5000μg·mL-1的系列混合标准工作溶液。
1.5 样品前处理
称取5g绞碎均匀的样品于50mL的聚丙烯离心管中,加入10mL水、3g无水MgSO4、1gNaCl和1g乙酸钠,再加入15mL乙酸-乙腈(1:99,V/V)溶液,用匀浆机高速均质2min,然后在4000r·min-1离心机上离心5min,将上清液转移至25mL容量瓶中。再用10mL乙酸-乙腈(1∶99,V/V)溶液重复提取一次,合并提取液于同一25mL容量瓶中,并用乙腈定容至刻度,用于下一步净化。
用移液管移取7mL上述提取液于15mL聚丙烯具塞离心管中,加入300mg无水MgSO4、250mg N-丙基乙二胺(PSA)吸附剂和500mg十八烷基硅烷(ODS)键合相,在混合器上混合2min,然后在4000r·min-1离心机上离心 5min。
准确移取5mL净化液于15mL刻度试管中,在50℃条件下氮气吹至近干,用流动相定容至溶解并定容至1.0 mL,待测。
2 结果与讨论
2.1 分析方法的选择
该化合物是一种热不稳定化合物,采用气相色谱法测定其残留量很难实现;液相色谱法虽然也能测定,但方法灵敏度达不到要求;国家标准(GB/T20772-2006)中采用LC-MS/MS法测定食品中虫酰肼残留量,其方法的检测限为4μg·kg-1,虽然能满足国外限量要求,但在实际工作中往往都是测定食品中单一农药残留,所以其适用性不强。为了能满足国外有关动物源性食品中虫酰肼残留限量(80~20μg·kg-1)要求,本文最后选用液相色谱 - 串联质谱开展研究工作,经实验表明,其方法检测限达为 1μg·kg-1。
2.2 提取剂的选择
根据虫酰肼农药化合物结构特点,结合其易溶于有机溶剂化学特性,本文采用了Anastassiades和Lehotay等[16]的探讨的前处理方法,用乙酸-乙腈(1∶99,V/V)对动物源性食品进行提取,乙腈提取时,分层更加明显,即乙腈的盐析效果好于甲醇,更有利于提取的分层,故选择酸性乙腈为提取剂。
2.3 净化方法的选择和优化
分散固相萃取的净化吸附剂有很多种类,选择两种离子交换吸附剂(PSA、ODS)和石墨化碳惰性吸附剂进行筛选。结果显示,石墨化碳对动物源性食品中色素的吸附作用不大,没有采用。通过P SA和ODS的组合进行优化实验,P SA和ODS吸附剂组合的净化效果最好。当PSA用量高于250mg,ODS高于500mg时,净化溶液中颜色无明显变化,考察其对回收率影响也不大。当吸附剂组合用量PSA低于250mg,ODS低于500mg时,提取液含杂质较多,颜色呈现黄色,会影响测定的准确度,故吸附剂的用量最终选择PSA250mg+ODS500mg较为合适。从谱图2、3可以看出,净化后虫酰肼目标物周围无杂质峰干扰。
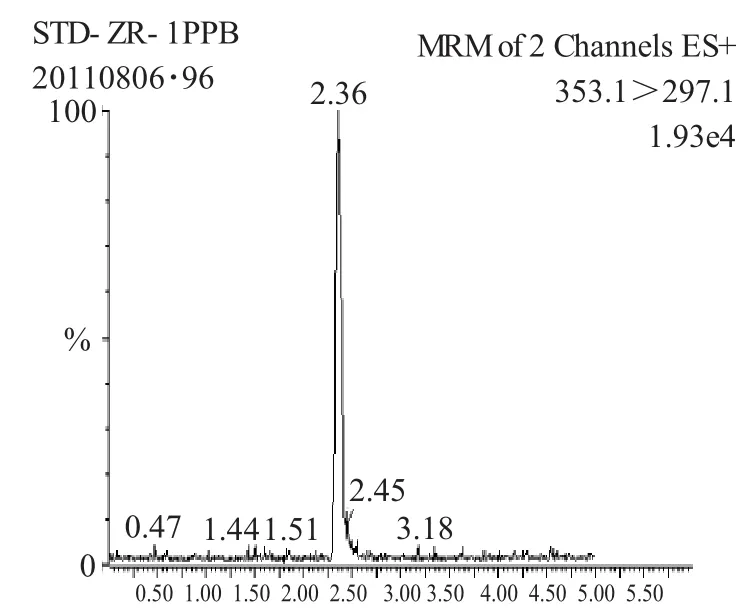
图1 标准品多反应监测色谱图Fig.1 MRM chromatogram of the tebufenozide standard
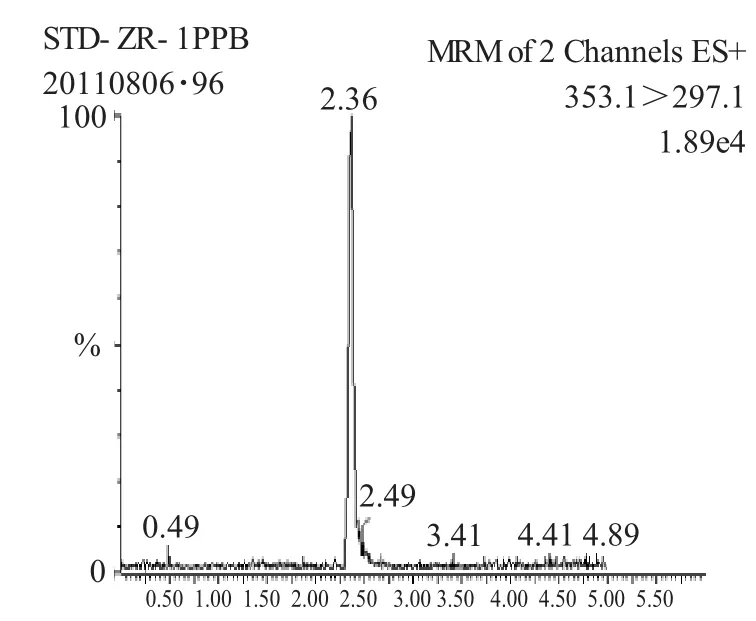
图2 猪肉样品添加1μg·kg-1色谱图Fig.2 Chromatogram of spiked pig meat sample at 1μg·kg-1

图3 猪肉样品空白色谱图Fig.3 Chromatogram of blank pig meat sample
2.4 方法的线性范围及检出限
取系列浓度 0.0004、0.002、0.010、0.04μg·mL-1和0.5000μg·mL-1的标准工作液,按上述色谱条件每种浓度进样l0μl,以峰面积为纵坐标、标准进样浓度为横坐标,绘制标准曲线,计算回归方程,以实际添加水平测定方法最低检出限,得回归方程:Y=9174.36X+2219.55,r=0.9933(n=5)。表明在 0.0004~0.5000μg·mL-1浓度范围内线性良好,检出限为1μg·mL-1。
2.5 方法的准确度及精密度实验
选取猪肉样品,分别准确称取5.0g匀浆进行1、50、25000μg·mL-1的标准的添加实验,结果见表1。
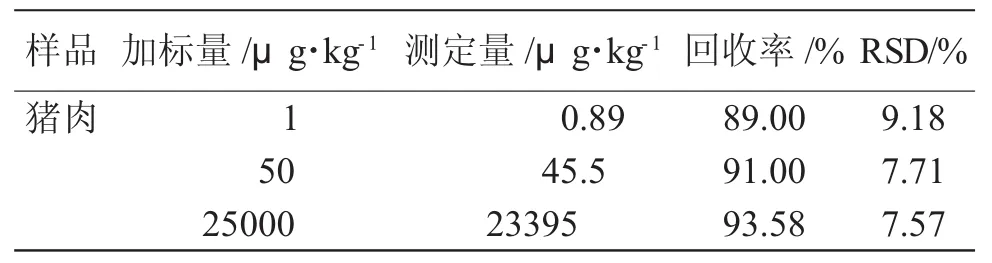
表1 猪肉中添加虫酰肼标准品的测定结果(n=6)Tab.1 Result of determination for tebufenozide in pig meat spiked at 3 levels(n=6)
不同添加浓度的回收率测定范围在79.0%~103.0%,相对标准偏差为7.57%~9.18%,均小于10%,其结果表明方法的准确度及精密度均可达到残留定量分析的要求。
3 结论
本研究建立的HPLC-MS/MS测定方法,样品前处理采用QuEChERS检测技术,提取效率高、净化效果好,条件易于控制,节约试剂和成本,减少对环境污染,极大地缩短了分析检测时间,提高了工作效率,利于样品的快速分析。本方法的回收率、精密度和检出限优于文献报道值和原有的标准,能够满足国外对动物源性食品中虫酰肼限量检测的要求。
[1] 冯坚.双酰肼类昆虫生长调节剂研究开发进展现代农药[J].2004,3(2):4-8.
[2] 章虎,吴俐勤,谢磊.高效液相色谱法测定甘蓝、青菜和番茄中虫酰肼、甲氧虫酰肼和呋喃虫酰肼残留[J].现代科学仪器,2006,(3):55-58.
[3] 杨长志,张晓华,康庆贺.高效液相色谱法测定大米中抑虫肼的残留量[J].化学工程师,2006,134(11):27-29.
[4] 董静,宫小明,张立.QuEChERS高效液相色谱法检测蔬菜中的吡虫啉、虫酰肼、阿维菌素和噻螨酮[J].分析试验室,2008,27(3):91-94.
[5] 戴琳,徐锦忠,丁涛.高效液相色谱-电喷雾串联质谱法测定蔬菜中虫酰肼和甲氧虫酰肼残留[J].分析化学,2008,36(1):87-90.
[6] 沈菁,刘军,陈平.液相色谱-质谱法测定土壤和甘蓝中的虫酰肼残留[J].湖北农业科学,2009,48(2):442-444.
[7] 石春红,施燕萍,许庆炎.高效液相色谱法检测茎椰菜中虫酰肼残留量[J].食品科技,2010,35(6):301-303.
[8] 葵英,吕文刚,孙军,等.分散固相萃取/高效液相色谱-串联质谱法检测大葱中虫酰肼、涕灭威及其衍生物的农药残留[J].分析测试学报,2011,30(3):312-315.
[9] 罗丽环,韩广源,杨长志,等.HPLC-MS/MS测定大豆中虫酰肼残留量[J].黑龙江粮食,2014,(8):44-46.
[10] 吕鹏,田丰,宋文成,等.高效液相色谱-串联质谱法测定玉米中虫酰肼残留量[J].食品安全质量检测学报,2017,8(2):416-420.
[11] GB/T20772-2008动物肌肉中461种农药及相关化学品残留量的测定液相色谱-串联质谱法[S].
[12] Masahiro Okihashi,et al.Determination of seventeen pesticide risidues in agricultural products by LC/MS.J.Food Hyg.Soc.Japan,2002,43(6):389-393.
[13] Satoshi Takatori,et al.Rapid and Easy Multiresidue Method forDetermination of Pesticide Residues in Foods Using Gas or Liquid Chromatography-Tandem Mass Spectrometry[M].Pesticides-Strategies for Pesticides Analysis,2011,(1):197-214.
[14] F.J.Arrebola,et al.Determinationof81 multiclasspesticidesin fresh foodstuffs by a single injection analysis usinggas chromatographychemicalionizationandelectronionization tandemmassspectrometry[J].AnalyticaChimicaActa,2003,484:167-180.
[15] Marina Radi ic′,et al.Determination of selected pesticides in fruit juices bymatrixsolid-phase dispersion and liquid chromatography-tandem mass spectrometry[J].Food Chemistry,2009,113:712-719.
[16] MichelangeloAnastassiades,Steven J Lehotay,Darinka Ltajnbaher,etal.Fast and easy multiresidue method employing acetonitrile extraction/partitioning and dispersive solid-phase extraction for the determination ofpesticide residues in product[J].J.AOACInt,2003,86:412.
Determination of tebufenozide residues in foodstuffs of animal origin by QuEChERS and HPLC-MS/MS
WANG Xao-han1,LIU Peng2,YANG Chen2,YANG Chang-zhi2*
(1.Heilongjiang Tobacco Industry Co.,Ltd.,Harbin 150010,China;2.Heilongjiang Entry&Exit Inspection and Quarantine Bureau,Harbin 150028,China)
A method has been developed for the determination of tebufenozide residues in foodstuffs of animal origin.Samples were extracted with acidic acid-acetonitrile (1∶99,V/V)after high-speed homogenization.The crude extract was purified on N-propyl ethylenediamine and octadecylsilane to remove fatty acid and polar pigment by complex matrix in samples.The tebufenozide residue was separated on ACQUITY UPLC BEH C18(50mm×2.1 mm,1.7μm)column using acetonitrile-acetic acid-aqueous solution water as the mobile phase by gradient elution and detected using for mass spectrometry analysis and confirmation,and quantified by external standard method.The developed method exhibited an excellent linear relationship (r>0.9933)and a detection limit of 1μg·kg-1.At the spiked levels of 1,50 and 25000μg·kg-1,the average recovery rates for tebufenozide were in the range of 79.0%~103.0%with a relative tandarddeviation(RSD)of less than 10%(n=6).This method proved rapid,accurate and highly sensitive and can therefore be used for the determination of tebufenozide residue in foodstuffs of animal origin.
tebufenozide;LC-MS/MS;foodstuffs of animal origin
A
10.16247/j.cnki.23-1171/tq.20171237
2017-11-06
王晓晗(1967-),女,工程师,毕业于哈尔滨师范大学化学专业,本科,研究方向:烟草及食品安全检测技术。
导师简介:杨长志(1962-),男,研究员,硕士,研究方向:食品安全检测技术。

