TTR Val50Leu突变导致家族性淀粉样多发性神经病的临床和电生理研究
杨硕 陈娜 潘华 翦凡 张磊 王颖
TTR Val50Leu突变导致家族性淀粉样多发性神经病的临床和电生理研究
杨硕 陈娜 潘华 翦凡 张磊 王颖
目的分析TTR Val50Leu突变导致家族性淀粉样多发性神经病的临床和电生理特点。方法对一个由TTR Val50Leu突变导致的家族性淀粉样多发性神经病家系进行报道,先证者以足部疼痛为首发症状,2年内逐渐向小腿及上肢进展,并出现自主神经症状。通过对先证者及其家系中相关者进行临床表现、电生理检查及基因检测,分析该病的临床和电生理特点。结果先证者的外祖父、母亲、舅舅、弟弟(其外祖父、母亲、舅舅已故)与其具有相似症状。先证者电生理检查上肢正中神经感觉传导受累,运动正常,尺神经的感觉传导及运动传导均正常,但尺神经F波异常,下肢胫神经和腓总神经的感觉传导及运动传导均未见肯定波形,腓肠神经受累,交感皮肤反应未引出。其弟弟上肢正中神经及尺神经改变同先证者,下肢胫神经运动波幅下降,腓总神经运动正常,交感皮肤反应四肢波幅降低,余同先证者。其女儿上述电生理检查未见异常。基因检测发现三者均在TTR基因exon2存在c.148G>T突变,TTR蛋白存在Val50Leu突变。结论TTR Val50Leu突变导致的家族性淀粉样多发性神经病家系属早发型,以足部疼痛为首发症状,进展迅速,自主神经症状出现较早。电生理符合多发性神经病表现,早期可伴有交感皮肤反应波幅降低。
家族性淀粉样多发性神经病;转甲状腺素蛋白;神经传导检测;交感皮肤反应
家族性淀粉样多发性神经病(familial amyloid polyneuropathies,FAPs)是一组由淀粉样纤维沉积在神经系统导致的常染色体显性遗传疾病。根据前体蛋白的不同可分为转甲状腺素蛋白(TTR)型,载脂蛋白A-1型和凝溶胶蛋白型,其中以TTR型最为常见[1]。TTR突变是导致TTR型FAP的主要原因,目前已经发现的TTR突变有100余种,Val30Met是最常见的一种,在全球范围内约占50%[2]。TTR型FAP由于基因突变类型、地域差异等因素而呈现多种多样的表现。发病年龄20~90岁均有报道,平均生存期约为10年[3]。经典TTR Val30Met早发型(发病年龄<50岁)FAP以足部感觉异常、感觉迟钝、痛觉过敏、痛觉超敏或自发痛为首发症状,在4~5年内进展至下肢近端及上肢,随后几年逐渐出现轻触觉、振动觉、位置觉及运动异常[4]。电生理研究发现足底交感皮肤反应波幅对TTR Val30Met型FAP早期诊断的特异性高达94%[5]。
由TTRc.148G>T突变所致FAP病例十分少见,仅Suhr等[6]曾报道过一例芬兰病例,国内尚无相关报道。本文对一个由TTRc.148G>T突变所致FAP家系进行报道,详细总结其临床及电生理特点,希望有助于提高临床医生对这一新型突变所致FAP的认识及早期诊断。
1 对象和方法
1.1观察对象患者(先证者,Ⅲ1)男性,46岁,主因“双足疼痛2年,伴麻木、无力1年余”于2016-03-08就诊于首都医科大学附属北京天坛医院神经内科。此次入院2年前患者无明显诱因出现双足趾尖疼痛,针刺样,以右侧为著,夜间重,间断反复发作。此次入院1年半前出现右脚麻木,半年后左脚出现麻木,由趾尖开始,逐渐进展至小腿下部及上肢,伴无力,肌肉萎缩,远端重,伴恶心、干呕,面部出汗减少,吞咽干食困难、喜食稀饭,无饮水呛咳,自觉说话无底气、声音嘶哑。入院10 d前由坐位、卧位、蹲位站起时,出现头晕,双眼黑蒙,视物模糊,1~2 min好转。小便略无力,间断便秘,勃起功能减退,体重下降15 kg。既往1996年车祸,骨盆骨折,遗留右腿行走不利。患者之外祖父(Ⅰ1)、母亲(Ⅱ4)、舅舅(Ⅱ3)、弟弟(Ⅲ2)均有相似症状,其外祖父、母亲、舅舅均于起病后3~8年去世。患者家系图见图1。查体双侧腕部以下,膝部以下痛触觉减退,双腕、踝、膝、髋振动觉减退,四肢肌张力稍低,双上肢肌力近端4+级、远端4级,双下肢肌力远近端均4级,双侧第一背侧骨间肌、大鱼际轻度萎缩,双下肢肌肉轻度萎缩,以远端为著。双侧肱二头肌、桡骨膜、膝腱、跟腱反射消失,肱三头肌反射减弱,双侧腹壁反射可引出(右侧稍弱于左侧),双侧提睾反射存在,双侧指鼻试验、跟膝胫试验尚稳准,双侧Hoffman征、Rossolimo征、掌颏反射、Babinski征均阴性。实验室检查:血、尿、便常规正常,肝肾功能、血糖、血脂、电解质正常,甲状腺功能正常,免疫全套正常。心电图正常,肝胆胰脾肾及泌尿系超声均未见明显异常,头MRI未见明显异常、MRA提示左侧颈内动脉虹吸段管腔粗细欠均,腰椎MRI提示L3-L5椎间盘膨出、L5-S1椎间盘突出、椎管狭窄,肺功能正常,胃镜提示反流性食管炎(LA-A),慢性非萎缩性胃炎。
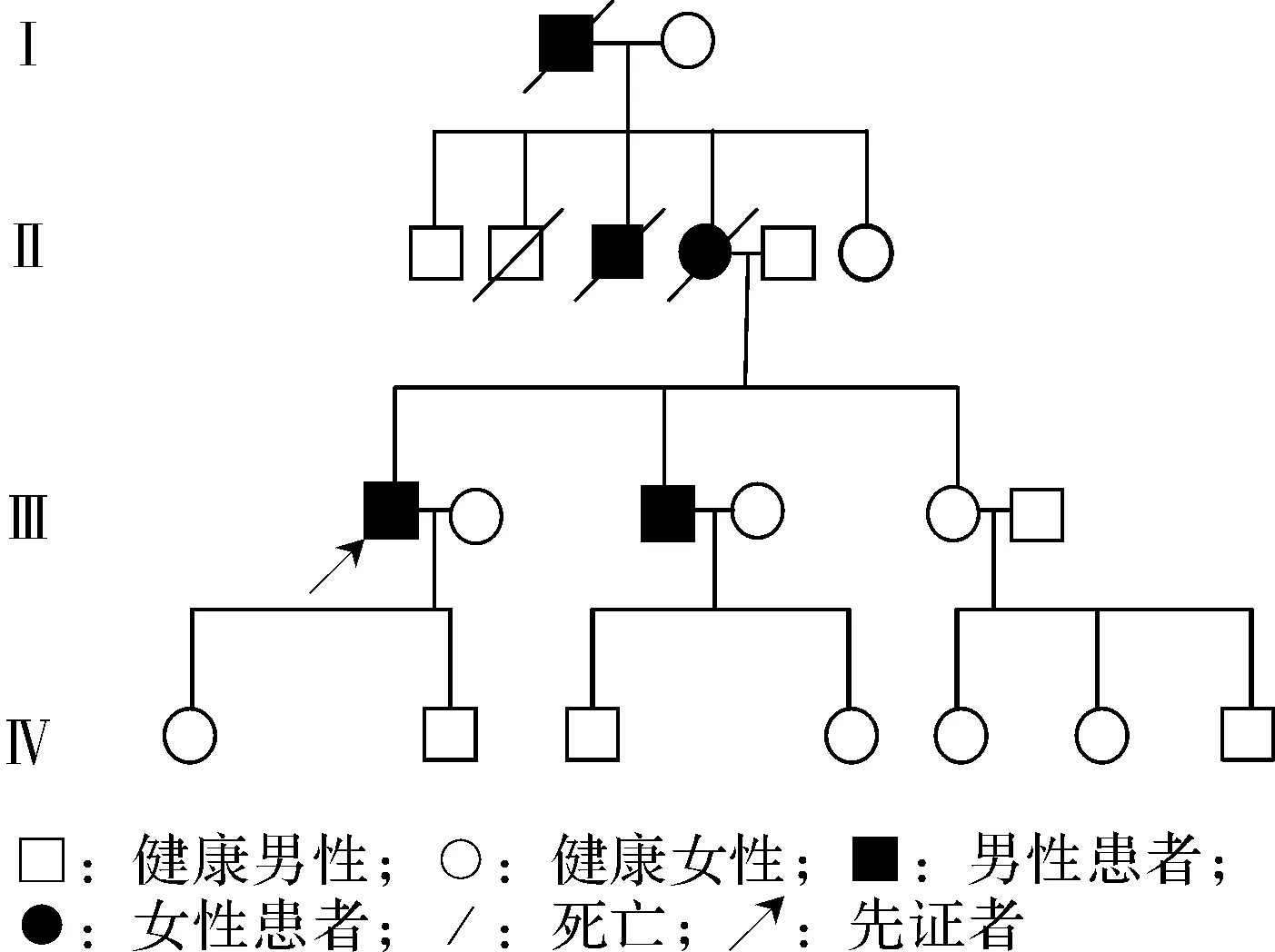
图 1 TTR c.148G>T突变所致FAP患者家系图
1.2方法
1.2.1临床表现:对患者家系中相似表现者(外祖父、母亲、舅舅)及其父亲、女儿的临床表现及转归进行分析。
1.2.2电生理检查:对患者及其弟弟、女儿进行右侧正中神经、尺神经、胫神经、腓总神经和腓肠神经神经传导检测,尺神经和胫神经的F波检测,以及四肢交感皮肤反应(sympathetic skin reactiom,SSR)检测。不同神经检测部位见表1。皮肤温度维持在32℃。记录复合肌肉动作电位(compound muscle action potential,CMAP)峰峰波幅、末端潜伏期和传导速度,以及感觉神经动作电位(sensory nerve action potential,SNAP)的峰峰波幅和传导速度;F波出现率和最短潜伏期;SSR的潜伏期和波幅。
1.2.3基因检测:在取得患者及其父亲、弟弟、女儿知情同意后,分别采取外周静脉全血4 mL,从血液中提取3~5 μg DNA,将其打断、扩增,建立含目标基因的全基因组文库,利用液相捕获方法捕获目标基因,然后应用高通量测序,与美国加州大学圣塔克鲁兹分校(UCSC)数据库提供的人类基因组 hg19 参考序列进行比对,找出样本中相关基因的所有突变信息(转录本编号:NM_000371)。
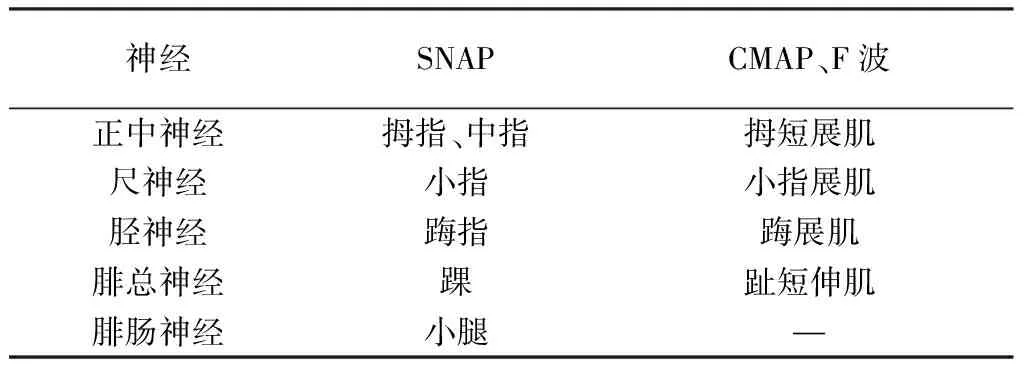
表1 不同神经检测部位
注:“—”表示未检测
2结果
2.1临床表现患者之外祖父、母亲、舅舅均有与患者相似的症状,其外祖父、母亲、舅舅均于起病后3~8年去世。
患者弟弟,41岁,患者此次入院2年前其弟出现双足持续性胀痛,以足底,趾尖为著,伴阵发性针刺感,持续数秒,20 d后自行恢复;1年前双足症状再次出现,性质同前,夜间重,10个月前出现长路程行走时双侧小腿酸痛、无力伴麻木,2个月后双下肢无力逐渐加重,伴额头出汗减少,咽干食困难,喜食软食,无饮水呛咳,易饭后呕吐胃内容物,自述咽部不适;3个月前发现双前臂酸痛,双手麻木,以手指为著,偶有针刺感。小便略无力,间断便秘,勃起功能减退,体重下降12 kg。既往体健,查体四肢肌张力正常,双上肢肌力5级,双下肢肌力5-级,未见明显肌肉萎缩,余同患者。
患者父亲,74岁,未发现有与患者相似表现。患者女儿,22岁,目前无不适主诉,查体未见明显异常。四者的临床特点总结见表2。
2.2电生理检查结果电生理检查结果见表3。

表2 患者及其父亲、弟弟、女儿的临床特点
注:“—”表示没有出现该症状
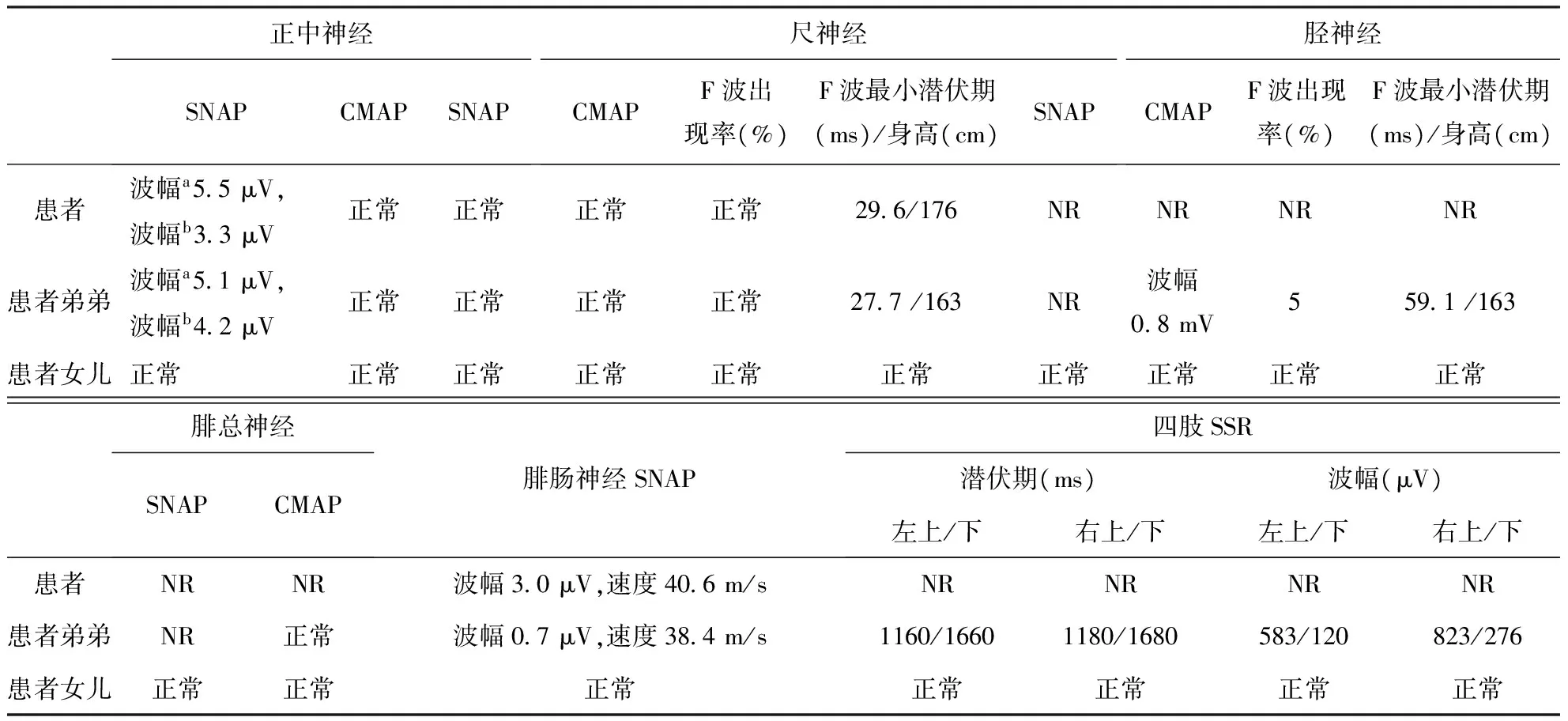
表3 患者及其弟弟、女儿的电生理检查结果比较
注:SNAP:感觉神经动作电位;CMAP:复合肌肉动作电位;NR:未见肯定波形/未引出;SNAP和CAMP的峰峰波幅及传导速度表中简称“波幅”和“速度”,波幅和速度均正常者标注为“正常”,有异常者仅标出异常结果;a:拇指;b:中指
患者上肢正中神经SNAP峰峰波幅降低,传导速度正常,CMAP正常,尺神经SNAP及CMAP正常,但尺神经F波最短潜伏期延长,下肢胫神经和腓总神经的感觉及运动传导均未见肯定波形,腓肠神经SNAP峰峰波幅及传导速度均降低。SSR未引出。其弟上肢正中神经及尺神经感觉及运动传导改变同患者,下肢胫神经CMAP峰峰波幅降低,腓总神经CMAP正常,二者感觉传导均未见肯定波形。SSR显示四肢波幅降低。其女儿上述电生理检查均正常。
2.3基因检测结果患者及其弟弟、女儿在TTR基因exon2均存在c.148G>T突变,TTR蛋白显示为Val50Leu突变,而其父亲无此突变(图2)。
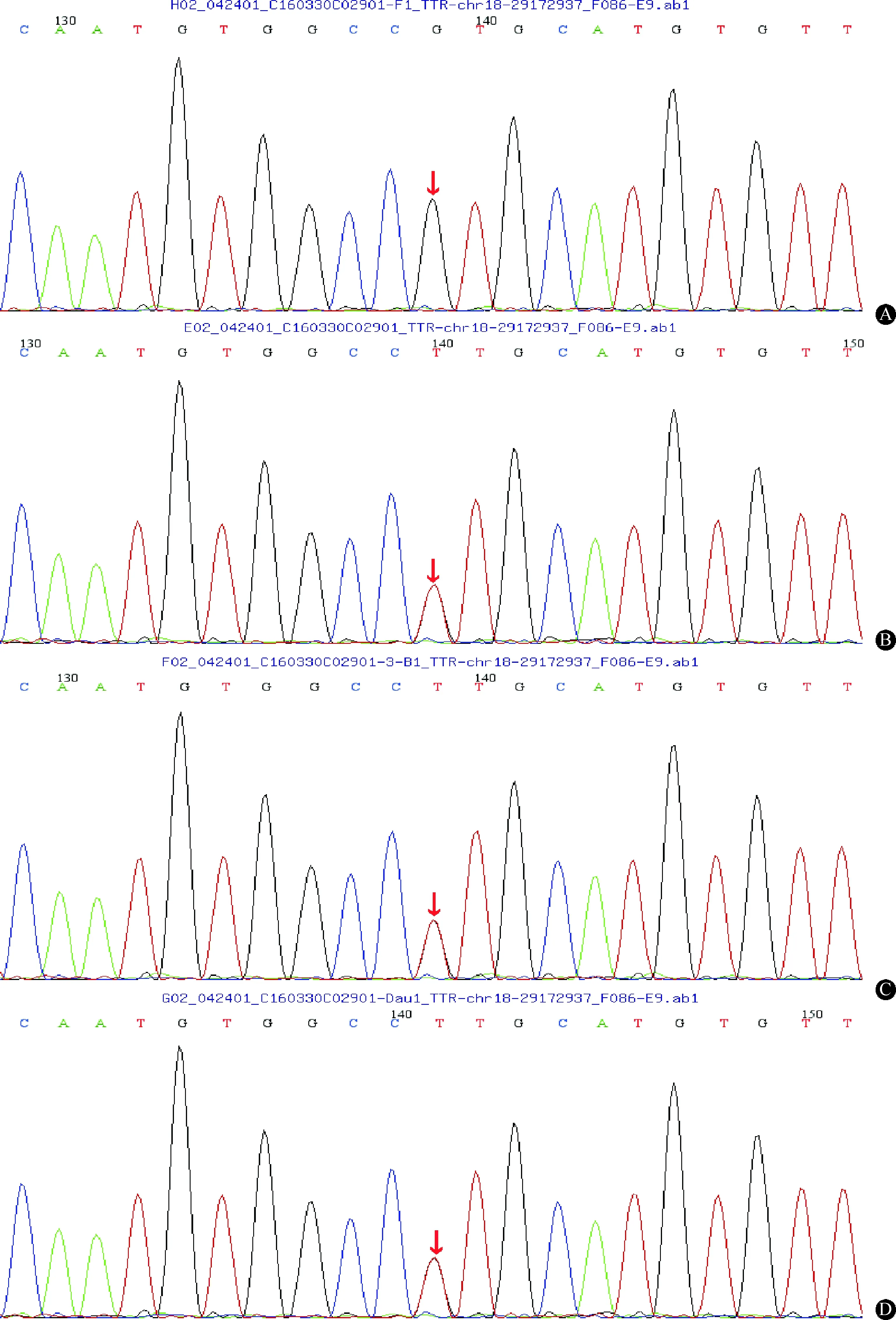
图 2 基因检测结果:患者父亲(A)未发现基因突变,编码区第148号氨基酸为鸟嘌呤(图中箭头所示);患者(B)及其弟弟(C)、女儿(D)均发现突变基因编码区第148号氨基酸由鸟嘌呤变异为胸腺嘧啶(图中箭头所示)
3 讨论
TTR型FAP是一种罕见疾病,目前国内尚缺乏确切的流行病学数据。本病在欧洲,尤其是葡萄牙及瑞典相对高发,据统计,其发病率在1/10000至1/1000,其中95%~99%为TTR Val30Met突变,平均发病年龄为33~56岁[7-8,2]。自发病始其平均生存期约为10年[1,3]。TTR由位于18q12.1的TTR基因编码,主要在肝脏合成。正常情况下,肝脏合成的TTR以可溶解的形式循环于外周血和脑脊液中,发挥转运甲状腺素和维生素A的作用。可溶解的TTR是单体通过非共价健形成的四聚体[9],而致病性TTR基因突变会导致四聚体分解成单体,被释放到细胞外的单体进一步形成不溶性淀粉样纤维,沉积在神经内膜引发疾病[10]。
TTR 型FAP根据发病年龄不同分为早发型和晚发型,以50岁为界[11]。该病的临床表现可能涉及多个系统,如神经系统、心血管系统、胃肠道、肾脏及眼部等,其中以神经系统,尤其是周围神经和自主神经症状及体征最为突出。经典TTR Val30Met早发型FAP的周围神经病变主要表现为长度依赖性感觉运动性多发性神经病,早期累及下肢远端薄髓及无髓神经纤维,表现为足部疼痛及温度觉异常,4~5年内轴索变性逐渐向下肢近端及上肢进展,随后出现大有髓感觉及运动纤维受累,表现为触觉和本体感觉异常,以及运动受损[4]。早发型患者自主神经症状出现较早,可表现为体位性低血压,腹泻、便秘或二者交替,恶心、厌食或消化紊乱,排尿困难,性功能障碍及泌汗异常等。而TTR Val30Met晚发型FAP由于无髓纤维相对保留,因此自主神经病变相对较轻[12-13]。
家族史在TTR型FAP的诊断中具有重要意义。如果家族史明确,且表现为多发性周围神经病及自主神经功能受损,此时病理检查并非必需;如果没有家族史,病理检查对诊断则是必需的[1,14]。确切的TTR突变可协助建立诊断。本患者家族史明确,临床表现典型,且基因检测显示患者及其弟弟、女儿TTR基因exon2均存在确切的 c.148G>T突变,这一基因突变进一步导致蛋白TTR 出现Val50Leu变异,故该家系可诊断为TTR型FAP。
经检索国内外文献,该突变类型在国内尚无报道,国外仅Suhr等[6]报道过1例TTR基因c.148G>T突变患者,该患者为一芬兰女性,66岁起病,以双足部感觉异常为首发症状,4年后出现自主神经受损表现,电生理检查提示轴索性多神经病,直肠黏膜病理显示淀粉样物质沉积。虽然该芬兰女性的基因突变位点与本研究家系一致,但是与该芬兰病例相比,本研究家系的发病年龄较早,进展速度较快。
综上,TTR Val50Leu突变所致FAP临床较为罕见。本文对国内TTR Val50Leu突变所致FAP一家系进行报道,通过对其临床特点及电生理进展性改变的总结,希望有助于临床医生早期识别并诊断该病。
[1]Planté-Bordeneuve V, Said G. Familial amyloid polyneuropathy[J]. Lancet Neurol, 2011, 10(12): 1086-1097.
[2]Parman Y, Adams D, Obici L, et al. Sixty years of transthyretin familial amyloid polyneuropathy (TTR-FAP) in Europe: where are we now?A European network approach to defining the epidemiology and management patterns for TTR-FAP[J]. Curr Opin Neurol, 2016, 29 (Suppl 1):S3-S13.
[3]Ando Y, Coelho T, Berk JL, et al. Guideline of transthyretin hereditary amyloidosis for clincians[J]. Orphanet J Rare Dis, 2018,8:31.
[6]Suhr OB, Andersen O, Aronsson T, et al. Report of five rare or previously unknown amyloidogenic transthyretin mutations disclosed in Sweden[J]. Amyloid, 2009, 16(4):208-214.
[7]Sousa A, Coelho T, Barros J, et al. Genetic epidemiology of familial amyloidotic polyneuropathy (FAP)-type Ⅰ in Póvoa do Varzim and Vila do Conde (north of Portugal)[J]. Am J Med Genet, 1995, 60(6):512-521.
[8]Sousa A, Andersson R, Drugge U, et al.Familial amyloidotic polyneuropathy in Sweden: geographical distribution, age of onset, and prevalence[J]. Hum Hered, 1993, 43(5): 288-294.
[9]Benson MD, Kincaid JC. The molecular biology and clinical features of amyloid neuropathy[J]. Muscle Nerve, 2007, 36(4): 411-423.
[10]Faria TQ, Almeida ZL, Cruz PF, et al. A look into amyloid formation by transthyretin: aggregation pathway and a novel kinetic model[J]. Phys Chem Chem Phys, 2015, 17(11):7255-7263.
[11]Adams D, Lozeron P, Lacroix C. Amyloid neuropathies[J]. Curr Opin Neurol, 2012, 25(5):564-572.
[12]Koike H, Misu K, Sugiura M, et al. Pathology of early-vslate-onset TTR Met30 familial amyloid polyneuropathy[J]. Neurology, 2004, 63(1): 129-138.
[13]Koike H, Hashimoto R, Tomita M, et al. Diagnosis of sporadic transthyretin Val30Met familial amyloid polyneuro-pathy: a practical analysis[J]. Amyloid, 2011, 18(2): 53-62.
[14]Plante-Bordeneuve V. Update in the diagnosis and management of transthyretin familial amyloid polyneuropathy[J]. J Neurol, 2014, 261(6):1227-1233.
ClinicalandelectrophysiologicalfeaturesoffamilialamyloidpolyneuropathyinducedbyTTRVal50Leumutation
YANGShuo*,CHENNa*,PANHua#,JIANFan,ZHANGLei,WANGYing.
#ClinicalNeurophysiologyCenter,DepartmentofNeurology,BeijingTiantanHospital,CapitalMedicalUniversity,Beijing100050,China*These authors contributed equally to this work
PAN Hua,Email:panhua0676@163.com
ObjectiveTo analyze the clinical and electrophysiological characteristics of familial amyloid polyneuropathy caused by TTR Val50Leu mutation.MethodsA pedigree of familial amyloid polyneuropathy caused by TTR Val50Leu mutation was reported. The proband presented with foot pain as the first symptom. The lower and upper extremities were progressively involved within 2 years, and autonomic symptoms also developed. The clinical and electrophysiological characteristics of the proband and his pedigree were analyzed through clinical manifestation, electrophysiological examination and genetic testing.ResultsThe proband’s grandfather, mother, uncle and brother (the former three had died) manifested as symptoms similar to him. For the proband, CMAPs of the median and ulnar nerves showed normal results, while CMAPs of the tibial and peroneal nerves were not elicited. F-wave minimum latency (Fmin) of the ulnar nerve was prolonged. SNAPs of the median, tibial, peroneal and sural nerves showed abnormal results, except for ulnar nerve. SSR was not elicited. For his brother, the impaired range of peripheral nerves was similar to the proband, but with lesser severity. SSR showed decreased amplitude. For his daughter, electrophysiological studies did not detect any abnormality. All the three patients’ genes showed c.148G>T mutation in exon2 ofTTRgene and Val50Leu mutation in TTR protein.ConclusionsTTR Val50Leu FAP manifests as an early-onset and rapid-progression pattern. Usually, foot pain is the first symptom, and autonomic symptoms appear early. Electrodiagnosis is in line with the manifestation of polyneuropathy, and often accompanied by SSR abnormality.
familial amyloid polyneuropathies;transthyretin;nerve conduction study;sympathetic skin response
10.3969/j.issn.1006-2963.2017.06.004
100050 北京市首都医科大学附属北京天坛医院神经病学中心临床神经生理科
潘华,Email:panhua0676@163.com
杨硕与陈娜两作者对本文具有相同贡献
R744
A
1006-2963(2017)06-395-06
2017-03-01)
邹晨双)

