脓毒症新常态及其治疗研究进展
张文杰,何英丽,王 涛,董晨明*
·新进展·
脓毒症新常态及其治疗研究进展
张文杰1,何英丽2,王 涛1,董晨明1*
脓毒症是一项全球性公共卫生问题,其发病率、死亡率持续居高。虽然进行了大量研究,但至今未能完全阐述其病理生理机制。随着医疗技术进步和社会人口结构变化,脓毒症的临床表现及病理生理也在发生转变。因此充分了解脓毒症新的发展变化对临床诊治具有重要意义。近年来发现免疫应答在脓毒症发生、发展中具有重要作用,对脓毒症免疫应答的研究有希望成为未来诊治的突破口。现总结近年来国内外相关文献,阐述脓毒症的新发展变化及相应治疗的研究进展。
脓毒症;免疫应答;治疗;综述
尽管过去几十年中人们对脓毒症进行着不懈的研究,但脓毒症的诊治依然是世界性的难题。脓毒症不论在发达国家,还是在人口老龄化或新生儿增加的发展中国家均是严重的公共卫生问题[1],特别是在我国面临全面二胎和人口老龄化的国情背景下,情况可能更为突出。由于医疗技术的发展,虽然对脓毒症的早期诊断和规范化的管理策略使患者初始急性期的存活率增加,但临床发现随后滞留于ICU的人群增多,这已经逐渐成为现今ICU脓毒症治疗中面临的新问题。最新的证据表明,免疫反应在脓毒症的发病过程中起到极为重要的作用[2]。随着脓毒症病理生理的深入研究,免疫治疗已成为日益关注的研究领域[3]。现就近年来关于脓毒症免疫机制及治疗的研究进展进行总结,阐述其在脓毒症中的作用和影响。
1 脓毒症的新常态
1.1 新常态的临床发展演变 伴随着医学的进步,人们面对的疾病也在相应的改变。20世纪70年代临床发现“不受控制的感染”会致命,而且这种感染大多与腹内感染相关[4]。而到20世纪80年代由于手术和重症监护的进步,腹内感染已大幅减少[4],但除了腹内感染以外,这种“不受控制的感染”致死的情况依然存在。20世纪90年代发现腹腔间隔室综合征(ACS)成为失控感染的主要代表[5]。20世纪90年代中期,ACS逐渐被遏制,人们又将目光转向新的问题:全身炎症反应综合征(SIRS)。随着对疾病认识和治疗的进步,脓毒症患者疾病特征也发生转变。进入21世纪,伴随着社会人口结构变化和ICU对脓毒症的干预更全面、深入,脓毒症的治疗必然面临新的挑战。虽然对脓毒症的早期识别和初始管理策略致使脓毒症初始急性期的存活率明显改善[6],但临床观察到越来越多的初期存活患者滞留于ICU,通常需要长期医疗支持,其临床特点为:遗留有一定程度的器官功能障碍、高继发感染风险、体质量下降或极差的营养状况、创口愈合不良、甚至有出院后长期持久的免疫障碍或缺陷。进一步发现此类患者大多具有慢性炎症、获得性免疫抑制、继发院内感染和严重的蛋白分解代谢的特点[7]。故有学者将之定义为:持续性炎症-免疫抑制分解代谢综合征(PICS)[4]。众多证据已经表明PICS是增加长期急性医疗支持(LTAC)的主要病理表现,而且PICS的发病率可能随着人口老龄化和脓毒症早期治疗技术的改善而增加[8]。因此,有理由认为PICS将会是现代社会脓毒症患者病程后期出现的一种新常态。
1.2 新常态的病理发展演变 自20世纪80年代发现促炎细胞因子以来,人们便推测脓毒症的死因是由于早期过度的炎性反应和固有免疫反应所致,其过度产生多种促炎递质并通过中性粒细胞活化、内皮损伤、影响灌注等因素导致患者死亡[9]。随之进一步的研究提出SIRS以解释脓毒症。基于SIRS理论,试图阻断早期过度炎性反应的药物大量出现,但均无功而果。鉴于此,人们意识到SIRS不足以完全阐明脓毒症的发病机制。BONE[10]发现,在脓毒症中SIRS的一些方面被机体下调以使组织损伤最小化,经进一步研究提出代偿性抗炎反应综合征(CARS)。现在广泛认为:SIRS是先天炎性反应的结果,而CARS则代表适应性免疫反应,而且二者从炎症伊始就共同存在[11]。到20世纪90年代后期,SIRS/CARS模型已成为脓毒症病理生理机制的经典解释。然而,人们观察到很多经充分治疗初始感染的脓毒症患者在后期会发生病毒感染和继发性院内感染。例如多达1/3的患者通常会在入院第4~12天发生巨细胞病毒感染[12]。宿主免疫力正常时不会致病的细菌(如嗜麦芽寡养单胞菌)也会发生继发性感染[13]。还有研究发现,脓毒症患者出院后1年中复发性感染的风险增加,甚至在脓毒症初始感染发作后数年(最长达10年)内的病死率也会增加[7,14]。于是人们提出假设:部分脓毒症患者可能会遗留持久的免疫缺陷,不能彻底清除原发感染或更容易受到后期感染。这种免疫抑制是未知的,而且用SIRS/CARS模型来解释较为牵强。鉴于SIRS/CARS模型的局限性及已明确脓毒症患者后期具有的免疫抑制、分解代谢等特征,从而提出持续性炎症-免疫抑制、PICS是脓毒症患者后期出现的新表型[4]。现已有较高等级的证据证明,发生在PICS的免疫抑制是大多数脓毒症患者的主要免疫反应[15]。在对40例脓毒症死亡患者快速尸体解剖的研究中发现,脾脏中促炎细胞因子明显减少,而脾淋巴细胞几乎耗尽[16]。这项研究表明,败血症后期死亡患者具有显著的“免疫耗竭”,而其严重阻碍机体发生炎性反应。随着研究的进展,现在认为涉及免疫抑制的机制主要有:(1)固有免疫功能紊乱,包括吞噬作用受损、炎性细胞异常生成、免疫抑制因子及具有炎症和免疫抑制表型的髓样细胞的出现[17]。(2)适应性免疫表现为免疫细胞功能及代谢障碍,主要有淋巴细胞功能障碍和凋亡增加,缺乏T淋巴细胞(其机制包括凋亡清除、增殖减少和Th2极化)[18]。(3)转录重编程介导这种从活跃的促炎状态到免疫细胞活化减少的转变,其导致各种促炎递质和细胞因子受体的转录和表达减少[19]。(4)神经内分泌的参与,例如儿茶酚胺的增加会引起胆碱能抗炎反射,并减少免疫细胞释放促炎递质,也使机体发生从免疫系统激活到免疫抑制的转变[20]。以上通过脓毒症病理生理发展演变也充分说明PICS已成为现阶段脓毒症患者后期的新常态,而且免疫抑制起到极重要作用。
2 新常态下的脓毒症免疫治疗
虽然脓毒症初始管理策略仍是治疗的基石,但随着PICS的发现及广泛认可必将导致脓毒症的治疗发生深刻变化。现在越来越多的研究聚焦于免疫调节治疗,例如对于大多数免疫抑制或存在持久性免疫缺陷患者的辅助免疫刺激治疗。有希望的候选药物有粒细胞-巨噬细胞集落刺激因子(GM-CSF)、干扰素γ(IFN-γ)、白介素 7(IL-7)、程序性细胞死亡受体(抗PD-1抗体)。其中,GM-CSF和IFN-γ已经在实验室中显示出理想的结果,目前正在进行临床试验研究[21],而IL-7和抗PD-1抗体在动物模型中表现出较好的前景[22]。
2.1 GM-CSF GM-CSF在20世纪60年代首次由WALTER和HALL研究所发现[23]。临床主要用于继发于化疗诱导的骨髓抑制所致中性粒细胞减少的治疗中。受此启发,GM-CSF有望成为治疗具有免疫抑制脓毒症患者的潜在免疫激活剂。研究证实,GM-CSF对单核细胞、巨噬细胞、嗜中性粒细胞、嗜酸粒细胞、嗜碱粒细胞的增殖、分化、激活均有促进作用,并影响其凋亡[24]。已开展的几项针对免疫抑制败血症患者的临床试验证明,GM-CSF能有效恢复巨噬细胞免疫功能,可促进脓毒症患者感染的恢复,减少机械通气时间及住院天数并降低医疗成本,此外还显示无使用后的显著不良反应[25-26]。荟萃分析也支持上述结论,但显示在14、28 d或院内病死率方面没有差异[24]。这些为GM-CSF有希望成为脓毒症免疫治疗剂提供了有力依据。
2.2 IFN-γ IFN-γ是Ⅱ型IFN家族的唯一成员,其在免疫抑制中的主要作用有:(1)刺激大多数促炎细胞因子的基因表达并引发嗜中性粒细胞的吞噬作用[27]。(2)IFN-γ是巨噬细胞的关键激活剂,诱导Ⅰ类主要组织相容性复合体(MHC)表达[28]。(3)刺激单核细胞生成炎性因子[28]。有研究发现,脓毒症中自然杀伤(NK)细胞诱导IFN-γ的产生被明显下调[29]。潘爱军等[30]的临床研究也证实,脓毒症患者的IFN-γ生成减少,IFN-γ介导的免疫功能紊乱可能是脓毒症NK细胞功能低下的主要原因。LEENTJENS等[31]的临床试验证实,使用IFN-γ可以改善脓毒症患者的免疫状态。相信通过深入地研究可更深刻地揭示IFN-γ在脓毒症中的作用。下一步将进行多中心随机对照临床试验,以进一步明确IFN-γ对脓毒症患者的作用。
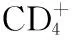
2.4 抗PD-1抗体 干预抗原提呈细胞(APC)和T淋巴细胞之间的相互作用是调节脓毒症免疫应答的重要方向之一。在脓毒症免疫应答中,APC上的CD80或CD86与诱导型T淋巴细胞共刺激因子(ICOS)及CD28形成共刺激复合物,其诱导T淋巴细胞的增殖和活化,而PD-1具有抑制这种共刺激复合物的功能,从而调节T淋巴细胞[32]。PD-1在脓毒症期间显示出过度表达,并高度参与免疫抑制过程[20]。此外,脓毒症患者外周血PD-1表达明显升高,不仅影响细胞增殖、分化,而且与患者院内感染率及病死率密切相关[36]。张小玲等[37]发现脓毒症小鼠外周血中PD-1明显升高,提示脓毒症早期机体特异性免疫主要呈现负性调节。SHINDO等[38]在脓毒症小鼠的研究中证实,抗PD-1抗体能改善宿主的免疫抑制,是理想的免疫治疗剂。吕艺等[39]亦得出了相似结论。抗PD-1抗体作为有潜力的脓毒症免疫调节剂备受关注,期望有进一步对脓毒症患者群体的临床研究。
3 结语及展望
脓毒症是一种具有高度异质性且病理生理复杂的综合征,目前尚不能完全解释其病理生理机制。随着治疗技术的进步及社会发展,临床上面临的脓毒症表型及患者群体也在随之发生改变。脓毒症新常态——PICS的出现对进一步理解脓毒症病理生理机制具有重要意义,并为临床治疗提供了新的方向。作为PICS的重要内容,免疫抑制的研究将有望成为脓毒症诊治的新突破口。对脓毒症免疫抑制的治疗研究已是当前的热点,但多为单个免疫调节剂的研究。脓毒症免疫应答涉及大量免疫细胞及因子之间复杂的相互调节作用,单一的免疫调节剂未必能实现预期疗效。借鉴癌症患者免疫调节治疗方案的思路,期待未来会出现脓毒症免疫调节剂的组合化、个体化、精确化治疗方案。
作者贡献:张文杰、何英丽进行文章的构思与设计及可行性分析,撰写论文;张文杰、王涛进行文献/资料收集,论文的修订;何英丽进行文献/资料整理;何英丽、董晨明负责文章的质量控制及审校;董晨明对文章整体进行负责及监督管理。
本文无利益冲突。
本文文献检索策略:
(1)检索数据库及检索时间:计算机检索PubMed(建库至2017年2月)、SCI(建库至2016年12月)、万方数据知识服务平台(建库至2017年2月)、中国期刊全文数据库(建库至2017年2月)、中国知网(建库至2017年2月),同时手动检索相关的专业杂志和资料,并追溯部分纳入研究的参考文献。(2)检索关键词:中文检索词包括:脓毒症、新进展、全身炎症反应综合征、代偿性抗炎反应综合征、免疫应答、免疫抑制、脓毒症治疗、动物试验、临床研究、综述、粒细胞-巨噬细胞集落刺激因子、干扰素γ、白介素7、程序性细胞死亡受体;英文检索词包括:Sepsis、New progression、Systemic inflammatory response syndrome、Compensatory antiinflammatory response syndrome、Immune response、Immunosuppression、Sepsis treatment、Animal testing、Clinical study、Review、GM-CSF、IFN-γ、IL-7、PD-L1/PD-1;复杂检索用布尔逻辑运算连接检索词。(3)纳入及排除标准:由2位研究者分别检索不同数据库,筛选近20年来相关文献。如文献的资料不全,则与该文献的作者联系获取相关资料,若未获得相关数据或全文,则视写作中具体情况,采用或剔除该文献。后期写作中遇到必须引用而又超过20年的文献,则纳入。(4)检索结果:通过数据库检索及其他途径获得相关文献后再通过剔重、阅读标题及摘要后初选文献208篇,有2篇联系作者后,未获得全文。最终纳入符合标准的文献共140篇,其中外文文献132篇,中文文献8篇。最终引用文献39篇(外文文献34篇,中文文献5篇)。
[1]RASID O,CAVAILLON J M.Recent developments in severe sepsis research:from bench to bedside and back[J].Future Microbiol,2016,11(2):293-314.DOI:10.2217/fmb.15.133.
[2]MONNERET G,VENET F.Sepsis-induced immune alterations monitoring by flow cytometry as a promising tool for individualized therapy[J].Cytometry B Clin Cytom,2016,90(4):376-386.DOI:10.1002/cyto.b.21270.
[3]DELANO M J,WARD P A.Sepsis-induced immune dysfunction:can immune therapies reduce mortality?[J].J Clin Invest,2016,126(1):23-31.DOI:10.1172/JCI82224.
[4]GENTILE L F,CUENCA A G,EFRON P A,et al.Persistent inflammation and immunosuppression:a common syndrome and new horizon for surgical intensive care[J].J Trauma Acute Care Surg,2012,72(6):1491-1501.DOI:10.1097/TA.0b013e318256e000.
[5]BALOGH Z,MCKINLEY B A,COX Jr C S,et al.Abdominal compartment syndrome:the cause or effect of postinjury multiple organ failure[J].Shock,2003,20(6):483-492.DOI:10.1097/01.shk.0000093346.68755.43.
[6]CUSCHIERI J,JOHNSON J L,SPERRY J,et al.Benchmarking outcomes in the critically injured trauma patient and the effect of implementing standard operating procedures[J].Ann Surg,2012,255(5):993-999.DOI:10.1097/SLA.0b013e31824f1ebc.
[7]FACY O,PAQUETTE B,ORRY D,et al.Diagnostic accuracy of inflammatory markers as early predictors of infection after elective colorectal surgery:results from the IMACORS study[J].Ann Surg,2016,263(5):961-966.DOI:10.1097/SLA.0000000000001303.
[8]NACIONALES D C,GENTILE L F,VANZANT E,et al.Aged mice are unable to mount an effective myeloid response to sepsis[J].J Immunol,2014,192(2):612-622.DOI:10.4049/jimmunol.1302109.
[9]OKUSAWA S,GELFAND J A,IKEJIMA T,et al.Interleukin 1 induces a shock-like state in rabbits.Synergism with tumor necrosis factor and the effect of cyclooxygenase inhibition[J].J Clin Invest,1988,81(4):1162-1172.DOI:10.1172/JCI113431.
[10]BONE R C.Sir isaac newton,sepsis,SIRS,and CARS[J].Crit Care Med,1996,24(7):1125-1128.
[11]TAMAYO E,FERNNDEZ A,ALMANSA R,et al.Pro- and anti-inflammatory responses are regulated simultaneously from the first moments of septic shock[J].Eur Cytokine Netw,2011,22(2):82-87.DOI:10.1684/ecn.2011.0281.
[12]YADAV H,CARTIN-CEBA R.Balance between hyperinflammation and immunosuppression in sepsis[J].Semin Respir Crit Care Med,2016,37(1):42-50.DOI:10.1055/s-0035-1570356.
[13]OTTO G P,SOSSDORF M,CLAUS R A,et al.The late phase of sepsis is characterized by an increased microbiological burden and death rate[J].Crit Care,2011,15(4):R183.DOI:10.1186/cc10332.
[14]KJAERGAARD A G,NIELSEN J S,TØNNESEN E,et al.Expression of NK cell and monocyte receptors in critically ill patients——potential biomarkers of sepsis[J].Scand J Immunol,2015,81(4):249-258.DOI:10.1111/sji.12272.
[15]LIESENFELD O,LEHMAN L,HUNFELD K P,et al.Molecular diagnosis of sepsis:new aspects and recent developments[J].Eur J Microbiol Immunol (Bp),2014,4(1):1-25.DOI:10.1556/EuJMI.4.2014.1.1.
[16]BOOMER J S,TO K,CHANG K C,et al.Immunosuppression in patients who die of sepsis and multiple organ failure[J].JAMA,2011,306(23):2594-2605.DOI:10.1001/jama.2011.1829.
[17]GABRILOVICH D I,NAGARAJ S.Myeloid-derived suppressor cells as regulators of the immune system[J].Nat Rev Immunol,2009,9(3):162-174.DOI:10.1038/nri2506.
[18]马晓春,陈铭铭.持续性炎症-免疫抑制分解代谢综合征——ICU滞留患者炎症、免疫及代谢状态新解说[J].中国危重病急救医学,2012,24(9):514-516.DOI:10.3760/cma.j.issn.1003-0603.2012.09.002.
MA X C,CHEN M M.Persistent inflammatory immune suppression catabolic syndrome——a new explanation of inflammation,immunity and metabolism in ICU patients[J].Chinese Critical Care Medicine,2012,24(9):514-516.DOI:10.3760/cma.j.issn.1003-0603.2012.09.002.
[19]HOTCHKISS R S,OPAL S.Immunotherapy for sepsis——a new approach against an ancient foe[J].N Engl J Med,2010,363(1):87-89.DOI:10.1056/NEJMcibr1004371.
[20]HOTCHKISS R S,COOPERSMITH C M,MCDUNN J E,et al.The sepsis seesaw:tilting toward immunosuppression[J].Nat Med,2009,15(5):496-497.DOI:10.1038/nm0509-496.
[21]LEENTJENS J,KOX M,PICKKERS P.Immunomodulation for sepsis:a change of tack?[J].Ned Tijdschr Geneeskd,2014,158:A6859.
[22]BOOMER J S,GREEN J M,HOTCHKISS R S.The changing immune system in sepsis:is individualized immuno-modulatory therapy the answer?[J].Virulence,2014,5(1):45-56.DOI:10.4161/viru.26516.
[23]BRADLEY T R,METCALF D.The growth of mouse bone marrow cells in vitro[J].Aust J Exp Biol Med Sci,1966,44(3):287-299.
[24]MATHIAS B,SZPILA B E,MOORE F A,et al.A review of GM-CSF therapy in sepsis[J].Medicine (Baltimore),2015,94(50):e2044.DOI:10.1097/MD.0000000000002044.
[25]MEISEL C,SCHEFOLD J C,PSCHOWSKI R,et al.Granulocyte-macrophage colony-stimulating factor to reverse sepsis-associated immunosuppression:a double-blind,randomized,placebo-controlled multicenter trial[J].Am J Respir Crit Care Med,2009,180(7):640-648.DOI:10.1164/rccm.200903-0363OC.
[26]BO L,WANG F,ZHU J,et al.Granulocyte-colony stimulating factor (G-CSF) and granulocyte-macrophage colony stimulating factor (GM-CSF) for sepsis:a meta-analysis[J].Crit Care,2011,15(1):R58.DOI:10.1186/cc10031.
[27]GIAMARELLOS-BOURBOULIS E J.Should we be moving from suppression to stimulation to deal with immunoparalysis in sepsis patients?[J].Immunotherapy,2014,6(2):113-115.DOI:10.2217/imt.13.161.
[28]DÖCKE W D,RANDOW F,SYRBE U,et al.Monocyte deactivation in septic patients:restoration by IFN-gamma treatment[J].Nat Med,1997,3(6):678-681.
[29]SOUZA-FONSECA-GUIMARAES F,PARLATO M,PHILIPPART F,et al.Toll-like receptors expression and interferon-γ production by NK cells in human sepsis[J].Crit Care,2012,16(5):R206.DOI:10.1186/cc11838.
[30]潘爱军,邓艳如,杨田军,等.脓毒症患者外周血自然杀伤细胞的表型和功能及其临床意义[J].中华危重病急救医学,2014,26(11):827-831.DOI:10.3760/cma.j.issn.2095-4352.2014.11.012.
PAN A J,DENG Y R,YANG T J,et al.Phenotype and functions of natural killer cells in septic patients and its clinical significance[J].Chinese Critical Care Medicine,2014,26(11):827-831.DOI:10.3760/cma.j.issn.2095-4352.2014.11.012.
[31]LEENTJENS J,KOX M,KOCH R M,et al.Reversal of immunoparalysis in humans in vivo:a double-blind,placebo-controlled,randomized pilot study[J].Am J Respir Crit Care Med,2012,186(9):838-845.DOI:10.1164/rccm.201204-0645OC.
[32]ROSSAINT J,ZARBOCK A.Pathogenesis of multiple organ failure in sepsis[J].Crit Rev Immunol,2015,35(4):277-291.
[33]UNSINGER J,MCGLYNN M,KASTEN K R,et al.IL-7 promotes T cell viability,trafficking,and functionality and improves survival in sepsis[J].J Immunol,2010,184(7):3768-3779.DOI:10.4049/jimmunol.0903151.
[34]KASTEN K R,PRAKASH P S,UNSINGER J,et al.Interleukin-7(IL-7) treatment accelerates neutrophil recruitment through gamma delta T-cell IL-17 production in a murine model of sepsis[J].Infect Immun,2010,78(11):4714-4722.DOI:10.1128/IAI.00456-10.
[35]VENET F,FORAY A P,VILLARS-MÉCHIN A,et al.IL-7 restores lymphocyte functions in septic patients[J].J Immunol,2012,189(10):5073-5081.DOI:10.4049/jimmunol.1202062.
[36]邵瑞,李春盛.负性共刺激分子在脓毒症中的免疫调节[J].中华危重病急救医学,2014,26(9):681-684.DOI:10.3760/cma.j.issn.2095-4352.2014.09.016.
SHAO R,LI C S.Immune regulation of negative costimulatory molecules in sepsis[J].Chinese Critical Care Medicine,2014,26(9):681-684.DOI:10.3760/cma.j.issn.2095-4352.2014.09.016.
[37]张小玲,王国恩,张军,等.PD-L1及 CD86在脓毒症小鼠外周血单核细胞中的表达趋势[J].中国急救医学,2015,35(10):950-953.DOI:10.3969/j.issn.1002-1949.2015.10.020.
ZHANG X L,WANG G E,ZHANG J,et al.Expression of PD-L1 and CD86 in the peripheral blood mononuclear cells of septic mice[J].Chinese Journal of Critical Care Medicine,2015,35(10):950-953.DOI:10.3969/j.issn.1002-1949.2015.10.020.
[38]SHINDO Y,UNSINGER J,BURNHAM C A,et al.Interleukin-7 and anti-programmed cell death 1 antibody have differing effects to reverse sepsis-induced immunosuppression[J].Shock,2015,43(4):334-343.DOI:10.1097/SHK.0000000000000317.
[39]吕艺,刘茜,赵敏,等.PD-L1阻断改善酵母多糖致伤小鼠脾脏耐受性 DC对T淋巴细胞活性的影响[J].临床与实验病理学杂志,2014,30(9):1016-1020,1025.DOI:10.13315/j.cnki.cjcep.2014.09.017.
LYU Y,LIU Q,ZHAO M,et al.PD-L1 blockade ameliorates suppression of tolerogenic dendritic cells on immunoactivity of T lymphocytes in spleen of zymosan-injured mice[J].Chinese Journal of Clinical and Experimental Pathology,2014,30(9):1016-1020,1025.DOI:10.13315/j.cnki.cjcep.2014.09.017.
ResearchProgressoftheNewNormofSepsisandItsTreatment
ZHANGWen-jie1,HEYing-li2,WANGTao1,DONGChen-ming1*
1.FirstDivisionofIntensiveCareUnit,theSecondHospitalofLanzhouUniversity,Lanzhou730030,China2.DepartmentofGastroenterology,GaotaiPeople′sHospital,Gaotai734300,China
*Correspondingauthor:DONGChen-ming,Professor,Chiefphysician,Mastersupervisor,Mainresearchdirection:criticalcaremedicine;E-mail:dongcm0608@163.com
Sepsis is a global public health problem because of increased morbidity and mortality.Although there are a lot of researches,we still can not fully explain the pathophysiological mechanism.With the progress of medical technology and the change of social population structure,the clinical phenotype and pathophysiology of sepsis have been changing.Therefore,it is important to fully understand the new normal of sepsis for diagnosis and treatment.In recent years,it has been found that immune response plays an important role in the pathogenesis of sepsis,and the study of immune response will become a promising breakthrough in the diagnosis and treatment of sepsis in the future.This paper summarizes the domestic and foreign literature published in recent years,expounds the latest research progress of the new changes in sepsis and its therapy.
Sepsis;Immune response;Therapy;Review
R 631.1
A
10.3969/j.issn.1007-9572.2017.00.001
张文杰,何英丽,王涛,等.脓毒症新常态及其治疗研究进展[J].中国全科医学,2017,20(35):4470-4474.[www.chinagp.net]
ZHANG W J,HE Y L,WANG T,et al.Research progress of the new norm of sepsis and its treatment[J].Chinese General Practice,2017,20(35):4470-4474.
1.730030甘肃省兰州市,兰州大学第二医院重症医学一科
2.734300甘肃省高台县人民医院消化内科
*通信作者:董晨明,教授,主任医师,硕士研究生导师;主要研究方向:重症医学;E-mail:dongcm0608@163.com
2017-04-05;
2017-07-24)
陈素芳)

